Hypoxia, reperfúzió hatása a központi idegrendszerre
Contents
A hypoxiáról általában
Hypoxia során szöveti szinten romlik az agyvelő, illetve minden szerv, szervrendszer oxigénellátottsága. Habár az idegszövet csupán a test súlyának 4,5 %-a, a vér tápanyagtartalmának 15-20%-át használja fel. Ezt a vérmennyiséget 2/3 részben az arteria carotis externa illetve interna, 1/3 részben az arteria vertebralis és az arteria basilaris szállítja az agyba. Ebből levonhatjuk azt a következtetést, hogy az agyvelői szövetek oxigénfogyasztása lényegesen nagyobb a szervezet többi szöveténél.
A kóros hypoxia minden szövetet súlyosan érint, azonban a központi idegrendszer a fennálló hiányállapotra szövettani sajátosságai miatt érzékenyebben reagál a többi szervnél. Az agy anyagcseréjében a gliasejtek és a neuronok egysége a legjelentősebb komponens. Az idegszövet glikogénraktára alacsony, ezért iszkémia után az agy sejtjei anaerob glükolízisre váltanak, ez foszfokreatin és adenozin-trifoszfát bontásával jár, hiszen ilyenkor az agyszövet szénhidrátok helyett nukleinsavakat, fehérjéket és lipideket használ fel. Hasonló a helyzet hypoxia esetén, a foszfolipidek anyagcseréje sérül, a foszfatázaktivitás kisebb lesz a lizozim frakcióban. Így a gliasejtek anyagcseréje zavart szenved, felborul az extra-és intracelluláris ionegyensúly, ez vezet leginkább a sejtek halálához.
Laboratóriumi vizsgálatoknál megfigyelhető, hogy a neuronok plazmájában található Nissl-szemcsék (korábbi nevükön tigroid rögök), érzékenyen reagálnak erőteljes vagy kóros fizikai és kémiai igénybevételre. Hosszan tartó komoly terhelés esetén az idegsejt Nissl-rögein fénymikroszkóp alatt megfigyelhető, hogy –főleg a mag körül- elkezdenek feloldódni.
Hypoxia típusai és kialakulásának okai
Iszkémiás hypoxia
Ennek során maga a vérellátás zavara lép fel, az adott szövet nem jut elég vérhez, és így a vér szállította hemoglobinhoz sem. Ezt okozhatja többek között embólia, szívroham, a cukorbetegség kísérőjeként megjelenő üszkösödés, trauma, vagy akár különböző betegségek, amik a perifériás vérellátás zavarát okozzák, ami a reperfúzió, vagyis a vér újraelosztása után áll vissza élettani alapértékeire, azonban e folyamat is okozhat károsodásokat.
A reperfúziós károsodást néha ischaemia-reperfúziós károsodásnak (IRI) is nevezik. Az oxigén és tápanyagok hiánya a vérből az iszkémiás periódus alatt olyan állapotot eredményez, amelyben a keringés helyreállítása gyulladást és oxidatív károkat okoz az oxidatív stressz indukálásával, ahelyett, hogy a normál működés helyreállítását eredményezné. Az újonnan visszatérő vér által a területre szállított fehérvérsejtek számos gyulladásos faktort, például interleukint és szabad gyököket szabadítanak fel.(Clark, Wayne N., 2005) A reperfúziós károsodás szerepet játszik még az agy ischaemiás kaszkádjában, amely magába foglalja a stroke-ot és az agyi traumát.(Crippen, David, 2005)
A stroke következménye számos esetben rokkantság vagy halál. Legjellemzőbb tünetei az arcon, valamint a végtagokon előforduló féloldali érzéskiesés, illetve bénulás, valamint beszédképtelenség és látótérkiesés.
Az ischaemia az összes előforduló stroke-os eset 85%-át okozza, melynek hátterében legtöbbször a középső agyi artéria (arteria cerebri media) elzáródása áll. Az arteria cerebri media többek között a frontális, parietális és temporalis lebenyek ellátásáért felel. A core-ban – ahol a véráramlás a legjelentősebb mértékben csökken – a sejtek visszafordíthatatlanul károsodnak, amennyiben az ún. “infarktusküszöb” alá csökken az agyi vérellátás és oxigénfelhasználás. A core-t a penumbra veszi körül, ezt célozzák meg a neuroprotektív kezelések.
A neuroprotektív terápiák során felhasznált szerek hatékonysága nem igazolódott, annak ellenére, hogy állatkísérletek tekintetében pozitív eredmények születtek. Ezek a szerek az agyi ischaemia-reperfúzió (IR) miatt kialakuló kóros folyamatait befolyásolják és nélkülözhetetlenek a stroke-ot követő, az életminőséget javító kezelések során.(Benedek Angéla, 2008)
Az ischaemiás kaszkád az ischaemia alatt indul be. Az iszkémia néhány percen belül elhasználja az adenozin-trifoszfátot (ATP), ami a celluláris homeosztázis és az agyműködés szempontjából kritikus energiafüggő, celluláris folyamatok sokaságának kudarcához vezet. A sejten belüli legtöbb fiziológiai folyamatot vagy közvetlenül, vagy közvetve befolyásolja az energiavesztés. A csökkent energiatartalékok azonnali következménye a membrán elektrokémiai gradiensének megváltozása, amely depolarizációhoz vezet. A nátrium, a kalcium és a klorid beáramlása az intracelluláris térbe és a kálium kiáramlás megnövekedett intracelluláris víz és citotoxikus agyi ödémához vezet. Az iszkémiás események kaszkádja ilyen módon megzavarhatja a sejtes homeosztázist, és amennyiben nem fordítják vissza a károsodást, szöveti nekrózist okoz. Az ischaemia időtartama a patofiziológiai válasz nagyságának meghatározó tényezője.(Svetlana Pundik, Kui Xu, Sophia Sundararajan, 2012)
Hypoxémiás hypoxia
Ez esetén a vér oxigéntartalma nem megfelelő. Ez előfordulhat például alkalózis, vagy a tüdő nem megfelelő funkcionálása miatt. Ezen kívül olyan különleges körülmények között, ahol az oxigén parciális nyomása a külső környezetben túl alacsony, ilyen helyzet állhat elő búvárkodás közben (keszonbetegség), vagy magashegységekben (HACE). HACE: High Altitude Cerebral Edema: nem túl gyakori, esetenként halállal végződő komplikáció, mely során az egyén akklimatizáció nélkül túl gyorsan kerül túl nagy tengerszint feletti magasságra, ahol ritkább a levegő oxigénszintje. Ez a betegség jellemzően tudatzavarral, mély kómával, illetve bizonytalan és ügyetlen járással jár. Utóbbit ataxiának nevezzük, melyet a mozgáskoordináció zavarai okoznak.(Hackett Ph, Roach RC, 2004)
Szén-monoxid indukálta hypoxia
A hypoxia speciális esete a szén-monoxid mérgezés közben jelentkező oxigénhiány. Ebben az esetben a CO-molekula leszorítja az oxigént a hemoglobin-molekuláról, mivel a hemoglobin sokkal nagyobb affinitással köti azt. Ezáltal a hemoglobin funkcióját betölteni képtelen karboxi-hemoglobin molekulává alakul. Sokkal súlyosabb a helyzet a magzati korban, mivel a fetális hemoglobin affinitása a szén-monoxid molekulához még nagyobb, mint az anyai hemoglobin esetében.
Magzati hypoxia
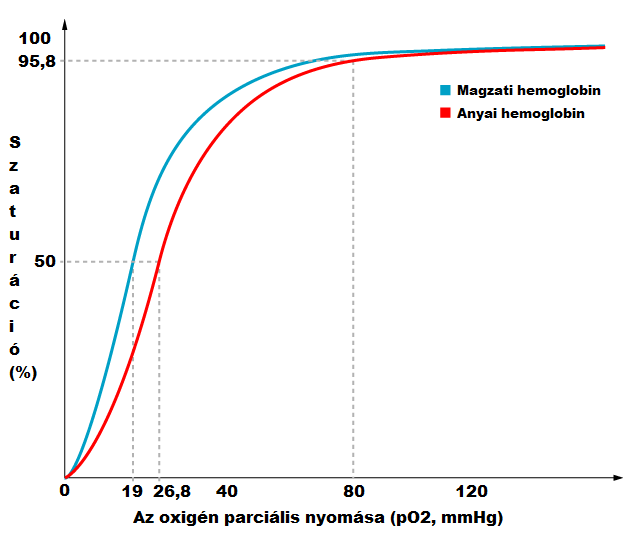
Az intrauterin oxigénhiány, bármilyen okból kifolyólag is áll fenn, különösen veszélyes. Enyhítő körülmény, hogy kísérleti úton bizonyított a magzati hemoglobin nagyobb affinitása az oxigénhez, mint az anyai hemoglobiné, így az anyát érő rövid ideig tartó oxigénhiány kevésbé érinti a magzatot. (1.ábra) Az eltérő érzékenységet korábban a hemoglobin molekula szerkezetének különbségeivel próbálták magyarázni, de David W. Allen és mtsai 1953-mas kísérletükben arra jutottak, hogy a magyarázat sokkal inkább a környezeti hatásokban keresendő. Kutatásuk során egyszerre vizsgálták a magzati és az anyai vért. A fetális vért a születés során a köldökzsinórból vették. Mindegyik minta centrifugálva és fiziológiás sóoldattal háromszor-négyszer átmosva, majd hemolizálva lett, utána addig centrifugálták, hogy egy összefüggő hemoglobin réteget kapjanak, a későbbiekben már csak ezt vizsgálták. A kísérletbe koraszülött magzatot is bevontak az időre születettek mellé. Végül arra jutottak, hogy tudnak olyan körülményeket teremteni a magzati hemoglobin molekulák számára is, hogy azok oxigén affinitása rosszabb legyen, mint az anyai hemoglobiné. Így a korábbi álláspont, miszerint a különbség csak a szerkezeti eltérésekben keresendő, mindenképp elvetendő.
|
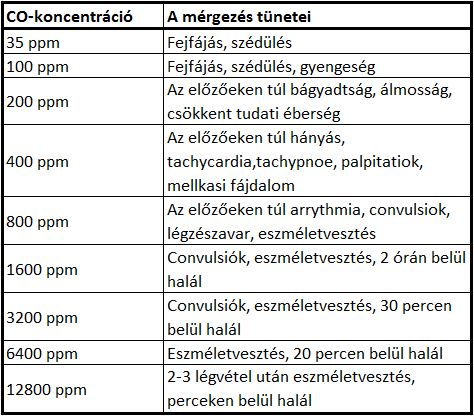
A CO affinitása a hemoglobinhoz 200-250-szer nagyobb, mint az oxigéné, ráadásul a molekulát irreverzibilisen köti, ezzel súlyos hypoxiás állapotot idézve elő. CO-mérgezés esetén a citokróm-rendszerek, valamint a mioglobin molekulák is érintve vannak, ám ezek csak magas CO koncentráció mellett okoznának klinikai tüneteket. A magzati hemoglobin jobb oxigénkötése mellett szén-monoxid kötése is sokkal hatékonyabb, tartósabban és stabilabban köti a molekulát. A CO-eliminációt elsősorban kilégzéssel végezzük, ami a magzat számára nem opció. Ismert olyan magyarországi eset is, ahol CO-mérgezésnek kitett családban jelen volt egy 39. hétben lévő kismama, akinek karboxi-hemoglobin értékei hamar rendeződtek, de mivel a magzati COHb-szint vizsgálatára jelenleg nem létezik közvetlen és nem invazív módszer, a kismamán megelőző jelleggel császármetszést végeztek, majd a köldökzsinórból vett mintában vizsgálták a CO-mérgezés mértékét. (Gara E., Gesztes É., Doroszlai R.,Zacher G. 2014) A CO-mérgezés, és így a szöveti oxigénhiány tünetei az enyhe fejfájástól és szédüléstől (5-20%-os COHb-szint) a perceken belüli halálig (66%-nál magasabb COHb-szint) változhatnak. Enyhébb tünetek még a tudatzavar, bágyadtság. álmosság, de hányás, tachypnoe, arrhythmia (a myoglobin CO-felvétele miatt), valamint convulsiok és eszméletvesztés is előfordulhatnak.(1. táblázat)
|
Összefüggést fedeztek fel a magzati CO-behatás és a bölcsőhalál (SIDS,  Sudden Infant Death Syndrome) között (Hutter és mtsai, 1996). Ez nem csak a rossz fűtési rendszerek miatt fellépő CO-mérgezéses esetekben állhat elő, hanem egyéb környezeti hatások miatt is. Ilyen például az anyai aktív, esetleg passzív dohányzás, hiszen kis mértékű CO-expozíció is káros hatást gyakorolhat a magzat légzésszabályozó központjára.
Sudden Infant Death Syndrome) között (Hutter és mtsai, 1996). Ez nem csak a rossz fűtési rendszerek miatt fellépő CO-mérgezéses esetekben állhat elő, hanem egyéb környezeti hatások miatt is. Ilyen például az anyai aktív, esetleg passzív dohányzás, hiszen kis mértékű CO-expozíció is káros hatást gyakorolhat a magzat légzésszabályozó központjára.
Hypoxia gyermekpszichiátriai vonatkozásai
A dopamin receptorokról általában
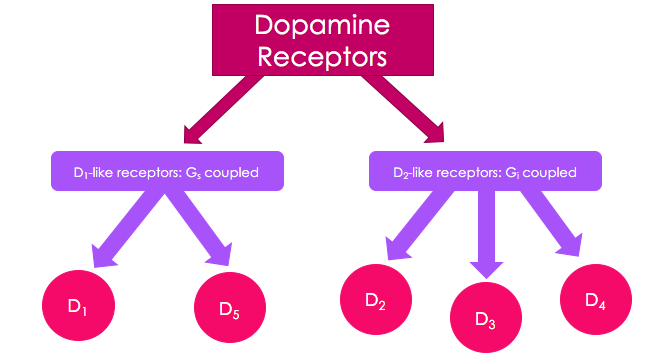
A dopamin receptorok szerepet játszanak számos neurológiai folyamatban, például a motivációban, az észlelésben, a memóriában, a tanulásban, a finommotoros kontrollban és a neuroendokrin jelátvitelben. (2. ábra)
|
A hypoxia indukálta faktor (HIF)-1α-altípusa
A HIF1α egy transzkripciós faktor, mely fontos szerepet játszik az oxigénszint változására adott sejtes válaszban. Aktivitása többek között a hidorxilácitól, az acetilációtól és a foszforilációtól függ. Több mint 60 gén transzkripcióját indukálja, például a VEGF-t és eritropoetint, melyek részt vesznek az angiogenezisben és az eritropoesisben, mely hozzájrul az oxigén szállításához a hypoxiás régiókba. A HIF1α a szisztémás oxigénszintre konformációs változásokkal reagál, stabilitása, sejten belüli lokalizációja, valamint transzkripciós aktivitása is kifejezetten az oxigénszint befolyása alatt áll. Normális oxigénszint esetében a HIF1α gyorsan degradálódik, ezzel ellentétben hypoxia esetén degradciója akadályozott.
A dopamin D4-es receptor hipoxia érzékenységének gyermekpszichiátriai vonatkozásai
Számos tanulmány foglalkozik a magzati, illetve csecsemőkori hypoxia és a különböző kognitív diszfunkciók, többek között a figyelemhiányos hiperaktivitási zavar (ADHD) összefüggésével. Az ADHD fő tünetei közé tartozik a figyelemzavar, összpontosítási nehézségek, hiperaktivitás és impulzivitás. Kialakulásában a genetikai tényezőkön kívül számos környezeti faktornak, többek között a hypoxiának is szerepe van.
A koraszülés következtében kialakuló intermittáló légzészavar miatt az artériás vér deszaturálódik. Az így perinatálisan kialakuló hypoxiás károsodások nagymértékben megnövelik az axonok degenerációjának, valamint a későbbiekben kialakuló gyermekkori neuropszichiátriai problémák és az időskori demencia esélyét. A hypoxiás károsodás súlyosságától függően eltérő tünetekkel számolhatunk. Súlyos károsodás esetén cerebrális paresis, mentális károsodás, valamint epilepszia is megfigyelhető lehet. Mérsékelt vagy enyhe károsodás esetén magatartási zavarokat, tanulási nehézségeket, illetve egyéb kognitív zavarokat figyelhetünk meg.
A perinatális hypoxia modellezésével több kutatásban is vizsgálták a hypoxia hatását a központi idegrendszerre. Az egyik esetben normál hüvelyi úton, császármetszéssel, valamint 15 perc anoxia után császármetszéssel született patkányokat vizsgáltak. A császármetszéssel, illetve 15 perc anoxia után császármetszéssel született patkányok szignifikánsan magasabb lokomotoros aktivitást mutattak, emelkedett a dopamin transzporter (DAT) szintjük a jobb oldali prefrontális kéregben, illetve a stressz hatására csökkent a dopamin kiáramlás.
Egy másik esetben az állatok intermittáló hypoxiás kezelést kaptak, utána pedig a lokomotoros aktivitásukat, az alvás-ébrenléti ciklusukat, a tanulási képességüket és a munkamemóriájukat vizsgálták. Megfigyelték, hogy a hypoxiás patkányok ébren lokomotoros hiperaktivitást mutatnak, összességében kevesebb ideig vannak ébren, alvás közben több időt töltenek REM fázisban, rosszabb a munkamemóriájuk, valamint szignifikánsan alacsonyabb a striatum dopamintartalma, mint a hypoxiát el nem szenvedett társaiknak. Mások hasonló vizsgálattal épp az ellenkezőt figyelték meg: abban az esetben a hypoxia in vitro fokozta a középagyi dopaminerg neuronok differenciálódását. Ennek az lehet a magyarázata, hogy nem mindegy, hogy a hypoxia melyik fejlődési szakaszban éri az agy bizonyos területeit, illetve az in vitro kísérletek nem feltétlenül tükrözik megfelelően az in vivo körülményeket.
Úgy vélik, hogy az ADHD hátterében főként a prefrontalis dopaminerg szabályozó körök zavara áll. A rendszer károsodásának következtében csökken az egészséges körülmények között fennálló dopamin által kialakított tónusos gátlás. A dopamin a nigrostriatalis pályákon, illetve az extrapiramidális mozgásokon kívül befolyásolja a hangulati-érzelmi életet, az impulzivitást, valamint a kognitív funkciókat. A dopaminerg neurotranszmisszió kifejezetten érzékenyen reagál ischaemiára és anoxiára, mely korrelációt mutat a schizophrenia és az ADHD előfordulásával.
A kórkép továbbörökítésében kiemelt szerepe van a dopamin transzporter (DAT1), a posztszinaptikus dopamin receptorok (pl. DRD4), illetve a dopamin bioszintézisét és inaktiválását befolyásoló enzimek génjeinek. A genetikai tényezők közül a DRD4 harmadik exonjában található ún. „7-repeat allele” növeli legszembetűnőbben az ADHD prevalenciáját. E hosszúság-polimorfizmuson (VNTR) kívül a promoter variánsok jelentőségét is több vizsgálatban igazolták.
A mai napig nem tisztázott a hypoxia dopaminerg neurotranszmisszióra kifejtett pontos hatása. A hypoxiának bizonyos génekre gyakorolt hatása függ a vizsgált agyterülettől, valamint a hypoxiás epizódok hosszától. A D2-es dopamin receptort pedig a schizophrenia pathogenezisében betöltött szerepe miatt vizsgálták, viszont ellentmondásos adatokat kaptak. Ezzel szemben kimutatták, hogy az ADHD pathogenezisében nagy jelentősége van a D4-es dopamin receptor expressziójának emelkedésének. A hypoxiára adott sejtválaszt génexpresszió szintjén főleg a hypoxia indukált faktor (HIF-1α) közvetíti, mely leginkább az eritropoetin és a vaszkuláris endotheliális növekedési faktor (VEGF) génjeire hat. Valószínű, hogy a DRD3 és DRD4 posztszinaptikus dopamin receptorok aktiválásáért nem közvetlenül a HIF-1α, hanem más, lassan reagáló, hypoxia-érzékeny transzkripciós faktorok felelnek, mivel a DRD3 és DRD4 promoterek sokkal később aktiválódnak hypoxia hatására, mint a VEGF, mely akár már háromórás hypoxiás kezelés hatására is aktiválódik. Ezzel szemben a HIF-1α közvetlenül, már a hypoxia első óráiban aktiválhatja a tirozin-hidroxiláz promoterét. Elképzelhető, hogy így a magzatban kialakult egy kompenzációs mechanizmus: a sejtek rövid időn belül fokozzák a tirozin- hidroxiláz transzkripcióját, mely katalizálja a bioszintézis meghatározó lépését, valamint utána az idegsejtekben és az asztrocitákban aktiválódik a posztszinaptikus dopamin receptorok promotere, így a sejtek képesek a dopaminerg rendszert érintő hypoxiás károsodás miatt kialakult dopaminhiányt kompenzálni.
További vizsgálatokra van szükségünk, hogy feltárhassuk a pontos összefüggéseket a hypoxia és az ADHD között. (Mózes V., Bence M., Sasvári-Székely M., Keszler G., 2010)
Hypoxia és reperfúzió hatása a microglia sejtekre
A központi idegrendszerben a neuronok által közrezárt tereket gliasejtek töltik ki. Két típusát különböztetjük meg, a macro-, és a microgliát. A microglia morfológiailag különbözik az idegsejttől és az astrocytától. Kisebb sejttesttel és sejtmaggal rendelkezik, nyúlványrendszere is szegényesebb. Sántha Kálmán és Juba Adolt (1933) magyar neuropatológus feltételezése szerint a microglia sejtek monocytákból alakultak ki az egyedfejlődés során és felnőtt, egészséges egyedben nyugalmi állapotban találhatóak meg. Ezeknek a pontos funkciója nem ismert, azonban feltételezhető, hogy az intercelulláris térben történő koncentrációváltozásokra, valamint antigénekre aktiválódnak( Kreutzberg, 1996), és gyulladásos faktorok megjelenése esetén (gyulladásos megbetegedés, fertőzés, ischemia-reperfúzió) immunológiai végrehajtó sejtekké alakulnak. Képesek lehetnek fagocitózisra, valamint B- lymphocytákhoz és macrophágokhoz hasonlóan fagocitált antigént a saját sejtfelületi fehérjéjükkel együtt a sejtfelszínre juttatni (antigén prezentáció).
Aktiválódáskor a sejt alakja megváltozik, a sejttest megnagyobbodik, vastagabbak és rövidebbek lesznek a nyúlványaik, valamint, amit a kísérlet is kihasznál, intenzívebben festhető a CR3 komplement receptor ellen termelt antitesttel (OX 42 antitest), illetve a Bandeiraea simlicifolia B4 izolektinnel (Graeber és mtsai., 1988; Streit, 1990). Ezt követi a neurális károsodás valószínűségének növekedése és ezzel párhuzamosan a microglia reakció is egyre kiterjedtebbé válik.
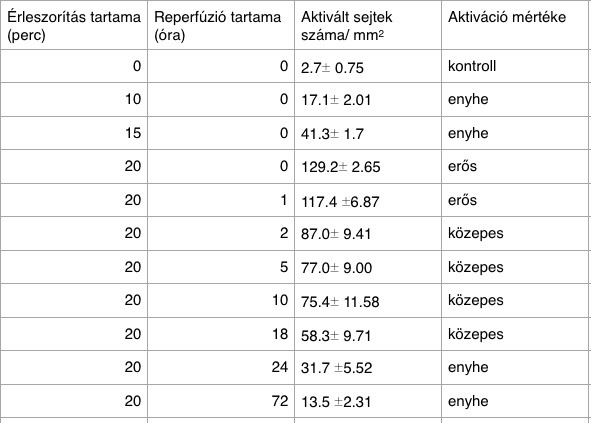
Ezen sejteket kutatta Dr. Ábrahám Hajnalaka 2003-ban Pécsett. A kutatás alapját a microglia sejtek aktivitásának vizsgálata képezi különböző műtéti, illetve egyéb természetes okokból történő oxigénhiányos állapot után. A kísérletben patkány hyppocampusból készítettek 400 mikrométer vastagságú horizontális, valamint frontális szeleteket. A fixálásoz a fokális valamint az enyhe előagyi ischaemia után mély anesztéziában foszfát puffert az aortába perfundáltak. Majd az arteria carotis communis kétoldali leszorítása után 2%-os paraformaldehiddel fixálták. Az eredmény vizsgálata a sejtek festődésének intenzitása és megváltozott alakjuk alapján zajlott. Az aktiválódott microgliasejtszám meghatározása valamint az aktiváció foka mm2-nyi egységben történt (kontroll által meghúzott határ 10 sejt/mm2) Az a. carotis communis 15, 20 perces elzárása, valamint 1 órás reperfúzió után az agyszelet több régióján is kimutatható volt a microglia sejtek igen erős aktiválódása. A sejt morfológiai változása mellett kimutatható volt az OX 42 antitest, amelyet Bandeiraea simlicifolia B4 izolektinnel tettek láthatóvá. A reperfúzió idejét 2-10 órára emelve a hippocampus területén a számuk jelentősen csökkent (2. táblázat). 24 óra elteltével az aktiváció szintje enyhe lett, 72 óra elteltével pedig már nyugalmi állapotra jellemző alakot vettek fel a microglia sejtek. A neuronokra kifejtett hatást, neurondegenerációt azonban a kísérletek után nem mutattak ki, bár szisztémás sejtszámolás nem történt.
|
A hypoxiás agyszeleteket egy olyan kamrában készítették ahol az oxigént nitrogénre cserélték és 10, 15 és 20 percig tartották fent ezt az állapotot, majd ezután reoxigenizáció következett és végül fixálták a preparátumokat. 10 perces hypoxia hatására az aktivációt enyhének, 15 perceset közpesenek, 20 perceset pedig már erősnek ítélték meg, de a reoxigenizációt követően a sejtek nem mutattak eltérést a kísérlet előtti állapotukhoz képest.
A megfigyelés eredményeként megállapítható, hogy olyan kórfolyamatokban, mint a hypoxia és a repezfúzió is, ahol a neuronok átmeneti funkcionális zavart szenvednek, a microglia sejtek aktiválódnak. A sejtek nyúlványának megrövidülése eredményezi a könnyű mozgást a károsodás helyére. Bár az idegszövet érzékeny és könnyen sérül, a microglia sejtek gyors reakciója révén idegsejt degeneráció nem mutatható ki.
Irodalomjegyzék
- Benedek Angéla: Az ischaemiás-reperfúziós agyi károsodás korai fázisának vizsgálata szövettani, neurokémiai és funkcionális módszerekkel; Doktori tézisek Semmelweis Egyetem Gyógyszertudományok Doktori Iskola (2008)
- Clark, Wayne M. (January 5, 2005). "Reperfusion Injury in Stroke". eMedicine. WebMD. Retrieved 2006-08-09.
Crippen, David. "Brain Failure and Brain Death: Introduction". Scientific American Surgery, Critical Care, April 2005. Retrieved 2007-01-09.
- DAVID W. ALLEN, JEFFRIES WYMAN, JR., AND CLEMENT A. SMITH (From the Biological Laboratories, Harvard University, Cambridge, the Department of Pediatrics, Harvard Medical School, and the Boston Lying-In Hospital, Boston, Massachusetts) (Received for publication, January 7, 1953)
- Dr. Ábrahám Hajnalka: Korai microglia aktiváció ischemia, hypoxia és különböző farmakológiai beavatkozások hatására,Doktori (Ph.D)-értekezés, Pécsi Tudományegyetem Általános Orvostudományi Kar), 2003.
- Gara, E., Gesztes, É., Doroszlai, R., Zacher G. [Urgent cesarean section in a pregnant woman with carbon monoxide poisoning]. Orv. Hetil., 2014, 155(22), 871–875.
- Graeber MB, Streit WJ, Kreuzberg GW. Axotomy of the rat facial nerve leads to increased CR3 complement receptor expression by activated microglia cells. J Neurosci Res. 1988 21:18-24
- Hackett PH1, Roach RC., High Alt Med Biol. 2004 Summer;5(2):136-46. High altitude cerebral edema.
- Hutter, C. D., Blair, M. E.: Carbon monoxide – does fetal exposure cause sudden infant death syndrome? Med. Hypotheses, 1996, 46(1), 1–4.
- Kreutzber GW. Microglia; a sensor for pathological events int he CNS. Trends Neurosci. 1996. 19;312-318
- Mózes Viktor, Bence Melinda, Sasvári-Székely Mária és Keszler Gergely ; Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet, Budapest; Neuropsychopharmacologia Hungarica 2010. XII . évfolyam 1. szám, 289-293. oldal
- Sántha K, Juba A. Weitere Untersuchungen über die Entwicklung der Hortegaschen Mikroglia Arch, Psychiatr, Nervenkr 1993. 98:598-613)
- Svetlana Pundik, Kui Xu and Sophia Sundararajan( September 24, 2012). „ Repercussion brain injury“
Ábrajegyzék
1. táblázat: saját készítésű
2. táblázat: saját készítésű
1. ábra: https://upload.wikimedia.org/wikipedia/en/8/86/HbA_vs_HbF_saturation_curve_unlabeled.png feliratokkal kiegészítve
2. ábra: https://upload.wikimedia.org/wikipedia/commons/5/5b/Dopamine_Receptor_Flowchart.png