Itt írjon a(z) Immuntherapie-ról/ről
Contents
Einführung
Die ersten frühen Bahnen der Immuntherapie wurden schon im vorherigen Jahrhundert gelegt. Antibiotika und anderen spezifische Medikamente waren noch unentdeckt, und so verließ sich die Medizin auf die Selbstheilungsfunktion des Körpers. Aus dieser Idee wurde nach und nach eine eigene Wissenschaft.
Therapieformen
Die aktive spezifische Immuntherapie
Diese Form der Therapie wird oft auch als Krebsimpfung oder Tumorvakzine benannt. Die aktive spezifische Immuntherapie (ASI) mit virusmodifizierten Tumorzellen ist die Injektion eines individuell hergestellten Impfstoffes, beziehungsweise eines inaktivierten Antigens. Die Antigene werden aus dem operativ entfernten Tumorgewebe entnommen und isoliert. Ziel dieses Verfahrens ist die Immunisierung der Tumorzellen durch die Induktion einer gegen den Tumor gerichteten Immunantwort, aber auch die spezifische oder unspezifische Modulation des Immunsystemswodurch ein zytotoxischer Mechanismus hervorgeht. Für eine erfolgreiche Tumorzerstörung wird durch die ASI ein immunologisches Gedächtnis geschaffen, welches von langer Lebensdauer geprägt sein soll. Dieses Gedächtnis hat bestenfalls eine präventive Schutzfunktion vor Neuerkrankungen. Dieser komplexe Mechanismus richtet sich gegen das erkrankte Tumorgewebe des Patienten. Zum Einsatz kommt bei der Vakzination eine Kombination aus autologen dendritischen Zellen mit einem oder mehreren Adjuvantien (wie beispielsweise abgeschwächten Tuberkelbakterien – BCG, oder in vitro-chemisch veränderte Tumorzellen). Durchaus werden auch Zytokinogene in Tumorzellen injiziert, was die zelluläre Immunantwort intensiviert. Als Tumorvakzine werden je nach Krankheit und Tumorstadium verschiedene Stoffe verwendet. Ein weit verbreitetes Injektionsmittel sind die Tumorassoziierten Antigene (TAA). Diese werden nach ihren typischen Immunantworten kategorisiert: humoral, zellulär oder aufgrund ihres Gewebsexpressionsmusters und der Entwicklungsursache. Vermittelt werden diese Antigene durch die CD4-T-Helferzellen oder CD8-T-Helferzellen. Bis heute ist es jedoch noch ungewiss, welche Immunreaktion eine erfolgreiche Tumorabstoßung nach einer Vakzinierung auslöst. Klar ist nur, dass der humoralen Immunantwort keine wichtige Rolle zuteil kommt. Neben Kategorien lassen sich die TAA auch in Gruppe klassifizieren, in sogenannte Antigenformate:
Proteine : mutationslose Autoantigene ; sie werden von Tumorzellen exprimiert ; Bei Injektion in Form von autologen oder gereinigten Proteinen ; Eher schwach auf normalen Zellen vorhanden (zum Beispiel: MAGE (Melanom-associated-antigen), GAGE ) ; Von den Tumorzellen werden auch gewebsspezifische Antigene exprimiert, diese erkennen die Melanomantigene (MLANA) (zum Beispiel: MART-1 Melan-1)
Ganglioside: zum Beispiel: GD2, GM2 ; Einsatzgebiet: Bei Tumoren (Melanome, kleinzellige Bronchialkarzinome)
Erfolge in Phase-1-Studien: GD2-Injektionen konnten positive humorale Immunantwort aktivieren
Erfolge in Phase-2-Studien: Patienten wurden mit BCG und BD2 behandelt. Die Überlebenschance bei BD2 war größer. Der Erfolg einer Vakzinierung hängt auch von der Qualität der Antigenpräsentation-, und -prozessierung ab. Als Folgeerscheinung bei der ASI kommt es häufig zur Immunsuppression.
Hierbei müssen einige Vorgänge berücksichtigt werden. Zum einen können die Tumorgewebszellen immunsuppressive Zytokine sekretieren. Zum anderen wachsen die Malignomen an Arealen, die für das Immunsystem schlecht zugänglich sind. Zusätzlich wichtig sind der Mangel und Schwund von den TAA und eine erheblich geschwächte Antigenpräsentation durch veränderte Human leukocyte Antigene. Um diese Mechanismen auszuschalten, wird eine systematisch gezielte Antigenpräsentation der TAA angestrebt.
Beispiele für den gezielten Einsatz in der Medizin:
Vakzine bei metastasiertem Melanomen:
- CT-Antigene: MARGE-3 + NY-ESO-1
- Melanozytendifferenzierungsantigene: gp100, Melan-1, Tyrosinase
- Antigenformate: Proteine, Peptide
Vakzine bei Ovarial,-Mammakarzinomen:
- TAA: MAGE 3 + HLA-A1 Peptid
(Beuth, 2014; Barth, 2000; Siewert et al., 2000, Schmoll et al., 2005)
Die spezifische Immuntherapie, Hyposensibilisierung
Die spezifische Immuntherapie (SIT), beziehungsweise Hyposensibilisierung, ist eine immunmodulierende Therapieform, welche auf der schrittweisen Immunisierung gegen ein oder mehrere spezifische Allergene fundiert. Hierbei ist das Ziel eine durch Allergene ausgelöste Immunantwort zu verhindern und die Verminderung von Entzündungsreaktionen im Gewebe durch die stufenweise Erhöhung der verabreichten Allergendosis. Ein weiteres Ziel ist auch das das Auftreten weniger Allergiesymptome. Sie kann nur einen optimalen klinischen Verlauf erzielen wenn die Diagnose genau ist, dass das auslösende Allergen ermittelt wurde und die Therapie über mindestens 5 Jahre angewendet wird. Ein sehr positiver Effekt der SIT ist die bis zu 16 Jahren anhaltende Wirkung und sie kann beliebig oft wiederholt werden. Die höchste Erfolgsquote bringt die SIT bei Allergien vom Soforttyp oder IgE-vermittelte (Immunglobulin E) Allergien, so wie beispielsweise Gräser,-Pollen,-Insektengift, oder –Hausmilbenallergien.In den nachstehenden Abbildungen kann entnommen werden, dass die SIT bei Pollenallergikern und Allergien verursacht durch Pollenflug bessere Wirkung zeigt, als Pharmazeutika. Es wird durch die Diagramme auch ersichtlich, dass die Heilungschance der SIT bei Haustierallergikern eher gering ist, und die Allgemeinvermeidung und medikamentöse Behandlung wirkungsvollere Möglichkeiten der Krankheitsbekämpfung darstellen. Neben dem Allergentyp kommt es auch auf den Patienten an, wobei man einige Faktoren berücksichtigen muss. Wichtige Parameter für einen sind Alter des Patienten, Art und Dauer des Krankheitsbildes. Aber auch in der Heilung von Asthma oder allergischer Rhinitis hat die SIT ihren Platz gefunden, worauf im nächsten Kapitel näher eingegangen wird. Die Wirkungsweise der SIT ist äußerst komplex. In erster Linie spielen die Lymphozyten als Zielzellen eine wichtige eine Rolle. Während einer (normalen) allergischen Reaktion kommt es zur Sekretion der Interleukine-4 und zur Synthese allergiespezifischen IgE-Antikörper durch die Plasmazellen. Diese Antikörper docken an die Mastzellen an. Kommt es dann zu einer erneuten allergischen Reaktion kommt es zur Sekretion der entzündungsauslösenden Stoffen, wie Histamin und die ersten allergischen Symptome folgen. Wurde jedoch eine SIT durchgeführt, kommt es bei einem erneuten Kontakt mit dem Allergen zu einer Hemmung der Mastzellen durch die Induktion der regulatorischen T-Zellen. Dieser Prozess dient der IL-10 Sekretion, welcher eine exzitatorische Wirkung auf die allergenspezifische IgG-Antikörpersynthese (Immunglobulin G) hat. Die IgG binden im nächsten Schritt das Allergen, worauf das Allergen nicht mehr in der Lage ist den IgE-Antikörper durch dessen Anbindung zu inhibieren. Schlussendlich folgt ein langsamer Verlust der allergenspezifischen TH2-Zellreaktivität. Langzeitig betrachtet kommt es zu einem erhöhten IgG- Antikörperspiegel, der die Allergenbindung an IgE-Antikörper unterbindet. In den ersten Studien war man der Meinung, dass es durch die SIT zu einer Ausbalancierung zwischen TH1 und TH2 Immunantwort kommt und zu einer verstärkten IgG-4 Antikörperproduktion worauf Immuntoleranz gegen das Allergen entsteht. Momentan gibt es zwei klinische Anwendungsformen zur Auswahl, die je nach Krankheitsbild des Patienten appliziert werden: Auf der einen Seite gibt es die Subcutane Immuntherapie (SCIT) und auf der anderen Seite die Sublingual immunotherapy (SLIT). SCIT und SLIT haben unterschiedliche Inhaltstoffe und Applikationsformen. Die SCIT wird subkutan in das Oberarmfettgewebe gespritzt und die SLIT als Tabletten oder wässriger Lösung sublingual, also unter der Zunge, verabreicht.
In den nachstehenden Grafiken werden die verschiedenen Methoden zur Allergiebekämpfung und deren Heilungschancen dargestellt:
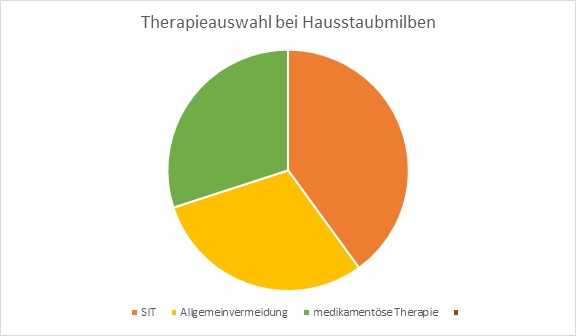
Abbildung 1 : Therapieanwendungen im Vergleich: Einsatz und Heilungschancen bei Hausstaubmilben
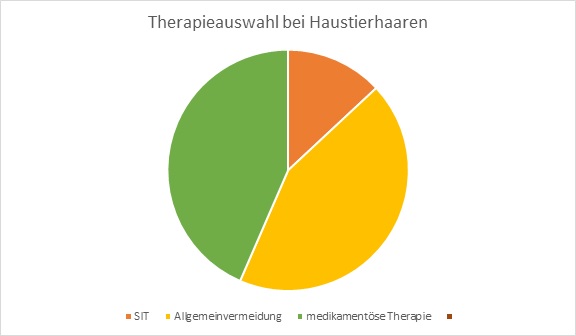
Abbildung 2 : Therapieanwendungen im Vergleich:Einsatz und Heilungschancen bei Haustierhaaren
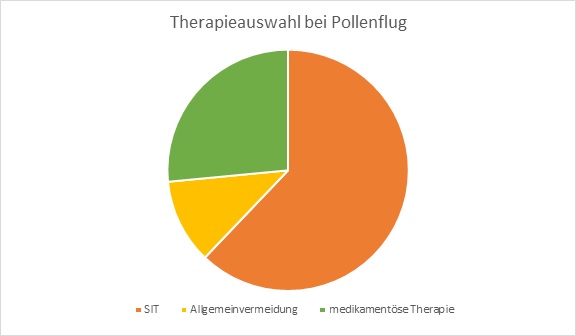
Abbildung 3 : Therapieanwendungen im Vergleich: Einsatz und Heilungschancen bei Pollenflug
(Eng, 2019)
SIT bei Asthma bronchiale
Vorweg muss erwähnt werden, dass die SIT nur bei der Asthmaform angewendet werden kann, welche einer Allergie zugrunde liegt und nur bei Menschen mit stabilem Asthma eingesetzt werden kann. Das Asthma bronchiale zählt zu den IgE-vermittelten Allergien und entsteht durch unbehandelte Pollen,-Gräser, oder -Tierhaarallergien. Bei unbehandeltem Asthma lösen die Allergene eine Verkrampfung der Atmungsmuskulatur und die Bildung eines zähen Schleimes auf den Atemwegen auf. Die SIT wird zur Prävention und Heilung der Krankheitssymptome verwendet, aber nur in Kombination mit einer medikamentösen Therapie. Während der Therapie bleiben die Lungenparameter wie Peak Flow oder Sekundenkapazität unverändert und werden nicht beeinflusst. Durch die immuntherapeutische Behandlung werden die Exazerbationen verringert und die Symptomkontrolle erleichtert. Die Wirksamkeit ist bei Kleinkindern und Jugendlichen besonders hoch. Die Injektion erfolgt monatlich und wird vom behandelnden Arzt durchgeführt. Als Nebenwirkungen können milde bis mittelschwere Symptome im Mund und Rachenraum auftreten.
(Buhl et al., 2003; Pfützner, 2013; Pfaar et al., 2019)
Spezielle Immuntherapieverfahren in der Onkologie
Genese
Die erste Person, die jemals eine Immuntherapie durchgeführt hat, war William Coley. Dieser legte unfreiwillig mit der Injektion von Streptokokken in einen fortgeschrittenen Tumor die Grundidee der Immuntherapie bei Tumoren. Auf diese anfänglichen Erkenntnisse wurde jedoch erst in den 1970er und 80er Jahren, nach weiteren Tests über das Immunsystem, zurückgegriffen. Hierzu wirkte das körpereigene Immunsystem sowohl als Prophylaxe, als auch als Therapiemaßnahme von bereits bestehenden Tumoren. Insbesondere der Rückgang von Lungenmetastasen bei Nierenzellkarzinomen, Melanomen und eine Prävention von Tumoren nach Organtransplantationen weckten Hoffnung auf eine langfristige Krebsbehandlung. Nach einer Skepsisgeprägten Zeit wurde mit gezielte Krebstherapie ein neuer Fortschritt, besonders in der Hämatoonkologie gelegt. So entwickelte sich die Immuntherapie stetig weiter.
(Füreder, 2017)
Immuntherapie in der Onkologie und ihrer Untergruppen
Körpereigene Hintergründe
Es gibt mehrere körpereigene Konzepte in der Onkologie, die zum grundlegenden Verständnis beitragen: Die Immunüberwachung, und der Tumorimmunzyklus. Laut Füreder kann mit der Immunüberwachung das Immunsystem bei perfekten Voraussetzungen Tumore kontrollieren und ihr Wachstum verhindern, und das jahrelang. In der Weiterentwicklung dieser Theorie steht das Immunediting. Diese Theorie unterscheidet unter 2 Phasen:
- Die Equilibrium Phase, in der der Tumor nicht komplett eliminiert wird, jedoch durch das Immunsystem kontrolliert werden kann. Die malignen Zellen nehmen dadurch an genetischer Instabilität kontinuierlich zu.
- Die Tumor-Escape-Phase, in der der Tumor nicht mehr supprimiert werden kann. In dieser Phase schafft es der Tumor, das Immunsystem aktiv zu hemmen, oder ihre eigene Immunität zu senken, und so der Elimination zu entkommen. Der Tumorimmunzyklus beschränkt sich auf andere Sieben Schritte:
1. Antigene von Tumorzellen werden durch Zelltod freigesetzt
2. Diese Antigene werden den Antigenpräsentierenden Zellen (APC) präsentiert
- 3. Aktivierung der T-Zellen in den Lymphknoten
4. T-Zellen bewegen sich von den Lymphknoten zum Tumor
5. T-Zellen dringen durch Endothelzellen in den Tumor ein
- 6. T-Zellen erkennen das Tumorgewebe
- 7. Tumorzellen werden zerstört
(Füreder, 2017)
Immuntherapeutische Verfahren
Die Immuntherapie ist ein weites Behandlungsfeld und hat viele Wege der Differenzierung. Sie können das Immunsystem stimulieren, hemmen, oder sie liegen in passiver und aktiver Form vor. Diese Unterteilungen liegen der Vielfältigkeit der aktivierenden und inhibierenden Rezeptoren der T-Zellen zu Grunde. Bei der passiven Form handelt es sich um Therapien mit intrinsischen antineoplastischen Verfahren, während die aktiven Therapien eine vollständige Wirkung des Immunsystems des zu behandelnden Patienten aktiviert. Auch die Strahlentherapie und die Chemotherapie können durch den flüssigen Übergang beider Formen mit eingeordnet werden. Es folgen neuere zugelassene Beispiele von Therapien: Checkpointinhibitoren, CAR-T-Zellen und onkolytische Viren.
Checkpointinhibitoren
Checkpointinhibitoren sind wichtig für die T-Zell Immunantwort und dessen Interaktion mit den APCs. Da sie Inhibitoren sind, sind sie folglich für die Hemmung dieser Vorgänge verantwortlich. Wichtig für die Immuntherapie bei Tumoren sind die Immuncheckpoints CTLA 4 und PD-1. Diese hemmen die Interaktion zwischen APCs, und somit die Immunreaktion. Tumorzellen speziell verhindern durch Expression von PD-L1 die Immunantwort, da die T- Zellen durch PD-1-Rezeptoren PD-L1 erkennen und gehemmt werden. Bei der Immuntherapie werden diese Stoffe blockiert und somit die T- Zellen nicht gehemmt, sodass sie eine normale Immunantwort durchführen und die Tumorzellen zerstören können. Es gibt allerdings auch zahlreiche Immuncheckpoints, die auf den T-Zellen aktivierende Rezeptoren besitzen. Für diese werden antagonistische und agonistische Antikörper bereits entwickelt.
CAR-T-Zellen
Diese Methode ist vor allem bei Leukämie eine sehr erfolgreiche, aber aufwendige Methode. Hier werden dem Patienten autologe T-Zellen entnommen. CAR besagt, dass diesen T-Zellen mit einem retroviralen Vektor genetisch ein extrazelluläres Antikörperfragment hinzugefügt wird, welches tumorspezifisch wirkt und nach ex vivo Vermehrung im Patienten den Tumor bekämpfen kann. Die Therapie mit gegen CD19 gerichtete CAR-T-Zellen (s.o.) ist erwiesenermaßen eine sehr effektive Methode bei verschiedenen B-Zell-Tumoren.
Onkolytische Viren
Onkolytische Viren haben zwei essenzielle Effekte zur Immuntherapie. Als erstes vermehren sie sich im Tumorgewebe und injizieren den Abbau von Tumorzellen. Die Lokalisation erfolgt durch das Erkennen der Unterschiede zwischen normalem und Tumorgewebe (zum Beispiel das Fehlen der Proteinkinase R). Als zweites wird durch TAAs (s.o.), DAMPs („immunologische Alarmsignale wie DNA, oder bestimmte Proteine“), oder neue Viruspartikel eine Immunantwort des Körpers induziert. Die Effektivität beider Mechanismen und ihre Gewichtung hängt von den Interaktionen von Virus, Tumor und Körper ab. Auch besteht die Gefahr, dass anatomische Barrieren, oder die Blut-Hirn-Schranke eine Wirkung der injizierten Viruszellen verhindern. Ein Beispiel hierfür ist das Herpes-simplex Virus 1 Talimogen laherparepvec, auch T-VEC genannt. Dieses Virus wurde genetisch so verändert, dass eine körpereigene, neurale Infektion nicht möglich ist und die infizierte Tumorzelle den wichtigen Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor produziert. So wird die Immunantwort verstärkt.
(Füreder, 2017; Bischoff, 2018)
Spezielle Tumortypen
Nichtkleinzelliges Bronchialkarzinom (NSCLC)
Hier sind die beiden Antikörper Pembrolizumab und Nivolumab im Fokus als zugelassene Therapiemittel. In der Zweitlinientherapie lässt sich eine deutliche Überlegenheit der Immuntherapie feststellen. Die Antikörper wirken als Hemmer für die Checkpointinhibitoren (PD-1 Blockade), daher ist die restliche Lebenslänge des Patienten bei der Immuntherapie signifikant höher. Bei der Erstlinientherapie ist die Immuntherapie ebenso Standardmethode.
Nierenzellkarzinom
Auch bei den metastasierten Nierenzellkarzinomen ist die PD-1 Blockade eine Standardtherapie. Bei unbehandelten Patienten wird die Therapie mit Nivolumab durch die Gabe eines Tyrosinkinaseinhibitors verbessert. Laut Huland, Heinzer, Timm und Aalamian spielen Interferon-α und IL-2, welche allerdings trotz Zulassung zahlreiche Nebenwirkungen haben, ebenfalls eine wichtige Rolle in der Behandlung von Nierenzellkarzinomen.
Melanom
Die ersten Erfolge der Behandlung eines Melanoms erfolgten ebenfalls mit Checkpointinhibitoren, welche auch hier die Chemotherapie als beste Behandlungsmethode abgelöst haben. Es werden Pembrolizumab und Nivolumab als Antikörper allein oder auch in Kombination benutzt. Trotz zahlreicher Nebenwirkungen ist die Kombination mehrerer Antikörper effizienter als die Monotherapie.
Leukämie
Bei der Behandlung von Leukämie werden andere Therapiewege verfolgt. Wie bereits erwähnt, ist die Behandlung mit CAR-T-Zellen eine bereits in Kliniken erfolgreich angewandte Methode gegen Leukämie. Andere ähnliche Methoden sind laut Haubner die mit Toxin-konjugierten Antikörper, oder auch ADC (Antibody drug conjugates) genannt, die Behandlung mit BITE (Bispecific T cell engagers), welches T-Zell- aktivierende Antikörper darstellt. Alle richten sich gegen Antigene auf der Oberfläche. CD33 und CDI123 sind aktuell die häufigsten Zielantigene für die Therapie von akuten myeloischen Leukämien. Theobald kommt zu dem Fazit, dass Patienten mit bestimmtem Krankheits- und Risikobild von den neuen nebenwirkungsarmen Immuntherapie profitieren werden.
(Füreder, 2017; Huland, 2002; Haubner, 2017; Theobald, 2005)
Immuntherapie in der Veterinärmedizin
Auch in der Veterinärmedizin beginnen Immuntherapieverfahren sich zu etablieren. Forschung wird auf vielen verschieden Gebieten betrieben, am prominentesten sind Anwendungen in der Krebs-, und Allergieforschung.
Adjuvante Immuntherapie bei Fibrosarkomen
Vakzine Fibrosarkome, tumoröse Bildungen an den Injektionsstellen nach Impfungen, sind bei Katzen keine Seltenheit. Sie treten hauptsächlich an Stellen zwischen den Schulterblättern, sowie an Vorder- und Hintergliedmaßen auf. Die mit Vakzin assoziierten Tumore sind rezidiv und mit herkömmlichen chirurgischen und radioaktiven Behandlungsverfahren schwer vollständig zu entfernen, ohne wiederauftretende Geschwülste zu riskieren.
King GK et al. (1995) testeten in einer Studie die Wirksamkeit von dem Polysaccharid Acemannan auf Fibrosarkome in gemeinsamer Anwendung von Chemotherapie und chirurgischen Eingriffen an ausgewählten Katzen und Hunden.
Abbildung 4: Struktur des Acemannans
Das Acemannan wird extrahiert aus dem Gel und Haut der Pflanze Aloe Vera und findet in diversen Feldern Verwendung. In der Krebsforschung ist das Polysaccharid aufgrund seiner antitumorösen Wirkungen Gegenstand von aktuellen Forschungen. Die tumorösen Zellen werden durch das Acemannan gehemmt, während normal funktionierende Körperzellen verschont bleiben. Dies ist nur einer der wenigen Gründe warum Acemannan vor allem in der adjuvanten Immuntherapie Verwendung findet. Das Extrakt der Aloe Vera hat zusätzlich einen immunomodulatorischen Effekt und ist imstande das Immunsystem zu regulieren und zu stimulieren. Darüber hinaus aktiviert es Makrophage und fördert die Ausschüttung von Zytokinen wie IL-1 und IFN- alpha. Obendrein wird es bei Herz-Kreislauf Störungen eingesetzt, bei Stoffwechselkrankheiten, sowie bei Wundheilungen.
Die 13 Hunde und Katzen erhielten das Acemannan in einer Behandlungsdauer von bis zu 7 Wochen verabreicht. Die Größe der Fibrosarkome nahm im Vergleich zu Beginn der Studie bei 4 von 12 Patienten erheblich ab. Nach operativen Entfernungen der Tumore und weiteren Behandlungsintervallen mit dem Extraktstoff Acemannan erhöhte sich die tumorfreie Periode und Überlebenschance der Patienten. Von den 13 Hunden und Katzen konnten 7 als offiziell Fibrosarkomfrei anerkannt werden und die Rezidivität der Tumore nahm ab.
(King GK et al., 1995; Kessler, 2016; Liu C et al., 2019)
Immunisierung gegen Fel d 1
Die Therapie gegen Allergene in Katzen und Hunden ist eines der wichtigsten Felder in der veterinärmedizinischen Immuntherapie-Forschung. Ausgelöst werden allergische Reaktionen durch Allergene. Diese sind genauer Proteine und werden in den Speichel-, Talg-, und Analdrüsen gebildet. Die Tierhaarallergie wird somit nicht willkürlich durch die Haare ausgelöst, sondern durch die sezernierten Eiweiße, die sich über den Putzakt auf das Fell anheften und sich mit der Zeit im Raum verteilen. Eine Katzenhaarallergie findet sich nach Thoms et al. in 10% der westlichen Bevölkerung. Das Hauptallergen in den Katzen ist das Fel d 1. Nach Kelly et al. (2018) besitzen von allen Betroffenen einer Katzenallergie 94% erhöhte Fel d 1 Werte, 90% weisen IgE Antikörper auf. Neue Studien machen es möglich das Fel d 1 mittels Bildung von spezifischen Antikörpern zu neutralisieren und Katzen so gegen das eigene Hauptallergen zu immunisieren. Auf Grundlage dessen kreierten Thoms et al. einen Impfstoff der aus dem rekombinierten Fel d 1, Virus like particles, und T-Zellepitopen tt830-843, extrahiert aus dem Tetanustoxin, bestand. Für die Studie wurden 3 Gruppen mit jeweils 3 Katzen gebildet. Zwei Gruppen erhielten das Vakzin Fel- CuMVTT (Cucumber mosaic virus containing the tetanus toxin–derived universal T-cell epitope tt830-843) drei Mal, in einem jeweils dreiwöchigem Abstand. Gruppe 3 erhielt das CuMVTT gemeinsam mit einem Saponin verabreicht. Hauptziel der Studie war zu zeigen, dass das konjugierte Vakzin anti- Fel d 1 Körper bilden konnte. Vor der Immunisierung waren weder anti- Fel d 1 noch anti- CuMVTT IgG ausgebildet. Die ersten Fel d 1 spezifischen IgG bildeten sich nach der ersten Immunisierung und wurden am 22. Tag der Studie erfasst. 2 Impfungen später, Tag 43, festigte sich ein hohes Konzentrationslevel an den gewollten IgG´s. Anti Fel d 1 IgG´s zeigten nicht nur an dem natürlich vorkommenden Protein eine hohe Spezifität und Aktivität sondern auch an rekombinierten Versionen von Fel d 1. Die in vivo und in vitro getestete Methode zeigte, dass der Impfstoff Fel- CuMVTT als Immunisierungsmittel wirkte und die Produktion von Antikörpern induzieren kann und somit das Allergenlevel in den Speicheldrüsen der Katzen erheblich senken konnte.
(Thoms et al., 2019; Kelly et al., 2018)
Behandlung von IBH
Die Insect- bite hypersensitivity (IBH), oder allgemein bekannt als das Sommerekzem, gehört zu einer der meist verbreiteten Hautkrankheiten unter den Pferden, von der knapp 10% betroffen sind. Genauer versteht man darunter eine allergische Reaktion, ausgelöst durch Stiche der Gattung Culicoides. Das Sommerekzem tritt hauptsächlich in den wärmeren Monaten des Jahres auf. Maxima erreichen die Symptome in der Zeit zwischen Juni und Juli. Merkmale von IBH sind ein auffällig erhöhtes Bedürfnis des Pferdes sich zu kratzen, daraus folgender Haarverlust an Mähnen- und Schweifbereich, sowie Ausbildung von entzündeten Stellen über den gesamten Körper verteilt. Folglich bilden sich zum größten Teil Geschwülste. Diese bringen mit sich Blutungen, Schwellungen, Verdickungen an der Epidermis, Dermis und dem Stratum Corneum. IBH gehört zum einen zu der IgE- abhängigen Typ 1 Allergieklasse, zum anderen auch zu dem Typ IV. Für die Typ 1 Allergieklasse ist eine späte Eosinophilie, ein starker Anstieg der Eosinophilen Konzentration im Blut, sowie die Umlagerung von ausgeschütteten Eosinophilen zu der allergisch reagierenden Seite, charakteristisch. Der hypersensitive Typ IV lässt sich in vier weitere Subtypen unterteilen: IVa, IVb, IVc, IVd. Relevant ist hier Allergie Typ IVb. IVb steht in einer engen Verbindung mit den Interleukin- 5 produzierenden TH2- Zellen und kann somit als ein indirekter Stimulator von entzündlichen Prozessen angesehen werden. Das von den TH2- Zellen synthetisierte Zytokin IL-5 fungiert als Regulator der Eosinophilen und stimuliert zusätzlich deren Ausschüttung in den Blutkreislauf. Die Eosinophile partizipieren an der Immunantwort und an allergischen sowie entzündlichen Reaktionen, sie werden im Kontext von IBH als die vorherrschenden inflammatorischen Zellen charakterisiert. Bei einer Degranulation schütten Sie Effektor Moleküle wie Histamin, Cysteinyl Leukotriene und die Major basic Proteins (MbP) aus und sind maßgeblich an einer Hyperreaktion und Gewebeschädigungen beteiligt. Von den MbP´s werden zusätzlich Mastzellen und Basophile ausgeschüttet und fördern so folglich die allergischen Prozesse. Grundstein der Immuntherapie Forschungen ist die Hemmung des IL- 5, das durch seine Funktion als Eosinophilen Stimulator als Ursprung für die inflammatorische Hautreaktion gilt. Eine aktuelle Studie von Fettelschoss- Gabriel et al. (2018) belegten diese Methode mittels Kreierens eines neuen Vakzins, dass die IL- 5 hemmen soll und somit IBH in breiten Maßen kontrollierbar macht. Basis der Studie waren ausgewählte Islandpferde, welche alle unter dem Sommerekzem in verschiedenen Schweregraden litten. Bereits aufgetretene Läsionen wurden anfangs beobachtet und nach unterschiedlichen Gesichtspunkten analysiert. Zu den Parametern zählten Lokalisation am Körper, Größe, Stärke der Verletzung, Blutungen, Schwellungen sowie der Zustand der histologischen Hautschichten. Die aufgefassten Daten wurden dokumentiert und über die Studie hinweg weiter kontrolliert. Abschließend konnten die anfangs aufgefassten Daten mit den Ergebnissen von nach der Studie verglichen werden. Das verwendete Vakzin CuMVTT ist in der Immuntherapie an Tieren nicht unbekannt und wurde bereits in der oberen erläuterten Studie zu Fel d 1 bei Katzen verwendet. Der wesentliche Unterschied hier liegt in der Zusammensetzung des Vakzins. Für die Herstellung des endgültigen Impfstoffes wurde das equine IL-5 rekombiniert und anschließend zu eIL-5-C-His reduziert. VLP-CuMVTT konnte danach mit dem eIL-5-C-His zu dem gewollten Endprodukt zusammengefügt werden. Die ausgesuchten Islandpferde wurden in einem 4 Wochen Abstand mit dem kreierten eIL-5-C-His-CuMVTT-VLP immunisiert. Sie erhielten keine zusätzlichen adjuvanten Substanzen. Ziel des neu kombinierten Vakzins ist es die Bildung von Antikörpern gegen das equine IL-5 zu induzieren und die allergischen Hautreaktionen in ihrer Stärke zu vermindern. Die ersten positiven anti-eIL-5 Antikörper Ergebnisse erhielt man bereits nach der ersten Immunisierung, durch eine zweite, dritte und vierte Impfung konnte sich das Konzentrationsniveau auf einer hohen Menge stabilisieren. Neben der erwünschten Bildung von Antikörpern verbesserten sich auch die klinischen Symptome der Testpferde erheblich.
Verglich man die Zahlen und die Größe der Läsionen von vor der Immuntherapiebehandlung mit den Ergebnissen danach, wurde ein deutlicher positiver Effekt sichtbar. 47% der geimpften Pferde erfuhren eine 50%- ige Verbesserung ihrer Symptome, bei 21% konnte man eine 75%-ige Besserung ausmachen.
In der folgenden Grafik werden die Zahlen der durch IBH bedingten Läsionen ohne eine Therapie mit der Läsionenanzahl von Pferden nach einer Behandlung verglichen.
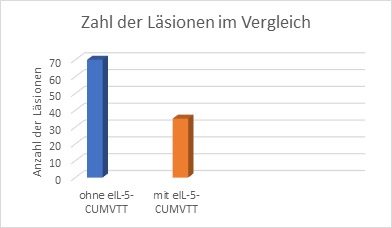
Abbildung 5: Vergleich der durch IBH bedingten Verletzungen ohne und mit einer eIL-5-CUMVTT Behandlung. Die Menge der Läsionen gingen nach der Therapie mit dem Impfstoff erheblich zurück.
(Fettelschoss- Gabriel et al., 2018)
Quellenverzeichnis
Fachartikel
1. King, G.K.; Yates, K.M.; Greenlee, P.G.; Pierce, K.R.; Ford, C.R.; Mc Analley, B.H.; Tizard, I.R. (1995): The effect of Acemannan Immunostimulant in combination with surgery and radiation therapy on spontaneous canine and feline fibrosarcomas. Journal of the American Animal Hospital Association 31: (5) 439-447
https://www.ncbi.nlm.nih.gov/pubmed/8542364
2. Liu, C.; Cui, Y.; Pi, F.; Cheng, Y.; Guo, Y.; Qian, H. (2019): Extraction, Purification, Structural Characteristics, Biological Activities and Pharmacological Applications of Acemannan, a Polysaccharide from Aloe Vera: A Review. Molecules 24: (8) 1554
http://europepmc.org/article/MED/31010204
3. Kwon Lee, J.; Koo Lee, M.; Yun, Y. P.; Kim, Y.; Kim, J. S.; Kim, Y. S.; Kim, K.; Han, S. S.; Lee, C. L. (2001): Acemannan purified from Aloe Vera induces phenotypic and functional maturation of immature dendritic cells. International Immunopharmacology 1: (7) 1275-1284
https://www.sciencedirect.com/science/article/pii/S1567576901000522
4. Thoms, F.; Jennings, G.T.; Maudrich, M.; Vogel, M.; Haas, S.; Zeltins, A.; Hofmann-Lehmann, R.; Riond, B.; Grossmann, J.; Hunziker, P.; Fettelschoss-Gabriel, A.; Senti, G.; Kündig, T.M.; Bachmann, M.F. (2019): Immunization of cats to induce neutralizing antibodies against Fel d 1, the major feline allergen in human subjects. Journal of Allergy and Clinical Immunology 144: (1) 193-203
https://www.jacionline.org/article/S0091-6749(19)30349-5/fulltext
5. Kelly, S.M.; Karsh, J.; Marcelo, J.; Boeckh, D.; Stepner, N.; Santone, B.; Yang, J.; Yang, W.H. (2018): Fel d 1 and Fel d 4 levels in cat fur, saliva, and urine. Journal of Allergy and Clinical Immunology 142: (6) 1990-1992
https://www.jacionline.org/article/S0091-6749(18)31175-8/fulltext
6. Fettelschoss-Gabriel, A.; Fettelschoss, V.; Thoms, F.; Giese, C.; Daniel, M.; Olomski, F.; Kamarachey, J.; Birkmann, K.; Bühler, M.; Kummer, M.; Zeltins, A.; Marti, E.; Kündig, T. M.; Bachmann, M. F. (2018): Treating insect-bite hypersensitivity in horses with active vaccination against IL-5. The Journal of Allergy and Clinical Immunology 142: (4) 1194-1205.e3
https://www.jacionline.org/article/S0091-6749(18)30291-4/fulltext
7. Füreder, T. (2017): Immuntherapie in der Onkologie. Wien. Klin. Wochenschr. Educ 12: 17–33
https://link.springer.com/article/10.1007/s11812-017-0089-1
8. Huland, E., Heinzer, H., Timm, S. et al. (2002): Immuntherapie des metastasierten Nierenzellkarzinoms in Deutschland Eine Standortbestimmung. Urologe [A] 41: 282–287
https://link.springer.com/article/10.1007/s00120-001-0170-2
9. Haubner, S., Subklewe, M. (2017): Immuntherapie von akuten Leukämien. Info Onkol. 20: 43–48
https://link.springer.com/article/10.1007/s15004-017-5792-7
10. Bischoff, A. (2018): Leukämie: Zelluläre Immuntherapie bringt erstaunliche Erfolge. Info Onkol. 21: 48
https://link.springer.com/article/10.1007/s15004-018-6292-0
11. Theobald, M. (2005): Immuntherapeutische Ansätze zur Behandlung von Leukämien. Onkologe 11: 578–581
https://link.springer.com/article/10.1007/s00761-005-0870-0
Fachliteratur
1.Schmoll, Prof. Dr. Med. H.J.; Höffken, Prof. Dr. Med. K.; Possinger, Prof. Dr. Med. K. (2006): Kompendium Internistische Onkologie - Standards in Diagnostik und Therapie, Teil 1, 4. Auflage, Springer Verlag: 710-721
Weiterführende Links
1.Eng, Dr. Med. P. (2019): Spezifische Immuntherapie - Was ist in der Praxis zu beachten?
2.Beuth, Dr. Med. J. (2014): Krebs ganzheitlich behandeln. Komplementäre Methoden vom Experten bewertet.: 4
3.Barth, S. (2000): Tumorvakzine Immuntherapie im Jahr 2000
4.Siewert, Prof. Dr. J.R.; Hartel, Prof. Dr. W. (2002): Deutsche Gesellschaft der Chirurgie, Kongressband 2002.: 396-398
5.Pfützner, Dr. Wolfgang (2013): Wirkungsweisen der SIT - Mechanismen der spezifischen Immuntherapie.: 65-67
6.Pfaar, O.; Gerstlauer, M.; Saloga, J.;Vogelberg, C.; Kleine-Tebbe, J. (2019): Allergen- Immuntherapie. Weißbuch Allergie in Deutschland 4: 284-251
7. R. Buhl, R.; Beeh, K.M.; (2003): Spezifische Immuntherapie bei allergischem Asthma bronchiale. Pneumologie 57: (2) 69
https://www.thieme-connect.com/products/ejournals/html/10.1055/s-2003-37156
8.Kreutzkamp, B. (2019): Feline Anti-Fel-d-1- Immunisierung macht Katzen allergikerfreundlich. Allergo Journal 28: (10)
https://link.springer.com/article/10.1007/s15007-019-1907-9
9.Kempf, C.K. (2005): Nonviraler Gentransfer der felinen Zytokin- Gene IL-2, IFNy und GM- CSF als adjuvante Immuntherapie beim Fibrosarkom der Katze: Eine klinische Phase 1- Studie. Dissertation, LMU München Tierärztliche Fakultät: 13
https://edoc.ub.uni-muenchen.de/4725/
Abbildungsverzeichnis
Abbildung 1: Selbst angefertigtes Diagramm nach Vorlage von L. Klimek, C. Vogelberg, T. Werfel (2019): Weißbuch Allergie in Deutschland. 4
Abbildung 2: Selbst angefertigtes Diagramm nach Vorlage von L. Klimek, C. Vogelberg, T. Werfel (2019): Weißbuch Allergie in Deutschland. 4
Abbildung 3: Selbst angefertigtes Diagramm nach Vorlage von L. Klimek, C. Vogelberg, T. Werfel (2019): Weißbuch Allergie in Deutschland. 4
Abbildung 4: https://en.wikipedia.org/wiki/Acemannan
Abbildung 5: Selbst angefertigtes Diagramm nach Vorlage von Fettelschoss- Gabriel et al. (2018)
