Der Wirkungsmechanismus und die Wirkung von Inhalationsnarkotika auf die Organe
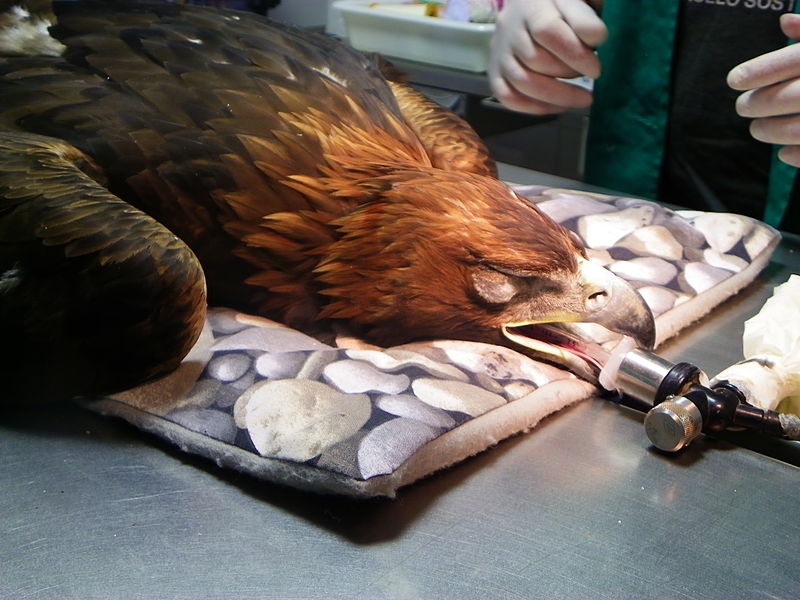
Ein intubierter Adler in Narkose |
|
Abbildung 1 |
Contents
Was sind Inhalationsnarkotika
Ein Vaporizer zur Beimischung von Atemluft bei flüchtigen Anästhetika |
|
Abbildung 2 |
Inhalationsnarkotika, auch volatile Narkotika genannt oder Inhalationsanästhetika, sind dampfförmige oder gasförmige Narkosemittel, welche mit der Einatmungsluft durch die Atemwege in den Organismus gelangen und zu einer allgemeinenAnästhesie des Körpers führen (Löscher et al., 2006).
DasInhalationsanästhetikum wird durch passende Apparaturen mit der Einatmungsluft vermischt (siehe Abbildung 2) und dem Patienten durch einen Trachealtubus zugeführt (siehe Abbildung 1 und 5). Man unterscheidet geschlossene, halboffene und offene Systeme. Bei ersterem atmet der Patient das in der Expirationsluft enthaltene Narkotikum wieder ein. In den halboffenen Systemen wird dem Patienten nur das frische Gasgemisch zugeführt, welches eingeatmet wird. Somit führt dieses System zu einem erhöhten Gebrauch an Narkotikum, sodass die Verwendung bei größeren Tieren zu höheren Kosten führt. Offene Systeme, die das Narkotikum über einfache Masken verabreichen, eignen sich in der Veterinärmedizin weniger. Allerdings existieren für Kleintiere sogenannte Narkoseglocken, die ein geschlossenes Behältnis darstellen, in welches das Tier hineingebracht wird und somit das Narkotikum einatmet, wobei bei dieser Methode die Kontrollierbarkeit und Steuerung die der konventionellen Narkose mit einer Gasmaske unterliegen (Löscher et al., 2006).
Welche Arten von Inhalationsnarkotika gibt es
Wie bereits erwähnt werden Inhalationsnarkotika in dampfförmige und gasförmige Substanzen unterteilt. Erstere sind bei normalen Bedingungen in einem gasförmigen Zustand, wie das Stickoxydul (auch Lachgas oderDistickstoffmonoxid genannt), letztere befinden sich bei Raumtemperatur in einem flüssigen Zustand und müssen somit vor der Gabe der Narkose in einen gasförmigen Zustand umgewandelt werden. Das Erreichen des gewollten Zustandes, das Toleranzstadium, wird durch bestimmte physikalische und chemische Faktoren beeinflusst, vor allem aber durch den Anteil des Narkotikums in der Einatmungsluft und die Löslichkeit des Narkotikums im Blut. Dies bedeutet, je kleiner der Anteil des Narkotikums in der Einatmungsluft ist, desto kürzer ist die Einleitungszeit, wobei die Blutlöslichkeit des Narkotikums direkt antiproportional dazu ist. Das heißt, dass Inhalationsnarkotika mit einem hohen Blut/Gas Verteilungskoeffizienten eine längere Einleitungszeit benötigen, da eine bestimmte Zeit gebraucht wird, bis die Konzentrationen von Blut und Einatmungsluft ausgeglichen sind. Ebenfalls ein Faktor, der das Erreichen des Toleranzstadiums beeinflusst, stellt die Lipidlöslichkeit des Narkotikums dar, da sie die Diffusion des Stoffes in das Gehirn bestimmt, wobei das Gehirn das Zielorgan und Hauptwirkungsort des Narkotikums ist. Inhalationsnarkotika mit hoher Lipidlöslichkeit, wie zum BeispielHalothan, können in der Einleitungs – und Erhaltungsphase mit einer geringeren Konzentration dosiert werden, als Narkotika mit einer geringeren Lipidlöslichkeit. Ebenso interagiert die Lipidlöslichkeit direkt proportional mit der MAC (minimale alveoläre Konzentration) von Inhalationsnarkotika, die zu einer bestimmten Narkosetiefe führen. Das bedeutet, je geringer die Lipidlöslichkeit, desto niedriger kann die MAC sein, um die gewisse Narkosetiefe zu erreichen (Löscher et al., 2006) (Beubler, 2006).
Isofluran und Sevofluran
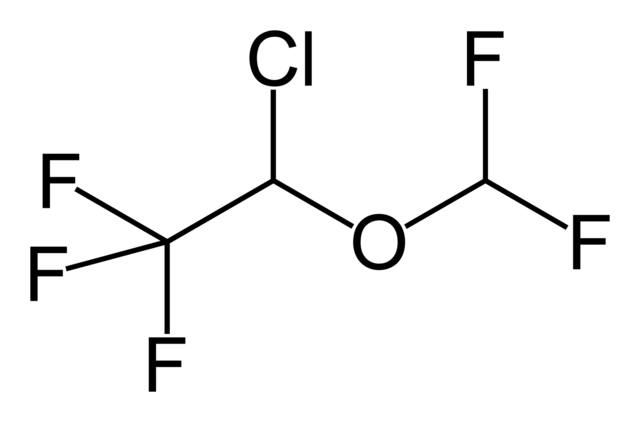
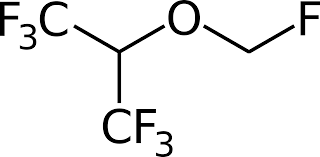
Die leichtflüssigen AnästhetikaIsofluran (siehe Abbildung 3)undSevofluran (siehe Abbildung 4) gehören zu der Gruppe der Flurane und sind somit, wie Enfluran, halogenierte Ether. Zudem sind sie ein Strukturisomer des Enflurans.
Die Strukturformel von Isolufuran |
Die Strukturformel von Sevofluran |
|
|
Abbildung 3 |
Abbildung 4 |
Summenformel: C3H2ClF5O |
Summenformel: C4H3F7O |
Sie bewirken nach der Inhalation einen Zustand der Allgemeinanästhesie. Durch die niedrigen Verteilungskoeffizienten von Blut und Gas, finden die Einleitung als auch die Ausleitung der Narkose, sowie Reaktionen auf veränderte Konzentrationen rapide statt. Hierbei zeichnet sich Sevofluran besonders durch ein schnelles An-und Ausleiten aus (Perez Perez, 2016) (Beubler, 2006).
Durch eine Erhöhung der Dosis des Narkotikums, nehmen das Atemzugvolumen und die Atemfrequenz ab. Das Tier zeigt einen fortschreitenden Verlust des Bewusstseins, der Muskelkontraktion und der Reflexe. Die Atemdepression wird selbst bei tiefer Narkose durch die chirurgische Stimulation zu Teilen aufgehoben. Beide haben keine oder nur wenig ausgeprägte analgetische Eigenschaften, deshalb wird der Bedarf des Patienten an einemAnalgetikum vor der Ausleitung der Narkose berechnet. Bei Pferden, Hunden, Katzen, Kleintieren, Reptilien, Ziervögeln und Brieftauben dürfen nur Isofluran und Sevofluran als Inhalationsnarkotika verwendet werden, da kein Wechsel zu humanmedizinischen Narkotika stattgefunden hat (Perez Perez, 2016).
Isofluran wird nur in sehr geringem Ausmaß metabolisiert, wodurch eine negative Wirkung auf die Leber und die Niere ausbleibt. Im Durchschnitt wird Isofluran fast unverändert über die Lunge ausgeschieden. Es ist als einziges Inhalationsnarkotikum bei lebensmittelliefernden Tieren zugelassen, jedoch führt sein hoher Preis zu einer geringeren Benutzung in der Veterinärmedizin. Im Gegenteil zu Enfluran bewirkt Isofluran keine zentrale Erregung. Durch seine niedrige Löslichkeit im Blut finden hier ebenso ein schnelles An-und Abfluten statt. Zur Erhaltung des Toleranzstadiums wird Isofluran mit Stickoxydul kombiniert. Als Nebenwirkungen tritt durch den Gebrauch von Isofluran eine Senkung des Blutdruckes auf. Das Risiko zur malignen Hyperthermie ist bei Isofluran geringer als bei Halothan, ebenso wie dessen Sensibilisierung des Herzens gegen Catecholamine (Perez Perez, 2016).
Der für eine effektive, aber für den Organismus möglichst schonende Narkose sehr wichtige Blut- Gas-Verteilungskoeffizient, beträgt für Sevofluran etwa 0,65 und für Isofluran 1,4. Dies bedeutet, dass bei einer Konzentration von 1 Volumenprozent in den Lungenbläschen die Konzentration im Blut bei 0,65 bzw. 1,4 Volumenprozent (Vol %) liegt. Die sehr geringe Hydrophilie sorgt bei der Narkose für eine sehr schnelle Einleitungs- und Ausleitungsphase. Die minimale alveoläre Konzentration (MAC) liegt für Isofluran bei 1,2% und für Sevofluran bei 2%; damit zeigt Sevofluran eine deutlich geringere Potenz als Isofluran auf (Perez Perez, 2016).
Inhalations- narkotikum |
Siedepunkt (°C) |
Spezifisches Gewicht |
Dampfdruck (mmHg bei 20°C) |
Maximal erreichbare Konzentra- tion (%) |
Verteilungs- koeffizient (Öl/Blut) |
Verteilungs- koeffizient (Blut/Gas) |
Verteilungs- koeffizient (Gehirn/Blut) |
Dauer der Einteilung (min) |
Narkotisch wirksame Konzentration in der Einatmungsluft (%) (Einleitung) |
Narkotisch wirksame Konzentration in der Einatmungsluft (%) (Einhaltung) |
Isofluran |
48,5 |
1,45 |
250 |
33 |
1,4 |
2,6 |
3-5 |
15-25 |
|
|
Sevofluran |
58,5 |
|
160 |
21 |
53* |
0,65 |
1,7 |
kurz |
5-7 |
3,3-3,8 |
(Löscher et al., 2006)
Sonstige Inhalationsnarkotika
- Halothan: ist ein halogenierter Kohlenwasserstoff, welches eine hohe Lipidlöslichkeit besitzt. Halothan wird heutzutage in den USA und Europa nicht mehr als Inhalationsnarkotikum verwendet, da es durch Isofluran und Sevofluran ersetzt wurde. Des Weiteren ist es nicht brennbar und bewirkt keine Reizung auf die Atemwege. In Bezug auf seine physiokinetische Wirkung, unterscheidet Halothan sich von anderen Inhalationsnarkotika insofern, dass es eine bronchodilatorische Wirkung hat. Ergänzend dazu entfaltet Halothan seine Wirkung auf den Kreislauf durch eine Bradycardie und eine Herabsenkung des Blutdrucks. Durch die Anwendung von Halothan kann es zu einer Sensibilisierung gegen Catecholamine kommen, welche eine Tachyarrythmie und im schlimmsten Fall zu einem Herztod durch Kammerflimmern hervorrufen können (Frey und Löscher, 2007).
Enfluran: ist Halothan sehr ähnlich und besitzt eine sehr hohe Löslichkeit im Blut, wodurch sehr schnell das Toleranzstadium erreicht wird. Im Gegensatz zu Halothan bewirktEnfluran eine sehr gute Muskelrelaxation, die durch die zentrale Einschränkung der motorischen Endplatte bewirkt wird. Auf den Kreislauf wirkt Enfluran blutdrucksenkend, die Atemfrequenz ändert sich kaum. Zu den auftretenden Nebenwirkungen von Enfluran zählen durch äußere Einflüsse zugefügte Veränderungen im EEG mit tonisch-klonischen Muskelzuckungen (Frey und Löscher, 2007).
- Distickstoffoxid (N2O, Stickoxydul, Lachgas): ist eines der am meisten verwendeten Narkosemittel mit einem geringen toxischen Anteil. Seine Wirkung ist primär analgetisch, allerdings nicht muskelrelaxierend. Stickoxydul wird mit einem mindestens Dreißig volumenprozentigem Anteil von Sauerstoff gleichzeitig verabreicht, wobei die richtige Tiefe der Narkose nicht ausreicht und nur durch eine Kombination mit Enfluran oder Isofluran erreicht werden kann. Zu den Nebenwirkungen zählen Blutdruckabfall und die Minderung der Atemfrequenz, wobei die Leber, die Nieren und die Darmfunktionen nicht beeinflusst werden. Häufig wird eine Zusammensetzung von Stickoxydul mit halogenierten Äthern wie Enfluran und Isofluran als Kombinationsmöglichkeit verwendet (Beubler, 2006).
Ein Vergleich der verschiedenen volatilen Anästhetika |
||||||
Eigenschaften |
Halothan |
Enfluran |
Isofluran |
Desfluran |
Sevofluran |
|
Hämodynamische Stabilität |
+ |
+ + |
+ + |
+ + |
+ + + |
|
Respiratorische Iritation |
+ + + |
+ + |
+ + |
+ |
+ + + |
|
Induktions Charakteristika |
+ + |
+ |
+ |
0 |
+ + + |
|
Einfachheit der Titration |
0 |
+ |
+ |
+ + + |
+ + |
|
Postoperative Nebeneffekte |
0 |
+ + |
+ |
+ + |
+ + |
|
Potenzielle Toxizität/Metabolismus |
+ |
+ |
+ + |
+ + + |
+ |
|
Beschaffungskosten |
0 |
+ + |
+ + |
+ + |
+ |
|
Skala: '0' = am schlechtesten, '+++' = am besten |
(White 1996)
Geschichte
In den 1930er Jahren begann die Geschichte der Sevofluran-Forschung zur Entwicklung eines sichereren, nicht brennbaren inhalativen Anästhetikums. Chemiker entdeckten, dass die Substitution vonFluor durch andere Halogene den Siedepunkt senkt, die Stabilität erhöht und die Toxizität allgemein verringert (White 1996).
Seit 1946 wurden anästhetische Eigenschaften mehrerer fluorierter Kohlenwasserstoffe beschrieben. Zwischen 1946 und 1959 wurden drei Verbindungen, zwei Ether und ein Kohlenwasserstoff in die klinische Praxis eingeführt: Im Jahre 1951 Fluoroxen von Ohio Medical Products, 1955 folgte Halothan von Ayerst Laboratories und 1959 wurde Methoxyfluran von Abbott Laboratories erstmals synthetisiert. Als anästhesierend wurden mehrere andere fluorierte Ether und Kohlenwasserstoffe eingestuft, keines davon wurde erfolgreich vermarktet. Innerhalb der nachfolgenden 15 Jahre wurde die Forschung intensiviert und mehrere hundert neue fluoriert Verbindungen hergestellt. Hierzu gehörten Enfluran, Isofluran, Sevofluran und Desfluran welche heutzutage in der klinischen Praxis eingesetzt werden. Besagte Stoffe, außer Sevofluran, wurden als Anästhetika patentiert, sind zugelassen und werden zurzeit vermarktet. Als Stoffzusammensetzung wurde Sevofluran patentiert, allerdings vom Hersteller nicht als Anästhetikum weiterentwickelt, weil es die Anforderung an die Stabilität vonNatronkalk nicht erfüllt. Instabil gegenüber Natronkalk waren alle Verbindungen der (CF3)2CHOR-Struktur und wurden aufgegeben (Terell 2008) (White 1996).
1968 wurde Sevofluran von Regan in den Travenol Laboratories, Illinois, erstmals synthetisiert, während er eine Reihe von Halogenmethylpoly-fluorisopropylethern untersuchte. Anschließend beschrieb eine Gruppe von Forschern die Ergebnisse von Tierversuchen, die die wichtigen klinischen Eigenschaften des neuen Anästhetikums charakterisierten. Aufgrund eines fehlerhaften Versuchsplans sollte die Entwicklung später durch scheinbare toxische Effekte behindert werden. Weiteren Forschungsarbeiten verliefen aufgrund der Probleme der Biotransformation und Stabilität mit Natronkalk langsam. Isofluran wurde damals als ein besser geeignetes Medikament für die kommerzielle Entwicklung angesehen. Die Forschung und Entwicklung von Sevofluran wurde weitergeführt und wurde im Jahr 1990 in erstmals Japan freigegeben. In den letzten Jahrzehnten folgten weitere Länder. Weltweit werden derzeit jährlich weit über 2000 Tonnen volatiler Anästhetika hergestellt (Terell 2008) (White 1996).
Wirkungsmechanismus
Allgemeines
Eine in Narkose gelegte Katze |
|
Abbildung 5 |
Die Wirkung eines Inhalationsnarkotikums ist abhängig von der Dosierung. Es gibt zwei verschiedene Theorien, welche die Wirkungsweise der Inhalationsnarkotika beschreiben können. Beide interagieren miteinander und können somit zusammen aufgeführt werden. Eine der beiden Theorien wird durch die Lipidtheorie beschrieben: Hierbei lagert sich das Narkotikum an der Lipidmembran eines Neurons an. Es kommt zu physiologischen Veränderungen der Membran und ihre neuronale Fähigkeit wird aufgehoben. Somit spielt dieLipophilie des Narkotikums eine entscheidende Rolle bei dessen Wirkungsmechanismus. Je lipophiler ein Narkosemittel ist, desto größer ist auch dessen Wirkungsstärke (Dellas, 2018).
Die Interaktion mit den hydrophoben Domänen Ionenkanalproteinen kann als zweite Theorie beschrieben werden: Diese Theorie ist weitaus gebräuchlicher und den modernen Forschungserkenntnissen angepasst. Hierbei sind weder die spannungsabhängigen Natrium- bzw. Kaliumkanäle sowie die Calcium-Kanäle dem narkotischen Effekt zugeordnet. Es kommt viel mehr zu einer Sensibilisierung derGamma-Aminobuttersäure, dem Agonisten desGABA-Rezeptors. Es kommt zu einem Chlorid-Einstrom in die Zelle, sie wird hyperpolarisiert und es wird kein Aktionspotential aufgebaut. Somit kommt es zu einer Zunahme der Chlorid Permeabilität und die Membran wird stabilisiert. Die Narkose sorgt hier für eine Verstärkung des hemmenden Faktors des GABA-Rezeptors. Die Hemmung liegt einem allosterischem Mechanismus zugrunde und ist reversibel. Zusätzlich kann der erregende Transmitter Glutamat als Teilnehmer am Wirkungsmechanismus des Inhalationsnarkotikums aufgeführt werden. Der Glutamat-Rezeptor wird gehemmt (Lüllmann et al., 2006) (Sirois et al., 2000) (Hoggard et al., 2019).
Pharmakologie
Hier kann man als die zwei wichtigsten Parameter die Löslichkeit und dieminimal alveoläre Konzentration eines Narkotikums (MAC) aufführen. Auch sind die Aufnahme in das Gewebe und die pulmonale Elimination zu beachtende Aspekte. Es wird sich hier auf die Löslichkeit des Narkotikums im Blut bezogen. Man spricht auch von dem sogenannten Blut-Gas-Verteilungskoeffizienten. Dieser wird beschrieben durch die Zeiteinheit, welche benötigt wird um den Partialdruck zwischen Inhalationsgemisch und Alveolarraum auszugleichen (Dellas, 2018).
Die minimale alveoläre Konzentration (MAC) beschreibt die Konzentration eines Inhalationsnarkotikums, welche bei 50 Prozent der Patienten zu keinerlei Schmerzreaktionen und keiner Reizwahrnehmung mehr führt. Das Produkt aus der Lipidlöslichkeit und der minimalen alveolären Konzentration ist konstant. Somit tritt eine Narkose erst dann ein, wenn eine bestimmte Molekülanzahl im zentralen Nervensystem gelöst ist. Je geringer die minimale alveoläre Konzentration, desto höher ist die narkotische Wirkung des Inhalationsnarkotikums (Lüllmann et al., 2006).
Durch die Aufnahme des Inhalationsnarkotikums in das Gewebe kann die Zeit des Wirkungsbeginns dokumentiert werden. Ein besser durchblutetes Gewebe kann das Inhalationsnarkotikum weitaus schneller aufnehmen. Somit setzt dort auch die Wirkung des Inhalationsnarkotikums schneller ein. Zu den gut durchbluteten Geweben unseres Körpers gehört zum Beispiel das zentrale Nervensystem. Jedoch kommt es nach einer gewissen Zeit zu einer Umverteilung des Wirkstoffes in alle Teile unseres Körpers. Die pulmonaleElimination beschreibt alle Vorgänge, um das Inhalationsnarkotikum durch die Lunge aus dem Körper zu bekommen. Sie ist bei Stoffen mit geringer Blut- und Lipidlöslichkeit besonders schnell (Dellas, 2018).
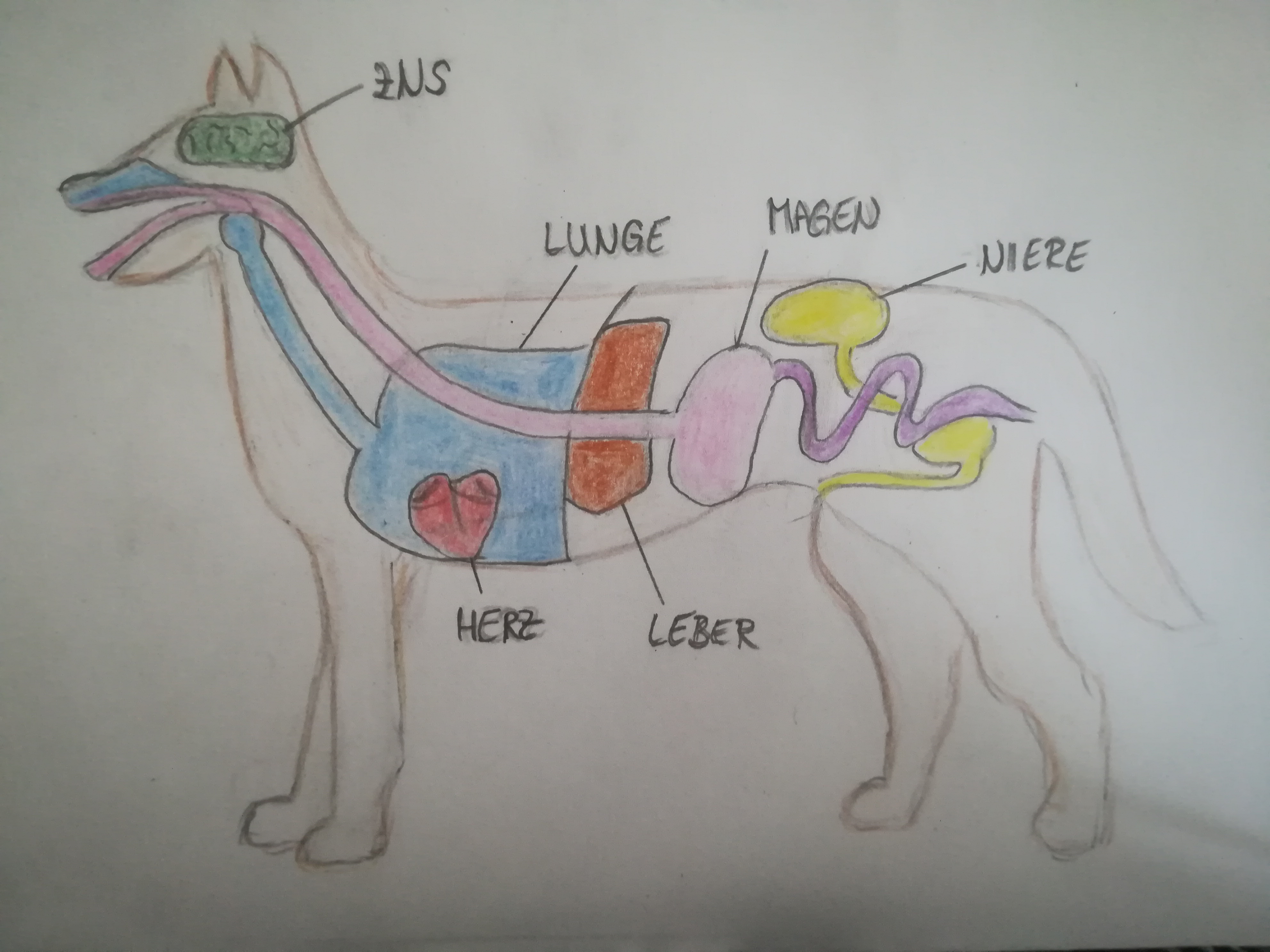
Wirkung auf die Organe
In der Abbildung 6 sind schematisch eine Organe dargestellt, welche unter der Wirkung von Inhalationsnarkotika stehen können.
Atmung
Durch die Verabreichung von Inhalationsnarkotika kommt es zu einer Erhöhung der Atemfrequenz und das Tidalvolumen verringert sich (Becker und Rosenberg, 2008).
Bei Halothan, Enfluran und Isofluran kommt es zu einerHypoventilation. Somit ist bei der Verwendung von diesen drei Mitteln eine künstliche Beatmung obligatorisch und definitiv angemessen (Löscher et al., 2006).
Verwendet man Lachgas so kommt es bei einer leichten bis moderaten Sedierung zu kaum einer Einschränkung der Atmung. Kombiniert man jedoch Lachgas mit Opioiden oder Beruhigungsmitteln kommt es zu einer klinisch relevanten Atemdepression (Becker und Rosenberg, 2008).
Betrachtet man die Veränderungen der Lungen so lässt sich eine Erweiterung der in der Lunge lokalisierten Gefäße feststellen. Tritt ein Sauerstoffmangel ein so kommt es durch die Gabe von Inhalationsnarkotika zu einer Vasokonstriktion der Lungengefäße (Hoggard et al., 2019).
Herz
Durch die Verwendung von Halothan kommt es zu einer stark depressiven Wirkung auf das Herz. Dies kann mit der Hemmung von der Freisetzung von Noradrenalin in der Peripherie sowie mit der Hemmung vom vasomotorischen Zentrum im Hirnstamm erklärt werden. Zusätzlich kommt es zu einerBradykardie durch einen erhöhten Vagotonus und zur Abnahme der Kontraktionskraft des Herzens. Außerdem kommt es zu einer Sensibilisierung gegen Catecholamine (Löscher et al., 2006).
Lachgas vermindert die Kontraktilität des Myokards leicht. Jedoch wird dies durch die sympathische Aktivität nicht bemerkt. Kommt es jedoch zu einer Kombination mit Opioiden so nimmt der sympathische Tonus ab und die Auswirkungen des geschwächten Herzmuskels werden sichtbar. Bei Patienten mit einem vorbelasteten Herzen ist dies signifikant zu wissen, denn es kommt zu einer höheren Anfälligkeit gegenüber Nebenwirkungen, welche die Funktion des Herzens beeinträchtigen (Becker und Rosenberg, 2008).
Kreislauf
Durch die Verwendung von Halothan kommt es zu einer Depression des Kreislaufs, da die pressorische Kreislaufregulation in Narkose ausgeschalten ist. Bei der Gabe von Sevofluran kommt es zu einem Blutdruckabfall was von einerTachypnoe gefolgt ist. Das heute nicht mehr gebräuchliche Diethylether führt erst in tiefer Narkose zu einer Depression des Kreislaufs (Löscher et al., 2006) (Dallas, 2018).
Lachgas hält den arteriellen Blutdruck stabil. Es kommt jedoch zu einer Erhöhung des Venentonus wodurch der Rückfluss zum Herzen verstärkt wird. Durch diese Eigenschaft kann Lachgas auch bei Patienten verwendet werden, welche bei Venenpunktionen Probleme mit der Blutabgabe zeigen (Becker und Rosenberg, 2008).
Muskulatur
Inhalationsnarkotika haben oft eine eigene muskelrelaxierende Wirkung, was vor allem bei der zusätzlichen Gabe von Muskelrelxantien beachtet werden muss. Die Intensität der muskelrelaxierenden Wirkung ist von den verschiedenen Inhalationsnarkotika abhängig. Beim Schwein kann durch die Gabe von Halothan eine besonders extreme Kontraktion der Skelettmuskeln oder eine Rigidität der Muskulatur beobachtet werden (maligne Hyperthermie). Dies lässt sich erklären durch eine genetisch bedingte Disposition der Calcium-Transportvorgänge in der Muskulatur selbst. Halothan bewirkt somit eine abrupte Freisetzung von Calcium-Ionen, welche dann zur oben aufgeführten maligne Hyperthermie führt (Löscher et al., 2006).
Lachgas besitzt keinerlei muskelrelaxierende Wirkung. Es kann zu einerHyperthermie kommen wodurch die Wirkung auf die Muskulatur negativ bewertet sein kann. Oftmals ist die Hyperthermie genetisch bedingt, dies wurde jedoch auch bei Personen ohne genetische Disposition beobachtet (Becker und Rosenberg, 2008).
Schematische Darstellung einiger Organe auf welche Inhalationsnarkotika wirken |
|
Abbildung 6 |
Verdauung
Durch die schon aufgeführte muskelrelaxierende Wirkung kann auch der Magen-Darm-Trakt durch Inhalationsnarkotika gehemmt werden. Somit kommt es zu einer Motilitätseinschränkung, welche auch postoperativ anhalten kann. Dies ist vor allem bei dem nicht mehr verwendeten Diethylether nachweisbar (Löscher et al., 2006).
Niere
Sowohl Sevo- als auch Isofluran wirken auf die Niere toxisch. Diese toxische Wirkung ist jedoch nur geringfügig ausgeprägt und nachgewiesen. Es kommt zu einer Zunahme der glomerulären Filtrationsrate der Niere. Außerdem erhöht sich das Verhältnis von Proteinen zu Kreatinin im Harn. Man findet jedoch keinerlei Glukose sowie Albumin im Harn, nach der Eingabe von Inhalationsnarkotika, vor (Ong Sio et al., 2017).
Leber
Durch die Verwendung von Halothan kann es zu Leberschädigungen führen, welche tödlich enden können. Somit ist empfiehlt sich nur eine einmalige Verwendung von Halothan (Löscher et al., 2006).
Zentrales Nervensystem
Durch Isofluran wird die Exocytose in den Sekretvesikeln der Dopamin gesteuerten Neuronen gehemmt. Dies geschieht durch eine direkte Hemmung des Calcium-Ionen Stroms. Es ist ein präsynaptischer Mechanismus, welcher eine Grundlage für die Rolle des Dopamin gesteuerten VTA-Neurons bildet (Torturo et al., 2019).
Literaturverzeichnis
Fachartikel und Einzelnachweise
Dissertation von Perez Perez, C. R. (2016): Vergleich der Wirksamkeit von zwei verschiedenen Adsorberfiltern zur Vermeidung der Kontamination mit Narkosegasen; Magister medicinae veterinariae der Veterinärmedizinischen Universität Wien (Klinische Abteilung für Anästhesiologie und perioperative Medizin)
https://www.vetmeduni.ac.at/hochschulschriften/diplomarbeiten/AC13271626.pdf
Hoggard, A.; Shienbaum, R. und Singh, P. (2019): Gaseous Anesthetics, Treasure Island (FL): StatPearls Publishing
https://www.ncbi.nlm.nih.gov/books/NBK539880/#article-22065.s2
Sirois, J. E.; Talley, E. M.; Lynch A. und Bayliss D. A. (2000): The TASK-1 Two-Pore Domain K+ Channel Is a Molecular Substrate for Neuronal Effects of Inhalation Anesthetics, Journal of Neuroscience, 20 (17) 6347-6354
http://www.jneurosci.org/content/20/17/6347.short
White, P. F.; Smith, I. and Nathanson, M. (1996): Sevoflurane - A long-awaited volatile anaesthetic, in BJA British Journal of Anaesthesia 76(3):435-45
https://www.researchgate.net/publication/14418005_Sevoflurane_-_A_long-awaited_volatile_anaesthetic
Becker, D.E. und Rosenberg, M. (2008): Nitrous Oxide and the Inhalation Anesthetics, Anesth Prog.; 55(4): 124–131
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2614651/?_escaped_fragment_=po=13.0769
Ong Sio, C. L.; dela Cruz, R. G. C. und Bautista, A. F. (2017): A comparison of renal responses to sevoflurane and isoflurane in patients undergoing donor nephrectomy: a randomized controlled trial, Department of Anesthesiology, University of Oklahoma Health Sciences Center, Oklahoma City, OK, USA; Med Gas Res.;7(1):19-27. doi: 10.4103/2045-9912.202906. eCollection
https://pdfs.semanticscholar.org/96e5/240bb23a58b61fdbcc9ee8a325843e0ccf13.pdf
Torturo, C. L.; Zhou, Z.-Y.; Ryan, T. A. und Hemmings, H. C. (2019): Isoflurane inhibits dopaminergic synaptic vesicle exocytosis coupled toCaV2.1 and CaV2.2 in rat midbrain neurons;6(1). pii: ENEURO.0278-18.2018. doi: 10.1523/ENEURO.0278-18.2018. eCollection
Fachliteratur
Terell, R. C. (2008):The Invention and Development of Enflurane, Isoflurane, Sevoflurane, and Desflurane, Anesthesiology, Vol.108, 531-533. doi:10.1097/ALN.0b013e31816499cc
http://anesthesiology.pubs.asahq.org/article.aspx?articleid=1932765
Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker (Berlin, Wien 2006): Pharmakotherapie bei Haus- und Nutztieren, Georg Thieme Verlag, 7. Auflage, ISBN: 3830441606; Bezüglich der Tabelle 1: Mit freundlicher Genehmigung des Georg Thieme Verlags
Eckard Beubler (Graz, 2006): Kompedium der Pharmakologie: Gebräuchliche Arzneimittel in der Praxis, Springer Verlag, 2. Auflage, ISBN: 3-211-25535-4
Hans-Hasso Frey und Wolfgang Löscher (Stuttgart, 2007): Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin, Enke Verlag, 2. Auflage, ISBN: 978-3-8304-1070-6
Claudia Dallas (Göttingen, 2018): Last Minute Pharmakologie, Elsevier Verlag, 3. Auflage, ISBN: 978-437-43084-8
Heinz Lüllmann, Klaus Mohr und Lutz Hein (2006): Pharmakologie und Toxikologie: Arzenimittelwirkungen verstehen - Medikamente gezielt einsetzen, Thieme Verlag, 16. Auflage, ISBN: 978-3-13-368516-0
Abbildungsverzeichnis
Abbildung 1: https://upload.wikimedia.org/wikipedia/commons/3/39/Revisi%C3%B3n_%C3%81guila_real.JPG Lizenzveröffentlichung siehe Wikimedia
Abbildung 2: https://upload.wikimedia.org/wikipedia/commons/b/b7/Vaporizer.jpg Lizenzveröffentlichung siehe Wikimedia
Abbildung 3: https://upload.wikimedia.org/wikipedia/commons/0/06/Isoflurane2.png Lizenzveröffentlichung siehe Wikimedia
Abbildung 4: https://upload.wikimedia.org/wikipedia/commons/2/25/Sevoflurane.svg Lizenzveröffentlichung siehe Wikimedia
Abbildung 5: Selbstangefertigte Abbildung von Tara Beck
Abbildung 6: Selbstangefertigte Abbildung von Tara Beck
Tara Beck, Johanna Fritz und Chiara Feige