A krokodilok hőmérsékletfüggő ivarmeghatározásának háttere és evolúciós előnyei
Contents
Bevezetés
Az élőlények különböző szaporodási stratégiái fajfenntartás mellett az ideális méretű és ivararányú populáció megteremtését is szolgálják.
A szaporodási stratégiák egyik típusa a genotípus által meghatározott ivar (genotypic sex determination, GSD). Ebben az esetben az utód nemét annak ivari kromoszómái szabják meg, és ennek a véglegesítése a magzati kor nagyon korai szakaszában történik meg. Az ivari kromoszómák fajtól függően akár a hímekben, akár a nőstényekben mutathatnak heteromorfizmust, de előfordulhat az is, hogy sem a hím, sem a nőstény nem rendelkezik heteromorf ivari kromoszómákkal. Ezt az ivar determináló módszert az emlősök mellett a madarak, és sok hüllőfaj is alkalmazza. (Wibbels és mtsai., 1994)
A szaporodási stratégiák másik formája a környezet által meghatározott ivar (environmental sex determination, ESD). Ennek egyik változata a hőmérséklet által megszabott ivar (temperature-dependent sex determination, TSD), amely számos hüllőre, valamint a Crocodilia rend összes fajára jellemző. A TSD szaporodási formának a lényege, hogy az utódok nemét a magzat fejlődésének egy bizonyos szakaszában - általában a középső harmadában - a környezet hőmérséklete alakítja ki. Ezt az időszakot hőmérséklet érzékeny időszaknak (temperature-sensitive period, TSP) nevezik. A TSD stratégiát követő krokodilok vizsgált kariogramjaiban egyik nemben sem találtak heteromorf ivari kromoszómákat (Cohen és Gans, 1970). A TSD és a GSD rendszerek közötti kapcsolatra többféle elmélet született, azonban ezek közül még egyik sem nyert teljes bizonyosságot. (Wibbels és mtsai., 1994)
TSD
Az alábbiakban szeretnénk ismertetni olyan elméleteket, amelyek a TSD működésének molekuláris, endokrinológiai és genetikai hátterét magyarázzák, valamint hogy az évek során ezek megítélése hogyan változott.
Endokrinológia
Az endokrinológiai kísérletek az elsők közé tartoztak, amellyel a tudósok a TSD mögött álló folyamatokat próbálták feltárni.
Ennek egyik formájaként exogén úton bejuttatott szteroid hormonok hatását vizsgálták a fejlődő embriókban (Raynaud és Pieau, 1985). Ennek a kísérletnek az volt a célja, hogy felderítsék, hogy a hormonok milyen kapcsolatban állnak a TSD-t kiváltó hővel. A kísérletek egyik részében az ösztradiol hatását vizsgálták hím egyedeket létrehozó hőmérsékleten (male producing temperature, MPT), másik részében androgének hatását a nőstény utódokat produkáló hőmérsékleten (female producing temperature, FPT). Az első esetben több tanulmány is azt találta, hogy a gonádok kortikális része megvastagodott, valamint a velői rész is női nemi jegyeket kezdett mutatni, sőt egyes egyedekben teljes petefészkek fejlődtek ki. Az az időszak, amikor az ösztradiol hatása legerőteljesebben érvényesült a magzaton egybeesett a TSP-vel (Gutzke és Chymiy, 1988; Wibbels és mtsai., 1991). Ebből arra következtettek, hogy az exogén ösztradiolnak és a hőnek szinergikus hatása van a nőstény egyedek fejlődésére (Wibbels és mtsai., 1991). Az androgén hatás esetében a tudományos cikkek arról számolnak be, hogy a nem aromatizálódó androgének, például a DHT (dihidrotesztoszteron) képesek FPT-n hím egyedek létrehozására, ám sokkal gyengébb maszkulinizáló hatása van az ösztradiol feminizáló hatásához képest. Egyes kísérletek során azt tapasztalták, hogy MPT-n tesztoszteront juttatva a magzatokba petefészkek fejlődéséhez vezethet. Ennek magyarázata, hogy a tesztoszteron ösztrogénné aromatizálódik, ezzel a női nemi jegyek kialakulását segíti elő (Pieau, 1974; Gutzke és Bull, 1986; Crews és mtsai., 1991; Wibbels és Crews, 1992). A fentieket támasztja alá az a tanulmány is, amelyben FPT-n aromatáz enzim gátló anyagokkal képesek voltak hím utódokat létrehozni (Dorizzi és mtsai., 1994).
Az exogén szteroid hormonok hatása alapján következtethetünk arra, hogy ezek a hormonok a természetben endogén úton is szerepet játszanak a hőmérséklet mellett a nemek kialakításában. Számos tanulmány foglalkozik ezek hatásaival, és mennyiségi változásaikkal az embriók különböző fejlődési stádiumaiban valamint a rájuk ható enzimekkel. Főleg teknősökön végeztek vizsgálatokat aromatáz és HSD (hidroxiszteroid dehidrogenázok) enzimekkel (Merchant-Larios és mtsai., 1989; Thomas és mtsai., 1992). Az aromatáz enzimről azt találták, hogy FPT-n a fejlődés előrehaladtával nőtt a mennyisége, míg ez MPT-n nem volt megfigyelhető (Desvages és Pieau, 1992a). Egy másik kísérletben azt vizsgálták, hogy hogyan változik az aromatáz mennyisége, ha FPT-ről MPT-re helyezik át a fejlődő tojásokat és fordítva. A tesztek során azt fedezték fel, hogy ha FPT-re kerülnek át a tojások az aromatáz aktivitásuk megnövekszik, ha pedig MPT-re akkor csökken. Az aromatáz aktivitást a citokróm P-450 aromatáz termelődésére vezették vissza, nem közvetlenül a hőmérséklet által befolyásolt enzimaktivitásra (Desvages és Pieau, 1992b). Az enzimműködés mellett több tanulmány vizsgálja maguknak a szteroid hormonoknak az endogén jelenlétét az embrió fejlődése során, amelyeket a gonádokból, a mellékvese-gonád komplexből (adrenal-kidney-gonad complex, AKG) és szérumból próbáltak kimutatni. A gonádokból egy teknősfajt vizsgálva radioimmunoassay technikával Dorizzi és munkatársai képesek voltak kimutatni a magasabb ösztrogén szintet az FPT-n fejlődő embriókból, mint azokból amik MPT-n növekedtek (Dorizzi és mtsai., 1991). Az AKG komplexből White és Thomas progeszteront és kortikoszteront tudtak kimutatni in vitro (White és Thomas, 1992). A hormonok egymáshoz viszonyított aránya és mennyisége fajonként nagy eltéréseket mutatott, így egyes cikkek azt feltételezték, hogy ha ezeknek a hormonoknak van hatása a TSD-ben akkor nem a mennyiségük, hanem az egyes szteroidoknak az egymáshoz viszonyított aránya a lényeges (Bogart, 1987).
Napvilágot láttak olyan teóriák is, miszerint a tojássárgájában található szteroidok befolyásolják az eltérő ivarok kialakulását (Elf, 2003). Ebben a tanulmányban kimutatták, hogy a hüllőknél már a tojás lerakásakor találhatók szteroid hormonok a tojássárgájában, mint például az ösztradiol-17β, androsztenedion, tesztoszteron, progeszteron és a kortikoszteron. Viszont ezen anyagok mennyisége még a TSP előtt közel 90%-kal csökken (Conley és mtsai., 1997), így ezeknek nem lehet komolyabb befolyásoló szerepe az utódok nemének meghatározásában (Lance, 2009).
Genetika
A huszadik század végén egyre több módszer állt a tudósok rendelkezésére a különböző fajok genomjának vizsgálatára, így ez a terület egyre hangsúlyosabbá vált. Ebben az időszakban kezdődött meg a TSD genetikai hátterének vizsgálata is.
Az első felfedezések Koopman és munkatársai Y kromoszómához kötött Sry (Sex-determining Region Y) gén emberben és egérben történő kimutatásához fűződnek (Koopman és mtsai., 1990). Erről a génről Koopman bebizonyította a herék fejlődésében betöltött központi szerepét (Koopman és mtsai., 1991). Azokban a nőstény egerekben, amelyekbe transzgenikusan beültették az Sry gént, herék kialakulását figyelték meg. Az Sry gén egy olyan fehérjét kódol, ami egy DNS-kötő domént is tartalmaz. Coriat és munkatársai megpróbálkoztak aligátorból egy homológ Sry génszakasz izolálásával PCR segítségével (Coriat és mtsai., 1993). Aligátor Sry gént nem tudatak kimutatni, viszont nyolc olyan DNS-szakaszt találtak, ami hasonlóságot mutatott az Sry gén DNS-kötő doménjével, de leginkább az egerek Sox génjeire hasonlított. Az Sox (Sry-type high mobility group box) géncsalád által expresszált fehérjék szintén tartalmaznak egy DNS-kötő domént, amely szekvenciája nagy mértékben egyezik az Sry gén ennek megfelelő szakaszával. Ez a géncsalád az embryogenesis alatt tölt be fontos szerepet a központi idegrendszer, a herék és porcok fejlődésében (Jiang és mtsai., 2013).
Az Sry és Sox gének által termelt fehérjék in vitro az A/TA/TGAAAG bázissorendű DNS-szakaszokhoz tudnak kötődni (van de Wetering és Clevers, 1992). Ezt felhasználva kísérleteztek Johnston és munkatársai (Johnston és mtsai., 1995). Csak hímeket vagy csak nőstényeket produkáló hőmérsékletekről vettek mintákat aligátor embriókból az urogenitális traktusból és az agyból. A mintából minden fehérjét kivontak, majd a fent említett bázissorrendet tartalmazó DNS-szakaszt elegyítettek hozzá. Ezután a fehérjéket gélelektroforézis segítségével megfuttatták, és míg az agyból származó mintákban nem találtak semmi rendkívülit, a hím egyedek urogenitális traktusából vett minták esetén egy kiugró sávra lettek figyelmesek. A kísérlet egy olyan fehérje jelenlétét igazolta, amely hasonló DNS-kötő doménnel rendelkezik mint az Sry és Sox gének. Arról, hogy ebben a rendszerben milyen szerepe van a hőmérsékletnek, csak hipotézisek születtek. Az egyik szerint a transzkripciót befolyásolhatja direkt vagy indirekt úton, amely során az eltérő hőmérsékleteken eltérő transzkripciós faktoroknak lehet jelentősége. Így a fehérje jelenléte vagy hiánya határozza meg az utódok nemét. A másik elgondolásuk szerint a hő közvetlenül a fehérjében okoz komformációs változást, amely így maga válik egy transzkripciós fakatorrá, és a hím egyedek kifejlődéséért felelős géneket fogja aktiválni.
Újabb kutatások a nőstény utódok kialakulását is vizsgálják, az ösztrogén vitathatatlan szerepe alapján a TSD-ben. Az aromatáz génjéről történő transzkripció magasabb azokban az embriókban, amelyek FPT-n voltak inkubálva, mint azokban az embriókban amelyek MPT-n (Jeyasuria és Place, 1998). A FOXL2 génjének expressziója hasonlóképpen az aromatázhoz magasabb a várhatóan nőstény egyedekben, mint a hímekben (Shoemaker és mtsai., 2007). Ez a gén egy transzkripciós faktort kódol, amely elengedhetetlen a petefészek szomatikus granulosa sejtjeinek megfelelő aktivitásáért. Ezek felelősek az oocyták táplálásáért, a folliculusok kialakulásáért és működéséért (Uhlenhaut és Treier, 2006). Továbbá az AR (androgén receptor) génről is kimutatták a magasabb expressziót FPT-n (Rhen és mtsai., 2007). Bár az androgének köztudottan a hím egyedek ivari érését biztosítják, megfelelő mennyiségben a petefészkek kialakulásáért is felelősek. Androgén receptor hiányos egerekben már kimutatták a petefészkek fejlődési rendellenességét, továbbá ezek az egyedek kevésbé voltak termékenyek, mint a receptorral rendelkező társaik (Hu és mtsai., 2004).
A fent leírt kísérletek egyik limitációja, hogy a gén expressziós módszerek csupán leíróak, magát a gén valós funkcióját nem vizsgálják. Így ha egy fehérje jelen van egy adott szövetben, adott időben, attól még nem lehetünk biztosak benne, hogy annak a szövetnek a fejlődésében szerepet játszik. Ez fordítva is igaz, hiszen attól hogy egy adott fehérje nincs jelen a fejlődő szövetben, különböző jelpályákon keresztül szerepet játszhat a kialakulásában. (Shoemaker és Crews, 2009)
Molekuláris háttér
Napjaink kutatásai leginkább a TSD mögött húzódó molekuláris háttérre próbálnak fényt deríteni.
Egy erre irányuló tanulmányban Yatsu és munkatársai egy már a korábbiakban jól leírt termoszenzoros mechanizmus alapján a TRP (transient receptor potential) kation csatorna szuperfamíliát vette tüzetesebb vizsgálat alá (Yatsu és mtsai., 2015). Ez a szuperfamília ioncsatornái receptorokként működnek, amiket változatos külső és belső ingerek hozhatnak működésbe. Az általuk felvett információkat kalcium iont alkalmazó jelátviteli utakon keresztül továbbítják (Gees és mtsai., 2012). Ezek a csatornák között van több termoszenzitív is, de ezek közül a TRPV4 csatornát találták a legalkalmasabbnak a kísérleteikhez, mivel ezt a 27-35 °C közötti hőmérséklet aktiválja (Güler és mtsai., 2002), ami leginkább lefedi a legtöbb TSD-t alkalmazó hüllő inkubációs hőmérsékletét. A kutatás során aligátor embriókból vettek mintákat, különböző fejlődési stádiumok során, MPT és FPT alatt inkubált egyedekből egyaránt. PCR-rel sikerült kimutatniuk aligátor TRPV4 csatornákat alkotó fehérjéket, amelyek a két nemben a fejlődési stádiumok során eltérő mértékben fejeződtek ki. Az FPT-n vett mintában az embrió növekedésének előrehaladtával lecsökkent a TRPV4 fehérjéinek a mennyisége. Ebből arra a következtetésre jutottak, hogy az ilyen típusú ioncsatornák valószínűleg a hím utódok kialakulásában játszhatnak fontosabb szerepet. Szintén ebben a tanulmányban egy másik kísérletben a TRPV4 csatornák agonistájával (GSK1016790A) és antagonistájával (RN1734) kezeltek eltérő hőmérsékleteken inkubált embriókat. MPT-n az RN1734 antagonistával kezelt egyedek AMH (anti-mulerian hormon) és Sox-9 downregulációt mutattak kvantitatív RT-PCR mérésekkel. Fenotípusos nemváltást nem tudtak elérni ezzel a módszerrel, csupán a szövettani vizsgálatok során tudtak abnormális ivari elváltozásokat kimutatni a fejlődő hím gonádokban. Ez is alátámasztja, hogy a TRPV4 csatornák feltételezhető nem a női ivarú egyedek kialakulásában játszanak szerepet. A feltételezést továbbá erősíti, hogy az FPT-n GSK1016790A agonistával kezelt egyedekben a CYP19A1 aromatáz enzim mennyiségében nem találtak változást, viszont immunohisztokémiai módszerekkel Sox-9 upregulációt tudtak kimutatni. Ezek az eredmények alapján arra jutottak, hogy a TRPV4 ioncsatornák csupán részei egy sokkal nagyobb és bonyolultabb kaszkádnak, amely a TSD molekuláris hátterét alakítja. (Yatsu és mtsai., 2015)
A krokodilok fészekrakási szokásai
A krokodilok más állatokkal, például a teknősökkel és a madarakkal együtt obligát tojásrakók. Ez azt jelenti, hogy a tojásuk nincs huzamosabb ideig az anyaállat testében (a petevezetőben), hanem viszonylag gyorsan bekerül a fészekbe. Ezek a tojások kemény héjúak, melegítésüket pedig ezen állatcsoportok tagjai különböző módokon oldják meg. Míg a madarak a kikelésig tartó idő viszonylag nagy részében rajta ülnek és a saját testükkel melegítik tojásaikat, addig a krokodilok magát a fészküket alakítják ki olyan módon, hogy abban az embriók számára folyamatosan megfelelő, lehetőleg állandó hőmérséklet és páratartalom uralkodjon.
Ennek érdekében például a Crocodylus porosus mindig az esős évszakban fészkel, amikor a hőmérséklet kellően magas és viszonylag stabil. A krokodilok alapvetően kétféle fészket készítenek. Vagy a földbe ásnak egy gödröt és abba rakják le tojásaikat több szintben lefedve, vagy pedig, mint ahogy a C. porosus is teszi különféle növényekből és földből egy kupacot építenek közel egy állandó vízforráshoz. Ennek a kupacnak a közepébe ásnak egy kamrát a tojásoknak, ahová ugyancsak egymás feletti rétegekbe teszik le átlagosan 50 tojásukat kevesebb mint egy óra leforgása alatt. A tojások így az egész keltetési idő alatt vastag réteg földdel el vannak szigetelve a környezettől, így a külső hőmérséklet-ingadozások ellenére a fészek belsejében, a tojásoknál végig nagyjából állandó a hőmérséklet. Ehhez a földréteg szigetelésén kívül az is hozzájárul, hogy a földbe kevert mindenféle növényi részek az egész költési időszak alatt folyamatosan bomlanak, ami hőtermeléssel jár, valamint az egyre növekvő embriók is egyre több hőt adnak le a metabolizmusuknak köszönhetően, ezzel is ellensúlyozva azt, hogy az időjárás a költés vége felé a hideg és száraz évszak beköszöntével egyre hűvösebb.
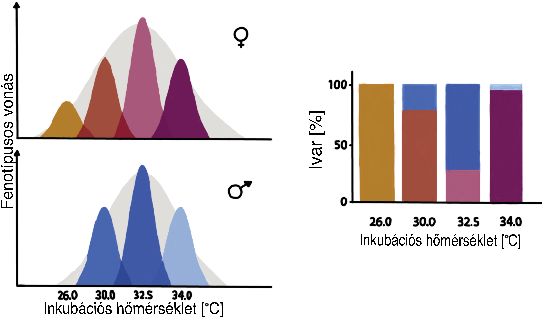
A fészek pontos felépítésében a TSD-nek is fontos szerepe van. A populáció fennmaradása szempontjából lényeges, hogy egy adott fészekaljból hímek és nőstények is keljenek ki, ennek biztosítása érdekében építik meg fészküket a krokodilok a megfelelő módon. A TSD szerepe a fészkek kialakításában a rétegzett tojáselhelyezésben látszik. A fészekben ugyanis a különböző rétegek között 1-3°C-nyi hőmérséklet-különbség is kialakulhat, ez pedig nagyban megnöveli annak az esélyét, hogy a kinti időjárástól függetlenül valamelyik szinten biztosan keljenek ki hím utódok is. A C. porosus esetében az a hőmérséklet, melyen nagy valószínűséggel hímek kelnek ki olyan 31,1-32 °C között van, ez alatt és felett is inkább nőstények fognak kifejlődni (1. ábra).
|
1. ábra: Az inkubációs hőmérséklet befolyásolja az ivararányokat (jobb oldali diagram), |
A tojások lerakása után az anyakrokodil végig, a kikelésig a fészek közelében marad. Amennyiben szükséges kisebb javítgatásokat végez rajta, valamint elüldözi, megtámadja az esetlegesen a tojásokra pályázó kisebb ragadozókat. Annak eredményeképp pedig, hogy ilyen sokat mozog a fészek környékén és konkrétan a fészken is, nagyban tömöríti, erősíti az anyagának a struktúráját, ezzel is növelve a hőmegtartás és -kiegyenlítés hatékonyságán.
A kikelésig tartó idő is nagyban függ az inkubációs hőmérséklettől, hiszen minél alacsonyabb az átlagos hőmérséklet, annál tovább fog tartani az embrióknak míg teljesen, kellően kifejlődnek. Ez 28-33°C-os átlagos inkubációs hőmérsékletek esetén kb. 130-80 napig terjed.
Ezen időszak letelte után a tojások elkezdenek kikelni. A tojásból frissen kibújt fiókák hívogatják anyjukat, aki segít a további tojásoknak a fészek szétszedésével, valamint a ki nem kelt tojások óvatos megharapásával a többi fióka sikeres kikelése érdekében. Miután minden fióka kikelt az anya bevezeti őket a vízbe és körülbelül 2 éves korukig gondjukat is viseli. Jól látszik tehát, hogy az anyai viselkedésnek a krokodilok esetében is nagyon fontos szerepe van mind a fiókák sikeres kifejlődésében, kikelésében, mind az eső két évben való túlélésükben is. (Webb és Cooper-Preston, 1989)
TSD előnyei
Annak ellenére, hogy a kutatók már évtizedek óta foglalkoznak TSD mögött húzódó folyamatokkal, magának a szaporodási formának az előnyeiről még nem született olyan hipotézis, amelyet egyezményesen elfogadnak. Egyes feltételezések szerint ez a reprodukciós stratégia csupán egy olyan ősi forma, amely olyan fajokban maradhatott fenn, amelyek evolúciós zsákutcának tekinthetőek, és jelenleg nem játszik nagyobb szerepet az adott faj adaptációjában. Más elképzelések szerint akár a beltenyészet megakadályozásában is szerepe lehet, ha csak egy ivarú utódok születnek adott hőmérsékleten. (Janzen és Phillips, 2006)
Mindezek közül a legelterjedtebb talán a Charnov-Bull modell, amely szerint olyan fajokban előnyös az ESD, amelyekben az egyedek fittségét nagyban befolyásolja egy adott környezeti tényező, ám a fogantatáskor még nem biztosított, hogy milyen körülmények közé fog az utód világra jönni. Így az adott tényezőre nézve mindig a legfittebb utódok jöhetnek létre. Ilyen környezeti tényező lehet akár az adott területen az ivarok eloszlása, az erőforrások mennyisége és minősége vagy éppen mortalitási faktorok. Ezek mind lehetnek ivarspecifikusak, így míg az egyik nemnek kedvezőbb, addig másiknak kevésbé kedvező feltételeket tudnak biztosítani, ezzel befolyásolva egy adott egyed relatív fittségét is. (Charnov és Bull, 1977)
TSD hátrányai
Globális felmelegedés
A változó globális klímának széles hatásai vannak a különböző ökoszisztémákban élő szervezetekre. A TSD-t mutató fajok különösen ki vannak téve a felmelegedő éghajlatnak, mivel fejlődésük során érzékenyebbek a hőmérsékletre, mint más élőlények.
A környezeti feltételek módosulásai közvetlenül a fészek mikroklímája változásán keresztül, valamint közvetetten az anyai fészkelő viselkedés összetevőire gyakorolt hatásokon keresztül is hatással lehetnek a fészek környezetére, beleértve a fészekhely választást és a fészek architektúráját. A fészek hőmérsékletének mintázatai az időbeli és térbeli tartományokban tükrözik ezeket az összetett kölcsönhatásokat, és betekintést nyújthatnak abba, hogy a fajok hogyan reagálnak a környezeti változásokra. A tényleges fészeküregekből származó hosszútávú adatkészletek azonban ritkák és taxonómiailag korlátozottak.
A krokodilfajok a TSD azon egyedi formáját mutatják, melyet FMF-nek (female-male-female) nevezünk. Mivel az FMF-re az jellemző, hogy a nőstények alacsony és magas hőmérsékleten, a hímek pedig köztes hőmérsékleten születnek (2. ábra), az éghajlatváltozás a hőmérséklet eltolódások mértékétől függően torzíthatja a populáció nemi arányát a hímek vagy a nőstények irányába. Ez a bizonytalanság a krokodilok hosszú generációs idejével és az utódok nemének meghatározásában kizárólag a hőmérséklettől való függéssel párosulva hozzájárul ahhoz, hogy ez az ivarmeghatározási mód sebezhető a gyors környezeti változásokkal szemben. Körülbelül a krokodilfajok fele már a kihalás szélén áll az antropogén fenyegetések miatt, beleértve az élőhelyük pusztítását, környezetszennyezést és az orvvadászatot. Ennek következtében hatékonyan megjósolni a környezeti változás hatásait a krokodilfélékre kihívást jelent.
Megfigyelt összefüggések és előrejelzések szerint a fészkek hőmérséklete 2100-ra 1,6-3,7 °C-kal fog megemelkedni a napi maximum levegőhőmérséklet emelkedésével egyidejűleg. Míg a legtöbb modell a hímek felé erősen torz ivararányt jelez előre 2050-re, addig a 2100-ra vonatkozó prognózisok közel 100% nősténytől közel 100% hímig terjednek.
Az adaptív evolúció és az anyák fészkelő viselkedésének plaszticitása olyan lehetséges mechanizmusokat kínál, amelyek révén a TSD fajok enyhíteni tudják az éghajlat által kiváltott ivararány-eltolódásokat. Különösen a viselkedési alkalmazkodás jelenti a legéletképesebb stratégiát, hogy reagáljanak a gyors klímaváltozásra. Míg a fészek felépítése részben kompenzálja a környezeti változások hatásait, a fészekhely kiválasztása domináns módon befolyásolja az inkubációs hőmérsékletet. (Bock és mtsai., 2020)
|
2. ábra: A krokodilok a TSD-én belül az FMF mintázatot követik. |
Xenobiotikumok
A krokodilokra nézve veszélyt jelent az ember által növekvő mértékben kibocsátott különböző kémiai anyagok, amik hosszú távon a TSD-t alkalmazó fajok ivararányának eltolódásához is vezethetnek.
Ezeket az anyagokat próbálta meg különböző kutatások alapján összegezni, és a jövőben betöltött szerepüket megjósolni S. Kohno (Kohno, 2021). Korábbi tanulmányok alapján több olyan anyagot is talált, amelyek képesek befolyásolni az ivari arányokat TSP alatt, általában nőstény egyedek kifejlődését eredményezve. Az egyik ilyen anyag a CWAF (Corexit 9500-enhanced Water-Accommodated Fraction of crude oil), amely egy emulgeálószer (Corexit) és nyers olaj 1:50 arányú elegye. Ezt az anyagot használták a Deepwater Horizon olajfúrótorony katasztrófája során is, hogy csökkentsék a tenger olaj terheltségét (Kohno, 2021). A CWAF in vitro luciferase assay-el vizsgálva az ösztrogén receptorokon keresztül növelte a sejtek transzkripcióját, valamint az ivari mRNS-esek hímivarú profilját nőivarúvá alakította (Williams és mtsai., 2018). Egy másik ilyen anyag a 17α-etinilösztrogén, amely fogamzásgátlókban található meg. Kísérletek során a 17α-etinilösztrogén aligátorokban az ösztrogén receptorok 1-es típusát aktiválta minden vizsgált egyedben (Kohno és mtsai., 2015), valamint MPT-n nőstény egyedek fejlődését váltotta ki (Matter és mtsai., 1998). Szintén ilyen anyag a BPA (biszfenol-A), amelyet polikarbonát műanyagokban szoktak használni. A kutatások alapján ennek a vegyületnek a hatása nagyban függ az alkalmazott mennyiségtől is. Kisebb koncentráción csak a hím egyedek gonádjainak szövettani rendellenességeit tudták megfigyelni, viszont nagyobb koncentráció már képes volt petefészkek kialakítására MPT-n inkubált egyedekben (Stoker és mtsai., 2003). A fenti tanulmányok alapján egyedül a 17α-etinilösztrogén lehet olyan vegyület, amely képes lenne önmagában befolyásolni a vadon élő krokodil populációk ivari egyensúlyát (Kohno, 2021).
Konklúzió
A TSD tehát alapvetően egy előnyös szaporodási forma, mivel hatékonyabb niche-kihasználás jellemzi. Azt azonban nem lehet megjósolni, hogy a globális felmelegedéshez és az emberiség pusztító tevékenységéhez képesek lesznek e a krokodilok eredményesen alkalmazkodni és ebben a TSD számukra előny vagy éppen hátráltató tényező lesz.
Irodalomjegyzék
Bogart MH (1987) Sex determination: a hypothesis based on steroid ratios. J Theor Biol 128:349–357.
Charnov EL, Bull J (1977) When is sex environmentally determined? Nature 266:828–830.
Cohen MM, Gans C (1970) The chromosomes of the order Crocodilia. Cytogenetics 9:81–105.
Gees M, Owsianik G, Nilius B, Voets T (2012) TRP channels. Compr Physiol 2:563–608.
Gutzke WH, Bull JJ (1986) Steroid hormones reverse sex in turtles. Gen Comp Endocrinol 64:368–372.
Kohno S (2021) Can Xenobiotics Alter the Sex Ratio of Crocodilians in the Wild? Sex Dev 15:179–186.
Uhlenhaut NH, Treier M (2006) Foxl2 function in ovarian development. Mol Genet Metab 88:225–234.
Ábrajegyzék
1. ábra (átrajzolt): Kabelik D, Crews D (2017) 2.10 - Hormones, Brain, and Behavior in Reptiles. In: Hormones, Brain and Behavior (Third Edition) (Pfaff DW, Joëls M, eds), pp 171–213. Oxford: Academic Press. Available at: https://www.sciencedirect.com/science/article/pii/B9780128035924000274 [Accessed May 8, 2022].
2. ábra (átrajzolt): Anon (2009) ETI - Turtles of the World: Information. Available at: https://web.archive.org/web/20091008130605/http://www.eti.uva.nl/turtles/ [Accessed May 8, 2022].