Contents
Xilit tulajdonságai, felhasználása
A napjainkban egyre inkább elterjedő xilit egy 5 szénatomos cukoralkohol, amit főleg édesítőszernek használnak. A xilitet Emil Fisher, német kémikus fedezte fel 1891-ben a D-xilulóz hidrogénezésével. Korai felfedezése ellenére kereskedelmi forgalomba csak a II. világháború idején került. Kezdetben Finnországban gyártották, mert a szacharózhoz alig lehetett hozzájutni. A háború után a xilit kereslete lecsökkent és csak az 1970-es években nőtt meg rá újra a piaci igény. Manapság egyszerűbb és gazdaságosabb előállítása és előnyös tulajdonságai miatt egyre nagyobb teret nyer az alkalmazása. Ugyanakkor természetesen is előfordul alacsony koncentrációban bizonyos gyümölcsökben, zöldségekben és gombákban. Leggyakrabban rágógumikban, italokban, süteményekben és fogászati termékekben használják fel édesítésre főként a cukorbetegek és a diétázni vágyók igényinek kielégítésére. Egyre nagyobb népszerűségének oka, hogy a szacharózhoz viszonyítva ugyanolyan édes, de a kalóriatartalma csak 2/3 annyi, ezért az alacsony szénhidrátbevitelen alapuló diétát folytatók számára ideális cukoralternatíva lehet. Másik kulcsfontosságú tulajdonsága, ami elterjedté teszi az a tény, hogy antiketogenetikus, tehát a sejtekbe jutásához nem igényel inzulint, így megfelelő energiaforrás lehet diabetesben szenvedők számára akár intravénásan akár szájon át. Továbbá a xilit antibakteriális és antibiofilm hatással is bír, ezért ideális fogszuvasodás megelőzésére. Újabb kísérletek alapján ez a cukoralkohol képes meggátolni bizonyos baktériumok szaporodását ezért alkalmas lehet gyermekek heveny középfül-gyulladásának megelőzésére. Ezen előnyös tulajdonságok mellett fogyasztása emberekben biztonságos, azonban a leggyakoribb házi kedvenceink, a kutyák számára végzetes kimenetelű lehet. Túlzott fogyasztása emberekben is okozhat hasmenést, azonban kutyák esetében már minimális mennyiség is súlyos, akár életveszélyes következményekkel járhat, mint hipoglikémia, hipokalémia és májkárosodás (2.ábra). Ebből kifolyólag a xilitnek az állatorvoslásban is jelentősen nő a szerepe, hiszen egyre gyakrabban kerülnek elő mérgezéses esetek (Remport és mtsai, 2018) (Dunayer, 2006).
Az egyéb cukoralkoholok, mint a szorbit vagy a mannit hatása a vércukorszintre vagy az inzulinszekrécióra kutyákban egyáltalán nem jelentős. Bár túl sok fogyasztásuk ozmotikus hasmenést okozhat. A mesterséges édesítők, mint a szaharin, aszpartám és a szukralóz általánosan biztonságosnak vannak tartva és nem okoznak lényeges megbetegedést még nagy adagban elfogyasztva sem (Dunayer, 2006).
A xilit metabolizmusa és forgalma
Az elfogyasztott xilit szervezeten belüli kinetikája jelentős állatfaji eltéréseket mutat. Emberben a felvett mennyiségnek 25-50%-a szívódik fel, a maradék hányad a vastagbélbe kerül, ahol prebiotikumként hasznosulhat. A felszívódás hátterében az áll, hogy a xilit emberben, valamint patkányban és lóban passzívan, egyszerű diffúzióval jut a bélhámsejtekbe, ezután a portális keringésbe, ami elnyújtott és viszonylag kis hatásfokú felszívódást tesz lehetővé (Remport és mtsai, 2018). Emberben átlagosan 3 és 4 óra között van ez az idő intervallum. Kutyában azonban rendkívül gyorsan, szinte teljes mértékben felszívódik valószínűleg az aktív transzportmechanizmusoknak köszönhetően, így már 30 perccel az elfogyasztás után a plazmakoncentráció eléri a csúcsát. Az így a vérbe került xilit nagy része a májban metabolizálódik és kapcsolódik be az anyagcserébe de ezen túlmenően a vese, a zsírszövet, a vörösvérsejtek és a hasnyálmirigy endokrin sejtjei is felhasználják. A korábban említett inzulin független tulajdonsága miatt a máj és az extrahepatikus szövetek passzívan veszik fel, így gyorsan jutnak be a sejtekbe. Az intermedier anyagcserébe belépve xilulózzá oxidálódik. A táplálkozással felvett xilit nagy része egy könnyen indukálható citoplazmatikus poliol-dehidrogenáz enzim segítségével metabolizálódik, de lejátszódhat nem specifikus, NAD+-függő poliol-dehidrogenázok vagy egy specifikus NADP+-függő xilit-dehidrogenáz segítségével is. Az e reakciókban keletkezett redukált koenzimeket a vörösvérsejtek hidrogéndonorként hasznosítják, így részt vehetnek a methemoglobin-reduktáz vagy glutation-reduktáz enzimek működésében. Ezután a xilulóz foszforilálódik a xilulóz-kináz enzim hatására és így a foszforilált formájában beléphet a pentóz-foszfát ciklusba. Itt végül glükóz-6-foszfáttá alakulhat, ami a májban és vesében a glikogén szintézisbe léphet vagy részt vehet az aerob és anaerob glükolitikus folyamatokban (1.ábra). A ciklusba lépett foszforilált xilulóz ribóz-5-foszfáttá is alakulhat, amely további átalakulások során felhasználódhat a nukleotid szintézisben (Remport és mtsai, 2018).
|| 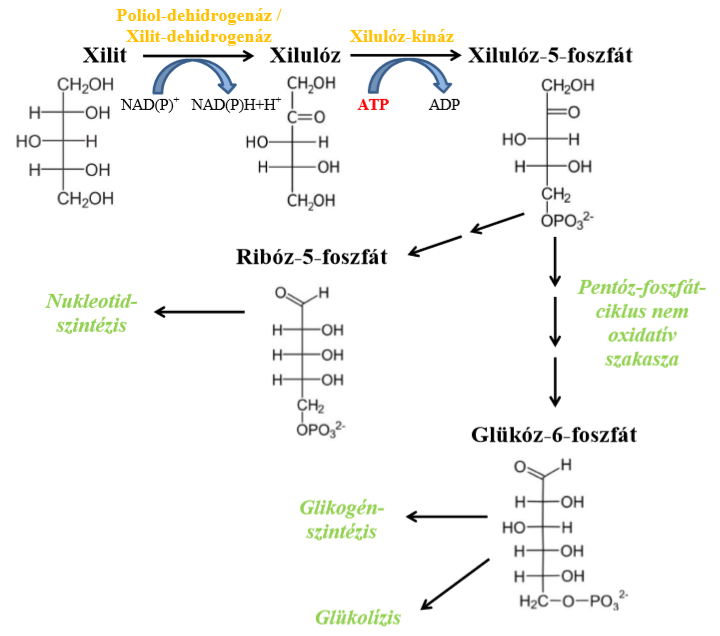 < >1. Ábra< >A xilit anyagcsere legfontosabb lépései (Remport és mtsai, 2018). ||
< >1. Ábra< >A xilit anyagcsere legfontosabb lépései (Remport és mtsai, 2018). ||
A xilit által kiváltott klinikai tünetek és post mortem elváltozások kialakulása
A hipoglikémia kialakulása
A szájon át felvett xilitnél széles a határa a biztonságos mennyiségnek a különböző fajok esetében. Az egerek esetében az LD50 nagyobb, mint 20g/kg, embernél pedig akár 130g xilit/nap elfogyasztása esetén is legfeljebb hasmenés jelentkezhet, de semmi komoly elváltozást nem okoz (Dunayer, 2006) (Murphy és Coleman, 2012). A xilit mérgezés tünetei macskáknál nem ismertek a kevés rendelkezésre álló eset miatt, illetve vadászgörények esetén is csak elszórtan írták le és ebből sem lehet pontos következtetéseket levonni. Kutyáknál azonban más a helyzet. Az APCC (Animal Poison Control Center) által összegyűjtött esetek alapján megállapítható, hogy 100mg/kg xilit fogyasztása esetén várhatóan csak enyhébb klinikai tünetei jelentkeznek a hipoglikémiának, azonban már 50mg/kg fogyasztásánál is ajánlott a kezelés és a vércukorszint ellenőrzése. 500mg/kg dózis esetén kutyáknál már májkárosodás is társulhat az előbb leírt tünetekhez (Murphy és Coleman, 2012).
||  < >2. Ábra< >Káros dózisok a különböző kutyafajtákban (Preventive Vet). ||
< >2. Ábra< >Káros dózisok a különböző kutyafajtákban (Preventive Vet). ||
Kutyáknál már rövid idővel a xilit elfogyasztása után jelentős inzulinszint emelkedés figyelhető meg, ami akár életveszélyes hipoglikémiát is eredményezhet. Ez a mértékű inzulin koncentrációemelkedés hatszor nagyobb is lehet, mint ugyanakkora adag glükóz elfogyasztása után. Ennek hátterében a hasnyálmirigy ß-sejtjeinek membrán áteresztő képességének eltérése áll. A glükóz számára a membrán teljesen átjárható, a xilit azonban csak kisebb mértékben jut be és már az előbb említett úton metabolizálódik és fokozott inzulin elválasztást vált ki. A ß-sejtekre való hatásának mechanizmusa nem teljesen tisztázott, több elképzelés is létezik. Kezdetben specifikus receptorok létezését gondolták a ß-sejtek felületén. Ma már inkább a xilitből képződő metabolitok szerepét tartják jelentősebbnek. Valószínűleg a xilit átalakulásai során képződő glükóz-6-foszfát inzulinotróp hatásával illetve a kálium csatornák működésére hatva fokozza az inzulin szintézisét és leadását. A glükóz esetében a ß-sejtekben csak kis aktivitású enzim hat ugyanerre a folyamatra és ez jelentősen befolyásolja az inzulinválasz kiváltásának sebességét. Ugyanakkor a xilitnél nagy aktivitású enzimek működnek, amelyek nagy mennyiségű glükóz-6-foszfátot eredményeznek, így a gyors felszívódással együtt különösen jelentős mértékű inzulinválaszt válthatnak ki. Továbbá feltételezik, hogy a xilitre érzékeny állatoknál egy bélfalban termelődő inkretin hormonok közé tartozó GIP-hez (glucose-dependent inhibitory peptide) hasonló szintén inzulinotróp hatású peptid is szerepet játszik, mivel már a xilit felszívódása előtt hozzájárul a plazma inzulinszintjének emelkedéséhez. Ezen túl kutyában xilit mérgezés során a fellépő hipoglikémia ellensúlyozására a diabetogén hormonok termelése nőhet, mint a vér adrenalin, glükagon illetve glükokortikoid szintje, ezek azonban a túl magas inzulincsúcs miatt nem képesek elég gyorsan a vércukorszintet normalizálni (Remport és mtsai, 2018).
A xilit elfogyasztása után az általános tünet kutyáknál a hányás. A hipoglikémia átlagosan 30-60 perccel a tápcsatornába jutás után jelentkezik, azonban ez akár 12-48 órára is kitolódhat. A hipoglikémia kezdete változhat attól függően, hogy milyen fajta xilit tartalmú terméket fogyasztott el az állat, továbbá az eltérő inzulinszekréciótól a különböző fajtákban illetve az esetlegesen fennálló májproblémák jelenlététől. A hipoglikémia klinikai tünetei magában foglalják a megváltozott viselkedést, gyengeséget, ataxiát, megváltozott látást, letargiát és rohamokat. Több esetben is előfordult, hogy a xilitfogyasztást hyperglikémia követte, ami a Somogyi jelenség eredménye. Ennek hátterében az inzulin túladagolás ellen termelt diabetogén hormonok állnak, mint a glükagon, kortizol, növekedési hormon, amik végül post-hipoglikémiás hiperglikémiához vezetnek. Bizonyos esetekben hipokalémia és hipofoszfatémia is előfordulhat (Dunayer, 2006) (Piscitelli és mtsai, 2010).
|| 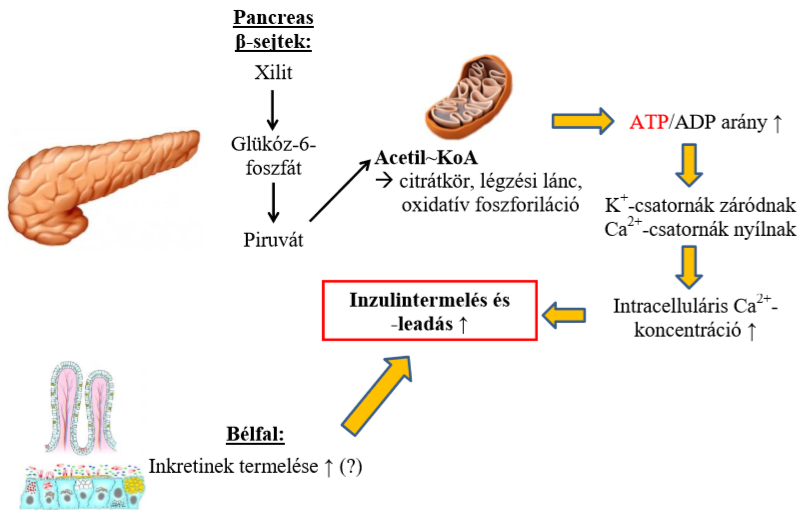 < >3. Ábra< >A xilit ß-sejtek inzulintermelésére gyakorolt hatásainak feltétetlezett mechanizmusai (Remport és mtsai, 2018). ||
< >3. Ábra< >A xilit ß-sejtek inzulintermelésére gyakorolt hatásainak feltétetlezett mechanizmusai (Remport és mtsai, 2018). ||
Xilit által okozott májkárosodás
A xilit májkárosító hatásai, mint a máj enzimek szintjének emelkedése vagy a máj szövetelhalása, csak az utóbbi időkben került előtérbe. A hepatotoxicitása több különböző folyamattal is összefüggésben lehet, de még nem ismert teljesen a hatásmechanizmusa. Májsejttenyészetekben végzett vizsgálat alapján közvetlen károsító hatást a xilit nem fejtett ki a sejtekre, tehát nem beszélhetünk közvetlen toxicitásról. A háttérben két alapvető folyamatot feltételeznek, bár sejthetjük, hogy ennek összetett metabolikus okai vannak. Az egyik elképzelés, hogy a xilit által kialakított hiperinzulinémia következtében a máj energiahiányos állapotba kerül, mivel a felvett glükóz nagy része az inzulin érzékeny extrahepatikus szövetekbe jut. ATP hiányában a májsejtek nem képesek az alapvető fontosságú feladataikat ellátni, mint a fehérjeszintézis vagy a membrán integritása, ami végül a sejtek elhalásához vezet. A másik elmélet, hogy az oxidatív stressz is szerepet játszik, mert a xilit anyagcseréje során az enzimek igénye miatt nagy mennyiségű NADH + H+ keletkezik, ami részt vesz a reaktív oxigén vegyületek keletkezésében. Ezek végül sejt és makromolekula károsító hatásukkal a májsejtek életképességét csökkentik. Ez a két mechanizmus akár együtt akár külön is okozhat májkárosodást. Újabb kutatások szerint a xilit immunválaszt is kiválthat és az ellene termelt antitestek májkárosodást okozhatnak (Remport és mtsai, 2018). A májkárosodásra a laboratóriumi vizsgálat eredményei is utalnak. A jellemző változások ezekben az esetekben: enyhétől súlyosig terjedő hipoglikgémia, meghosszabbodott véralvadási idő, mérsékelt throbocythopenia, emelkedett alanin-aminotranszferáz és alkalikus foszfatáz szint, illetve enyhétől mérsékeltig terjedő hiperbilirubinémia és hiperfoszfatémia. A post mortem megfigyelések is mutatják a xilit májkárosító hatását mivel tipikus a multifokális májsejtpusztulás miatt kiterjedt elhalásos gócok megjelenése illetve a kórszövettani képen is megfigyelhető a májsejtek elhalása és vakuolizációja (Dunayer, 2006) (Piscitelli és mtsai, 2010).
Kezelési módok
A kezelés a bevitt xilit mennyiségétől függ, ezért fontos, hogy meg tudjuk becsülni az elfogyasztott dózist, mert ez segíthet a kezelési mód megfelelő megválasztásában. A pontosabb becslésben az elfogyasztott terméken feltüntetett összetevők mennyiségének megfigyelése nyújthat segítséget (Piscitelli és mtsai, 2010).
A kutyák, amelyek kevesebb, mint 0,1 g/kg xilitet ettek, azoknál a hipoglikémia veszélye, míg a több, mint 0,5g/kg-t fogyasztottaknál a májkárosodás kialakulása áll fent. Azok az állatok, amelyek 0,1 kg alatti mennyiséget fogyasztottak, bent kell maradni a rendelőbe és folyamatos megfigyelés alatt kell tartani őket, mert a hipoglikémia tüneteinek jelentkezése késleltetett is lehet, különösen a xilit tartalmú rágógumik fogyasztása esetén. A hánytatást, mint kezelési lépést csak olyan állatoknál lehet végezni, amelyeknél még nincsenek klinikai tünetei a hipoglikémiának. Az aktív szén etetése nem ajánlott kezelési mód, mert a xilit már gyorsan felszívódik a gyomorbél traktusból és a kutatások is arra utalnak, hogy a szén xilit megkötő képessége gyenge (Piscitelli és mtsai, 2010) (Murphy és Coleman, 2012).
Ha a kutya 0,1 és 0,5g/kg közötti mennyiséget fogyaszt, akkor meg kell figyelni a hipoglikémia kialakulása miatt, 1-2 óránként legalább 12 órán keresztül. Ha hipoglikémia kialakul vagy az állat már beérkezéskor is rendelkezett a tüneteivel, akkor intravénásan nagy dózisú 1ml/kg 50%-os dextróz oldatot szükséges adni. Ezen kívül az intravénásan beadott dextróz után egy folyamatos 2,5 vagy 5%-os dextróz infúziót is el kell kezdeni, hogy megtartsuk a normális vércukor szintet. A kálium és foszfor szintet a vérben minden 4-6 órában ellenőrizni kell, hogy megállapítsuk, hogy a betegnél kialakult-e hipokalémia illetve hipofoszfatémia. A májenzimeket, a teljes bilirubin szintet, a thrombocyta- és vörösvérsejtszámot és a véralvadási időt is ki kell értékelni minden 24 órában 3 napon keresztül (Piscitelli és mtsai, 2010).
Ha a kutya több, mint 0,5 g/kg mennyiséget fogyasztott el, akkor azonnal el kell kezdeni az intravénás dextróz adagolását a korábban említett módon, még abban az esetben is, ha a vércukorszintjük az adott helyzetben normális és ezután ezt minden 2-4 órában mérni kell. Ezt az adagolás 24 óra után meg lehet szüntetni, ha a vércukorszint normál értékek között marad. Az előbb említett laborvizsgálatokat ugyanúgy el kell végezni. Megfontolandó a betegnek az esetleges májkárosodás ellen májvédőket és antioxidánsokat is adni beleértve N-acetilciszteint, S-adenozilmetionint, silymarint és E-vitamint is. Ezeknek lehet egy jótékony hatása, bár a hatékonyságuk még nem bizonyított a xilit okozta májkárosodásnál használt kezelés esetén. A véralvadási zavarokat friss vagy frissfagyasztott vérplazmával lehet kezelni, ha a vérzés fennáll vagy gyanított. Teljes vért csak azoknál az eseteknél érdemes felhasználni, amelyeknél jelentős anaemia alakult ki (Piscitelli és mtsai, 2010) (Dunayer, 2006).
A gyógyulásra való kilátások általában jók a korai felismerés, mielőbbi eltávolítás és a hipoglikémia hatásos kezelése esetén. Ez még azokban az esetekben is igaz, ahol egy minimális májenzim szintemelkedés volt tapasztalható, mert ez általában visszaáll néhány nap után a normális szintre megfelelő ápolással. Viszont ha súlyos májenzim szintemelkedés, hiperbilirubinémia és véralvadási zavarok alakulnak ki, akkor a kórjóslat kevésbé bíztató. Azoknál a betegeknél, amelyeknél hiperfosztémia alakul ki, rosszabb a túlélési esély (Murphy és Coleman, 2012).
Összességében elmondható, hogy sajnos a xilitmérgezések mennyisége kutyákban valószínűleg csak nőni fog, ahogy az embereknél egyre elterjedtebbé válik a xilit tartalmú termékek használata. Ebből kifolyólag a tulajdonosok felvilágosítása az állatorvosok fontos feladata, mert a legtöbb xilitet tartalmazó terméken nincs feltüntetve a kutyákra leselkedő esetleges veszély.
Irodalomjegyzék
Dunayer, E. (2006). New findings on the effects of xylitol ingestion in dogs. Veterinary Medicine, 101(12), 791–796. Retrieved from http://dx.doi.org/10.1186/s12917-016-0911-5%0Ahttp://bmcvetres.biomedcentral.com/articles/10.1186/s12917-016-0911-5
Murphy, L. A., & Coleman, A. E. (2012). Xylitol Toxicosis in Dogs. Veterinary Clinics of North America - Small Animal Practice, 42(2), 307–312. http://doi.org/10.1016/j.cvsm.2011.12.003
Piscitelli, C., Dunayer, E., & Aumann, M. (2010). Xylitol Toxicity In Dogs. Compendium (Yardley, PA), 32(2), E1–E4. http://doi.org/10.1136/vr.c3789
Remport Á., Mátis G., Juhász O., Kerek Á., Neogrády Zs. (2018). A xilitmérgezés kialakulásának mechanizmusa kutyában. Magyar Állatorvosok Lapja, Irodalmi összefoglaló, 140/109–117.
