Lizofoszfatidsav vazokonstrickcióban betöltött szerepe
Contents
-
Lizofoszfatidsav vazokonstrickcióban betöltött szerepe
- Általában a lizofoszfatidsavról és élettani hatásairól
- Bioszintézise, illetve biológiai és kémiai hatásai
- Élettani hatása
- Az LPA szerepe a vasculogenesisben
- A lizofoszfatidsav szerepe a kardiovaszkuláris élettani folyamatokban és megbetegedésekben
- Lizofoszfatidsav receptorok és a lizofoszfatidsav szerepe a vaszkuláris sérülésekre adott válaszban
- Vaszkuláris sérülésekre adott válasz vizsgálata
- Staiculescu és munkatársainak patkány vázizmon végzett kísérlete
- Irodalomjegyzék
- Ábrajegyzék
Általában a lizofoszfatidsavról és élettani hatásairól
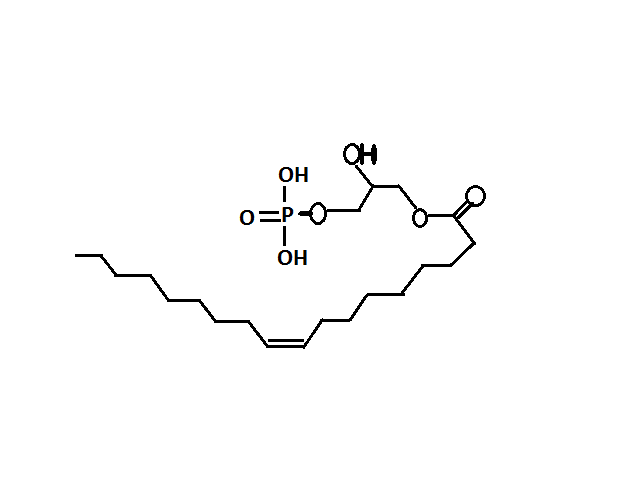
A lizofoszfatidsav (LPA) –szerkezete az 1. ábrán látható- egy szerteágazó hatású lipid mediátor, mely a szervezetben jelátvivő szerepet tölt be, hatását G-fehérje kapcsolt transzmembrán receptorokon keresztül fejti ki, úgy mint: LPAR1, LPAR2, LPAR3 és az újonnan felfedezett LPAR4, LPAR5, LPAR6. Az egyes receptoroknak eltérő a jelátviteli útvonala. Szerepe van az immunrendszerben, a különböző reproduktív funkciók fenntartásában, az idegrendszer megfelelő működésében, valamint kardiovaszkuláris rendszerben. Megtalálható a különböző testfolyadékokban, így a vérszérumban és citoplazmában is. Valamint bizonyos sejttípusok is képesek szekretálni (fibroblastok, zsírsejtek valamint a daganat sejtek) (Pagès és mtsai, 2001). Patofiziológiai jelentősége az érelmeszesedésben, valamint a trombocita aktivációban van.
|
Bioszintézise, illetve biológiai és kémiai hatásai
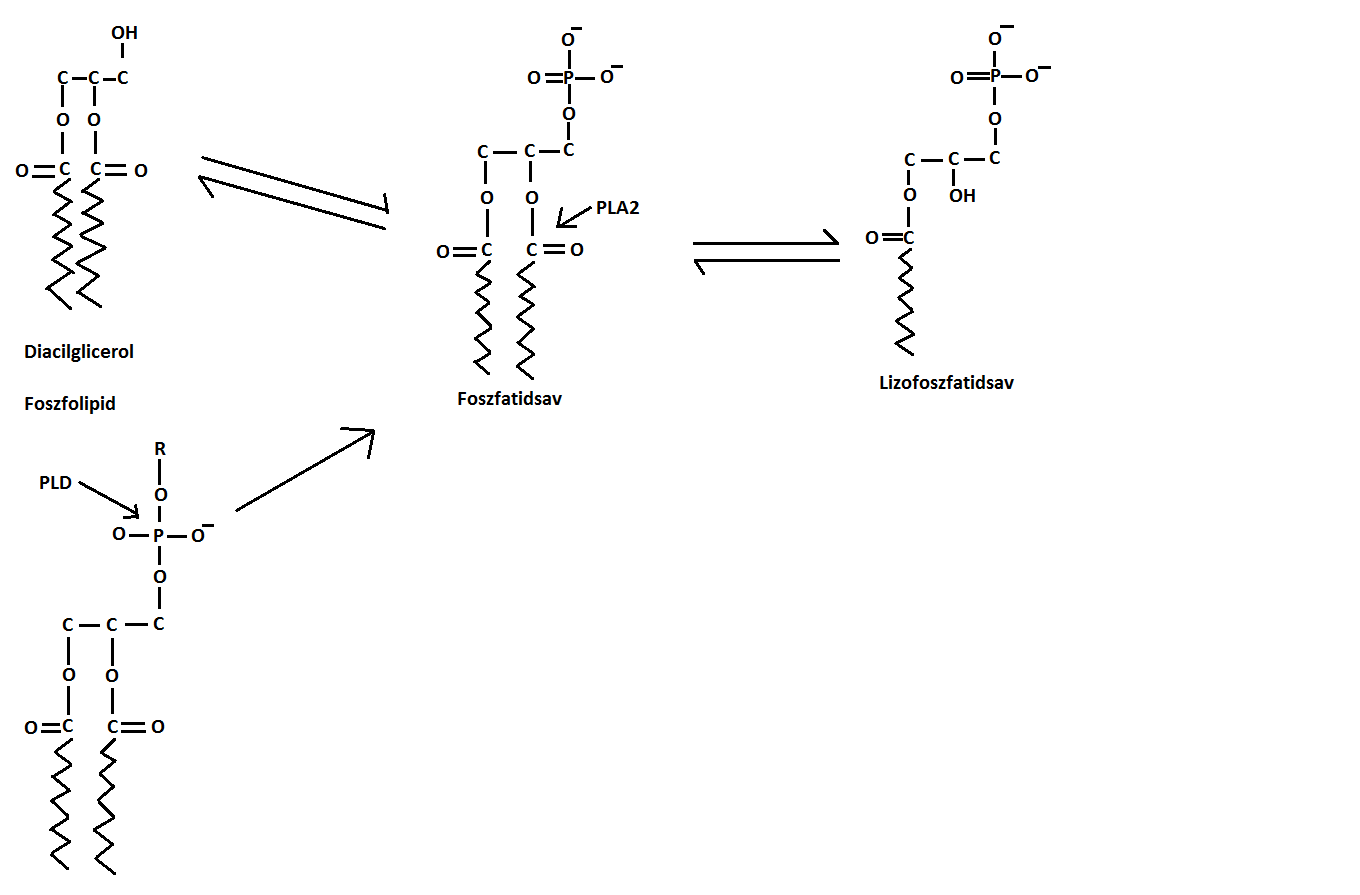
Képződése foszfolipedekből történik, de elengedhetetlen a foszfatidsav jelenléte. Egyik lehetséges szintézise az endoplazmatikus retikulumban történik és ugyanitt alakul összetett szerkezetű foszfolipiddé. Ugyanakkor már meglévő foszfolipidek hidrolíziséből is keletkezhet, sejtaktiválódást követően. Erre a legjobb példa a trombocitákban történő trombin-aktivált képződés, melyet extracelluláris térbe való kibocsájtás követ. Ennek során PLA2-mediált deacilezéssel, újonnan létrehozott foszfatidsavból keletkezik, a 2. ábrán bemutatott módon. Az azonban még felfedezésre vár, hogy a trombocita aktiváció mely szakaszában történik mindez. Többféle PLA-sejttípus megléte révén nem csak a trombocitákra korlátozódik a keletkezés, így létrejöhet a növekedési faktor stimulálta fibroblastok munkája során, valamint károsodott sejtek és különböző foszfolipázok nem-specifikus aktivációja során. A leggyakoribb képződési útvonal, a lizofoszfatidil-kolinból való keletkezése, mely során a lizofoszfatidáz-D autotaxin a kolin csoportot lehasítja a lizofoszfatidil-kolinról, létrehozva a lizofoszfatidsavat (Moolenaar, 1995).
|
LPA biokémiája
A lizofoszfatidsav hidroxil- és foszfátcsoportja miatt jóval vízoldékonyabb, mint a többi hosszúláncú foszfolipid. Hidrofilitása miatt, nem feltétlenül kötődik membránokhoz keletkezése után. Ám kalcium-ion hatására vizes oldatokból kicsapódik, amit albumin hozzáadásával meg lehet akadályozni, annak ellenére, hogy biológiai hatása általában albumintól független (Moolenaar, 1995).
LPA és LPA-szerű lipidek vérszérumban
Emlős vérszérumban oleoil- és palmitoil-lizofoszfatidsav található. Ezzel ellentétben trombocita-szegény vérplazmában, teljes vérben és cerebrospinális folyadékban nem található LPA. A hosszúláncú zsírsavakhoz hasonlóan az LPA nagy affinitással kötődik a szérum-albuminhoz, amiben felfedeztek egyelőre még azonosítatlan LPA-szerű lipideket, amelyek LPA-hoz hasonló biológiai aktivitással rendelkeznek. Emiatt lehet, hogy az LPA egy új családba, a foszfolipid mediátorok családjába tartozik (Moolenaar, 1995).
LPA katabolizmusa
Az LPA fibroblastokban monoacil-glicerollá, kisebb mennyiségben foszfatidsavvá és diacil-glicerollá bomlik, amely enzimatikus bontás az LPA sejtbeli hatásainak csökkentését szolgálja, mivel a keletkezett anyagok biológiailag inaktívak (Moolenaar, 1995).
LPA-ra adott biológiai válaszok
Az LPA a sejt proliferációt indukálja, valamint stimulálja a neuritok és a kemotaxis visszatartását. Az LPA hatásai szigorúan specifikusak és receptor mediáltak. Ugyan van példa egy PAF (trombocita aktivátor faktor) nevű anyagra, amely mind receptor mediált és receptor független folyamatokat idéz elő, de LPA-ra adott receptor független válaszokat eddig még nem fedeztek fel. Az LPA mitogén aktivitását fibroblastokban vizsgálva megfigyelhető, hogy a DNS-szintézishez elengedhetetlen a lizofoszfatidsav hosszú időn keresztüli jelenléte a közegben. Ugyanakkor PTX-szel (szamárköhögés toxinja) majdnem teljesen gátolni lehet a LPA ezen funkcióját. Ezen felül stimulálja az egér preimplantációs embriók növekedését, vagyis az emlősök korai fejlődésében is fontos szerepet játszik. További megfigyelések szerint keratinocitákban és valószínűsíthetően más sejttípusokban is, az LPA- indukált sejt proliferáció indirekt, mivel magában foglalja az α-átalakító növekedési faktor termelését is – PTX-dependens módon. Egyesülő keratinocyta-kultúrákban az LPA stimulálja a terminális differenciálódást, ennek megfelelően egér bőrére helyezve az epidermisz megvastagodását indukálja. Bizonyos sejttípusokban az LPA mitogén aktivitása reprodukálható foszfatidsavval, ám a foszfatidsav nem gyakorol hatást az LPA receptoron. Az LPA, peptid növekedési faktorokkal ellentétben képes utánozni a vérszérumot abban a tulajdonságában, hogy indukálja a karcinóma és hepatóma sejtek, valamint a mesothel sejtek monolayerei közé való behatolását. Az emögött álló mechanizmus még tisztázatlan, magyarázható esetleg megnövekedett sejt adhézióval és kifejezett sejt motilitással. A mitogénekhez hasonlóan az LPA azonnali változásokat képes indukálni az aktin alapú citoszkeletonban (Moolenaar, 1995).
Élettani hatása
Az LPA erős mitogén hatású, fontos szerepet tölt be a sejtproliferációban, ezért megfelelő regulációja nagyon fontos. Ha a szabályozás nem megfelelő, úgy hiperproliferáció, súlyosabb esetben onkogenezis következhet be. További abnormális reguláció esetén áttétképződés is felléphet. Ezen tulajdonsága miatt a rákkutatásban igen fontos szerepe van. Valamint epepangásos betegeknél pruritust (viszkető, kipirosodó bőrgyulladás) okoz (Panupinthu és mtsai, 2010). A lizofoszfatidsav specifikus és sokrétű hatással bír, mind a vérsejtekre, mind az érfal sejtjeire nézve, tehát részt vesz a fiziológiás sebgyógyulásban, vaszkuláris reparálásban. Bár számos bizonyíték utal rá, hogy ezek a lipid mediátorok bizonyos formákban arthero- és thrombogenetikus molekulákká is válhatnak, melyek súlyosbítják a szív-és érrendszeri megbetegedéseket. Például, az LPA jelenléte minimálisan módosult LDL szintben és az atherosclerotikus károsodások intimájánál, szerepet játszhat az érelmeszesedés korai fázisában. Beleértve a barrier diszfunkciót és a megnövekedett monocitás adhéziót az endotéliumban. Valamint a későbbi fázisban előidézhet vérlemezke aktivációt, és az intra-arteriális trombus megrepedését az atherosclerotikus plakkban. Mindezen túl, az LDA stimulálja a fibroblastok proliferációját és megnövelve a gyulladást okozó sejtek túlélési arányát, valószinűleg központi szerepet játszik a rendkívül megnövekedett fibroproliferatív és gyulladásos válaszban, az érsérülésre, ami jellemzi az athersclerosis folyamatát. Tervbe véve az LPA receptorok specifikus alosztályait, szelektív sejtekben a vérben és az érfalban, új távlatokat nyithat a szív- és érrendszeri megbetegedések gyógyításában és megelőzésében (Siess, 2002).
Az LPA szerepe a vasculogenesisben
Az első jelentős tanulmány, amely a lizofoszfatidsavat a vaszkuláris fejlődéshez kapcsolta, az autotaxin hiányos (ATX/Enpp-2) fenotípus vizsgálat volt. Ebben megállapították, hogy az ATX úgy funkcionál, mint a szekretált lizofoszfolipáz-D, amely az lizofoszfatidilkolint lizofoszfatidsavvá alakítja. A kísérlet során vizsgált autotaxin hiányos egérek elpusztultak az embrionális fejlődésük kilenc és feledik napján, a súlyos érrendellenességek következtében, amelyek a szikhólyagban és az embrióban jelentkeztek, amely véletlenül egybeesett a normál embriókban bekövetkezett LPA és ATX receptorok expressziójának emelkedésével. Az autotaxin hiányos egér embriókban számos rendellenességet figyeltek meg, beleértve az allantois és idegcső malformációt. Fontos megemlíteni, hogy bizonyos érrendellenességek, mint például a szikhólyag vaszkularizációjának hiánya és a megnövekedett embrionális erek megjelenése a fejlődés kilenc és feledik napján jelentek meg. A vérszigetek normális előfordulása esetén - PECAM-1 (CD31) festésnél- azt figyelhették meg, hogy megjelentek az angioblastból differeciálódott endotheliális sejtek, amelyből arra következtethettek, hogy a csökkent LPA koncentráció nem befolyásolja az endotheliális progenitor sejtek differenciálódási kapacitását. AZ ATX-re nézve heterozigóta egereknél azt állapították meg, hogy a plazmájuk lizofoszfatidsav koncentrációja feleannyi, mint alomtársaiké, ami arra utal, hogy in vivo az ATX a legjelentősebb LPA termelő enzim. Ez erősen azt sugallja, hogy az LPA termelés csökkenése felelős az észlelt pathológiai fenotípusért és az LPA szignál kritikus szerepet játszik az érrendszer fejlődésében (Teo és mtsai, 2009).
A lizofoszfatidsav szerepe a kardiovaszkuláris élettani folyamatokban és megbetegedésekben
A lizofoszfatidsav sokrétű hatást gyakorol a kardiovaszkuláris rendszerre, ami arra enged következtetni, hogy valószínűleg szerepet játszhat a különböző kritikus szív- és érrendszeri funkciókban és a klinikailag jelentős megbetegedésekben. Az LPA egy vérlemezke aktivátor, az emberi donorok nagy többségének beszámolója alapján, azt észlelték, hogy szerepet játszhat az akut trombózis kialakulásában és a vérlemezke funkcióban, valamint érelmeszesedésben, illetve az érfal sérülésre való válaszadásban. Különösen érdekes ebben a kontextusban, hogy az LPA fenotípusos modulátora a simaizom sejteknek, támogatva a de-differentalizáciot, a proliferációt és a migrációt, ami az intima hiperpláziájához elengedhetetlen. Az LPA exogén adagolása alapján akut és általános változásokat okoz különböző állatfajok vérnyomásában, amely megerősíti az LPA szerpét mind a normál vérnyomás regulációjában, mind a hipertenzióban (Smyth és mtsai, 2008).
Lizofoszfatidsav receptorok és a lizofoszfatidsav szerepe a vaszkuláris sérülésekre adott válaszban
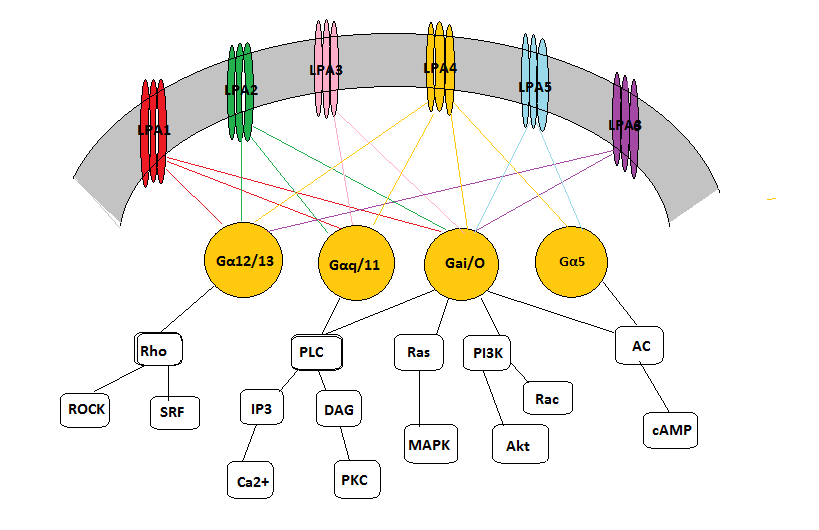
A vaszkuláris simaizomsejtek fenotípusos módosulása létfontosságú az érfal intima fejlődése, hiperpláziája során. Az LPA egy szérum komponens, mely képes támogatni ezen fejlődést, de in vivo még nem bizonyított, hogy szabályozó szerepet töltene be a vaszkuláris simaizomsejtek működésében. A carotis elkötése egerekben mind a két autotaxin mennyiségét megemelte, a lizofoszfolipáz-D enzim a felelős a LPA1 és LPA2 extracelluláris termeléséért, amely az LPA1-2 kapcsolt G-protein receptorokhoz kötődik. Az LPA1 és LPA2 kapcsolt receptorok részlegesen védettek a lekötés által indukált neointimális hiperpláziától. A szérumban való növekedése, egy LPA által indukált jel, mely szabályozza a protein-kináz aktivitást. A vaszkuláris simaizomsejtek összehúzódása sérülés hatására következik be, és ez fontos tényezője az atherosclerotikus és restenotikus léziónak. Az extracelluláris környezetben végbemenő változások elősegítik ezt a válaszreakciót, melyet jellemez a vaszkuláris simaziomsejtek differenciálódási állapota. Szérumból izolált, differenciált majd proliferált vaszkuláris simaizomsejtek emberből és rágcsálókból stimulálhatóak lizofoszfatidsavval. Az LPA a szérumban az első számú tényező, amely befolyásolja a fenotípusos modulációt. Az LPA a legegyszerűbb glicerofoszfolipid, amely elősegíti az izolált vaszkuláris simaizomsejtek dedifferenciációját, proliferációját és migrációját. Bár a pontos jelátviteli rendszer nem ismert, a bonyolult kapcsolatrendszert a 3. ábrán szemléltetjük. Az LPA szerepét a G-protein kapcsolt receptorokon keresztül tölti be. LPA 1-5 receptorok széles skálája lehetővé teszi, hogy különböző jelátviteli útvonalak valósuljanak meg intracellulárisan, mely fontos mind az egészség megőrzésében, mind bizonyos betegségek kialakulásában (Panchatcharam és mtsai, 2008).
Az LPA1 a legszélesebb körben expresszált receptor, magas mRNS szinttel található meg az agyban, a colonban, a vékonybélben, a placentában és a szívben. Illetve kisebb expresszióval a hasnyálmirigyben, petefészekben és prosztatában. Az LPA2 és LPA3 receptorok az LPA1-hez képest sokkal kevésbé elterjedtek. Egerekben az LPA2 expressziója a legnagyobb mértékű, megtalálható az embrió agyában, veséjében, heréjében. Az LPA3-as receptor pedig a tüdejében, veséjében és szintén a heréjében. Ezzel szemben az LPA4 kifejlett egyedekben mutat génexpressziót, nagyon alacsony szinten jelen van a legtöbb emberi szövetben, de ettől szignifikáns eltérést mutat a petefészekben való jelentős expressziója. Az LPA5 alacsony szinten van jelen a legtöbb szövetféleségben, köztük az embrionális agyban, de a vékonybélben magas számban megtalálható, míg a bőrben, lépben, gyomorban, thymusban, tüdőben és májban közepes koncentráltságban van jelen. Az LPA1 és LPA2 az embrionális agyban a neurogenezis során keletkezik, az LPA3 pedig a korai posztnatális periódusban jelenik meg. Az LPA többféle sejtválaszt indukál, beleértve az intracelluláris kalcium mobilizációt, stresszfehérje formációt, valamint a sejtlekerekedést. A nagy biológiai aktivitását azzal magyarázhatjuk, hogy az LPA receptorok képesek kapcsolódni legalább 4 különböző G-protein családhoz, amelyek alfa alegységeik alapján különböztethetők meg (Gαi, G12/13, Gαq/11, Gαs). A lizofoszfatidsav aktiválja a Gα/11-et, és ezen keresztül a foszfolipáz-C-t stimulálja, majd a foszfatidil-inozitol-biszfoszfát többféle másodlagos hírvivő keletkezését indukálja. Ezek a másodlagos hírvivők protein-kináz C aktivációhoz vezetnek, valamint citoszólikus kalcium változásokhoz.
A Gαi fehérje három különböző jelátvivő folyamathoz vezet:
- cAMP gátlásán keresztüli adenilát-cikláz gátlás
- foszfatidil-inozitol-3-kináz aktivációja, mely aktiválja a downstream RAC-GTPázt, amely kulcsregulátora a sejt morfológiájának és motilitásának.
- mitogén aktivált protein-kináz stimulációs kaszkád- A G12/13 aktivációja a kis RhoA GTPáz aktiválódásához vezet, ami felelős a citoszkeletális kontrakcióért és a sejtlekerekedésért.
- A Gαs aktivációja emeli a ciklikus AMP szintjét LPA4-en keresztül (Teo és mtsai, 2009).
Az LPA által kiváltott útvonalak a Rho GTP-ázok és az extracelluláris jel szabályozott protein kináz, amelyekről tudjuk, hogy fontos szerepet játszanak a vaszkuláris simaizomsejtek összehúzódásában. Az LPA termelési helye úgy pozícionált, hogy betölthesse patofiziológiás mediátor szerepét a vaszkuláris sejtek funkciójában. Az LPA nagyon alacsony koncentrációban van jelen a plazmában, viszont bőséges mennyiségben van jelen a szérumban, ahol azokból a folyamtokból származtatható, amelyek a vérlemezke aktivációban játszanak szerepet. Ebből adódóan az LPA helyi koncentrációja megnövekszik az erek fala mentén, a vérlemezke adhézió és trombus formáció során. Az LPA szintén nagy mennyiségben megtalálható a lipidekben gazdag, érelmeszesedést okozó plakkokban, ahol valószínűleg az enyhén oxidált LDL-ből (alacsony denzitású koleszterin) származik. És így az LPA jelen van, illetve termelődik a vaszkuláris simaizomsejtek funkcióját megváltoztatva. A lizofoszfolipáz-D autotaxin, amely katalizálja a lizofoszfolipid szubsztátok hidrolízisét, felelős a biológiailag aktív LPA termeléséért, és körforgásáért.
Az LPA exogén adagolása, endogén hatást vált ki, mediátora a vaszkuláris sejtek funkcióinak. Például, patkányoknak intravénásan LPA-t adva, megemeli az artériás vérnyomást az állatban. Vagy sertésekben lokális bevitele, cerebrális vazokonstrikciót eredményez (Panchatcharam és mtsai, 2008). Újszülött malacokban, zárt koponya ablak mellett tanulmányozták. A lizofoszfatidsav helyi alkalmazása érösszehúzó hatású volt, valamint gátolta a hipercapnia és isoproterenol által kiváltott vasodilatációt. Ezek a vasodilatátorok a cAMP tartalmának emelkedését váltják ki a cerebrospinális folyadékban, míg az LPA, dózis függően gátolja a cAMP képződését. A pertussis (szamárköhögés) toxin teljes mértékben megszűntette az LPA által kiváltott vazokonstrikciót, valamint megváltoztatta az erek reakcióképességét, így az LPA többé nem volt képes a cAMP szint csökkentésére. (Tigyi és mtsai 1995) Ezen kívül az LPA lokális infúziója patkányban, az artéria carotis communis-ban gerjeszti a vaszkuláris átalakulást, azáltal, hogy serkenti a neointima képződését. Hasonló reakció figyelhető meg egérben, valószínűleg PPARγ hatására (Panchatcharam és mtsai, 2008).
|
Vaszkuláris sérülésekre adott válasz vizsgálata
Carotis műtét után különböző időközönként 5 mm-nyi aorta került eltávolításra varrathoz közeli pozíciókból, majd a minta feldolgozása után RNS vizsgálatokra került sor, PCR és immunoblottolás segítségével. A neointima, érfal mentén való képződését négy héttel a műtét után értékelték számítógépes morfometriával. A femorális artérián denudációval okozott sérülést hajtottak végre, és elemeztek ki szintén negyedik héttel a műtét után. Ezidáig speciális eszközök hiányában az endogén lizofoszfatidsav érrendszerben betöltött patofiziológiai szerepét még nem sikerült meghatározni. Még a legalaposabb, eddig közölt in vitro tanulmányokban is patkány vagy emberi simaizomsejteket (SMC) használtak, mivel az egér SMC-k lizofoszfatidsavra adott válaszai részleteiben még nem lettek vizsgálat alá helyezve. Az egér simaizomsejtek LPA-ra adott válaszainak in vitro vizsgálatát összepárosítva, LPA-receptor hiányos egerek vaszkuláris sérülésekre adott válaszainak fenotípusos elemzésével, ahhoz volt szükséges, hogy pontos betekintést nyerjenek a lizofoszfatidsavnak a vaszkuláris működés eme vonatkozásában betöltött fontos szerepébe. Ebben a vizsgálatban az ATX- (lizofoszfolipáz-D autotaxin) LPA1- és LPA2 receptorok túlszabályozása észlelhető vaszkuláris sérülések következtében. A kísérletben felhasznált egerek LPA1 és LPA2 receptorai -mind önálló, mind kombinált módon- hiányoznak annak érdekében, hogy meghatározható legyen ezen receptorok és az LPA szerepe a patofiziológiailag releváns izomválaszokban, valamint a SMC-k fenotípusos szabályozásában, amelyek vaszkuláris sérülésekkel együtt fordulnak elő (Panchatcharam és mtsai, 2008).
Simaizomsejtek izolációja
Egérből származó thoracális aortából, az adventícia és az endotélium II típusú kollagenázos leemésztésével nyertek simaizomsejteket. A médiát tovább emésztették az előbb említett enzimmel és elasztázzal. A sejtek szaporítása 0.5 ng/mL EGF-et, 5 μg/mL inzulint, 2 ng/mL bázikus fibroblast növekedési faktort, 10% FBS-t, 100 U/mL penicillint és 100 μg/mL sztreptomicint tartalmazó DMEM tápfolyadékban történt, 37°C-os inkubációval, 5% CO2/95% levegő eloszlással. Az SMC eredetet az α-aktinra való immunoreaktivitás jelenlétével bizonyították a sejtek 99%-ában.
A kutatás eredményei
Izolált simaizomsejtek vagy intakt erek exogén LPA-nak való kitétele fenotípusos simaizomsejt modulációt vált ki, ámbár az endogén LPA-nak SMC válaszok szabályozásában betöltött szerepe a vaszkuláris sérülések kontextusában még ismeretlen. Ennek a tanulmánynak a célja az volt, hogy meghatározzák, vajon az LPA ép szervezetekben kivált-e érsérülésre adott választ. Ennek véghezviteléhez jelölt LPA receptor hiányos egereket és ezen receptorok farmakológiai antagonistáit használták, hogy gyengítsék a normál LPA-jeladást a vaszkuláris simaizomsejtekben és, hogy meghatározzák a következményeket az ér- és az izolált sejtek válaszaiban.
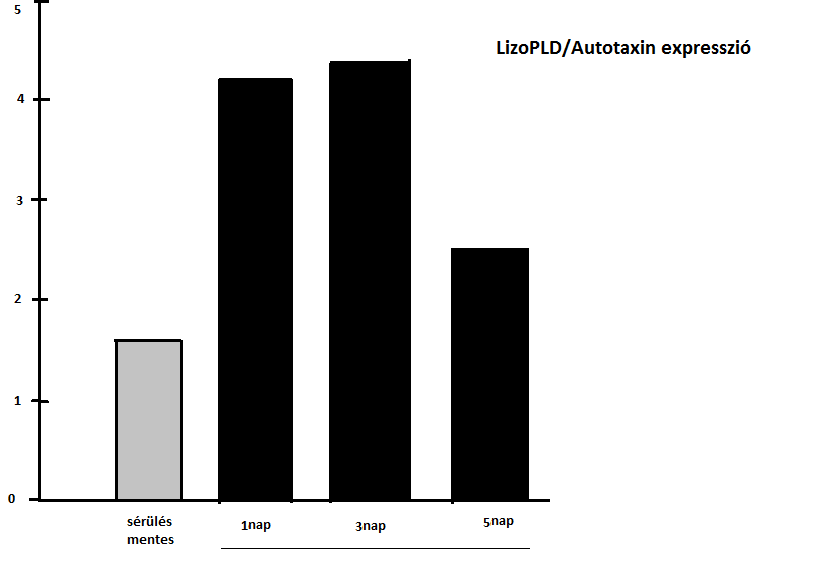
A 4. ábrához tartozó magyarázat: Az ATX (lizofoszfolipáz D autotaxin) szint és az LPA expresszió növekszik az artériás sérülés után. Az ATX kiválasztás szignifikánsan magasabb volt a sérülést követő első és harmadik napon, mint a sérülést nem szenvedő egerekben.
|
Staiculescu és munkatársainak patkány vázizmon végzett kísérlete
A lizofoszfatidsav integrin aktivációt idéz elő a vaszkuláris simaizomzatban és megváltoztatja az artériás vazokonstrikciót. Valamint az erek simaizomsejtjeiben fokozza az integrin adhéziót az extracelulláris mátrixhoz, de ezzel egyidejűleg oxigén eredetű szabadgyökök (ROS) termelését is fokozza, mely stresszfaktor a szervezet számára. A vizsgálat a patkány vázizomzat arterioláiból történik, az LPA indukálja az ROS (oxigén eredetű szabadgyökök) termelődését, melynek hatására fokozódik az integrin adhézió az extracelluláris mátrixhoz, azon belül is a fibronektinhez. A simaizomsejtekben lizofoszfatidsav hatására megduplázódik az integrin-fibronektin adhézió, a kontroll sejtekhez képest. Ha a sejteket pre-inkubációnak vetjük alá béta1 és béta3 integrinek elleni ellenanyagokkal, az LPA által indukált integrin-fibronektin adhéziót jelentősen csökkentheti. A lizofoszfatidsav elsősorban G-protein kapcsolt receptorokon keresztül hat, melyek blokkolásával gátolni lehet az LPA jelátvitelt, tehát ezzel is csökkenthető az LPA által erősített simaizomsejt-fibronektin adhézió. Az oxigén eredetű szabadgyökök elnyomása „tempol”-lal és „apocyninnel” lehetséges, ezen anyagokkal, közvetve szintén csökkenthető az adhézió. Az intakt arteriolákban az LPA felvétel megnöveli a miogén konstrikciós választ, lépcsőzetes intraluminális nyomásemelkedés mellett. A KI 16425 gátolja az LPA receptorokat, ezáltal blokkolja az LPA jelátvitelt, így csökkenti az LPA által fokozott miogén konstrikciót. Ezek az eredmények azt mutatják, hogy a simaizomsejtekben a lizofoszfatidsav által indukált integrin aktiváció magában foglalja az LPAR1 és LPAR3 receptorokat, az oxigén eredetű szabadgyök termelést, valamint, hogy a lizofoszfatidsavnak fontos szerepe lehet a mikrokapillárisok miogén viselkedésében, integrin aktivitás általi ROS-szabályozáson keresztül (Staiculescu és mtsai, 2014).
Irodalomjegyzék
Moolenaar, W.H. (1995): Lysophosphatidic Acid, a Multifunctional Phospholipid Messenger. Division of Cellular Biochemistry, The Netherlands Cancer Institute. The Journal of biological chemistry 270(22):12949-12952
Pagès, C.; Simon, M.F.; Valet, P.; Sauliner-Blache, J.S. (2001): Lysophosphatidic acid synthesis and release. Prostaglandins & Other Lipid Mediators 64 (1-4): 1-10
Panchatcharam, M.; Miriyala,S.; Yang, F.; Rojas, M.; End, C.; Vallant, C.; Dong, A.; Lynck, K.; Chun J.; Morris, A.J.; Smyth, S.S. (2008): Lysophosphatidic Acid Receptors 1 and 2 Play Roles in Regulation of Vascular Injury Responses but Not Blood Pressure. Circulation Research 103(6):662-670
Panupinthu, N.; Lee, H.Y.; Mills, G.B. (2010): Lysophosphatidic acid production and action: critical new players in breast cancer initiation and progression. British Journal of Cancer 102(6): 941-946
Siess, W.:(2002): Athero- and thrombogenic actions of lysophosphatidic acid and sphingosine-1-phosphate. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1582(1-3):204-215
Smyth, S.S.; Cheng, H.Y.; Miriyala,S.; Panchatcharam, M.; Morris, A.J. (2008): Roles of lysophosphatidic acid in cardiovascular physiology and disease. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1781(9):563-570
Staiculescu, M.C.; Ramirez-Perez, F.I.; Castorana-Gonzalez, J.A.; Hang, Z. ; Sun, Z.; Meininger G.A.; Martinez- Lemus, L.A. (2014): Lysophosphatidic acid induces integrin activation in vascular smooth muscle and alters arteriolar myogenic vasoconstriction. Front Physiol 5:413 doi: 10.3389/fphys.2014.00413
Teo, S.T.; Yung, Y.C.; Herr, D.R.; Chun, J. (2009): Lysophosphatidic Acid (LPA) in Vascular Development and Disease. IUBMB life 61(8):791-799
Tigyi,G; Hong, L.; Yakubu, M.; Parfenova, H.; Shibata, M.; Leffler, C.W. (1995): Lysophosphatidic acid alters cerebrovascular reactivity in piglets. The American journal of physiology - Heart and Circulatory Physiology 1995 268(5 Pt 2):H2048-55
Ábrajegyzék
1. ábra https://en.wikipedia.org/wiki/Lysophosphatidic_acid
2. ábra (Moolenar, 1995)
3. ábra (Siew, 2009)
4. ábra (Panchatcharam és mtsai, 2008)