Die Emissionsreduzierung des Methangases beim Rind
|
|
Einleitung
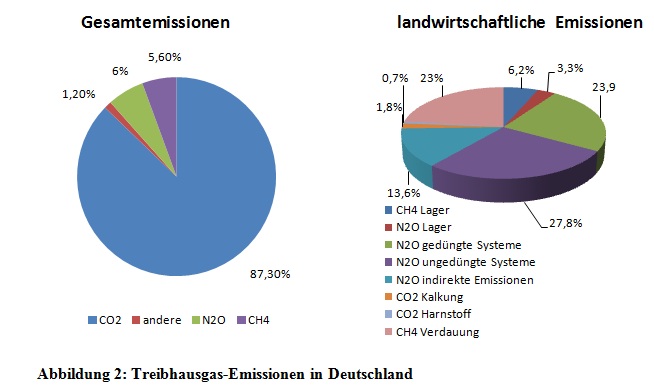
Nach Berechnungen des Weltklimarates IPCC wird im 21. Jahrhundert erwartet, dass es zu einem Anstieg der globalen Erdoberflächentemperatur zwischen 1°C bis 6°C kommt. Verantwortlich für diese Erhöhung sind unter anderem die Treibhausgase Kohlenstoffdioxid (CO2), Methan (CH4), Stickstoffoxid (NO) und Ozon (O3), welche in der Erdatmosphäre infrarote Strahlung absorbieren und dadurch im Wesentlichen zum Klimawandel beitragen. Derzeitigen Berechnungen zufolge, ist die Landwirtschaft weltweit maßgeblich am Ausstoß von Treibhausgasen beteiligt (siehe Abbildung 2). Der Ausstoß umfasst nahezu ausschließlich die CH4- und NO2- Emission. Das Treibhausgasaufkommen in der deutschen Landwirtschaft beläuft sich zurzeit auf etwa 6,3%. Dabei sind etwa 44% der CH4 - Emission landwirtschaftlichen Ursprungs, wobei die Wiederkäuer (siehe Abbildung 1) den wesentlichen Anteil ausmachen. Maßnahmen zur Reduzierung der Treibhausgasemissionen werden weltweit eingehend erforscht. Die Staaten der EU haben sich dazu verpflichtet, die Treibhausgasemission in naher Zukunft maßgeblich zu verringern (Flachowsky und Brade, 2007).
Methanbildung im Verdauungstrakt der Rinder
Die Orte der mikrobiellen Verdauung sind die drei Vormägen der Wiederkäuer, der Netzmagen (Retikulum), der Pansen (Rumen) und der Blättermagen (Omasum). In ihnen laufen wesentliche Verdauungsprozesse ab: (Flachowsky et al., 2004)
- Abbau von β-glykosidischen gebundenden Zellwandkomponenten (Cellulose, Hemicellulose)
- Mikrobielle Vitamin- und Proteinsynthese
Abbau, Umwandlung und Inaktivierung von Mykotoxine und sekundären Pflanzenstoffen
Die Mikroflora des Pansens besteht hauptsächlich aus Bakterien, Archaea, Protozoen und einigen anaeroben Pilzarten (Janssen, 2010). Die mikrobielle Verdauung in den Vormägen beginnt nach der Zerkleinerung des aufgenommenen Futters durch anfängliches Kauen und darauffolgendes Wiederkäuen (Hungate, 1966). Im Pansen wird das zerkleinerte Futter durchmischt und unter anaeroben Bedingungen, bei einem pH-Wert von 5,6-6,7 und bei 39°C durch Mikroben fermentiert (Hungate, 1966; Kolver und de Veth, 2002). Auch bereits vorverdaute Futterkomponenten werden hier umgewandelt, bevor sie in den weiteren Verdauungstrakt gelangen (Janssen, 2010). Während des mikrobiellen Abbauprozesses der Kohlenhydrate wird unter Anderem Methan erzeugt. Bei der Fermentation entstehen flüchtige Fettsäuren, hauptsächlich Acetat, Propionat und Butyrat (Demeyer und van Nevel, 1975; van Nevel und Demeyer, 1996). Flüchtige Fettsäuren werden vom Tier aufgenommen, da sie die Hauptenergiequelle der Wiederkäuer darstellen. Während der Produktion von Acetat und Butyrat, entsteht Wasserstoff. Zusätzlich entstehen Ammoniak und Kohlendioxid. Acetat, Propionat und Butyrat spielen eine wichtige Rolle in der Kohlenstoff- und Energieanforderung des Wiederkäuens und werden nahezu von der gesamten Pansenwand absorbiert (Janssen, 2010). Die für methanogene Archaea erforderliche Energie wird aus Wasserstoffgas gewonnen, welches dem Verdauungsvorgang entspringt (Hungate et al., 1970). Während der Produktion lagern sie das entstandene Wasserstoffgas an Kohlendioxid an, wodurch es zur Bildung von Methan kommt (Demeyer und van Nevel, 1975; van Nevel und Demeyer, 1996). Das Endprodukt Methan, wird während der Eruktation (Aufstoßen) durch den Wiederkäuer in die Umgebung abgegeben. Die Methangasbildung kann anhand folgender Gleichungen zusammengefasst werden: (Flachowsky und Brade, 2007)

Methangasmessungen
Während der letzten Jahre haben sich verschiedene Möglichkeiten zur Messung der Methangaskonzentrationen entwickelt (Van Zijderveld, 2011). Derzeitige Methanmessmethoden sind der Methandetektor, Futterstationshauben und Pansensaftproben (Röhe). Außerdem wird die Methangasproduktion von einzelnen Tieren in sog. Respirationskammern gemessen. Der Nachteil dieser Methode ist, dass der Aufenthalt in den Kammern für die Tiere eine Stresssituation darstellt und dies wohlmöglich eine Verfälschung des Ergebnisses als Konsequenz hat (Verstegen et al., 1987). Der Methandetektor ist ein Gerät, welches mit Laserstrahlen arbeitet. Das Gerät wird an die Nasenlöcher der Tiere gehalten wodurch das, über die Eruktation abgegebene, Methangas ermittelt werden kann (Chagunda et al., 2009). Eine weitere Messmethode sind die Futterstationshauben die über den Futtertrögen der Wiederkäuer installiert sind. Die ventilierten Hauben üben einen Saugeffekt aus und können so das Methangas, das während der Nahrungsaufnahme entsteht, messen. Außerdem besteht die Möglichkeit, anhand von Pansensaftproben einen groben Wert für die Methangasproduktion der Rinder zu ermitteln. Diese Methode basiert auf dem relativen Anteil der methanbildenden Mikroben (Röhe). Eine weitere Messmethode ist die SF6 tracer technique. Bei dieser Methode wird ein Gasröhrchen mit Schwefelhexafluorid (SF6) in den Pansen des Tieres eingeführt. Anschließend wird Luft aus den Nasenlöchern der Kuh über 24h lang in einen Vakuum-Sammel-Behälter geleitet. Abschließend wird die vom Wiederkäuer abgegebene Methan- und Schwefelhexafluoridmenge aus dem Kanister analysiert. Da die gesamte abgegebene Menge SF6 vom Tier bekannt ist kann die Methangasmenge im Kanister berechnet werden.
Potenziale zur Methangasreduzierung
Modifizierung des Futtermittels
Futteraufnahme und Passagezeit
Die Veränderung der absoluten Menge an täglicher Futteraufnahme und der Futtermischung haben das Potenzial den Methanausstoß zu reduzieren. Im gesamten Organismus wird pro Tag bei einer Trockensubstanzaufnahme von 1 kg zwischen 12g und 36 g Methan produziert. Davon zwischen 20g und 25 g im Pansen. Eine höhere Menge an Futter bewirkt eine reduzierte CH4 Bildung je kg Trockensubstanzaufnahme (Flachowsky und Brade, 2007). Hohe Anteile von faserarmer bzw. fettreicher Nahrung führen zu sehr niedrigen CH4 Emissionswerten, während bei faserreichem Futtermittel extrem viel CH4 ausgestoßen wird. Die Passagezeit/rate steht in direktem Zusammenhang mit der Nahrungsaufnahme und kann durch spezifische, faserarme Futtermittel (Pflanzenzüchtungen wie die brown-midrib-Hybriden) verkürzt werden (Tine et al, 2001). Eine schnellere Durchflussrate, bedingt durch eine erhöhte Nahrungsaufnahme und einer stärkeren Rumenfüllung, verringert die Methanproduktion (Blaxter et al., 1956; Evans, 1981). Getreidekörner haben eine höhere Passagerate als Gräser (Hartnell und Satter, 1979; Owens und Goetsch, 1986). Der Abbau faserreicher Futtermittel ist ein langsamer Prozess und resultiert in einer verlängerten Passagezeit, sowie in einer Erhöhung der H2 Konzentration und der Methanbildung. Auch der Lignifizierungsgrad könnte einen Anteil an der Methanproduktion haben. Demzufolge müssten Gräser mit zunehmendem Vegetationsstadium aufgrund der Anreicherung von Zellwandbestandteilen eine höhere Methanbildung verursachen. Dies wurde allerdings in Untersuchungen nicht bestätigt (Flachowsky und Brade, 2007). Studien haben gezeigt, dass Chicorée im Vergleich zu Weidelgras schneller verdaut wird, eine höhere Passagerate aufweist (Kusmatono et al., 1996, 1997) und insgesamt weniger Methan produziert wird (Swainson et al., 2008).
Futterzusammensetzung
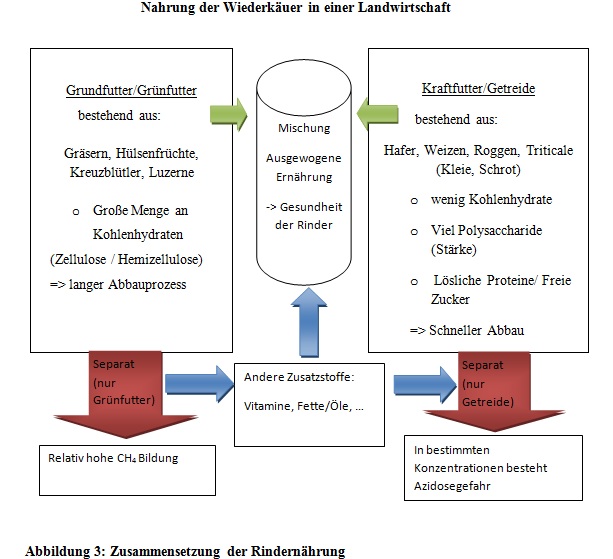
In der Agrarwirtschaft setzt sich die Nahrung von Wiederkäuern (siehe Abbildung 3) hauptsächlich aus Grünfutter und Getreide zusammen. Zu Grünfutter zählen Gräser und auch Luzerne, andere Hülsenfrüchtler und Kreuzblütler. Es kann frisch oder getrocknet in Form von Silage oder Heu verfüttert werden. Diese Futterart enthält eine große Menge an Kohlenhydraten (Zellulose/Hemizellulose), die schwerer verdaulich sind als Kraftfutter (Hungate, 1966; Sutton, 1971). Im Gegensatz dazu besteht Getreide aus einer kleineren Menge an Kohlenhydraten und besitzt einen höheren Anteil an leicht verdaulichen Stärkemolekülen. Weitere Bestandteile sind lösliche Proteine und freie Zucker, welche effizient abgebaut werden können (Mangan, 1972; Demeyer und van Nevel, 1975).
Proteine und NPN-Verbindungen (z.B. Freie Aminosäuren, Harnsäure, Harnstoff, Nitrat) stellen den durch die Nahrung aufgenommenen Anteil von Stickstoff zur Verfügung, der für die Vitamin- und Proteinsynthese in Mikroben und zum Zellwandabbau benötigt wird. Eine Reduktion proteinreicher Nahrung bewirkt somit eine Verringerung des Stickstoffgehalts und dadurch einen geringeren Abbau der pflanzlichen Zellwände durch die Pansenmikroorganismen. Schlussendlich führt dies zu einer Verringerung der Methanproduktion (Kirchgeßner et al., 1995).
Der Abbau von Kohlenhydraten führt zu einer Produktion von flüchtigen Fettsäuren (in erster Linie Essigsäure, Propionsäure, Buttersäure) und Wasserstoff. Die Methanogene lagern den Wasserstoff an CO2 an, welcher im weiteren Verdauungsprozess zu CH4 abgebaut und ausgeschieden wird. Im Vergleich zur Propionsäure-Produktion geht bei der Essigsäure-Produktion mehr Energie verloren (Demeyer und van Nevel, 1975). Daher fällt bei einer höheren Essigsäureproduktion relativ zur Propionsäure mehr Methan an, als bei einem gleichgroßen Anteil beider Substanzen. Untersuchungen haben ergeben, dass jedes verdaute kg an Glukose bei einem bestimmten Essigsäure: Propionsäure Verhältnis einen unterschiedlichen Methanausstoß hervorruft, wie in Tabelle 1 veranschaulicht ist.

In einem Modellversuch wurde durch Hinzufügen des CH4–Inhibitors 2-trichloromethyl-4-dichloromethylene benzo(1,3)dioxin-6-carboxylic acid (ICI 111075) die Methanproduktion verringert (Stanier and Davies, 1981). Höhere Mengen dieser Substanz bewirkten eine Verhältnisveränderung zu einer erhöhten Propionsäure-Bildung. Eun et al. (2004) gelangen zu der Schlussfolgerung, dass jene Nährstoffe, die größtenteils Propionsäure produzieren, eine geringere CH4 Bildung verursachen als Nährstoffe, welche Essigsäure im Verdauungsprozess bilden. Substanzen, wie z.B. Zucker, Stärke können jedoch nur in einer bestimmten Menge verfüttert werden. Eine zu hohe Konzentration kann eine drastische pH-Wert Veränderung nach sich ziehen, wodurch gesundheitliche Probleme entstehen können.
Fette haben, abhängig von der Fettquelle, einen sehr unterschiedlichen Effekt auf die Methanproduktion. Öle, mit einem hohen Anteil an ungesättigten Fettsäuren, wie z.B. Kokusnuss-, Sonnenblumen-, und Leinsamenöl rufen einen niedrigeren CH4 Ausstoß hervor. Ungesättigte Fettsäuren können als Wasserstoffrezeptoren (Boadi et al., 2004; Jordan et al., 2006) fungieren. Es kommt zu einer verringerten H2 Menge, wodurch Methanogene weniger H2 zur Verfügung haben, um Methan zu produzieren. Zudem können die Pansenprotozoen gehemmt werden, die in enger Verbindung mit methanproduzierenden Bakterien stehen (Finlay et al., 1994; Johnson und Johnson, 1995). Jedoch können hohe Fettrationen Schäden in den Verdauungsprozessen im Pansen verursachen, daher ist nur eine bestimmte Konzentration von Fetten in der Realität einsetzbar.
pH-Wert-Veränderung
Eine Umstellung des Futtermittels von Grünfutter-basierend auf Getreide kann den normalen pH- Wert im Rumen von 5,6-6,7 auf 4,0 senken (Ryan, 1964; Owens et al., 1998). Dieser Rückgang kann eine akute Azidose bewirken, was zu einer Veränderung der chemischen Abläufe führt. Anstelle von Essigsäure, Propionsäure und Buttersäure, wird Laktat gebildet und die Methanogene verschwinden (Slyter, 1979; Van Kessel und Russell, 1996). Darüber hinaus werden Faser-abbauende Mikroben gehemmt (Hoover, 1986; Russell und Wilson, 1996) und Einzeller eliminiert (Eadie et al., 1970; Franzolin und Dehority, 1996). Das beeinträchtigt die Gesundheit des Tieres erheblich und führt zu physiologischen Problemen, z.B. Zerstörung der Rumenwand, sinkender Blut-pH Wert, Hufrehe und Leber Abszessen (Ryan, 1964; Ganter et al., 1993). Eine Beeinflussung des pH-Wertes kann auch durch eine Veränderung der Konzentration von ungesättigten Fettsäuren bewirkt werden. Eine Erhöhung führt zu niedrigeren Wasserstoffwerten, konsequenterweise wird der pH-Wert in einem normalen Bereich gesenkt. Dies hat zur Folge, dass das Essigsäure: Propionsäure Verhältnis zu Gunsten der Propionsäure verschoben wird. Der pH Wert sinkt kurz nach der Fütterung (dramatischer bei Getreide, als bei Grünfutter)und steigt nach der Verdauung wieder an. Wird die Frequenz der Fütterung erhöht, so resultiert das in einem insgesamt niedrigeren pH Wert des Rumens. (Robinson und Sniffen, 1985; Shabi et al., 1999). Höhere Qualität des Futters bewirkt einen schnelleren Abbau und folglich einen niedrigeren pH-Wert (optimal bei 5,6-6,0), der die Aktivität der Mikroben hemmt. (Smith und Hungate, 1958; Paynter und Hungate, 1968).
Futterzusätze
Ionophore sind Moleküle, die die Permeabilität für Ionen erhöhen. Dazu gehören unter anderem Polyetherantibiotika wie Monesin, Salinomycin, Lasalocid. Diese Substanzen hemmen die CH4 Produktion, indem sie das Verhältnis von Essigsäure zu Propionsäure so verändern, dass mehr Propionsäure entsteht. Ionophore erwiesen sich in vitro als sehr effizient, jedoch wurden Antibiotika als Futtermittel- Zusatzstoffe von der EU verboten. Verschiedene Halogenderivate (z.B. CHCl3, CH2BrCl oder Chloralstärke) hemmen die Mikroben teilweise oder vollständig (vgl. Flachowsky, 1982) und bewirken einerseits eine signifikante CH4 Senkung, andererseits jedoch eine Leistungsverschlechterung (verminderte Futteraufnahme) der Rinder (Chalupa, 1977; Sawyer et al., 1971).
Es gibt viele Futtermittelzusätze, die an Rindern und anderen Wiederkäuern getestet worden sind, jedoch gibt es noch keinen sicheren Beweis für eine effektvoll methanreduzierende Wirkung. Einige Substanzen sind mit Nebeneffekten verbunden, die sich schädlich auf das Tier auswirken. Einige der Futtermittelzusätze sind hier aufgelistet:
- Omega-3-reiche Nahrung
- Verschiedene Pflanzenextrakte:
- condensed tannins (toxischen Effekt auf die Methanogene)
- Leucaena
Nitrat und Sulfat wurden bereits erforscht, jedoch mit gegensätzlichen Forschungsergebnissen. In einem Versuch hat die 89-tägige-Verfütterung von Nitrat an Getreidesilage fressende Milchkühe gezeigt, dass der Methanausstoß um 16% reduziert wurde. Eine Mischung aus Laurinsäure, Myristinsäure, Leinsamenöl und Calciumfumarsäure bewirkte eine 10% verringerte Methanbildung bei Milchkühen Diallyldisulfid, ein Hauptbestandteil von Knoblauch, löste eine in vitro Methanmengenverkleinerung von 69% aus (Busquet et al., 2005). Saponine zerstören die Zellmembran von Einzellern. Dadurch sinkt deren Anzahl und es kommt zu einer verminderten CH4 Bildung. Darüber hinaus ist die Genmanipulation der Pflanzen ein potentielles Forschungsgebiet.
Rinder sind evolutionstechnisch gesehen, eine der am weitesten entwickelten Spezies in Bezug auf die Komplexität ihres Verdauungstrakts. An den von der Natur fein aufeinander abgestimmten Vorgängen etwas zu verändern ist schwierig, ohne damit einen Schaden im gesamten Organismus anzurichten. Ein weiteres Problem besteht darin, dass selbst wenn eine Methode zur Reduzierung von Methan führt, das Interesse der Landwirte daran gering sein wird. Rinder sind auf Hochleistung gezüchtet und sollen den Bauern Gewinn bringen. Weniger Methan zu emittieren bringt keinen positiven Beitrag in ihrer Kosten-Nutzen Rechnung. Bei der Überlegung, den Methanausstoß zu verringern muss also berücksichtigt werden, dass dies mit erheblichen Kosten seitens des Staates verbunden sein wird. Subventionen und finanzielle Unterstützung der Landwirtschaft durch z.B. erfolgsgebundene Prämien (jedes Kilo Methan Einsparung wird mit einem bestimmten Eurobetrag vergütet) werden notwendig sein, um ein Umdenken überhaupt erst möglich zu machen.
Veränderung des Genoms
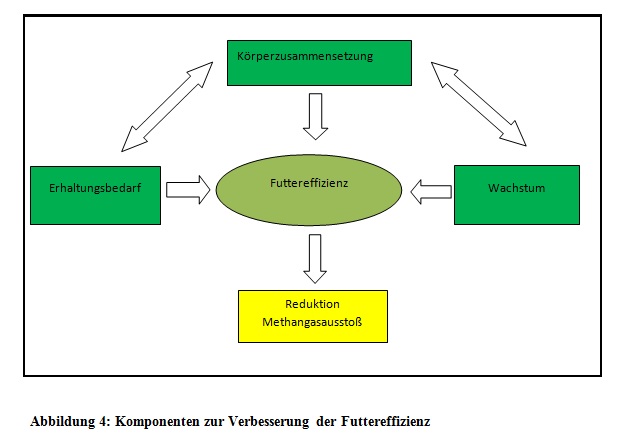
Die Reduzierung der Methangasemission des Rindes ist ein Thema von großer Bedeutung geworden, da die Anhäufung von Methangas mit der globalen Erderwärmung in Verbindung gebracht wird (Haas et al., 2011). Mikrobielle und ernährungstechnische Verfahren zur Reduzierung des Methangasausstoßes wurden umfassend erforscht, jedoch ist das Wissen über züchterische Verminderungen von Treibhausgasen eher begrenzt. Züchterische Fortschritte und Verbesserungen im Bezug auf die Nutzungsdauer, die Krankheitsresistenz, die Fruchtbarkeit und die Widerstandsfähigkeit des Kuhbestandes wirken sich positiv auf die Reduzierung der Methangasemission aus. Strategien zur Methangasreduzierung durch Optimierung der Futtereffizienz, siehe Abbildung 4, wurden im Laufe der Zeit entwickelt (Teil der „indirekten Selektion“). Bei Wiederkäuern ist die Futtereffizienz in hohem Maße abhängig von der Zusammensetzung der Futterration. Die Konsequenz aus den oben genannten Erkenntnissen müsste eine individuelle Futterzuteilung an die verschiedenen Genotypen zur Folge haben.
Weltweit erforschte Verfahren zur direkten Reduzierung der Methangasemission sind schwer umsetzbar und äußerst kostenaufwendig, da genaue Messgeräte zu direkten Messungen des CH4-Ausstoßes an Einzeltieren entwickelten werden müssten. Im Weiteren stellen metagenomische Analysen von Pansenmikroben Möglichkeiten zur Steigerung der Futtereffizienz, als auch der Methanemissionsreduzierung durch genomische Selektionen dar. Zuchtzielsetzung zur Verminderung von Treibhausgasen müssten durch Selektionen auf verbesserte Futtereffizienz in der Rinderzucht angestrebt werden. Dies würde bedeuten, Wiederkäuer genomisch derart zu selektieren, dass sie anfallende Residualfuttermengen energetisch nutzen und somit weniger, zur Ausscheidung kommende, Endprodukte entstehen (Röhe).
Umstrukturierung des Herdenmanagements
Eine Verkleinerung der Rinderherden wäre auf längere Sicht eine Möglichkeit, die Methanemission der Wiederkäuer zu reduzieren. In der Praxis würde dies bedeuten, dass ausschließlich Hochleistungstiere für die Lebensmittelproduktion eingesetzt würden. Dies hieße, dass man von einer geringeren Anzahl an leistungsfähigeren Tieren denselben Ertrag erhalten würde, wie von einer größeren Masse mit weniger produktiven Tieren. Demzufolge wäre der Methangasausstoß geringer, als der einer großen Herde.
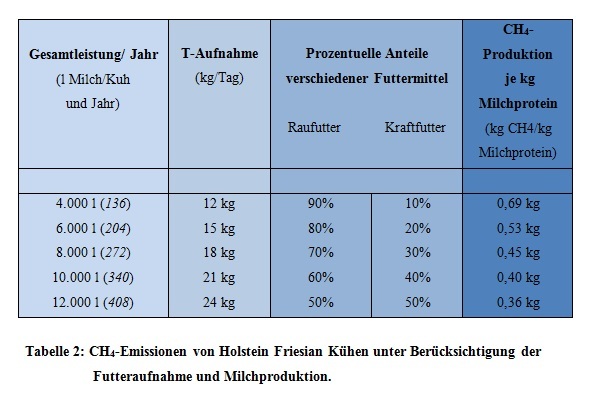
Es ist in der oberen Tabelle ersichtlich, dass der Methanausstoß pro Kuh und Jahr mit zunehmender Produktivität bzw. höherer Futteraufnahme zunimmt. Der entscheidende Faktor ist jedoch, dass die Methanemission pro kg Milch bzw. pro kg hergestellten Milchprotein abnimmt (Flachowsky und Brade, 2007).
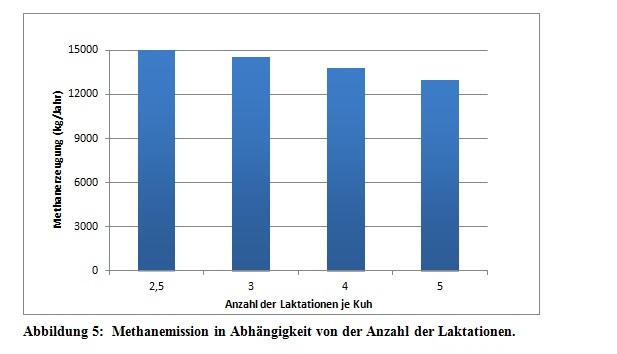
Einen weiteren positiven Effekt auf die Verringerung der Methanemission, hat die Nutzungsdauer der produktiven Tiere. Aufgrund einer längeren Nutzungsdauer der einzelnen Kühe, werden weniger weibliche Tiere zur Bestandsreproduktion benötigt. Anhand von Abbildung 5 ist es zudem erkenntlich, dass sich die Methangasemissionen im Laufe der einzelnen Laktationsphasen reduzieren. Eine längere Nutzungsdauer hat somit einen geringeren Methanausstoß zur Folge (Dämmgen et al., 2007; O’Mara, 2004).
Antimethanpille und Impfung gegen methanogene Bakterien
Wiederkäuern werden Hochleistungen in Fleisch- und Milchproduktion abverlangt. Eine optimale Nährstoffversorgung ist aus diesem Grund von höchster Priorität. Hypothetisch könnte eine Modifizierung der Pansenmikroorganismen zu einer verbesserten Nährstoffbioverfügbarkeit führen. Diese erhöhte Verfügbarkeit von Nährstoffen optimiert die Produktivität der Tiere, wie z.B. die Milchproduktion oder die Lebendgewichtzunahme. Zur Umsetzung dieser Ziele werden weltweit Methoden erforscht. Entwickelt wurde ein Impfstoff zur Immunisierung gegen methanogene Mikroben im Pansen der Wiederkäuer. Bislang wurden jedoch nur mäßige Erfolge erzielt. Auch eine sogenannte „Antimethanpille“, die der Kuh über den Schlund direkt in den Magen zugeführt wird, ist angedacht. Die Forschungen zu diesen Lösungsansätzen sind jedoch noch nicht ausgereift genug und werden weiterhin eingehend untersucht.
Fazit
Mit den Ergebnissen weltweit angestrengter Versuche zur Reduzierung der Treibhausgase steht man noch nahezu am Anfang. Im Brennpunkt der Erkenntnisse stehen die Wiederkäuerfütterung, Selektion und Haltung bestimmter Hochleistungstiere, sowie die Entwicklung methanreduzierender Nahrungsergänzungsstoffe.
Bibliographie
Blaxter K.L., Graham N.M. (1956): The effect of the grinding and cubing process on the utilization of the energy of dried grass. J. Agric. Sci. Camb. 47, 207–217.
Boadi D., Benchaar C., Chiquette J. and Masse D. (2004): Mitigation strategies to reduce enteric methane emissions from dairy cows. Update review. Can. J. Anim. Sci. 84, 319-335.
Busquet M., Calsamiglia S., Ferret A., Carro M.D., Kamel C. (2005): Effect of garlic oil and four of its compounds on rumen microbial fermentation. J. Dairy Sci. 88, 4393–4404.
Chagunda M.G.G., Ross D., Roberts D.J. (2009): On the use of a laser methane detector in dairy cows. Comp. Electr. Agric. 68, 157– 160.
Chalupa W. (1977): Manipulating rumen fermentation. J. Anim. Sci. 46, 585-595.
Dämmgen U., Lüttich M., Haenel H.D., Döhler H., Eurich-Menden B., Osterburg B. (2007): Berechnungen der Emissionen aus der deutschen Landwirtschaft – Nationaler Emissionsbericht (NIR) 2007 fur 2005. Methoden und Daten (GAS-EM). Landbauforschung Volkenrode Sonderheft 304, 9-243.
Demeyer D. L., Nevel C. J. (1975): Methanogenesis, an integrated part of carbohydrate fermentation, and its control. In: I.W. McDonald, A.C.I. Warner (ed.): Potenziale zur Reduzierung der Methan-Emissionen bei Wiederkäuern 457, Proc. IV Int. Symp. Ruminant Physiology, Univ. of New England Publ. Unit. Armidale, Australia, 366-382.
Eadie J.M., Mann S.O. (1970): Development of the rumen microbial population: high starch diets and instability. In: Phillipson, A.T. (Ed.), Physiology of Digestion and Metabolism in the Ruminant. Oriel Press, Newcastle upon Tyne, UK, pp. 335–347.
Eun J-S., Fellner V., Gumpertz M.L. (2004): Methane production by mixed ruminal cultures incubated in dual-flow fermentors. J. Dairy Sci. 87, 112-121
Evans E. (1981): An evaluation of the relationships between dietary parameters and rumen solid turnover rate. Can. J. Anim. Sci. 61, 97–103.
Finlay B.J., Esteban G., Clarke K.J., Willians G. Embley T.M., Hirt R.R. (1994): Some rumen ciliates have endosymbiotic methanogens. FEMS Microbiol.Lett. 117, 157-162.
Flachowsky G. (1982): Methaninhibitoren In: A. Hennig, Ergotropika, Berlin: VEB Deutscher Landwirtschaftsverlag, 237-242.
Flachoswsky G., Brade W. (2007): Potenziale zur Reduzierung der Methan-Emissionen bei Wiederkäuern, Züchtungskunde, 79, (6) S. 417 – 465, ISSN 0044-5401
http://www.zuechtungskunde.de/artikel.dll/einfluss-treibhaus-zueku5-08_ODU4MTU2.PDF
Flachowsky G., Lebzien P., Strobel E. (2004b): „Biotechnikum“ Pansen – Potenziale und Grenzen. Züchtungskunde 76, 46-65.
Franzolin R., Dehority B.A. (1996): Effect of prolonged high-concentrate feeding on ruminal protozoa concentrations. J. Anim. Sci. 74, 2803–2809.
Ganter M., Bickhardt K., Winicker M., Schwert B. (1993): Experimentelle Untersuchungen zur Pathogenese der Pansenacidose beim Schaf. J. Vet. Med. A40, 731-470.
Haas Y., Windig J.J., Calus M.P., Dijkstra J., Haan M., Bannink A., Veerkamp R.F. (2011): Genetic parameters for predicted methane production and potential for reducing enteric emissions through genomic selection, American Dairy Science Association
http://www.ncbi.nlm.nih.gov/pubmed/22118100
Hartnell G.F., Satter L.D. (1979): Determination of rumen fill, retention time and ruminal turnover rates of ingesta at different stages of lactation in dairy cows. J. Anim. Sci. 48, 381–392.
Hoover W.H. (1986): Chemical factors involved in ruminal fiber digestion. J. Dairy Sci. 69, 2755–2766.
Hungate R.E. (1966): The Rumen and its Microbes, Academic Press, New York, NY, USA.
Hungate R.E., Smith W., Bauchop T., Yu I., Rabinowitz J.C. (1970): Formate as an intermediate in the rumen fermentation. J. Bacteriol. 102, 384–397.
Janssen P.H. (2010): Influence of hydrogen on rumen methane formation and fermentation balances through microbial growth kinetics and fermentation thermodynamics Animal Feed Science and Technology, Volume 160, issue 1-2, ISSN: 0377-8401
Johnson K.A., D.E. Johnson (1995): Methane emissions from cattle. J Anim Sci 73, 2483-2492.
Jordan E., Kenny D., Hawkins M., Malone R., Lovett D.K., O’Mara F.P (2006b): Effect of refined soy oil or whole soybeans on intake, methane output, and performance of young bulls. J. Anim. Sci. 84, 2418-2425.
Karnati S.K.R., Yu Z., Firkins J.L. (2009): Investigation of unsaturated fat, monensin, or bromoethansulfonate in continous cultures retaining ruminal protozoa. II Interaction of treatment and presence of protozoa on prokaryotic communities, J. Dairy Sci. 92, 3849–3860.
Kirchgeßner N., Windisch W. and Müller H. L. (1995): Nutritional factors for the quantification of methan production. Proc. of the 8th Int. Symp. on Ruminant Physiology. Enke, Stuttgart, 333-348.
Kolver E.S., de Veth M.J. (2002): Prediction of ruminal pH from pasture-based diets, J. Dairy Sci. 85, 1255–1266
Kusmatono, Shimida A., Stafford K.J., Barry T.N. (1996): Intra-ruminal particle size reduction in deer fed fresh perennial ryegrass (Lolium perene) or chicory (Cichorium intybus). J. Agric. Sci. Camb. 127, 525–531.
Kusmatono, Shimida A., Barry T.N. (1997): Rumen digestion and rumen outflow rate in deer fed fresh perennial ryegrass (Lolium perene) or chicory (Cichorium intybus). J. Agric. Sci. Camb. 128, 87–94. (Janssen)
Mangan J.L. (1972): Quantitative studies on nitrogen metabolism in the bovine rumen. Br. J. Nutr. 27, 261–283.
O’Mara F. (2004): Greenhouse gas production from dairying: reducing methane production. Adv. Dairy Technol. 16, 295-309.
Owens F.N., Goetsch A.L. (1986): Digesta passage and microbial protein synthesis. In: Milligan, L.P., Grovum, W.L., Dobson, A. (Eds.), Control of Digestion and Metabolism in Ruminants. Prentice-Hall, Englewood Cliffs, NJ, USA, pp. 196–223.
Owens F.N., Secrist D.S., Hill W.J., Gill D.R. (1998): Acidosis in cattle: a review. J. Anim. Sci. 76, 275–286.
Paynter M.J.B., Hungate R.E. (1968): Characterization of Methanobacterium mobilis, sp. n., isolated from the bovine rumen. J. Bacteriol. 95, 1943–1951.
Robinson P.H., Sniffen C.J. (1985): Forestomach and whole tract digestibility for lactating dairy cows as influenced by feeding frequency. J. Dairy Sci. 68, 857–867.
Röhe R.: Züchterische Verminderung von Treibhausgasen beim Rind, Animal Breeding and Genomics, Sustainable Livestock Systems Group, Scottish Agricultural College, Edinburgh, Scotland
http://www.tierzucht.uni-kiel.de/workshops/rinderworkshop2012/5.2_Roehe.pdf
Russell J.B., Wilson D.B. (1996): Why are rumen cellulolytic bacteria unable to digest cellulose at low pH? J. Dairy Sci. 79, 1503–1509.
Ryan R.K. (1964): Concentrations of glucose and low-molecular-weight acids in the rumen of sheep following the addition of large amounts of wheat to the rumen. Am. J. Vet. Res. 25, 646–652
Sawyer M.S., Hoover W.H., Suiffen C.J. (1971): Effects of a methane inhibitor on growth and energy metabolism in sheep. J. Dairy Sci. 54, 792.
Shabi Z., Bruckental I., Zamwell S., Tagari H., Arieli A. (1999): Effects of extrusion of grain and feeding frequency on rumen fermentation, nutrientdigestibility, and milk yield and composition in dairy cows. J. Dairy Sci. 82, 1252–1260.
Slyter L.L. (1979): Monensin and dichloroacetamide influences on methane and volatile fatty acid production by rumen bacteria in vitro. Appl. Environ. Microbiol. 37, 283–288.
Smith P.H., Hungate R.E. (1958): Isolation and characterization of Methanobacterium ruminantium n. sp. J. Bacteriol. 75, 713–718.
Stanier G., Davies A. (1981): Effects of the antibiotic monensin and an inhibitor of methanogenesis on in vitro continuous rumen fermentations. Brit. J. Nutr. 45, 567–578.
Sutton J.D. (1971): The rate of carbohydrate fermentation in the rumen. Proc. Nutr. Soc. 30, 36–42.
Swainson N.M., Hoskin S.O., Clark H., Brookes I.M. (2008): The effect of coconut oil and monensin on methane emissions from sheep fed either fresh perennial ryegrass pasture or chicory. Aust. J. Exp. Agric. 45, lxxviii.
Tine M.A., McLeod K.R., Erdman R.A. and Baldwin R.L. (2001): Effects of Brown midrib corn silage on the energy balance of dairy Cattle. J. Dairy Sci. 84, 885-895.
Van Kessel J.A.S., Russell J.B. (1996): The effect of pH on ruminal methanogenesis. FEMS Microbiol. Ecol. 20, 205–210.
Van Nevel C.J., Demeyer D.I. (1996): Control of rumen methanogenesis. Environ. Monit. Assess. 42, 73–97.
Van Zijderveld S. (2011): Dietary strategies to reduce methane emissions from ruminants PhD thesis, Wageningen University, Wageningen, the Netherlands ISBN 978-94-6173-022-0
http://edepot.wur.nl/179281
Verstegen M. W. A., Van der Hel W., Brandsma H.A., Henken A.M., Bransen A.M. (1987): The wageningen respiration unit for animal production research: A description of the equipment and its possibilities. In: Energy metabolism in farm animals: Effects of housing, stress and disease. Martinus Nijhoff Publishers, Dordrecht, The Netherlands.
Abbildungen
Abbildung 1: http://commons.wikimedia.org/wiki/File:Kuh_5778.JPG
- Abbildung 2: Selbst angefertigtes Diagramm mit Hilfe von Angaben von Flachowsky (2007)
- Abbildung 3: Selbst erstellte Abbildung
- Abbildung 4: Selbst erstellte Abbildung basierend auf den Informationen von Röhe
- Abbildung 5: Selbst angefertigtes Diagramm mit Hilfe von Daten von O’Mara (2004)
