A mintázatfelismerő receptorok szerepe
Bevezetés
A természetes immunitás az első védelmi vonal a mikroorganizmusokkal szemben, ugyanis azonnal reagál az idegen anyagokra a mintázatfelismerő receptorok (pattern recognition receptors- PRR) segítségével. A mikrobiális fertőzés felismerése és az antigének elleni védekezés összetett folyamatok által szabályozott. Ezek a receptorok a patogének molekuláris mintázatát detektálják. A mintázat felismerő receptorok jelenléte az állatvilágban elterjedt, azonban kimutatták, hogy a növényekben is létezik egy patogén-specifikus aktivitást felismerő rendszer. Ez a stratégia hasonló az állatok intracelluláris fertőzést detektáló mechanizmusaihoz.
A veleszületett immunitásnak szerepe van a saját és idegen megkülönböztetésében, és a veszélyt jelentő antigén ártalmatlantól való elkülönítésében ezen molekuláris struktúrák segítségével. Sejtes elemei közé soroljuk a természetes lymphocytákat- melyek átmenetet képeznek a veleszületett és szerzett immunitás között-, a granulocytákat, a hízósejteket, az úgynevezett NK-sejteket (natural killer) és mint antigénbemutató sejteket (APC): a macrophagokat és a dendritikus sejteket. Az APC sejtek termelik a mikroorganizmusok molekuláit (pathogen associated molecular pattern - PAMP) felismerő mintázatfelismerő receptorokat, amelyekre az elmúlt évtizedben a legnagyobb figyelmet fordították. 2002-ben Janeway és Medzhitov felfedezte, hogy ezek a receptorok genetetikai kódja csíravonalban rögzített, a gének nem rendeződnek át szomatikusan. A mikroorganizmusok metabolizmusa által keletkezett konzervált molekuláris mintázat felismeréséért felelősek. Szerepük van a komplement és a koagulációs kaszkád aktiválásában, az opszonizációban (gyorsítják a baktérium bekebelezését), phagocytosisban, gyulladásos folyamatok elindításában és az apoptózis serkentésében. A legismertebb mintázatfelismerő receptor a Toll like receptor, mely a sejt felületén expresszálódik, de ugyanakkor több egyéb fontos receptort is felfedeztek intracellulárisan és szecernáltan.(1. ábra)( Gordon, 2002)
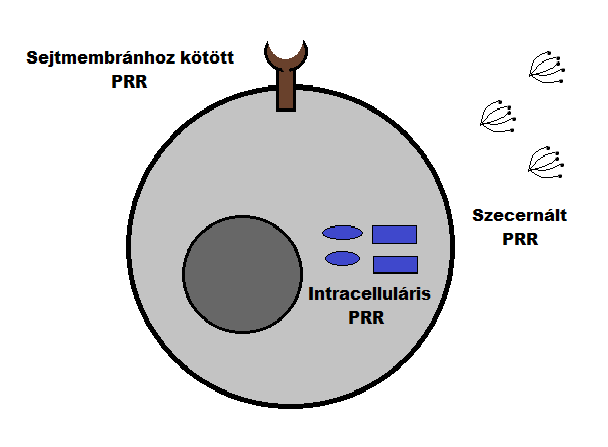
1. Ábra
A természetes immunitásban kiemelkedően fontos szerepet játszanak a mintázatfelismerő receptorok,melyeket az alapján csoportosíthatunk, hogy a molekula felszínén vagy intracellulárisan expresszálódnak, vagy a vérkeringésbe, interstitialis térbe szekretálódnak.
APC sejtek
Az antigénprezentáló sejtek termelik a mintázatfelismerő receptorokat, amelyek lehetővé teszik a sejtnek az idegen és saját struktúrák felismerését. Az egész szervezetben szétszóródnak, mindenütt megtalálhatók. Ennek köszönhetően hatékony védelmet nyújtanak mind az endogén, mind az exogén antigénekkel szemben, ugyanakkor bekebelezik az elöregedett, vagy már elhalt sejteket is. Olyan anyagokat szekretálnak, amelyek kiváltják és szabályozzák a helyi és általános gyulladást és az immunreakciót.
A phagocitózist, intracelluláris jelátvitelt, módosított bioszintézist és szekréciót követően expresszálják az antigént a felszínen az MHC Class I és II molekulákon és gyulladás, immunválasz lép fel. A természetes immunitás aktiválódásának hatására kostimulációs molekulák termelődnek, ezáltal erősítik, fokozzák a védelem hatását. Ezután a speciális B- és T- lymphocytákat aktiválják az APC-k, amik felismerik a prezentált antigént - fehérjéket, szacharidokat, lipideket- és létrejön az specifikus (adaptív) immunválasz. A két rendszer közötti együttműködés nélkülözhetetlen.(2. ábra)(Gordon, 2002 ; Janeway and Medzhitov, 2002)
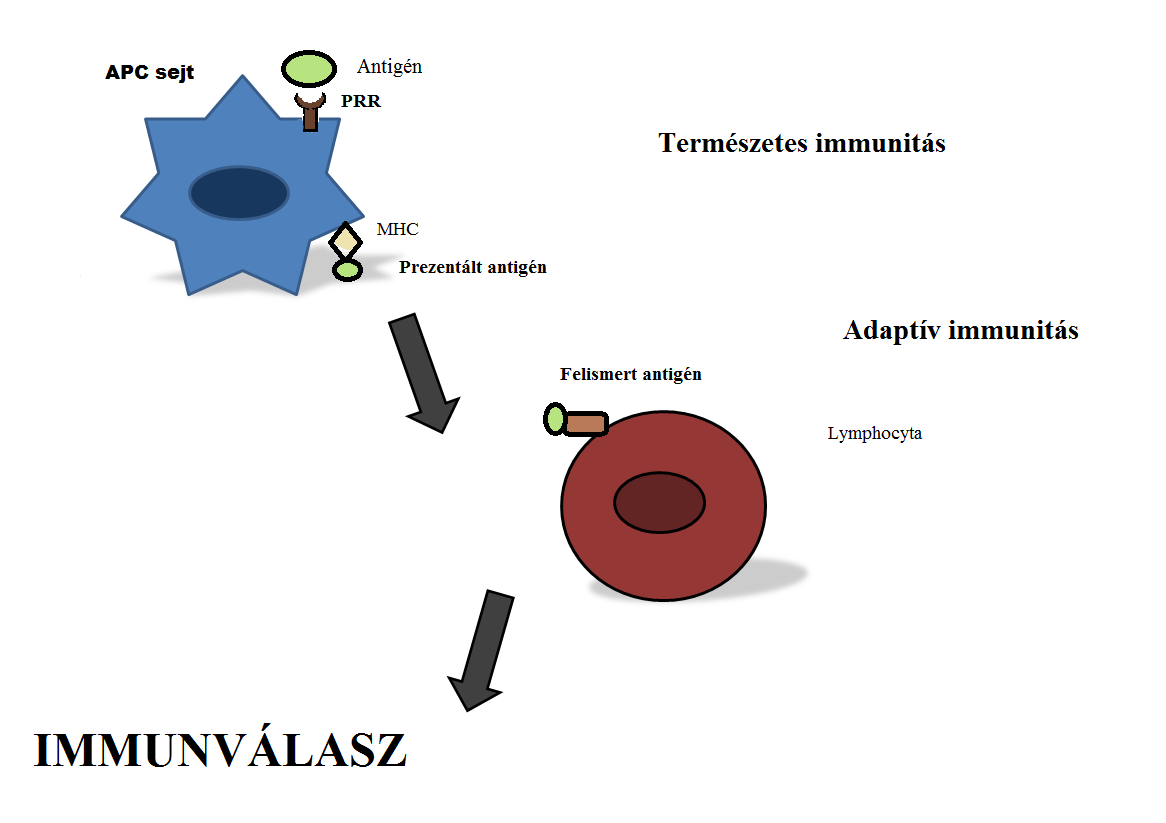
2. Ábra
A mintázatfelismerő receptorok által kiváltott folyamat
Sejtmembránhoz kötött mintázatfelismerő receptorok
Toll-like receptor (TLR)
A Toll-like receptorok kulcsfontosságú szerepet töltenek be a patogén anyagok eliminálásában, és a védekezési reakciók koordinálásában. A TLR család egyike az APC sejteken expresszálódó mintázatfelismerő receptorok típusainak. Elhelyezkedhetnek a plazmamembránon, de intracellulárisan, az endolysosomák falában is. A sejtfelszínen előforduló receptorok döntően a patogén mikrobiális ágensek molekuláris struktúráit, az úgynevezett kórokozóhoz kapcsolódó molekuláris mintázatot (pathogen-associated molecular pattern, PAMP) ismerik fel. („missing-self ”elv).(Iwasaki and Medzhitov ,2004)
Felfedezés
Kezdetben a Toll-fehérjét a rovarok embrióinak dorsoventrális tengelyének kialakításában fontos szerepet játszó molekulaként azonosították. Később ismertté vált, hogy ezen anyagok a rovarok gombás fertőzések elleni veleszületett védekezésében vesznek részt. A TLR-ok jelző mechanizmusokban betöltött fontos szerepének felfedezését segítette elő az ecetmuslicával (Drosophila melanogaster) kapcsolatos kutatások megindulása, melynek során 1997-ben megtalálták az ecetmuslica Toll-fehérjéhez hasonló aminosav sorrendű első emlősfehérjét.Ezért nevezték el Toll-szerű receptoroknak ezeket a molekulákat. (Takeuchi and Akira, 2010 ; Akira and Takeda , 2004)
Szerkezet, illetve jelátvitel
A TLR-ok 1-es típusú integráns membrán glikoproteinek. A molekula extracelluláris patogén felismerő része patkó alakú, leucinben gazdag. Ez a rész kb. 24-29 aminosav hosszúságú ismétlődő szakaszokból épül fel (LRR domén). Citoplazmatikusan az interleukin-1 (IL-1) receptorokhoz hasonlóan rendelkezik még egy kb. 200 aminosavból álló TIR (Toll/ interleukin-1 receptor) doménnel is. (Akira and Takeda , 2004)
Az emberi szervezetben 10, míg az egereknél 12 féle TLR lelhető fel. Ezek egymástól a következő szempontokból különböznek: ligand-specifitás, az expresszió mintázata, illetve az általuk befolyásolt gének. A ligandumok, melyek a TLR-ok által adnak jeleket, főleg exogének, de vannak endogének is. Az exogének közé sorolhatóak a lipopoliszacharidok (LPS), a bakteriális lipoproteinek (BLP), a peptidoglikánok (PGN), a lipoteicholsav (LTA), és a nem metilált bakteriális CpG-DNS stb. A Toll-like receptorok endogén patogénekként ismerik fel a hibás apoptikus sejteket, és azok nukleinsavait, ezáltal szerepet vállalnak a szervezet autoimmunitásában. (Janeway and Medzhitov, 2002)
A megfelelő ligandumok felismerése után a TLR-ok olyan gének expresszióját indukálják, melyek a gazdasejt védelmét szolgálják. A TLR a ligand kötődése után aktiválódik, mely által egy TIR szupercsaládra jellemző jelátvitel indul el. A citoplazmatikus domén más TIR doménekkel (MyD88, NFkB) lép kölcsönhatásba, mely során konformáció változásokon megy keresztül. A Toll-receptorok szignálútjai közös transzkripciós faktorok aktivációját (NFkB és MAP-kinázok) hozzák létre és az IL-6, IL-10, IL-12 citokinek termelését eredményezik. (Takeuchi and Akira, 2010; Akira and Takeda, 2004)
TLR-ok szerepe az emlősök immunitásában
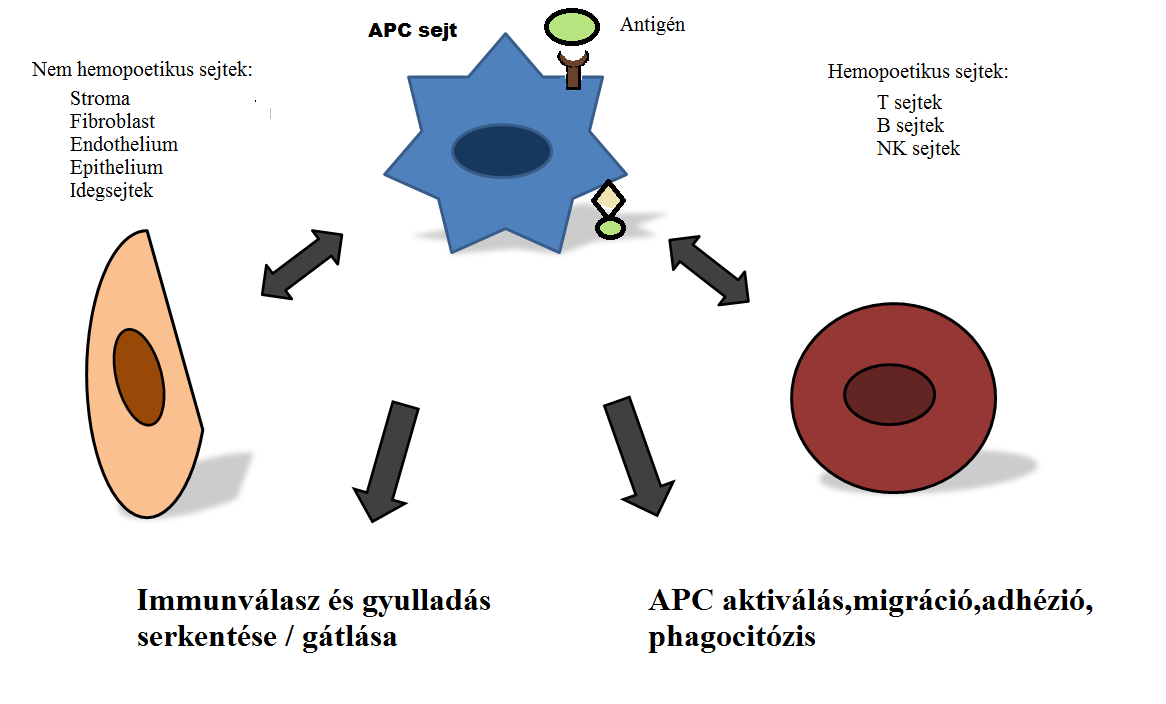
3. Ábra
Antigén prezentáló sejtek az immunválaszokban. Az APC-sejtek endogén és exogén eredetű ligandumokból származó jeleket dolgoznak fel és sejtes kölcsönhatások révén különféle válaszokat hoznak létre.
●TLR által irányított sejt toborozás
A veleszületett és a szerzett immunitás egyik közös jellegzetessége, hogy képes sejt migrációt indítani a támadó kórokozók ellen. Ennek két típusa ismeretes: az indukálható és a homeosztatikus sejt migráció. A beindíthatót általánosan a PRR által érzékelt patogének aktiválják, az utóbbi pedig az éretlen T-lymphocyták szekunder nyirokszövetben való keringését foglalja magában. A TLR által beindított sejt vándorlás célja a szervezetbe bejutott patogének elpusztítása, illetve további terjedésük megakadályozása. Ezen sejtek a perifériás keringésből különböző kemotaktikus faktorok és sejtfelületi molekulák által jutnak el az érintett szövetekhez. A TLR aktivációja kemokinek, illetve kemokin receptor gének expresszióját váltja ki. Az akut mikrobiális fertőződés során többek között interleukin 8 és monocyta kemotaktikus faktorok (MCP-1, MCP-2, MCP-3, MCP4) keletkeznek, melyek az ér belső falán elhelyezkedő integrinekhez kötődnek, ezáltal konformáció változást hoznak létre abban, elősegítve ezzel a leukocyták perifériás környezetbe való kijutását.
A leghatékonyabb védelem érdekében a test nyálkahártyával borított felszínein, melyek kitűnő lehetőséget biztosítanak a kórokozók bejutására, dendritikus sejtekből, mastocytákból, illetve macrophagokból álló sejt tömörülések jönnek létre. A TLR által irányított patogén felismerés fokozza a leukocyták fertőzött szövetekbe való bevándorlását, emellett aktiválja sztróma sejteket, szöveti sejteket és a keringő leukocytákat.(3.ábra)(Iwasaki and Medzhitov, 2004)
●A leukocyták aktivációja
Az akut fertőződés területére beszivárgó sejtek többsége monocyta, neutrofil granulocyta, basofil granulocyta, eosinofil granulocyta és NK sejt.
A különböző toll-like receptorok expressziója leukocytákon, illetve más sejteken fajspecifikus. Egyes kutatások bebizonyították, hogy a humán neutrofi granulocyták amellett, hogy toll-like receptorokat hordoznak, megfelelő hatásra (LPS /lipopolyszacharidok/ jelenléte) kemokineket is szekretálnak. Az emberi NK sejtek TLR9 receptorral rendelkeznek, és interferon-alfa molekulákat termelnek. Az eosinofil granulocyták felszínén TLR1, TLR4, TLR7, TLR 9, TLR10 receptorokat; a mastocytákon TLR1, TLR2, TLR4, TLR6 receptorokat találhatunk. A monocyták szinte valamennyi toll-like receptort hordozzák, mivel ezen sejtek tovább differenciálódhatnak például macrofágokká, illetve dendritikus sejtekké. A TLR szignálok nemcsak a kemokinek és kemokin receptor gének, de a sejt felületi kemokin receptorainak expresszióját is szabályozzák. Például a neutrofil granulocyták TLR4 által stimuláltan csökkentik a G-proteinhez kötött receptor kináz aktivitását.(Iwasaki and Medzhitov, 2004)
●A sztróma sejtek aktiválása
A patogénekkel szemben az epithelialis sejtréteg képezi a szervezet első védelmi vonalát. Emiatt sok TLR expresszálódik az emésztő, légző és urogenitális traktus epithelialis sejtjein. A kórokozók ezen sejtek általi felismerése cytokinek, kemokinek, és antibakterialis peptidek termelődéséhez vezet. Az epithelialis kemokinek bemutatásra kerülhetnek a helyi illetve a lymphonodusok elvezető ereinek endotheliumán, így részt vesznek a sejtek toborzásban. Kísérleti egerek által kimutatták, hogy szisztematikus LPS(lipopoliszacharid) injektálása gyors neutrofil granulocyta tömörülést vált ki az állat tüdejében.
Az epithelialis, endothelialis illetve hematopoietikus őssejtek toll-like receptorai által történő patogén felismerés meghatározó tagja a természetes immunitás védekezési mechanizmusának. A jövőbeli kutatásoknak kell feltérképeznie az egyes sejttípusukhoz tartozó specifikus TLR funkciókat, mint ahogy a leukocyták esetében történt.(Iwasaki and Medzhitov, 2004)
●A TLR kapcsolata a dendritikus sejtekkel
A dendritikus sejtek központi szerepűek a T-lymphocyták aktiválásában és T-helper 1, T-helper 2, illetve citotoxikus T sejtekké (CTL) való differenciálásában. Ezen sejttípus számos mintázat felismerő receptorral rendelkezik, tartalmazva C típusú lecitineket, mannóz receptorokat és nem utolsó sorban toll-like receptorokat. Például a humán myeloid dendritikus sejtek TLR1, TLR2, TLR3, TLR5, TLR6, és TLR8 receptorokat expresszálnak.
A dendritikus sejtek az adaptív és a veleszületett immunitás határterületét képezik. Az éretlen DC sejtek a perifériás szövetekben találhatóak, és aktívan ,,mintát vesznek fel” a környezetükből endocytosis és macropinocytosis révén. Amikor találkoznak a patogénnel, megkezdődik a dendritikus sejtek érése. Ez a folyamat magába foglalja a kostimuláns aktivitás megkezdődését, az antigén feldolgozást, a megnövekedett MHC (major histiocompatibility complex) expressziót és a nyirokcsomókhoz való vándorlást. Ezen sejtmigrációt a toll-like receptorok biztosítják a fertőződési kemokin receptorok érzékenységének csökkentésével, illetve a lyphatikus kemokin receptorok érzékenységének fokozásával. A T-lymphocyták stimulációját a T-sejt receptorának antigenetikus peptidhez való kötődése, illetve a dendritikus sejtek által expresszált aktivátor markerek (CD60, CD80) mediálják. Egy adott dendritikus sejt populáció csak azon patogénekre érzékeny, melyekhez rendelkezik a megfelelő TLR típusokkal. Továbbá hatása függ attól is, hogy mely dendritikus sejtek expresszálják ezen receptorokat. A perifériás tolerancia és a szignálok által kiváltott válasz T-regulátor sejtek által szabályozott.(Janeway and Medzhitov, 2002)
A T-sejtek aktiválódása után már az adaptív immunválasz kerül előtérbe. A dendritikus sejtek más és más típusú citokineket termelhetnek és így az éretlen T-helper sejteket dominálóan T- helper 1 vagy T-helper 2 irányba segítik differenciálódni. Ezen hatásmechanizmusokat egereken vizsgálták. Miután az állatokkal alacsony dózisú LPS (lipopoliszacharid) molekulákat lélegeztettek be, azok szervezetében fokozódott a 2-es típusú T helper sejt termelődése. A dózis növelésével T-helper 1 sejtek általi allergiás gyulladási folyamat indult be. E megfigyelések lehetőséget nyújtanak az egyes megbetegedések kialakulásának megismeréséhez. Az alacsony dózisú LPS a belélegzett környezeti antigén koncentrációt szimbolizálja, mely feltételezi az asztmatikus reakciók beindulását, a magas dózisban alkalmazott LPS a Gram negatív baktérium által kiváltott immunreakcióval egyezik. Ezáltal bebizonyították, hogy a TLR-oknak szerepük van a gyulladásos és autoimmun folyamatokban is. A TLR-ok bakteriális komponensek révén történő aktiválódása akut gyulladáshoz vezet, mely sok esetben szeptikus sokkal is jár. A TLR-ligandokat sokszor hatásfokozóként is használják, azért, hogy szerv-specifikus autoimmun betegségeket generáljanak, mint ahogy az egereken végzett kísérleteknél is tették. A TLR-ok negatív regulátorainak hiánya autoimmun betegségeket okozhat.(Iwasaki and Medzhitov, 2004)
●A TLR szerepe a B sejtek aktivációjában és antitestek termelésben
A B sejteken expresszált TLR-ok stimulálása poliklonális(≈többféle B-sejt klón) aktivációhoz és alacsony affinitású immungobulin M (IgM) antitestek termeléséhez vezet. A B2 sejtek poliklonális aktivációja viszont autoreaktív antitestek képződéséhez vezethet, ezért számos olyan mechanizmus létezik, mely a B-sejt mechanizmust szabályozza.
A TLR-ligandumok által létrehozott poliklonális aktiváció jelentősége a B memóriasejtekkel kapcsolatban került kimutatásra. Ezek alapján a B memóriasejtek specifitásuk miatt szelektált sejtek, ezért ezen sejtek poliklonális aktivációja nem vezet autoimmun folyamatokhoz.(Iwasaki and Medzhitov,2004)
Típusok
●TLR4
A Drosophila Toll humán homológja. A feltételezés, miszerint az emlősök TLR-ai mintázatfelismerő receptorként funkcionálhatnak a TLR4 vizsgálatának köszönhetően fogalmazódott meg. Fontos szerepe van a gram negatív baktériumok felismerésében. Ezen kívül szerepe van a H5N1 madárinfluenza vírus kórfejlődésének változtatásában is. A madárinfluenza által okozott akut tüdőbetegség következtében endogén oxidált foszfolipidek szabadulnak fel, amelyek stimulálják a TLR4-es receptorokat. Egereken végzett kísérletek azt mutatták ki, hogy azok az egerek, melyek nem rendelkeztek ilyen típusú receptorokkal, rezisztensek a madárinfluenzával szemben. (Janeway and Medzhitov, 2002; Takeuchi and Akira, 2010)
●TLR2
Az emlősök TLR-ai közül ez képes a legnagyobb mennyiségű ligand felismerésére. Főleg baktériumok, mikoplazmák és vírusok különböző komponenseit ismeri fel olyan módon, hogy heterodimert képez a TLR1 vagy TLR6 receptorokkal és az így keletkező komplexek különböző ligandumok felismeréséért felelősek. Az általa felismert ligandok közé tartoznak a következők: proteoglikánok, bakteriális lipoproteinek, a Staphylococcus epidermis egy fenolban oldódó faktora, a Prophyromonas gingivitis és a Leptospora interrogans lipoproteinjei, glikozil foszfatidilinozitol lipid a Trypnaosoma cruziból és a zimozán, amely az élesztőgombák sejtfalának a komponense. (Janeway and Medzhitov, 2002; Takeuchi and Akira, 2010)
●TLR5
A flagellint ismeri fel. Ez egy olyan protein alkotó, mely a baktériumok flagellumát építi fel. A flagellum vagy ostor feltétlenül szükséges a baktériumok életben maradásához. Az S. adelaide flagelluma fontos szerepet játszott az immunitás kutatásának kezdeti szakaszában. Ez egy olyan nagy potenciálú antigén volt, amiről kiderült, hogy pajzsmirigy-independens. A TLR5 receptort a vékonybél lamina propriájának DC sejtjei nagy mennyiségben expresszálják. A flagellinre válaszul a lamina propria DC sejtjei arra serkentik a B sejteket, hogy IgA- termelő plasma sejtekké alakuljanak át és stimulálják a naív T-sejtek antigén specifikus Th17 és Th1 sejtekké való átalakulását. (Janeway and Medzhitov, 2002; Takeuchi and Akira, 2010)
●TLR9
Olyan metilálatlan CpG motívumokat ismer fel, melyek a bakteriális DNS-ben vannak jelen. Ez azért lényeges, mert az emlősök genomjának döntő része metilált, míg a baktériumok nem rendelkeznek CpG-metiláló enzimekkel. A TLR9 ezen kívül fel tudja ismerni a hemozoint. Ez egy olyan kristályos metabolit, amit a malária parazitája állít elő. Fontos megjegyezni, hogy a TLR-ok nem csak a sejtek felszínén helyezkedhetnek el, hanem intracellulárisan is. Ez a TLR9-re is igaz. (Janeway and Medzhitov, 2002; Takeuchi and Akira, 2010)
●TLR11
Ez a receptor típus egerekben megtalálható, viszont embereknél nem. Uropatogenetikus baktériumokat, valamint olyan molekulákat ismer fel, amelyek az intracelluláris protozoa Toxoplasma gondii-ból származnak. A TLR3, TLR7, TLR8 és TLR9 képesek a vírusokból és baktériumokból származó nukleinsavak felismerésére is. (Takeuchi and Akira, 2010)
TLR Lokalizáció Ligandum A ligandum eredete TLR1 Plazmamembrán Triacil lipoprotein Baktériumok TLR2 Plazmamembrán Lipoprotein Baktériumok, vírusok, paraziták TLR3 Endolizoszóma Dupla szálú RNS Vírus TLR4 Plazmamembrán Lipopoliszacharid Baktériumok, vírusok TLR5 Plazmamembrán Flagellin Baktériumok TLR6 Plazmamembrán Diacil lipoprotein Baktériumok, vírusok TLR7 Endolizoszóma Egyszálú RNS Vírusok, baktériumok TLR9 Endolizoszóma CpG-DNS Vírusok, baktériumok, protozoák TLR10 Endolizoszóma Nem ismert Nem ismert TLR11 Plazmamembrán Profilin-szerű molekula Protozoa
Táblázatban összefoglalva a TLR típusok
Konklúzió
A veleszületett immunitás nagyon összetett, hiszen meg kell védenie a gazdaszervezetet a nagy diverzitású mikrobiális világgal szemben. A TLR-ok a mikrobiális fertőzést érzékelve több olyan mechanizmust alkalmaznak, melyek az adaptív immunrendszer válaszait szabályozzák. A dendritikus sejtek kulcsfontosságú szerepet játszanak a TLR-ok által mediált immunfelismerésben, és a T illetve B-sejtek aktiválásában. A legújabb kutatások szerint a DC sejtek a különböző feladatok teljesítésének érdekében képesek specializálódni. Ez azt jelenti, hogy számos DC-altípus létezik és ezek mind egy-egy fertőzés esetén kialakuló válaszért felelősek. Ez a funkcionális specializáció magyarázatot jelenthet az expresszált TLR-ok sokféleségére.(táblázatban összefoglalva a TLR típusok) (Janeway and Medzhitov, 2002)
Mannózreceptor-család (MMR)
Az MMR macrophagok, dendritikus sejtek felületén expresszálódik. Kölcsönhatásba lép számos Gram pozitív és Gram negatív baktériummal és gombákkal. A fő szerepük a patogének bekebelezése és a lizószómákhoz való szállításuk, ahol az enzimek lebontják. (Janeway and Medzhitov, 2002)
Scavenger receptorok (SR)
A scavenger receptorok a fagocitózist segítik elő a macrophagok membránjának felületén. Ligandjai közé sorolhatók az anionos polimerek ( RNS, lipopoliszacharidok ). Szerepet játszanak az endotoxikus sokk megakadályozásában, és a szervezet védelmében. Ezt demonstrálja, hogy a SR hiányában az egér fogékonyabb a Listeria monocytogenes baktériumokra, a herpesz vírusra és a malária fertőzésekre.(Janeway and Medzhitov, 2002)
Szecernált mintázatfelismerő receptorok
A legősibb védekező mechanizmus a különböző antimikrobiális fehérjék termelése, melyek közé sorolhatjuk a szecernált PRR-eket.
A mintázatfelismerő receptorok ezen típusának legismertebb családja a Ca2+ függő C- típusú lektinek. Ezen belül kiemelkedő szerepű a kollektinek, pentraxinok alcsalád. A fertőzés korai stádiumában a májban termelődő mannóz kötő lektin (MBL), C-reaktív fehérje (CRP) és a szérum amiloid fehérje (SAP) elsődleges szerepet játszanak az immunválaszban. Részt vesznek a homeosztázisban is. ( Gordon, 2002)
Kollektinek
Az elnevezés onnan ered, hogy kollagénszerű sorrend jellemző erre a csoportra. Ezek a fehérjék rendelkeznek egy C-típusú doménnel és egy kollagénszerű régióval. Ide sorolhatjuk az MBL-t, ami specifikusan terminális mannózhoz kötődik, ami bőséges mennyiségben megtalálható számos mikroorganizmus felszínén. Kapcsolódnak a szerin-proteázokhoz (MASP) és aktiválják a komplement rendszert.
Pentraxinok
Ehhez az alcsoporthoz tartozik a CRP és a SAP. Ezek az akutfázis-fehérjék szerepet játszanak az opszonizációban a baktérium felszínén foszforilkolinhoz kötődve. Ugyanakkor a komplementrendszer egyik fontos proteinjéhez, a C1q-hoz is képesek kapcsolódni és ezúton aktiválni azt. (Janeway and Medzhitov, 2002)
Intracelluláris mintázatfelismerő receptorok
Intracelluláris kompartmenek is jelentős szerepet játszanak a természetes immunitásban, ugyanis képesek érzékelni a mintázatfelismerő receptoraik segítségével a sejten belüli vírusokat és bakteriális patogéneket. Az egészséges szervezetben inaktív formában vannak jelen.
A legismertebb intracelluláris PRR a NOD molekulacsalád. A NOD fehérjék rendelkeznek egy C-terminális leucinban gazdag ligandfelismerő doménnel (LRR), egy nukleotid kötő résszel (NBD), és egy N-terminális CARD doménnel. Amennyiben PAMP kötődik a receptorhoz, konformációváltozást idéz elő. A CARD rész kapcsolódik egy protein kinázzal, és ezúton aktiválja az NF-κB-t és az intracelluláris kapcsolatban résztvevő jelzőmolekulák (pl. : citokinek) aktivációjára kerül sor.
Felfedezték, hogy a NOD2 gének mutációi nagyobb kockázatot jelentenek a Chron betegségre, ami krónikus vastagbélgyulladással jár.
Számos PRR a citoplazmában expresszálódik, ahol detektálja a patogéneket és választ indukál, aminek hatására blokkolódik a replikációjuk. A protein kináz receptor (PKR) a vírusfertőzés során termelődött RNS-hez kötötten aktiválódik. Az aktivált PKR foszforilálódik és inaktiválja a transzlációt serkentő faktort (eIF2α), és ez gátolja a fehérjeszintézist. Végül aktiválja az NF-κB sejtmagba történő transzlokációját követően aktiválja az antivirális IFN gének I-es típusát. A PKR egyben akadályozza is a vírus terjedését azáltal, hogy serkenti a fertőzött sejtek apoptózisát. Egy másik RNS kötődés által aktivált út a 2’- 5’- oligoadenilát szintetáz (OAS), ami hasonló hatást fejt ki. ( Janeway and Medzhitov, 2002)
Irodalomjegyzék
1. Akira S., Takeda K.(2004): Toll-like receptor signalling. Nature Reviews Immunology, 4(7):499-511,
2. Gordon S.(2002): Pattern Recognition Receptors: Doubling Up for the Innate Immune Response. Cell, Vol. 111(7), 927–930
3. Iwasaki A., Medzhitov R.(2004): Toll-like receptor control of the adaptive immune responses.Nature Immunology, 5(10):987-95
4. Janeway C.A. Jr., Medzhitov R.(2002): Innate immune recognition. Annual Review of Immunology, 20(1):197–216
5. Takeuchi O., Akira S.(2010): Pattern Recognition Receptors and Inflammation, Cell, 140, 805–820
(Az ábrák és a táblázat saját készítésűek)
