A mitokondriumok szerepe az öregedésben
Az öregedés során bekövetkező változások a szervezetben
Az öregedés az elmúlt évtizedekben egy nagyon intenzíven kutatott terület, amelyben számos folyamat közrejátszik. Ezek közül a mai tudásunk szerint a mitokondriumoknak van a legnagyobb szerepe, ugyanis az energiatermelés nélkülözhetetlen a sejtek megfelelő működéséhez. Az öregedés során romlanak a szervezet élettani funkciói: mitokondriális légzési lánc diszfunkció alakul ki, amely csökkent energiatermelést eredményez a sejtben. Ennek következtében kialakulnak az öregedéssel kapcsolatos betegségek is, mint például az Alzheimer kór, Parkinson kór, daganatos betegségek, 2-es típusú cukorbetegség (Anton és mtsai, 2015; Basaria, 2013; Fulop és mtsai, 2010). A kialakuló életminőség csökkenésben szerepet játszanak külső (exogén), és belső (endogén) tényezők, azonban ezek éles elkülönítése nem lehetséges, mivel egymásra kölcsönösen ható, komplex folyamatokról van szó.
A mitokondrium funkcióra hatással lévő exogén tényezők között meg kell említenünk a hormonokat (Vaitkus és mtsai, 2015; Velarde, 2014), a test fizikai állapotát (Gram és mtsai, 2015), valamint egyéb hatásokat, mint a dohányzás, karcinogén anyagok, sugárzás.
Az endogén tényezők közé pedig a sejtben és a mitokondriumban keletkező termékek tartoznak, amelyek zavart okoznak a mitokondrium funkcióban: mitokondriális DNS mutációk, reaktív oxigén gyökök (ROS).
Ezen tényezők együttes hatása fejti ki a mitokondriumban bekövetkező funkcionális degradációt, amely az öregedéshez vezethet (Kauppila és mtsai, 2017).
A mitokondriumban bekövetkező változások
Morfológiai változások
Az említett exogén és endogén tényezők következtében morfológiai és számbeli változások következnek be a mitokondriumok esetében. A vázizomban és az agyban az öregedéssel párhuzamosan megfigyelték a mitokondriumok számának csökkenését, abnormális megnagyobbodását, és morfológiai változását: a mitokondriumok ovális helyett egyre inkább gömb alakúak lettek (Palomera-Avalos és mtsai, 2016; Crane és mtsai, 2010; Shigenaga és mtsai, 1994; Terman és mtsai, 2010).
Mutációk a mitokondriális DNS-ben
Nem csak morfológiai változások következnek be az öregedéssel, a mitokondriális DNS is jelentős változásokon megy át. Az idő előrehaladtával mitokondriális DNS mutáció akkumuláció figyelhető meg, ezáltal oxidatív foszforiláció diszfunkció alakul ki, ami a sejtek között mozaikszerűen jelenik meg (Larsson, 2010).
A mtDNS mutációk jelentősége kiemelendő, ugyanis a mitokondriális DNS által kódolt, és termelt fehérjék az oxidatív foszforilációban vesznek részt, amely a sejt energia ellátásáért felelős. Az itt keletkező mutációk jelentős hatással vannak a sejt energia háztartására, valamint funkciójára (Chinnery, 2015; Keogh, M.J. és Chinnery, P. F., 2015).
Bogenhagen és Clayton (1977) kimutatták, hogy a mtDNS több száz példányban van jelen minden sejtben, és az élet során replikálódik a sejtciklus által meghatározott módon.
Minden szervezetben jelen van egy bizonyos szintű mtDNS mutáció (Payne és mtsai, 2013). Ez érintheti a teljes mitokondriális genomot (homoplazmás mutáció), vagy csak a másolatok egy részét (heteroplazmás mutáció). A mutációk mértékének el kell érnie egy küszöbértéket, hogy mitokondrium diszfunkció alakuljon ki (Boulet és mtsai, 1992; Larsson és mtsai, 1992; Rossignol és mtsai, 2003; Stewart és Chinnery, 2015). Ezt a bizonyos küszöbértéket, csak azon mutációk érhetik el, amelyeknek elég idejük van replikálódni, tehát, amelyek öröklődtek, vagy az embrionális korban keletkeztek (Elson és mtsai, 2001).
A mtDNS mutációk többféle módon keletkezhetnek: örökletesen, oxidatív sérülések által, replikációs hibákból adódóan, illetve az elégtelen hibajavító működés következtében.
ROS (reaktív oxigén gyökök) okozta változások
Harman elmélete
A XX. század közepén kezdtek el foglalkozni a reaktív oxigén gyökök szerepével azon folyamatokban, amelyek az öregedéshez vezethetnek. Harman (1956) adta ki az öregedés szabad gyökös elméletét, miszerint az öregedéshez a növekvő ROS termelés vezet, amely oxidatív sérüléseket okozva, következetes diszfunkciót vált ki a nukleinsavakban, fehérjékben, lipidekben.
Harman (1972) kiegészítette alapvető teóriáját, miszerint az öregedésben szerepet játszó reaktív oxigén és nitrogén gyökök egyaránt a mitokondriumban termelődnek, és ott is fejtik ki hatásukat.
A ROS kialakulása, hatásmechanizmusa
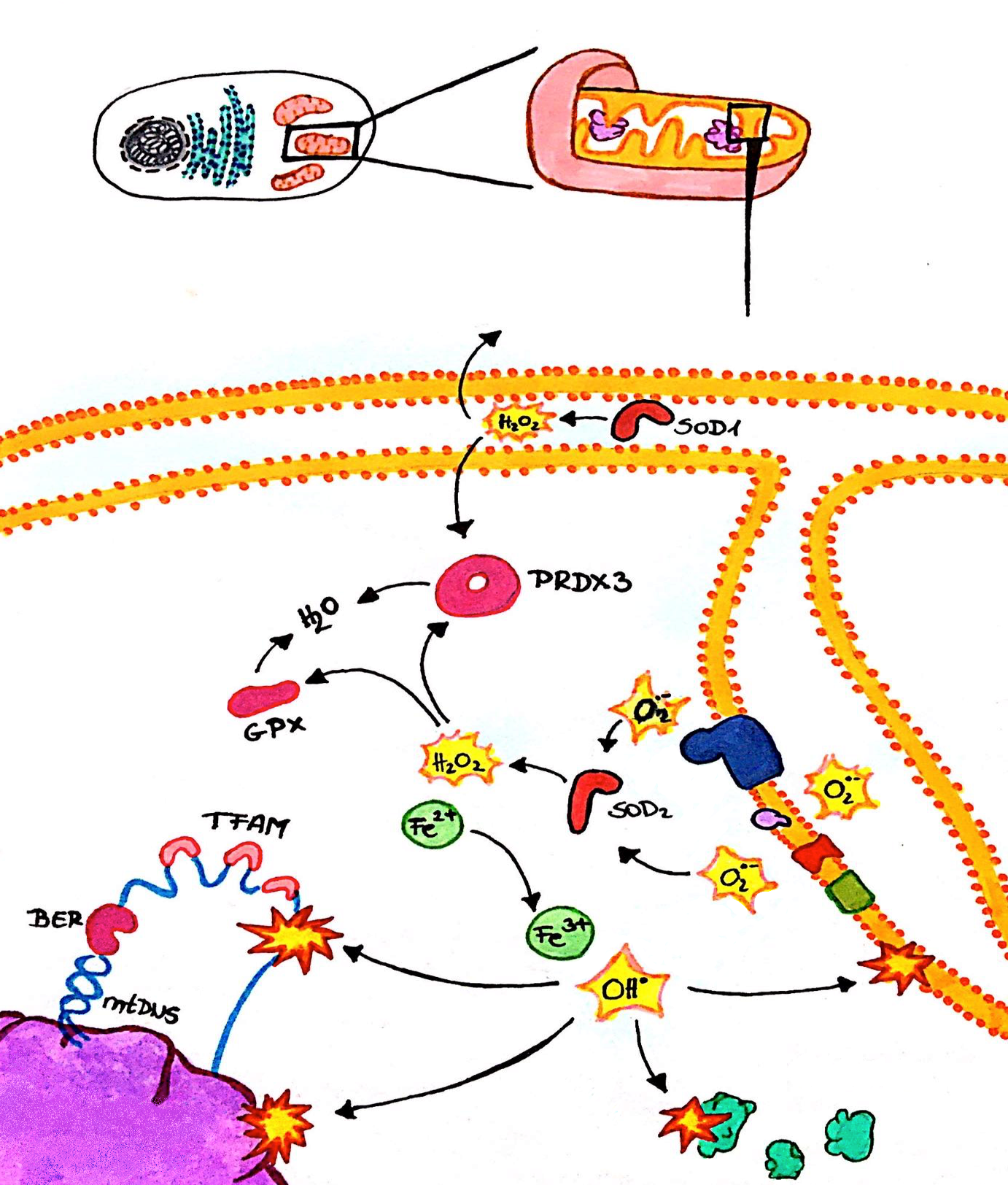
A ROS legnagyobb része a mitokondriumban termelődik az elektrontranszport-lánchoz kötötten a terminális oxidáció során. Az elektronok szivárgása (főleg az I., és III. komplexből) a termelődés oka, ugyanis ezek az elektronok az oxigént szuperoxid anionná redukálják. A szuperoxid jelentősége abban rejlik, hogy számos sejten belüli folyamatnak a prekurzora (Turrens, 2003; Murphy, 2009).
|
1. ábra: ROS kialakulása |
A sejtlégzés során keletkező szuperoxid a szuperoxid-dizmutáz 1 (SOD1), valamint szuperoxid-dizmutáz 2 (SOD2) segítségével hidrogén-peroxiddá (H2O2) alakul. Sem a szuperoxid, sem a H2O2 nem elég reakcióképes, hogy effektív károsító hatást fejtsen ki, azonban a H2O2-ból keletkező hidroxil gyök Fe2+ jelenlétében (Fenton reakció), igencsak reakcióképes vegyület, és bármilyen molekulával reakcióba tud lépni. A hidroxil gyök mennyiségét a H2O2 vízzé alakulása korlátozza, amelyhez a glutation peroxidáz 1 (GPX1), vagy a tioredoxin függő peroxiredoxin enzim (PRDX3) szükséges. A H2O2 a tiol csoportok oxidálásával fontos jelközvetítőként funkcionál, valamint a mitokondriumból való kidiffundálásával, részt vesz különböző redoxi folyamatok szabályozásában (Kauppila és mtsai, 2017).
A fiziológiás ROS termelés során a gyökök jelentős részét képesek semlegesíteni az antioxidánsok, valamint egyéb enzimek. Azonban az antioxidánsok elégtelen működése, vagy a légzési láncot gátló anyagok jelentősen fokozzák a ROS termelést. Ilyen légzési láncot gátló anyagok lehetnek maguk a reaktív gyökök, valamint termelődhetnek a fent említett exogén tényezők következtében, mint dohányzás és a sugárzás (Turrens, 2003).
A ROS valódi szerepe
Harman teóriáját számos kutatás megkérdőjelezte, ugyanis bizonyos esetekben nem tudták kimutatni az emelkedett ROS szintet az öregedés folyamán, valamint a ROS fontos jelközvetítő, aktiváló mechanizmusokban is részt vesz (Finkel, 2003; Lagouge és Larsson, 2013). További ellenérvként szolgál, hogy a ROS káros hatásai csak akkor érvényesülnek, ha a szintjük meghaladja a sejt ROS semlegesítő képességének küszöbértékét (Alexeyev, 2009).
Lewis és mtsai (2013) kimutatták, hogy a csupasz vakondpatkány (Heterocephalus glaber) 25-30 évig is képes élni, ellentétben az egerek 3-4 éves maximális életkorával, miközben a ROS szintjük közel azonos az idős egerekével. Ez azért meglepő, mert a rágcsálók közül egyedül a csupasz vakondpatkányok rendelkeznek ilyen kimagasló élettartammal. A lényeges különbség a két faj között, hogy a csupasz vakondpatkányok ROS szintje egy állandó, az élet során nem változó, magas szintet képvisel. Erre a különös jelenségre magyarázatul szolgál, hogy a csupasz vakondpatkányok az állandóan magas oxidatív sérüléseknek ellen tudnak állni különböző védekező mechanizmusoknak köszönhetően.
A kísérlet eredményeiből arra lehet következtetni, hogy ugyan ki lehetett mutatni a magas oxidatív sérülések szintjét, de direkt összefüggést nem találtak a ROS szint növekedés és az öregedés között.
Összefoglalva a ROS káros hatása abban rejlik, hogy oxidatív sérüléseket okozva a lipidekben, fehérjékben, valamint a DNS-ben a sejt és az oxidatív foszforiláció diszfunkciójához vezethet. (Cui és mtsai, 2012).
Az oxidatív foszforilációt érintő változások
A különféle okok miatt keletkezett mitokondriális DNS mutációk, oxidatív sérülések legfőképpen a mitokondriális elektrontranszport-láncot gátolják. Az elektrontranszport-lánc diszfunkció manapság nagyon intenzíven kutatott téma, ugyanis számos neurodegeneratív betegség köthető hozzá: Parkinson kór, Alzheimer kór, I. komplex szindróma…
Az eletrontranszport-lánc sérülésének következtében az ATP-szintáz aktivitása csökken, ezáltal kevesebb energiát tud előállítani a sejt, amely szövet degradációhoz vezet. Leggyakrabban a legtöbb polipeptidláncból álló, és az elektrontranszferben nagy szerepet játszó I. és IV. komplex sérül. A sérülés oka általában a peroxinitrit anion (ONOO-) által nitrált fehérjékben a kovalens keresztkötések kialakulása. A ONOO- a mitokondrium mátrixában termelődik a NO és a O2- reakciójával, ezért elsősorban a peroxinitrit szint emelkedéséért a mitokondriális NO szintetáz és a fokozott szuperoxid termelés felel (Navarro és Boveris, 2010).
A mitokondriális funkciót javító lehetőségek
Antioxidánsok
Antioxidánsok segítségével enyhíteni lehet a mitokondriális diszfunkciót a reaktív oxigén gyökök toxikus hatásának csökkentésével. Így ez nagy szerepet kaphat a neurodegeneratív betegségek kezelésében.
Számos endogén antioxidáns jelen van a szervezetünkben, amelyet a saját sejtjeink állítanak elő: E vitamin, szuperoxid-dizmutáz, glutation-peroxidáz. Emellett vannak exogén antioxidánsok, amelyeket a szervezet nem tud előállítani. Többek között ide tartoznak a célzott mitokondriális antioxidánsok is: MitoVitE, MitoQ, tiron.
A MitoVitE és a MitoQ azért különlegesek, mert a mitokondrium belső membránja nagy mértékben átjárható számukra, és pozitív töltésük miatt az elektrokémiai potenciál következtében fel tudnak halmozódni a mátrixban. Ebből kifolyólag a mitokondrium mátrixában tudják kifejteni a hatásukat.
Emellett a tiron úgynevezett kettős antioxidáns hatással rendelkezik. Az oxidatív sérülések enyhítésén túl szerepet kap a fémkelát képzésben is, csökkentve a szabad fémek koncentrációját a sejtben (Oyewole és Birch-Machin, 2015).
A mitokondrium biogenezis
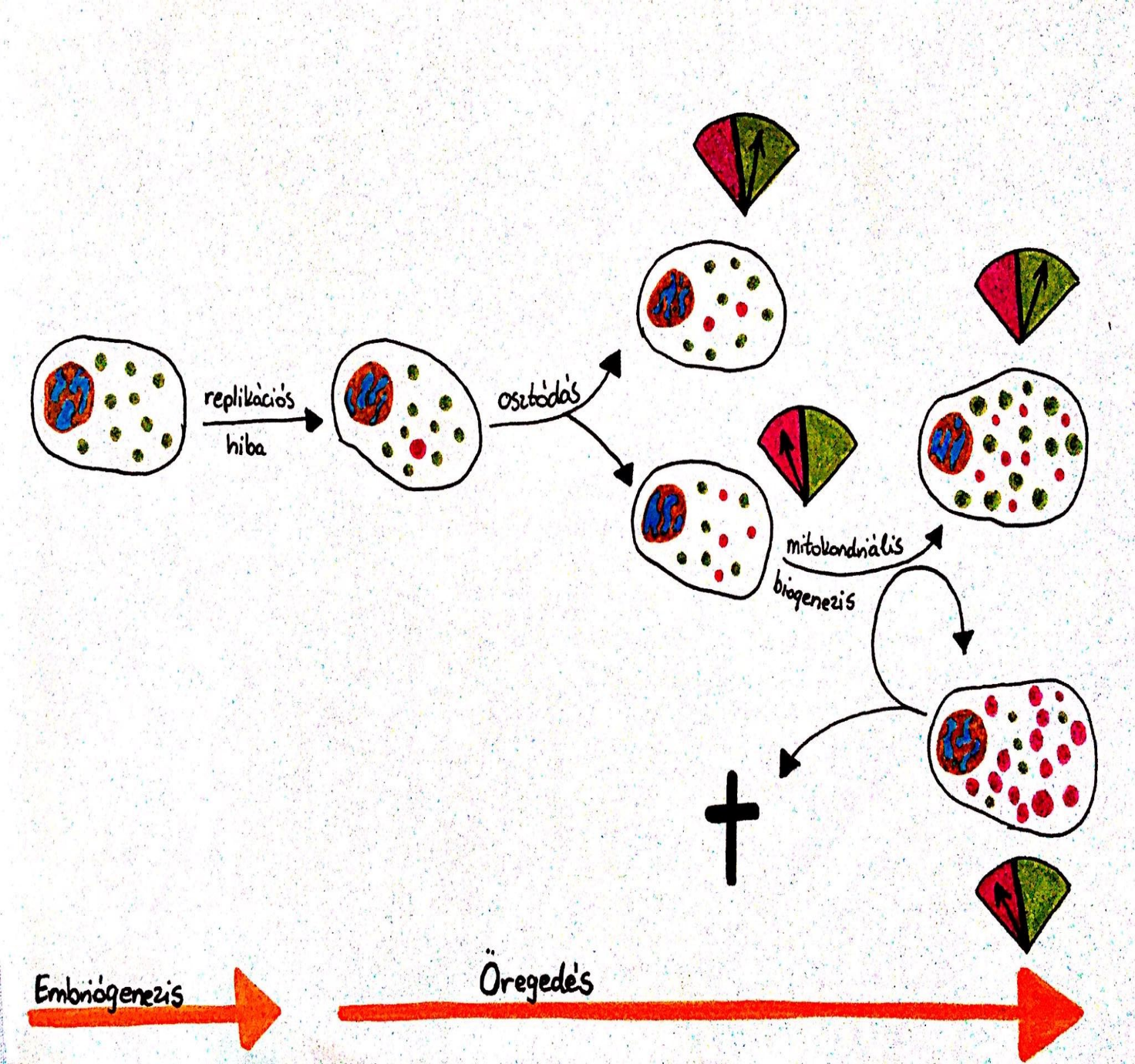
A mitokondriális biogenezis, tehát a mitokondriumok keletkezése, számuk emelkedése pozitív hatással lehet a mitokondriális funkcióra. A biogenezis gyakran elektrontranszport-lánc sérült sejtekre hat (Kauppila és mtsai, 2017), ugyanis a mitokondriális NO a peroxinitrit képzésen kívül, biogenezist indukáló hatással is rendelkezik (Navarro és mtsai, 2009)
|
2. ábra: Mitokondrium biogenezis |
A károsodott mitokondriumok esetében biogenezis útján növekszik a mitokondriumok száma, azonban ezáltal csökkenhet, valamint emelkedhet is a relatív szintje a mtDNS mutációknak a sejten belül. Ezáltal két út áll a sejt előtt. Túlél, azáltal, hogy az újonnan keletkezett mitokondriumok egészségesek, és biztosítják a megfelelő energiamennyiséget, vagy a mutáció megjelenik az új mitokondriumokban is, és a káros hatások tovább rontják a sejt túlélési esélyeit, amely végül apoptózishoz vezet (Kauppila és mtsai, 2017).
Mindezeken kívül a sejtek képesek fokozni a biogenezist külső hatásokra is, mint például testedzés, hormonok, diéta (Ruetenikand és Barrientos, 2015).
A mitokondriumok eltávolítása
Mitofágia
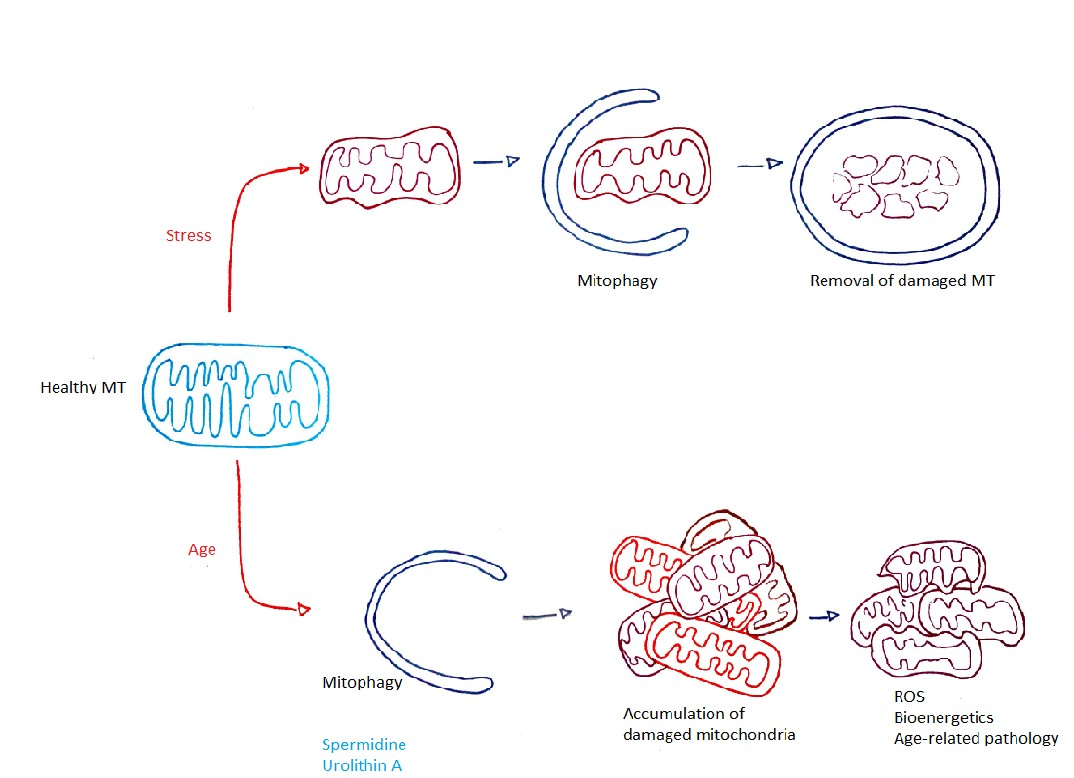
Az autofágia egy speciális esete a mitofágia, amely során az eltávolított sejtorganellum egy mitokondrium. (Ohsumi, 2014).
A folyamat jelentősége, hogy a sérült, működésképtelen mitokondriumok eltávolításával, majd új, egészséges mitokondriumok kialakulásával biogenezis útján növekedhet a sejt energia mérlege.
|
3. ábra: Mitofágia |
A stressz hatására károsodott mitokondriumokat a sejt mitofágiával tudja eltávolítani. Az életkorral csökken a mitofágia mértéke, hatékonysága (Rubinsztein és mtsai, 2011). A spermidin és az urolitin A fokozza a mitofágiát, ezáltal növeli az élettartamot, és a védelmet a korral járó betegségekkel szemben (Eisenberg és mtsai,2016; Ryu és mtsai, 2016).
A gránátalmában (Punica granatum) nagy mennyiségben található urolitin, ezáltal fogyasztása esetén pozitív hatást tudunk kifejteni a mitofágiára (Ryu és mtsai, 2016).
Egyéb eltávolító mechanizmusok
MDV
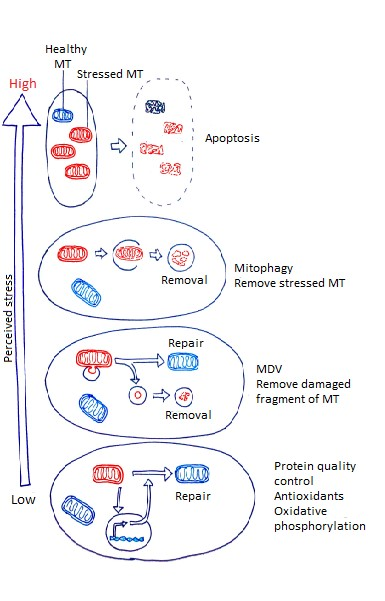
A mitokondrium egészének eltávolítása nagyon nagy energia befektetést igényel, ezért bizonyos esetekben csak a mitokondriumok egy része kerül eltávolításra az úgynevezett MDV (mitochondrial-derived vesicles) segítségével. Ezt a folyamatot több fehérje is szabályozza, ezek közül a PINK1 és a Parkin a két legjelentősebb. Ezen fehérjék irányításával a sérült mitokondriális makromolekulák egy vezikulumba kerülnek (a mitokondrium külső és belső membránját is tartalmazhatja), amely lefűződik és a citoplazmában lizoszómává alakul, ahol lebontásra kerülnek a káros anyagok (Sugiura és mtsai, 2014).
Retrograde signaling
A mitokondriumok minőségi, funkcionális szabályozásában maga a sejtmag is részt vesz, a mitokondriumból érkező jelek hatására a mitokondriális stressz csökkentésével, valamint a hibás fehérjék kijavításával (retrograde signaling), amelyben számos fehérje, és gén szerepét rögzítették már. Az egyik legfontosabb ilyen visszajelző mechanizmus az UPR, unfolded protein response, ahol a DNS depléció, vagy a fehérje hibás kialakulása az indukciós faktor (Fiorese és mtsai, 2016).
|
4. ábra: A mitokondrium eltávolítás szabályozása |
A sérült, károsodott mitokondriumok eltávolítására többféle folyamat is lehetséges (komplett mitofágia, MDV, retrograde signaling). Az, hogy melyik folyamat megy végbe a mitokondriumot ért stressz típusának, és erősségének a függvénye (Jang és mtsai, 2018).A mitofágia nem kizárólag a sérült sejtszervecskék eltávolítását végzi, számos metabolikus, valamint embrionális fejlődési folyamat során az ép mitokondriumok is eltávolításra kerülhetnek, ezért a jövőbeli cél a kutatók számára a célzott mitofágia folyamatának kifejlesztése. Ezt hatékonyan lehetne használni az orvoslásban, mind az öregedéssel járó betegségek kialakulásának megelőzésére, vagy a tünetek enyhítésére.
A mtDNS javító mechanizmusok
A mitokondriumok meghibásodásában, ezáltal az öregedő fenotípus kialakulásában a mitokondriális DNS mutációk, sérülések mellett legalább ugyanakkora szerepe van a DNS hibajavító mechanizmusainak.
A mitokondriális DNS-nek különös védelemre van szüksége, ugyanis fokozott ROS okozta oxidatív támadásnak van kitéve az elektrontranszport-lánchoz való közelsége miatt. Ezt a védelmet megkaphatja egyrészt a nukleoidok, valamint a belső membrán fehérjéi által, vagy a hibajavító mechanizmusoknak köszönhetően (Boesch és mtsai, 2009).
A javító mechanizmusok két szempontból is fontosak:
1. a reaktív gyökök, egyéb káros anyagok, valamint a mutációk okozta hibák helyreállítása
2. a javító mechanizmusokban részt vevő enzimeket nukleárisan kódoló gének mutációját, sérülését követően a hibajavító funkciók működése elégtelen. Ennek következtében a hibák felhalmozódnak a mtDNS-ben (Bohr, 2002).
Különböző eredetű károsodásokért eltérő javító mechanizmusok felelősek:
· UV, karcinogén anyagok → NER: nucleotide excision repair
· ROS, nitrogén gyökök → BER: base excision repair (Seeberg és mtsai, 1995)
· Téves párosítások → MMR: mismatch repair pathway
· Téves rekombinációk → Recombinational DNA repair (Bohr,2002)
A mtBER
A jelenlegi ismeretek szerint a mitokondriális BER-nek van a legnagyobb szerepe az oxidatív károsodások enyhítésében.
Főbb lépések:
1. Hiba felismerés és bázis eltávolítás
2. A keletkezett “abázikus” elem kivágása (cukor+foszfát)
3. Megfelelő nukleotid beillesztése (DNS polimeráz gamma)
4. Ligáz aktivitás (DNS ligáz III.) (Gredilla, 2011)
Az emlős mitokondriumban egyetlen DNS polimeráz található, a DNS polimeráz gamma, amely mind a replikációban, mind a hibajavító mechanizmusokban részt vesz. A hibajavító mechanizmusokban az új nukleotidok beépítése a feladata (Trifunovic és mtsai, 2004; Kujoth és mtsai, 2005).
A BER, mtDNS mutáció akkumuláció és az öregedés közötti kapcsolatra magyarázatot adhat a DNS polimeráz gamma mutáns egér kísérlete. A mutáns egerekben a DNS PolG replikációs sajátságát meghagyták, azonban a javító funkciót megszüntették. A mutáns egereket vizsgálva a vad típusokkal szemben szignifikánsan kimutatták a mutáns egerek korai öregedését (Trifunovic és mtsai, 2004; Kujoth és mtsai, 2005).
A kísérletből azt a következtetést lehet levonni, hogy a replikáció során akkumulálódott mtDNS mutációk, hibajavítás nélkül korai öregedéshez vezetnek (Edgar és Trifunovic, 2009).
Poszttranszlációs módosítások
A mitokondrium funkció és metabolizmus szabályozásában a mitokondriális poszttranszlációs módosítások is szerepet játszanak (Reeve és mtsai, 2009). Ezek közül a legfontosabb a ROS mediált tiol szabályozás, amely a szignál transzdukciós folyamatokban játszik szerepet, és a lizin oldalláncok acetilációja, dezacetilációja.
Acetiláció esetén a mitokondriális enzim aktivitás csökkenését figyelték meg. Fontos kiemelni, hogy a mitokondriumban kiemelkedően magas az acetil-CoA szint, ezáltal a fehérjék könnyen acetilálódnak (Wagnerand és Payne, 2013).
Dezacetiláló enzimek közül pedig a sirtuinok (SIRT1-7) a legjelentősebbek emlősökben. Azonban számos egyéb funkciójuk is megfigyelhető. A SIRT enzimek jelentősége abban rejlik, hogy túltermelődésük esetén előnyös hatásokat lehetett megfigyelni az élettartam tekintetében (Brownet és mtsai, 2013; Herranz és mtsai, 2010; Kanfi és mtsai, 2012).
Apoptózis
Amennyiben a sejt túl nagy mértékű károsodást szenved, és a mitokondriumok nem tudnak elegendő energiát termelni a sejt megfelelő működéséhez apoptózis következik be. A folyamatban számos, egymással kölcsönhatásban lévő mechanizmus vesz részt. Megkülönböztetünk külső és belső apoptotikus útvonalakat.
Az extrinsic útvonalon a sejt úgynevezett death receptorai által érzékelt stimulusok hatására indukálódhat apoptózis, míg az intrinsic folyamatban a mitokondriumban kialakuló indukciós faktorok okozzák az apoptózist.
Mindkét mechanizmus meghatározó enzime a JNK (Jun N-terminal kinase).
A mitokondriumban túl nagy mennyiségben felhalmozódott, főleg oxidatív sérülések következtében keletkezett fehérjék, DNS fragmentumok, lipidek hatására a JNK enzimek aktiválódnak, amelyek különböző proapoptotikus folyamatokat serkentenek, vagy antiapoptotikus folyamatokat gátolnak. JNK mediált citokróm c, valamint egyéb proapoptotikus anyagok felszabadításával aktiválódik a kaszpáz-9 kaszkád, amelynek következtében végbemegy az apoptózis (Dhanasekaran és Reddy, 2008).
Klinikai vonatkozás
A mitokondriális légzési láncot ért sérülések, mutációk következtében a sejtek nem tudnak elegendő energiát előállítani a megfelelő szöveti funkcióhoz. Ez az elsődleges oka az öregedő fenotípus megjelenésének, és az öregedéssel járó betegségek kialakulásának.
A mitokondriális funkció javításával lehetőség nyílhat a korai öregedés megelőzésére, valamint a betegségek kezelésére. Ezen lehetőségek közé tartozik a mitokondriális biogenezis serkentése, a célzott mitofágia és apoptózis, valamint a célzott mitokondriális antioxidáns terápia.
Irodalomjegyzék
Felhasznált irodalom
1. Alexeyev, M. F. (2009): Is there more to aging than mitochondrial DNA and reactive oxygen species? The FEBS Journal 276: (20) 5768–5787 https://dx.doi.org/10.1111%2Fj.1742-4658.2009.07269.x
2. Anton, S. D.; Woods, A. J.; Ashizawa, T.; Barb, D.; Buford, T. W.; Carter, C. S.; Clark, D. J.; Cohen, R. A.; Corbett, D. B.; Cruz-Almeida, Y.; Dotson, V.; Ebner, N.; Efron. P. A.; Fillingim, R. B.; Foster, T. C; Gundermann, D. M.; Joseph, A. M.; Karabetian, C.; Leeuwenburgh, C.; Manini, T. M; Marsiske, M.; Mankowski, R. T.; Mutchie, H. L.; Perri, M. G.; Ranka, S.; Rashidi, P.; Sandesara, B.; Scarpace, P. J.; Sibille, K. T.; Solberg, L. M.; Someya, S.; Uphold, C., Wohlegmuth, S.; Wu, S. S.; Pahor, M. (2015): Successful aging: advancing the science of physical independence in older adults. Ageing Research Reviews 24: (PtB) 304-327 https://doi.org/10.1016/j.arr.2015.09.005
3. Basaria, S. (2013): Reproductive aging in men. Endocrinology and Metabolism Clinincs of North America 42: (2) 255-270
4. Bogenhagen, D.; Clayton, D. A. (1977): Mouse L cell mitochondrial DNA molecules are selected randomly for replication throughout the cell cycle. Cell 11: (4) 719–727
5. Bohr, V. A. (2002): Repair of oxidative DNA damage in nuclear and mitochondrial DNA, and some changes with aging in mammalian cells. Free radical biology and medicine 32: (9) 804-812 https://doi.org/10.1016/s0891-5849(02)00787-6
6. Boulet, L.; Karpati, G.; Shoubridge, E. A. (1992): Distribution and threshold expression of the tRNA (Lys) mutation in skeletal muscle of patients with myoclonic epilepsy and ragged-red fibers (MERRF). America Journal of Human Genetics 51: (6) 1187–1200
7. Chinnery, P. F. (2015): Mitochondrial disease in adults: what’s old and what’s new? EMBO Molecular Medicine 7: (12) 1503–1512 https://dx.doi.org/10.15252%2Femmm.201505079
8. Crane, J. D.; Devries, M.C.; Safdar, A.; Hamadeh, M. J.; Tarnopolsky, M. A. (2010): The effect of aging on human skeletal muscle mitochondrial and intramyocellular lipid ultrastructure. The journals of gerontology. Series A, Biological sciences and medical sciences 65: (2) 119-128 https://doi.org/10.1093/gerona/glp179
9. Cui, H.; Kong, Y.; Zhang, H. (2012): Oxidative stress, mitochondrial dysfunction, and aging. Jounal of Signal Transduction 2012: 646354 https://doi.org/10.1155/2012/646354
10. Dhanasekaran, D.; Reddy, E. (2008): JNK signaling in apoptosis. Oncogene 27: (48) 6245–6251 https://doi.org/10.1038/onc.2008.301
11. Eisenberg T.; Abdellatif, M.; Schroeder, S.; Primessnig, U.; Stekovic, S.; Pendl, T.; Harger, A.; Schipke, J.; Zimmermann, A.; Schmidt, A.; Tong, M.; Ruckenstuhl, C.; Dammbrueck, C.; Gross, A. S.; Herbst, V.; Magnes, C.; Trausinger, G.; Narath, S.; Meinitzer, A.; Hu, Z.; Kirsch, A.;13, Eller, K.; Carmona-Gutierrez, D.; Büttner, S.; Pietrocola, F.; Knittelfelder, O.; Schrepfer, E.; Rockenfeller, P.; Simonini, C.; Rahn, A.; Horsch, M.; Moreth, K.; Beckers, J.; Fuchs, H.; Gailus-Durner, V.; Neff, F.; Janik, D.; Rathkolb, B.; Rozman, J.; de Angelis, M. H.; Moustafa, T.; Haemmerle, G.; Mayr, M.; Willeit, P.; von Frieling-Salewsky, M.; Pieske, B.; Scorrano, L.; Pieber, T.; Pechlaner, R.; Willeit, J.; Sigrist, S. J.;33, Linke, W. A.; Mühlfeld, C.; Sadoshima, J.; Dengjel, J.; Kiechl, S.; Kroemer, G.; Sedej, S.; Madeo, F. (2016): Cardioprotection and lifespan extension by the natural polyamine spermidine. Nature Medicine 22: (12) 1428–1438 https://doi.org/10.1038/nm.4222
12. Elson, J. L.; Samuels, D. C.; Turnbull, D. M.; Chinnery, P. F. (2001): Random intracellular drift explains the clonal expansion of mitochondrial DNA muta-tions with age. American Journal of Human Genetics 68: (3) 802–806
13. Finkel, T. (2003): Oxidant signals and oxidative stress. Current Opinion in Cell Biology 15: (2) 247-254
14. Fiorese, C. J.; Schulz, A. M.; Lin, Y. F.; Rosin, N.; Pellegrino, M. W.; Haynes, C. M. (2016): The transcription factor ATF5 mediates a mammalian mitochondrial UPR. Current Biology 26: (15) 2037–2043 https://doi.org/10.1016/j.cub.2016.06.002
15. Fulop, T.; Larbi, A.; Witkowski, J. M.; MCElhaney, J.; Loeb, M.; Mitnitski, A.; Pawelec, G. (2010): Aging, frailty and age-related diseases. Biogerontology 11: (5) 547-563 https://doi.org/10.1007/s10522-010-9287-2
16. Gram, M.; Vigelso, A.; Yokota, T.; Helge, J. W.; Dela, F.; Hey-Mogensen, M. (2015): Skeletal muscle mitochondrial H2O2 emission increases with immobilization and decreases after aerobic training in young and older men. The Journal of Physiology 593: (17) 4011–4027 https://doi.org/10.1113/JP270211
17. Harman, D. (1956): Aging: a theory based on free radical and radiation chem-istry. The Journals of Gerontology 11: (3) 298–300
18. Harman, D. (1972): The biologic clock: the mitochondria? Journal of the American Geriatrics Society 20: (4) 145–147
19. Jang, J. Y.; Blum, A.; Liu, J.; Finkel, T. (2018): The role of mitochondria in aging. The Journal of Clinical Investigation 128: (9) 3662–3670 https://doi.org/10.1172/JCI120842
20.Kauppila, T. E. S.; Kauppila, J. H. K.; Larsson, N.-G. (2017): Mammalian mitochondria role in aging: An update. Cell Metabolism 25: (1) 57-71 https://doi.org/10.1016/j.cmet.2016.09.017 21. Keogh, M. J.; Chinnery, P. F. (2015): Mitochondrial DNA mutations in neurodegeneration. Biochimica et Biophysica Acta 1847: (11) 1401–1411 https://doi.org/10.1016/j.bbabio.2015.05.015
22. Kujoth, C. C.; Hiona, A.; Pugh, T. D.; Someya, S.; Panzer, K.; Wohlgemuth, S. E.; Hofer, T.; Seo, A. J.; Sullivan, R.; Jobling, W. A.; Morrow, J. D.; Van Remmen, H.; Sedivy, J.M.; Yamasoba, T.; Tanokura, M.; Weindruch, R.; Leeuwenburgh, C.; Prolla, T. A. (2005): Medicine: mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging. Science 309: (5733) 481–484
23. Lagouge, M.; Larsson, N.- G. (2013): The role of mitochondrial DNA mutations and free radicals in disease and ageing. Journal of Internal Medicine 273: (6) 529–543 https://doi.org/10.1111/joim.12055
24. Larsson, N.-G. (2010): Somatic mitochondrial DNA mutations in mammalian aging. Annual Review of Biochemistry 79: (1) 683–706 https://doi.org/10.1146/annurev-biochem-060408-093701
25. Larsson, N.-G.; Tulinius, M. H.; Holme, E.; Oldfors, A.; Andersen, O.; Wahlstrom, J.; Aasly, J. (1992): Segregation and manifestations of the mtDNA tRNA(Lys) A/G(8344) mutation of myoclonus epilepsy and ragged-red fibers(MERRF) syndrome. American Journal of Human Genetics 51: (6) 1201–1212 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1682923/
26. Lewis, K. N.; Andziak, B.; Yang, T.; Buffenstein, R. (2013): The naked mole-rat response to oxidative stress: just deal with it. Antioxidants and Redox Signaling 19: (12) 1388–1399 https://dx.doi.org/10.1089%2Fars.2012.4911
27. Murphy, M. P. (2009): How mitochondria produce reactive oxygen species. Biochemical Journal 417: (1) 1-13 https://doi.org/10.1042/BJ20081386
28. Navarro, A.; Boveris, A. (2010): Brain mitochondrial dysfunction in aging, neurodegeneration, and Parkinson’s disease. Frontiers in Aging Neuroscience 2: (pii) 34 https://doi.org/10.3389/fnagi.2010.00034
29. Navarro, A.; Boveris, A.; Bandez, M. J.; Sanchez-Pino, M. J.; Gomez, C.; Muntane, G.; Ferrer, I. (2009): Human brain cortex: mitochondrial oxidative damage and adaptive response in Parkinson disease and in dementia with Lewy bodies. Free Radical Biology and Medicine 46: (12) 1574–1580 https://doi.org/10.1016/j.freeradbiomed.2009.03.007
30. Ohsumi, Y. (2014): Historical landmarks of autophagy research. Cell Research 24: (1) 9–23 https://doi.org/10.1038/cr.2013.169
31. Oyewole, A. O.; Birch-Machin, M. A. (2015): Mitochondria-targeted antioxidants. The FASEB Journal 29: (12) 4766-4771 https://doi.org/10.1096/fj.15-275404
32. Palomera-Avalos, V.; Grinan-Ferré, C.; Puigoriol-Ilamola, D.; Camins, A.; Sanfeliu, C.; Canudas, A. M.; Pallás, M. (2016): Resveratrol protects SAMP8 brain under metabolic stress: focus on mitochondrial function and Wnt pathway. Molecular Neurobiology 54: (3) 1661-1676
33. Payne, B. A. I.; Wilson, I. J.; Yu-Wai-Man, P.; Coxhead, J.; Deehan, D.; Horvath, R.; Taylor, R. W.; Samuels, D. C.; Santibanez-Koref, M.; Chinnery, P. F. (2013): Universal heteroplasmy of human mitochondrial DNA. Human Molecular Genetics 22: (2) 384–390 https://doi.org/10.1093/hmg/dds435
34. Reeve, A. K.; Krishnan, K.J.; Taylor, G.; Elson, J. L.; Bender, A.; Taylor, R. W.; Morris, C. M.; Turnbull, D. M. (2009): The low abundance of clonally expanded mitochondrial DNA point mutations in aged substantia nigra neurons. Agin Cell 8: (10) 496-498 https://doi.org/10.1111/j.1474-9726.2009.00492.x
35. Rossignol, R.; Faustin, B.; Rocher, C.; Malgat, M.; Mazat, J. P.; Letellier, T. (2003): Mitochondrial threshold effects. Biochemical Journal 370: (3) 751–762 https://doi.org/10.1042/BJ20021594
36. Ruetenik, A.; Barrientos, A. (2015): Dietary restriction, mitochondrial function and aging: from yeast to humans. Biochimica et Biophysica Acta 1847: (11) 1434–1447
37. Ryu, D.; Mouchiroud, L.; Andreux, P. A.; Katsyuba, E.; Moullan, N.; Nicolet-Dit-Félix, A. A.; Williams, E. G.; Jha, P.; Lo Sasso, G.; Huzard, D.; Aebischer, P.; Sandi, C.; Rinsch, C.; Auwerx, J. (2016): Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents. Nature Medicine 22: (8) 879–888 https://doi.org/10.1038/nm.4132
38. Seeberg, E.; Eide, L.; Bjoras, M. (1995): The base excision repair pathway. Trends in biochemical sciences 20: (10) 391-397 https://doi.org/10.1016/s0968-0004(00)89086-6
39. Shigenaga, M. K.; Hagen, T. M.; Ames, B. N. (1994): Oxidative damage and mitochondrial decay in aging. Proceedings of the National Academy of Sciences of the USA 91: (83) 10771-10778 https://doi.org/10.1073/pnas.91.23.10771
40. Stewart, J. B.; Chinnery, P. F. (2015): The dynamics of mitochondrial DNA heteroplasmy: implications for human health and disease. Nature Reviews Genetics 16: (9) 530–542 https://doi.org/10.1038/nrg3966
41. Sugiura, A.; McLelland, G. L.; Fon, E. A.; McBride, H. M. (2014): A new pathway for mitochondrial quality control: mitochondrial-derived vesicles. The EMBO Journal 33: (19) 2142–2156 https://doi.org/10.15252/embj.201488104
42. Terman, A.; Kurz, T.; Navratil, M.; Arriaga, E. A.; Brunk, U. T. (2010): Mitochondrial turnover and aging of long-lived postmitotic cells: the mitochondrial-lysosomal axis theory of aging. Antioxidants and Redox Signaling 12: (4) 503-535 https://doi.org/10.1089/ars.2009.2598
43. Trifunovic, A.; Wredenberg, A.; Falkenberg, M.; Spelbrink, J. N.; Rovio, A. T.; Bruder, C.E.; Bohlooly-Y, M.; Gidlöf, S.; Oldfors, A.; Wibom, R.; Törnell, J.; Jacobs, H. T.; Larsson, N.-G. (2004): Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature 429: (6990) 417-423 https://doi.org/10.1038/nature02517
44. Turrens, J. F. (2003): Mitochondrial formation of reactive oxygen species. The Journal of Physiology 552: (2) 335-344 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2343396/
45. Vaitkus, J. A.; Farrar, J. S.; Celi, F. S. (2015): Thyroid hormone mediated modulation of energy expenditure. International Journal of Molecular Sciences 16: (7) 16158–16175 https://dx.doi.org/10.3390%2Fijms160716158
46. Velarde, M. C. (2014): Mitochondrial and sex steroid hormone crosstalk during aging. Longevity and Healthspan 3: (1) 2 https://dx.doi.org/10.1186%2F2046-2395-3-2
Ábrajegyzék
Ábra 1.,2.: Kauppila, T. E. S.; Kauppila, J. H. K.; Larsson, N.-G. (2017): Mammalian mitochondria role in aging: An update. Cell Metabolism 25: (1) 57-71 https://doi.org/10.1016/j.cmet.2016.09.017
Ábra 3.,4.: Jang, J. Y.; Blum, A.; Liu, J.; Finkel, T. (2018): The role of mitochondria in aging. The Journal of Clinical Investigation 128: (9) 3662–3670 https://doi.org/10.1172/JCI120842