Die Rattenniere
Die Niere ist ein paariges, bei der Ratte bohnenförmig angelegtes Harnsystemorgan, welches dorsal in der caudalen Bauchhöhle liegt. Sie dient der Bildung und Ausscheidung des Harns. Die Ratte ist in der modernen Medizin als Forschungsobjekt unabkömmlich. Mit Hilfe der Rattenniere kann auf die physiologische Tätigkeit und die Funktion anderer Säugetiere geschlossen werden. Im folgenden Text werden zunächst die wichtigsten anatomischen und physiologischen Daten der Rattenniere genannt und später Beispiele aus der modernen Forschung erwähnt.[2]
Contents
- Lage und Aufbau der Rattenniere
- Funktion der Rattenniere
- Die wichtigsten physiologischen Werte der Rattenniere
- Die Rattenniere als Versuchsobjekt bei der Organtransplantation
- Heranreifung von Mäuse-Eizellen in Rattennieren
- Hämatomentstehung bei ESWL
- Literaturverzeichnis
- Weblinks
- Bildnachweise
- Danksagung
Lage und Aufbau der Rattenniere
Versuchsbeschreibung
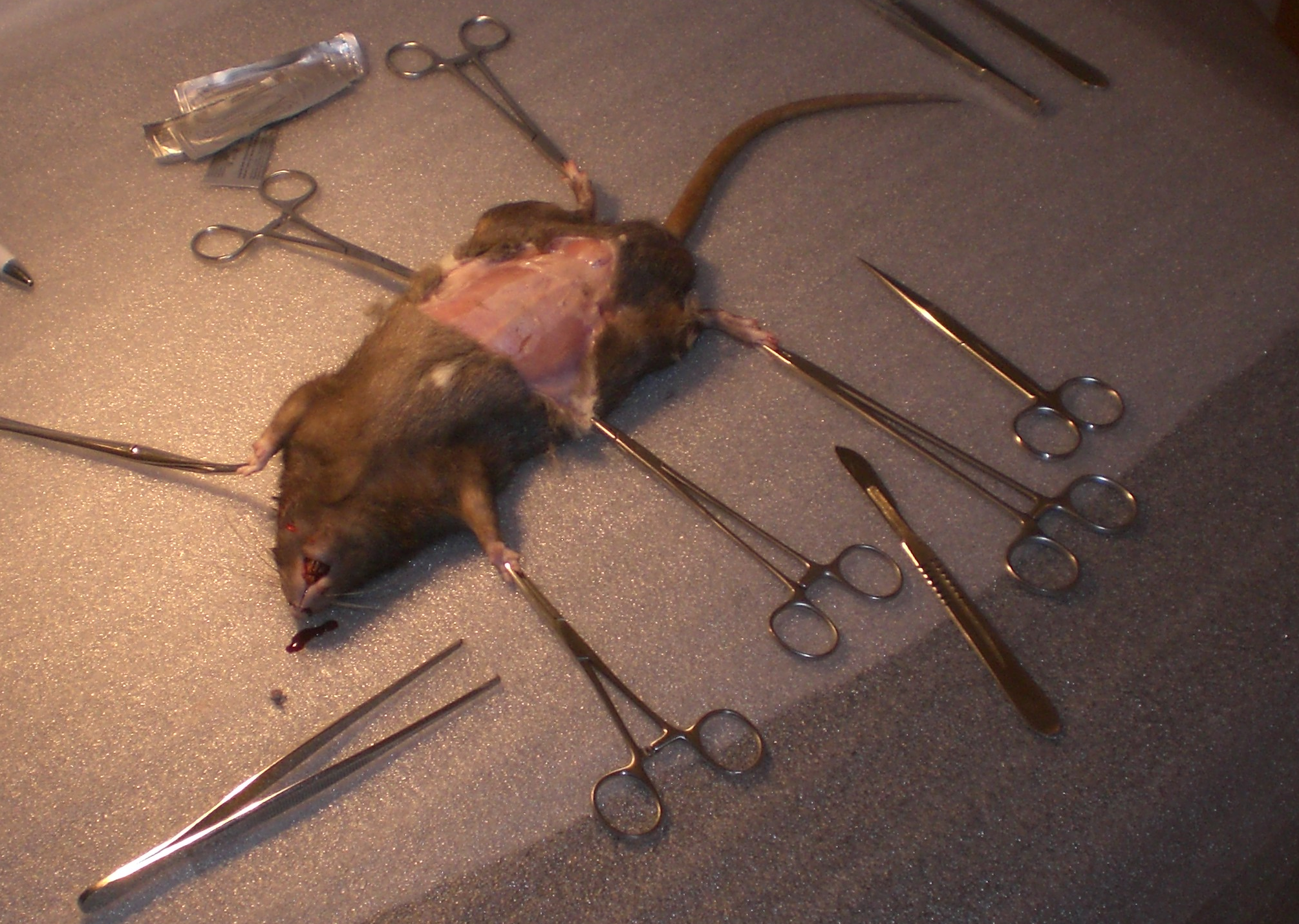
Um die anatomische Lage der Rattenniere besser zu beschreiben können haben wir uns entschlossen einen eigenen Versuch an einer Ratte durchzuführen. 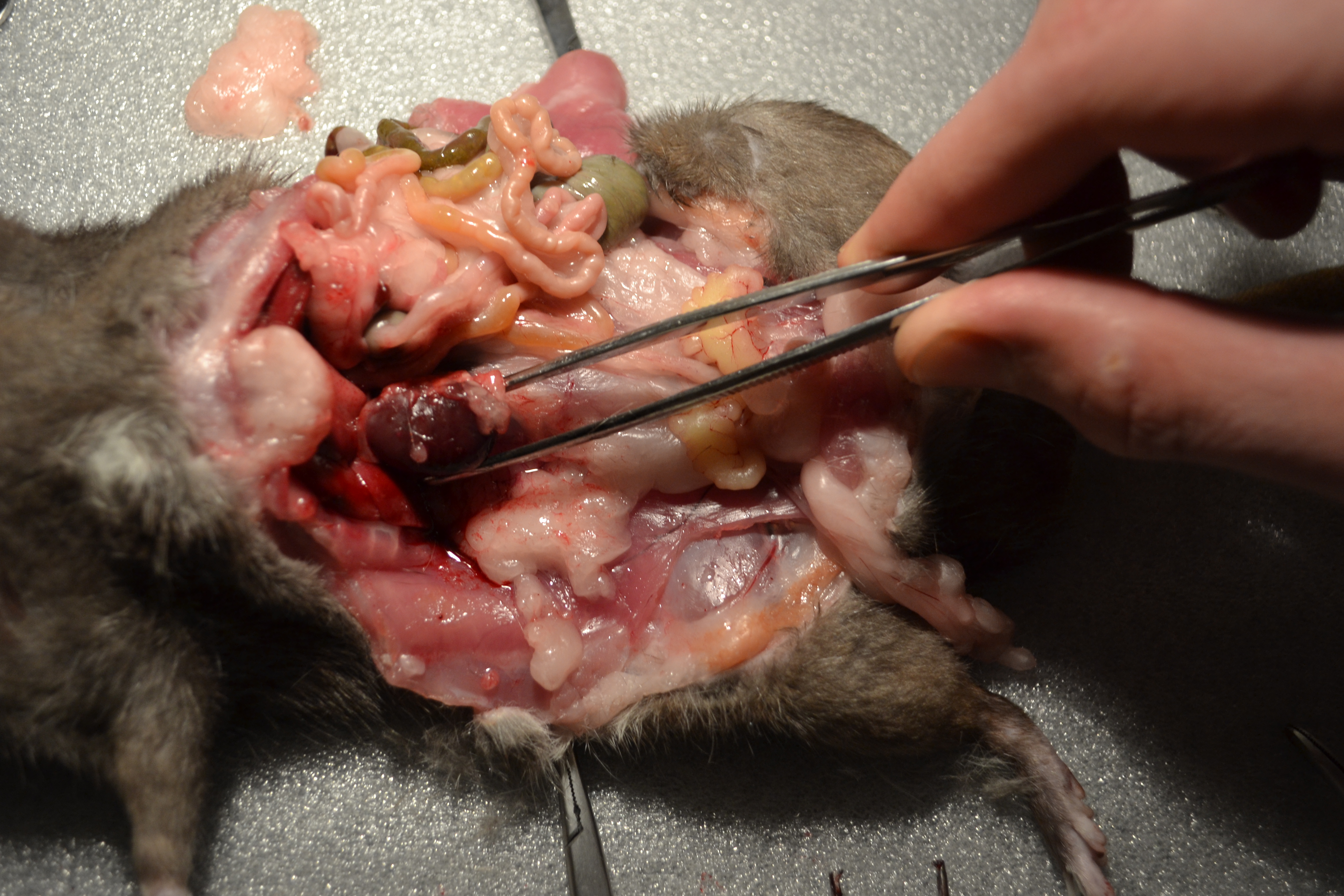 Bei dem Versuchstier handelte es sich um vegicus forma domestica)eine Farbratte (Rattus norvegicus forma domestica) mit einem Gewicht von 453g. Die Länge der Ratte betrug, gemessen vom Kopf bis zum Schwanzansatz, 23 cm. Das Tier war männlich und unkastriert und befand sich in einem sehr guten Ernährungszustand. Im Zuge unseres Versuches wurde die Ratte sachgerecht getötet und dann präpariert. Dazu wurde zunächst die Haut an der Linea alba durchtrennt, nach lateral weggezogen und mit Klemmen fixiert. Die Muskulatur der Bauchwand wurde auch an der Linea alba eröffnet und so die musculi rectus abdominis voneinander getrennt und ebenfalls mit Klemmen fixiert. Anschließend wurden die Bauchorgane nach rechts gezogen, um so an die linke Niere zu gelangen. Das selbe Verfahren wurde auch bei der rechten Niere angewandt, die man auf der nebenstehenden Abbildung sieht. Die Niere wurde aus ihrem Fettpolster freipräpariert und anschließend in der ursprünglichen Position im Körper vermessen, genauso wie bei der rechten Niere. Die dabei gemessenen Parameter werden in der unten stehenden Tabelle (siehe 1.3) näher aufgeführt. Nach Beendigung der makroskopischen Untersuchung wurden die Nieren zur genaueren Untersuchung aus der Ratte entnommen.
Bei dem Versuchstier handelte es sich um vegicus forma domestica)eine Farbratte (Rattus norvegicus forma domestica) mit einem Gewicht von 453g. Die Länge der Ratte betrug, gemessen vom Kopf bis zum Schwanzansatz, 23 cm. Das Tier war männlich und unkastriert und befand sich in einem sehr guten Ernährungszustand. Im Zuge unseres Versuches wurde die Ratte sachgerecht getötet und dann präpariert. Dazu wurde zunächst die Haut an der Linea alba durchtrennt, nach lateral weggezogen und mit Klemmen fixiert. Die Muskulatur der Bauchwand wurde auch an der Linea alba eröffnet und so die musculi rectus abdominis voneinander getrennt und ebenfalls mit Klemmen fixiert. Anschließend wurden die Bauchorgane nach rechts gezogen, um so an die linke Niere zu gelangen. Das selbe Verfahren wurde auch bei der rechten Niere angewandt, die man auf der nebenstehenden Abbildung sieht. Die Niere wurde aus ihrem Fettpolster freipräpariert und anschließend in der ursprünglichen Position im Körper vermessen, genauso wie bei der rechten Niere. Die dabei gemessenen Parameter werden in der unten stehenden Tabelle (siehe 1.3) näher aufgeführt. Nach Beendigung der makroskopischen Untersuchung wurden die Nieren zur genaueren Untersuchung aus der Ratte entnommen.
Anatomische Lage
Der craniale Rand der Rattenniere befindet sich in Höhe des Rippenbogens und wird von der Leber und Milz begrenzt. Dorsolateral wird sie von der Bauchwand begrenzt. Die Niere liegt bei der Ratte extraperitoneal an der Bauchwand und ist mit Bauchfell überzogen, in ein Fettpolster eingebettet und von einer fibrösen Schicht umhüllt. Caudal wird die Niere von einem Fettpolster eingerahmt, das direkt an die innere Bauchmuskulatur anschließt.[1,2]
Form, Farbe und Größe
Form, Farbe und Größe der Rattenniere Die Form der Niere ist bohnenförmig, ihre Farbe ist weinrot. Die untersuchten Nieren wogen 3g. 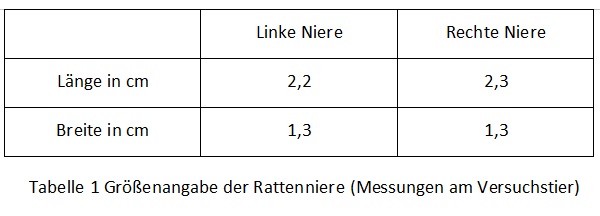
Feinaufbau der Rattenniere
Die Rattenniere ist eine einfache, glatte, unipapillare Niere. Von außen betrachtet können wir einen oberen und unteren Pol, sowie eine Vorder-, und Rückseite erkennen. An der der Wirbelsäule zugewandten Seite der Niere befindet sich das Nierenhilum, der Nierennabel, an dem die wichtigen Blutgefäße, Nerven und der Ureter in die Niere ziehen, beziehungsweise aus ihr entspringen. Wie im vorherigen Thema bereits angedeutet, liegt die Niere zusammen mit der Nebenniere in einem lockeren Fettgewebskörper, die auch Capsula adiposa genannt wird. Dieser schützt die Niere vor 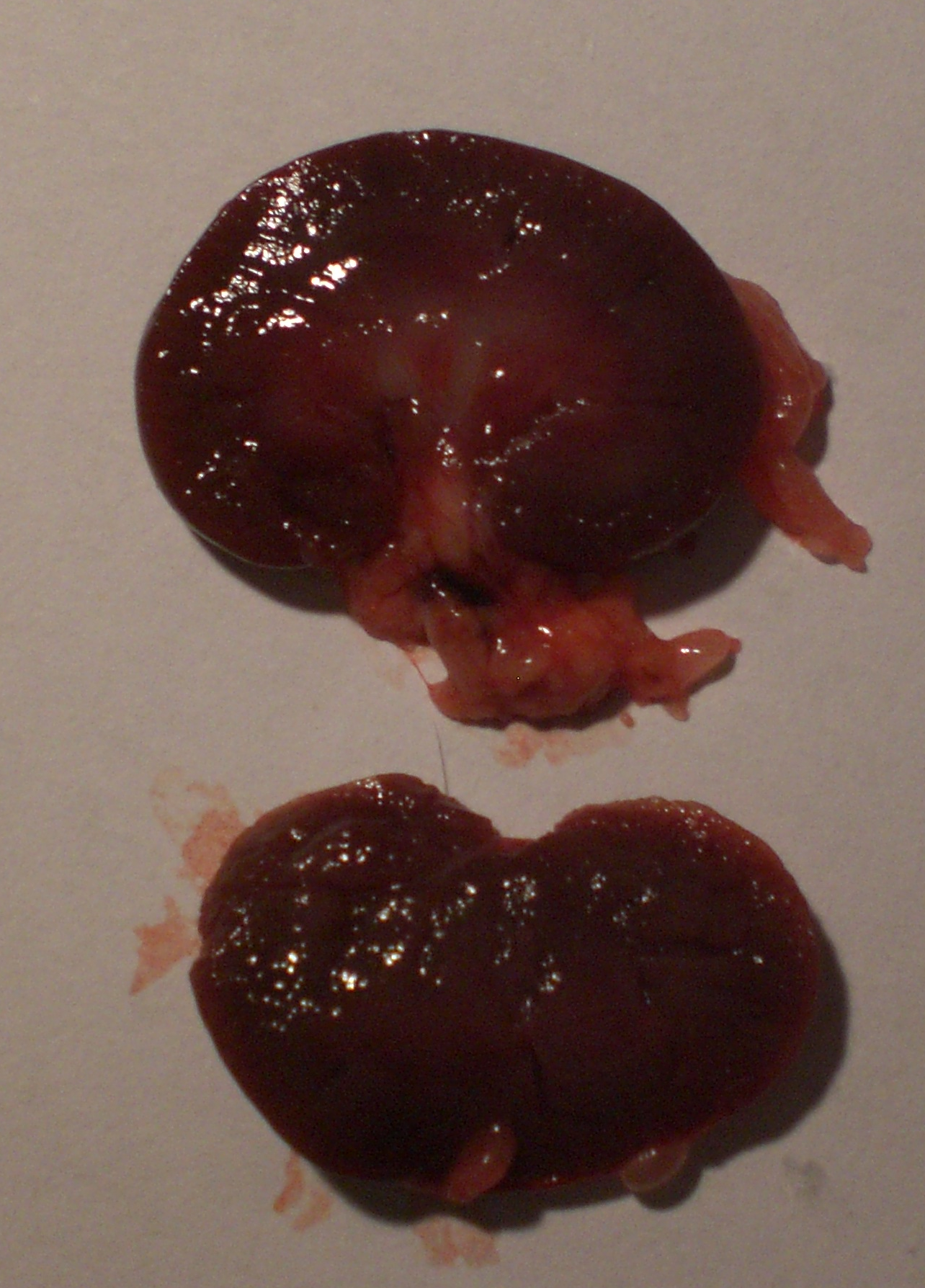 Erschütterungen und Stößen und stabilisiert ihre Lage im Körper. Die Niere selbst ist von einer bindegewebigen Schicht der Capsula fibrosa umgeben. Um die Capsula fibrosa und Capsula adiposa herum liegt die Fascia renalis, die die Aufhängung der Niere an die Bauchwand sicherstellt. Im Schnittbild sind Cortex (Nierenrinde) und Medulla (Nierenmark) bereits deutlich zu erkennen. Im Mark, der Medulla, ziehen die Nierenkanäle von der Papille zur Cortex, in der sich die Nierenkörperchen befinden. Die Nierenkörperchen sind die funktionelle Einheit der Niere und ihre Tätigkeit wird näher im Thema Funktion der Rattenniere erläutert. Diese sind als dunkle Punkte auszumachen. In der Mitte des Schnittbildes befindet sich das Nierenbecken (Pelvis renalis). Aus diesem geht der Ureter hervor. Auf weitere Einzelheiten zum Aufbau der Niere wird im Thema Funktion der Rattenniere gesondert eingegangen.[2,3]
Erschütterungen und Stößen und stabilisiert ihre Lage im Körper. Die Niere selbst ist von einer bindegewebigen Schicht der Capsula fibrosa umgeben. Um die Capsula fibrosa und Capsula adiposa herum liegt die Fascia renalis, die die Aufhängung der Niere an die Bauchwand sicherstellt. Im Schnittbild sind Cortex (Nierenrinde) und Medulla (Nierenmark) bereits deutlich zu erkennen. Im Mark, der Medulla, ziehen die Nierenkanäle von der Papille zur Cortex, in der sich die Nierenkörperchen befinden. Die Nierenkörperchen sind die funktionelle Einheit der Niere und ihre Tätigkeit wird näher im Thema Funktion der Rattenniere erläutert. Diese sind als dunkle Punkte auszumachen. In der Mitte des Schnittbildes befindet sich das Nierenbecken (Pelvis renalis). Aus diesem geht der Ureter hervor. Auf weitere Einzelheiten zum Aufbau der Niere wird im Thema Funktion der Rattenniere gesondert eingegangen.[2,3]
Blutversorgung der Niere
Die Niere erhält ihr Blut aus der Arteria renalis, die direkt aus der Aorta abdominalis entspringt. In der Niere teilen sich die Blutgefäße in die Arterien zwischen den Lappen (Aa. Interlobares), die Arterien zwischen den einzelnen Läppchen (Aa. Interlobularis) und den Aa. Arcuatae, die Bogenarterien. Die einzelnen Nierenkörperchen werden über die Vas afferens versorgt. Der venöse Abfluss der Niere beginnt bei den Vas efferens , geht dann über in die Vv. Interlobalis und Vv. Arcuatae, um dann über die Vena reanlis in die hintere Hohlvene, die Vena cava caudalis ,zu münden.[4]
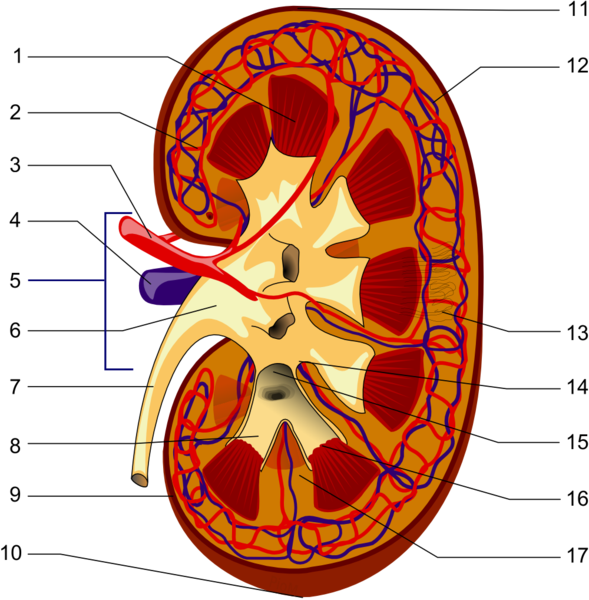
1. Nierenmark mit Markkegeln (Pyramides renales) 2.Vas afferens 3. Nierenarterie (Arteria renalis) 4. Nierenvene (Vena renalis) 5.Hilum renale 6.Nierenbecken (Pelvis renalis) 7.Harnleiter (Ureter) 8.kleine Nierenkelche (Calices minores renales) 9.Nierenkapsel (Capsula fibrosa renalis) 10.unterer Nierenpol (Extremitas inferior) 11.oberer Nierenpol (Extremitas superior) 12.Vas efferen 13.Nephron 14.Nierenbucht (Sinus renalis) 15.große Nierenkelche (Calices majores renales) 16.Spitzen der Markkegel (Papillae renales) 17.Bertini-Säulen (Columna renalis)
Aufbau des Nephron
Das Nephron ist die funktionelle Einheit der Niere. Es besteht aus dem Nierenkörperchen und dem daran angeschlossenen Tubulussystem. Die Unterteilung des Nephrons im Einzelnen schaut wie folgt aus. Das Nierenkörperchen besteht seinerseits wiederum aus dem Glomerulus und der Bowman-Kapsel. Der Nierentubulus besteht aus dem proximalen Tubulus mit seinen Pars convolute und Pars recta, dem Intermediärtubulus mit dem Pars descendens und Pars ascendens und dem distalen Tubulus, der wiederum aus dem Pars recta und dem Pars convoluta besteht. Die geraden Stücke (Partes rectae) des proximalen und distalen Tubulus werden mit dem Intermediärtubulus zusammen als Henle-Schleife bezeichnet. Der distale Tubulus mündet schließlich in das Sammelrohr. [6,12]
Funktion der Rattenniere
Allgemeiner Überblick Funktion
Die Niere hat im Körper verschiedene Aufgaben. Dazu gehört als erstes die Aufrechterhaltung der Homesostase. Homeostase bedeutet das Aufrechterhalten verschiedener Gleichgewichte im Körper. Hierbei zu nennen sind die Isovolämie, Isotonie, Isoionie und Isohydrie. Zudem ist die Niere auch an der Aufrechterhaltung des Blutdrucks beteiligt. Eine wichtige Aufgabe ist die Ausscheidung harnpflichtiger Substanzen wie Harnsäure, Harnstoff und Keratinin sowie giftiger Substanzen, z.B. Medikamente. Eine weitere Funktion der Niere liegt in der Endokrinologie. Hierbei werden Hormone wie das Erythropoetin abgesondert, welches eine wichtige Rolle in der Blutbildung hat. Zusätzlich wird in der Niere Vitamin D in seine aktivierte Form dem Calcitriol umgewandelt, welches die Kalziumaufnahme steigert und so die Knochenstabilität erhöht. Ein Hormon, das den Blutdruck regelt, ist das Renin, das einen Prozess in Gang setzt, an dessen Ende sich die Gefäße verengen und weniger Wasser und Salze ausgeschieden werden, was den Blutdruck erhöht.[5,6,7,8]
Funktion eines Nephrons
Das Blut gelangt durch die Vas afferens der Arteria interlobularis ins Nephron. Im Blut sind neben den Blutzellen auch andere Stoffe wie Wasser, Salze, Glukose und Giftstoffe enthalten. Das Blut fließt durch das Glomerulum der Bowmankapsel. Die glomeruläre Filtrationsbarriere ist aus den Poren der glomerulären Endothelzellen, der glomerulären Basalmembran und aus den Schlitzen zwischen den Fortsätzen der Podozyten aufgebaut. Wegen der Größe der Poren und der elektrischen Ladungen der einzelnen Elemente besteht eine hohe Permeabilität für Wasser und kleine wasserlösliche Stoffe, aber eine niedrige Permeabilität für Plasmaproteine. Dabei entsteht der sogenannte Primärharn, der in seiner Zusammensetzung stark dem eiweißfreien Primärharn entspricht. Makromoleküle sind, wie bereits erwähnt, auf Grund der kleinen Porengröße nicht vorhanden. Andere enthaltene Stoffe sind hauptsächlich Ionen, Elektrolyte sowie Aminosäuren. Dieser Primärharn fließt nun über die Henlesche Schleife in den distalen Tubulus. Dort wird nun der Salzgehalt des Blutes durch Abgabe von Salzen an das Blut reguliert. Mit anderen Stoffen wie Glukose wird ähnlich verfahren, zudem werden 99% des Wasser wieder an die Blutbahn abgegeben. Der nun übriggebliebene Stoff wird als Endharn oder Urin bezeichnet. Er gelangt über das Sammelrohr ins Nierenbecken und von dort über den Urethra in die Harnblase.[9,10,11]
Die wichtigsten physiologischen Werte der Rattenniere
Um Auskunft über die physiologische Tätigkeit der Niere zu erhalten, bieten sich mehrere Messmethoden an. Mit diesen Messungen kann so auch der Gesundheitszustand der Ratte ermittelt werden. Die wichtigsten Parameter sind hierbei Urinmenge, die Urinkonzentration und die vorhandene Konzentration der harnpflichtigen Stoffe (Kreatinin, Harnstoff, Harnsäure, Kalium) im Blutkreislauf .
Die Kreatinin-Clearance ist das gebräuchlichste Mittel zur Feststellung der Nierenleistung. Um diesen Wert zu vestehen, ist zunächst wichtig, etwas über das Kreatinin zu wissen. Es ist das Abbauprodukt des Muskelkeratins, welches Energie speichern kann und bei Bedarf freigibt. Mit diesem Wert kann man Rückschlüsse auf die glomeruläre Filtrationsrate (GFR) ziehen. Veränderungen dieses Wertes lassen zum Beispiel auf Niereninsuffizienz, Diabetes mellitus, Hypertonie oder Gicht schließen.[14,15,16,17,18,19]
Die Rattenniere als Versuchsobjekt bei der Organtransplantation
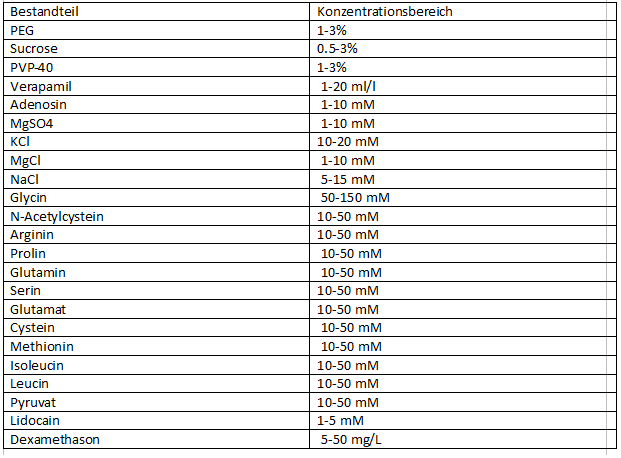
Um dieTransplantation von Organen beim Menschen zu verbessern wird zuerst bei der Ratte geforscht. Vor allem ist ein gutes Konservierungsverfahren für einen sicheren und längeren Transport wichtig. Das Vermeiden von temperaturbedingterOrganischämie und auch Reperfusionsschädigung beim Wiedererwärmen ist entscheidendend für eine erfolgreiche Transplantation. Hierfür gab es bisher 2 unterschiedliche Verfahren. Zum einen die HTK-Lösung nach Bretschneider (Custodiol®) , diese ist in Europa sehr verbreitet. Eine weitere Methode ist das UWS-ViaSpan. Beide Lösungen sollen das Organ vor den oben genonnten beschaedigungen shcützen. Kürzlich wurde ein neues Verfahren mit einer anderen Lösung der neuen HBS(Human Biosystems)- Lösung endeckt und mit den beiden anderen Methoden verglichen. Das HbS besteht aus energiereichen Substraten und einer Mischung von antiproteolytisch wirkenden Aminosäuren, Antioxidantien und entzündungshemmenden Verbindungen. Die genaue Zusammensetzung sieht aus wie folgt:
TABELLE 1 Bestandteile der HBS-Konservierungslösung
Im Test wurden Rattennieren entnommen und für 12 Stundenn in den unterschiedlichen konservierungslösungen aufbewahrt. Dannach wurden sie transplantiert. Die transplantierten Nieren wurden auf folgende Dinge getestet :
-Farbe der transplantierten Niere während der ersten 10 Minuten der Reperfusion Reperfusionszeit
-Die Zeit, die für die vollständige Reperfusion der Niere unmittelbar nach Entfernung der Klammern am Ende der vaskulären Anastomose erforderlich ist
-Harnproduktion
-Die Zeit, die die Niere für die Aufnahme der Urinproduktion nach Entfernung der Klammern am Ende der vaskulären Anastomose benötigt
-Makroskopischer Befund. Untersuchung der Niere nach 10 Minuten Reperfusion( auf Ödeme, usw.)
Die HBS-Lösung zeigt sich als bessere Konservierung für ein transplantiertes Organ am Ende der Tests. Auch wurde festgestellt, dass 80% der Ratten mit in HBS-Lösung konservierten Nieren mehr als sieben Tage überlebten, während bei der gleichen Ausgangszahl von Ratten mit in HTK-Lösung konservierten Nieren keine länger als vier Tage überlebte. Diese neuen Ergebnisse sind deshalb so entscheidend weil sie Schlüsse auch auf ein für den Menschsen besseres Organkonservierungsverfahren zulassen. Laut Dr. Luis Toledo, Chief Medical Officer bei dem oben beschriebenen Versuch, entspricht eine Rattenniere, die für 12 Stunden konserviert wurde einer menschlichen Niere, die für 30 Stunden konserviert wurde. Diese Neuentdeckung ist daher nach weiteren Tests sehr wichtig für die Humanmedizin. [20,21,22]
Heranreifung von Mäuse-Eizellen in Rattennieren
Aufgrund der Reifeproblematik von Mammalia-Oozyten im Reagenzglas, haben australische Wissenschaftler eine neue mögliche Alternativmethodik gefunden, um Oozyten reifen zu lassen.
Hierbei wurden unreife Mäuse-Eizellen durch Transplantation direkt unter der Cortex der Rattenniere platziert. Derzeit wird an der Einsetzbarkeit dieser neuen Methode geforscht; sollte die neue Technik auch bei anderen Tieren funktionieren, wird sie von Wissenschaftler vielfältig angewendet werden. 
So entnahmen Wissenschaftler von der Monash University in Melbourne jungen Mäusen die Eierstöcke für ihre Untersuchungen und transplantierten diese unter die Nierenkapsel von weiblichen Ratten. Gegenüber dem fremden Gewebe zeigten die weiblichen Ratten nahezu keine Abstoßungsreaktionen, da die Wissenschaftler zuvor an ihnen eine Immunsystemzerstörung vornahmen. Nach gut 20 Tagen der Reifung konnte man die nun gereiften Oozyten entnehmen und mit Mäusesperma befruchten, um sie dann im Anschluss in eine so genannte Leihmutter zu transplantieren. Bei diesem wissenschaftlichen Versuch kamen fünf lebende Mäusenachkommen aus 65 transplantierten Embryos zur Welt. Die Projektleiterin vertritt den Standpunkt, dass sich diese Zahl zwar niedrig anhöre, aber wenn man bedenke, dass mit dieser neuen Technik nur ein Tier einer gefährdeten Art nachgezüchtet werden könnte, sei das schon ein riesen Erfolg.
Ein Beispiel hierfür wäre die Rettung des Wombats, die man auf dem nebenstehenden Bild sieht. Fortschritte dies bezüglich wurden berits gemacht, es sind bereits Methoden entwickelt um aus dem paarig angelegten Oophoron, Gewebe von kürzlich verstorbenen weiblichen Wombats, zu gewinnen. Dieses australische Beuteltier ist ein häufiges Opfer von Autounfällen und ist vom Aussterben bedroht. Da sich kaum noch 100 Exemplare in freier Wildbahn befinden, könnte man in Zukunft Ova derartig gefährdeter Arten unter die Rattennierenkapsel transplantieren, sie dort reifen lassen, im Anschluss befruchten, und zuletzt nahverwandten Arten einsetzten, welche nicht vom Aussterben bedroht sind.
Eine weitere, zukünftige Möglichkeit dieser neuen Technik könnte auch darin bestehen, künstliche Befruchtungen in der Humanmedizin leichter zu machen. Dies ist bislang aber nur ein Zukunftsgedanke, welcher vor allem in ethischer Hinsicht und im Hinblick auf infektiöse Gefahren zu überdenken ist.[23,24,25]
Hämatomentstehung bei ESWL
Der Hämatomentstehungmechanismus nach der Extrakorporale Stoßwellenlithotripsie(ESWL), welche ein Vorgang des Zertrümmern von Nierensteinen durch Stoßwellen ohne einen percutanen Schnitt ist, ist ein weitgehend unerforschtes Gebiet in Anbetracht auf die ultrastrukturelle Ebene.
Ein wichtiger Fakt hierbei ist, dass die Thrombozytenfunktion durch die Einnahme von Acetylsalicylsäure vor der ESWL die Hämatomentstehung stark erhöhen kann. Um diesen Mechanismus genauer zu untersuchen wurde die Wirkung der Stoßwelle auf die Nieren von Wistar-Ratten unter Verwendung von Transmissions- und Rasterelektronenmikroskopie und Lichtmikroskopie im Experiment-Lithotripter untersucht. Die Wissenschaftler diagnostizierten nach diesen Vorgängen regelmäßig und unabhängig von Acetylsalicylsäureeinnahme auftretende Symptome, wie Zeichen des Zelluntergangs, Kapillarschlingenzerreißungen, Veränderungen am Deckepithel, Wanddefekte am Glomerulum und vereinzelt auch Fibrosierungen.
Die Folgerung hierbei ist, dass die Extrakorporale Stoßwellenlithotripsie zu ultrastrukturellen Verletzungen an den Nieren der Versuchsratten führte. Somit ist festzuhalten, dass nach einer ESWL mit anschließender Hämatombildung im Nierenbereich, eine Fortsetzung mit der Stoßwellentherapie frühestens nach 7 Tagen möglich ist, denn um die Schäden zu beheben braucht die Niere ein einwöchiges Reparations- und Regenerationsintervall. [26,27]
Literaturverzeichnis
[A]Pflüger's Archiv für die gesamte Physiologie des Menschen und der Tiere, Th. Dume, K. M. Koch, H. H. Krause, B. Ochwadt, 1966
[B]Harnstoff- und Inulin-Clearance der Rattenniere bei osmotischer Diurese unter Reinfusion des Urins, Hans-Werner Callsen, Kiel, 1974
[C]Messungen des Ammoniakdruckes in den corticalen Tubuli der Rattenniere, Hellmut Oelert, Eike Uhlich, A. Gorman Hills
[D]Physiologie der Haustiere 2te Auflage herausgegeben von Prof.Dr.Dr.h.c. Wolfgang von Engelhardt und Prof. Dr. Gerhardt Breves Seite 277-300, 2005
[E]König Liebich Anatomie der Haustiere, 5. Anlage , 389- 404, 2012
[F]Der Urologe, Volume 46, issue 2 (February 2007), p. 150 - 155. ISSN: 0340-2592 DOI: 10.1007/s00120-006-1266-5 Springer-Verlag, Berlin/Heidelberg
Weblinks
[1]http://www.medizinfo.de/urologie/anatomie/nierenlage.shtml
[2]http://de.wikipedia.org/wiki/Niere
[3]http://www.histonet2000.de/praeparat.php?pzid=029_012
[4]http://www.pflegewiki.de/wiki/Niere#Blutversorgung
[5]http://medizin-fuer-kids.de/bibliothek/koerperfunktionen/flash/harnsystem.swf
[6]http://www.pharma.ethz.ch/scripts/external_student/wagner_Niere_1_HS_2010.pdf
[7]http://www.pharma.ethz.ch/scripts/external_student/wagner_Niere_2_HS_2010.pdf
[8]http://www.pharma.ethz.ch/scripts/external_student/wagner_Niere_3_HS_2010.pdf
[9]http://flexikon.doccheck.com/de/Primärharn
[10]http://flexikon.doccheck.com/de/Prim%C3%A4rharn]]
[11]http://www.transplantation-verstehen.de/organe/niere/einleitung/aufbau-und-funktion.html
[12]http://flexikon.doccheck.com/de/Nephron
[15]http://de.wikipedia.org/wiki/Proteinurie
[16]http://flexikon.doccheck.com/de/Proteinurie
[17]http://de.wikipedia.org/wiki/Mikroalbuminurie
[18]http://www.medizinfo.de/diabetes/kontrolle/albumin.htm
[19]http://www.med4you.at/laborbefunde/lbef2/lbef_kreatinin_clearance.htm
[20]http://www.vem-aktienbank.de/irpages2/show.ssp?id=399&companyName=vem&newsID=23953
[21]http://www.ncbi.nlm.nih.gov/pubmed/17710607
[22]http://www.vem-aktienbank.de/irpages2/show.ssp?id=399&companyName=vem&newsID=23953
[23]http://www.netzeitung.de/1/209316.html
[24]http://wissenschaft.de/wissenschaft/news/149654.html
[25]http://warpsix.komedia.de/sixcms/detail.php?id=149654
[27]http://journals.ohiolink.edu/ejc/article.cgi?issn=03402592&issue=v46i0002&article=150_uvandeua
Bildnachweise
Sämtliche Bilder mit Ausnahme des Nierennephrons(http://commons.wikimedia.org/wiki/File:Kidney_PioM.png) sind geistiges Eigentum der Verfasser
Danksagung
Wir danken Frau Anna Klein, Herrn Ingo Oeppert und Herrn Felix Schellinger für die Mithilfe an diesem Artikel
