Die Rattenniere
Die Niere ist ein paariges, bei der Ratte bohnenförmig angelegtes Harnsystemorgan, welches dorsal in der caudalen Bauchhöhle liegt. Sie dient der Bildung und Ausscheidung des Harns. Die Ratte ist in der modernen Medizin als Forschungsobjekt unabkömmlich. Mit Hilfe der Rattenniere kann auf die physiologische Tätigkeit und die Funktion anderer Säugetiere geschlossen werden. Ein wichtiger Modellversuch ist die isoliert perfundierte Rattenniere. Neben der Beschreibung dieses Versuches wird im Artikel die Niere anatomisch und physiologisch näher betrachtet. Dazu werden auch Daten aus einem eigenen Versuch erhoben. 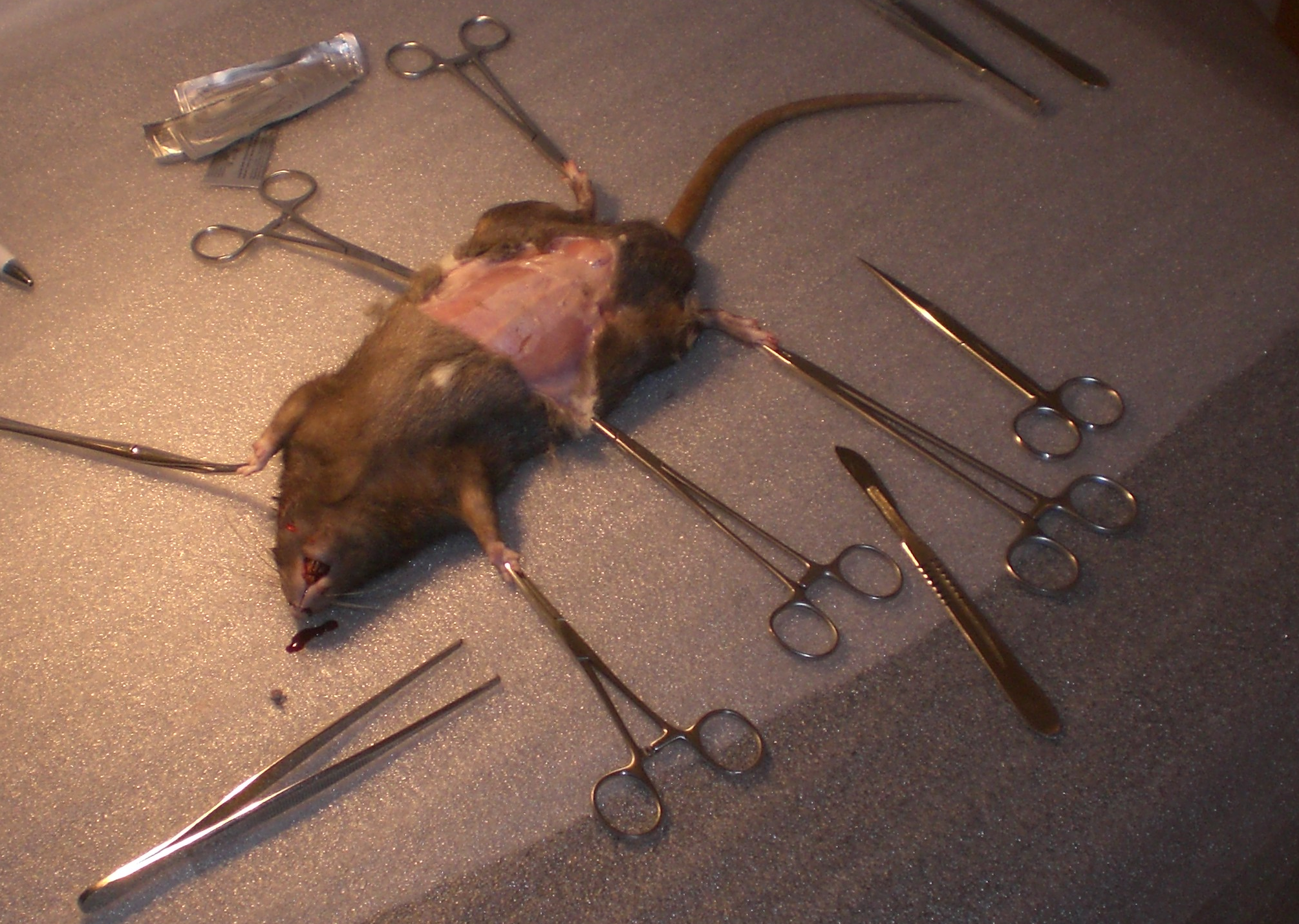
Contents
Lage und Aufbau der Rattenniere
Versuchsbeschreibung
Da in der uns zur Verfügung stehenden Fachliteratur 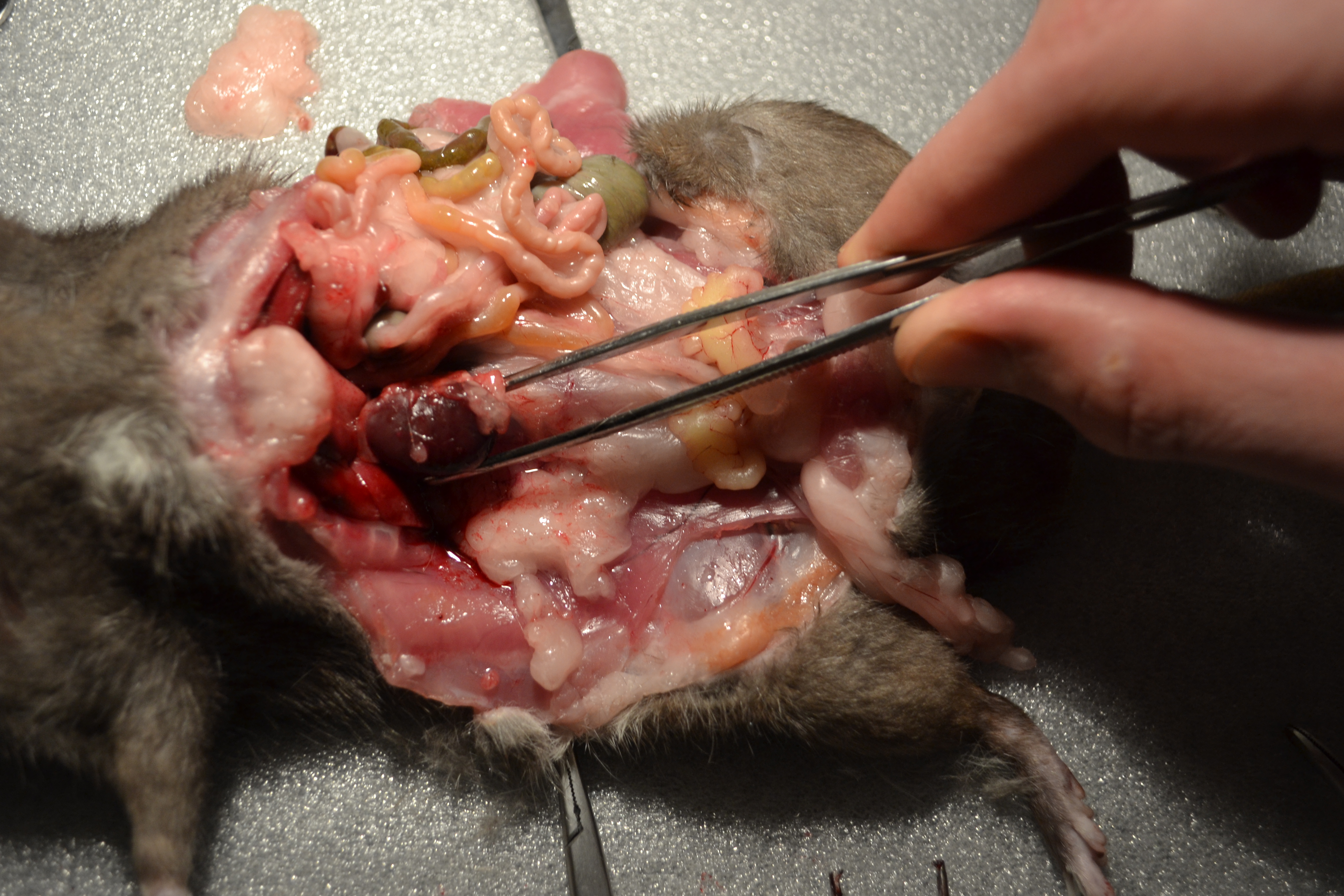 nur unzureichend über die anatomische Lage der Niere berichtet wurde, haben wir uns entschlossen, selber diese Vermessungen und Einordnungen an einer Ratte vorzunehmen. Bei dem Versuchstier handelte es sich um vegicus forma domestica)eine Farbratte (Rattus nor vegicus forma domestica) mit einem Gewicht von 453g. Die Länge der Ratte betrug, gemessen vom Kopf bis zum Schwanzansatz, 23 cm. Das Tier war männlich und unkastriert und befand sich in einem sehr guten Ernährungszustand. Die Ratte hatte bis zum Versuchsbeginn freien Zugang zu Futter und Wasser. Im Zuge unseres Versuches wurde die Ratte sachgerecht getötet und dann präpariert. Dazu wurde zunächst die Haut an der Linea alba durchtrennt, nach lateral weggezogen und mit Klemmen fixiert. Die Muskulatur der Bauchwand wurde auch an der Linea alba eröffnet und so die musculi rectus abdominis voneinander getrennt und ebenfalls mit Klemmen fixiert. Anschließend wurden die Bauchorgane nach rechts gezogen, um so an die linke Niere zu gelangen. Das selbe Verfahren wurde auch bei der rechten Niere angewandt. Die Niere wurde aus ihrem Fettpolster freipräpariert und anschließend in der ursprünglichen Position im Körper vermessen, genauso wie bei der rechten Niere. Die dabei gemessenen Parameter werden in der unten stehenden Tabelle (siehe 1.3) näher aufgeführt. Nach Beendigung der makroskopischen Untersuchung wurden die Nieren zur genaueren Untersuchung aus der Ratte entnommen.
nur unzureichend über die anatomische Lage der Niere berichtet wurde, haben wir uns entschlossen, selber diese Vermessungen und Einordnungen an einer Ratte vorzunehmen. Bei dem Versuchstier handelte es sich um vegicus forma domestica)eine Farbratte (Rattus nor vegicus forma domestica) mit einem Gewicht von 453g. Die Länge der Ratte betrug, gemessen vom Kopf bis zum Schwanzansatz, 23 cm. Das Tier war männlich und unkastriert und befand sich in einem sehr guten Ernährungszustand. Die Ratte hatte bis zum Versuchsbeginn freien Zugang zu Futter und Wasser. Im Zuge unseres Versuches wurde die Ratte sachgerecht getötet und dann präpariert. Dazu wurde zunächst die Haut an der Linea alba durchtrennt, nach lateral weggezogen und mit Klemmen fixiert. Die Muskulatur der Bauchwand wurde auch an der Linea alba eröffnet und so die musculi rectus abdominis voneinander getrennt und ebenfalls mit Klemmen fixiert. Anschließend wurden die Bauchorgane nach rechts gezogen, um so an die linke Niere zu gelangen. Das selbe Verfahren wurde auch bei der rechten Niere angewandt. Die Niere wurde aus ihrem Fettpolster freipräpariert und anschließend in der ursprünglichen Position im Körper vermessen, genauso wie bei der rechten Niere. Die dabei gemessenen Parameter werden in der unten stehenden Tabelle (siehe 1.3) näher aufgeführt. Nach Beendigung der makroskopischen Untersuchung wurden die Nieren zur genaueren Untersuchung aus der Ratte entnommen.
Anatomische Lage
Der craniale Rand der Rattenniere befindet sich in Höhe des Rippenbogens und wird von der Leber und Milz begrenzt. Dorsolateral wird sie von der Bauchwand begrenzt. Die Niere liegt bei der Ratte extraperitoneal an der Bauchwand und ist mit Bauchfell überzogen, in ein Fettpolster eingebettet und von einer fibrösen Schicht umhüllt. Caudal wird die Niere von einem Fettpolster eingerahmt, das direkt an die innere Bauchmuskulatur anschließt.
Form, Farbe und Größe
Form, Farbe und Größe der Rattenniere Die Form der Niere ist bohnenförmig, ihre Farbe ist weinrot. Die untersuchten Nieren wogen 3g. 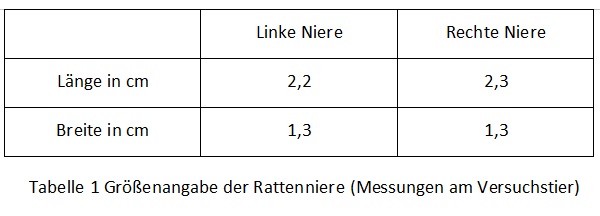
Feinaufbau der Rattenniere
Die Rattenniere ist eine einfache, glatte, unipapillare Niere. Von außen betrachtet können wir einen oberen und unteren Pol, sowie eine Vorder-, und Rückseite erkennen. An der der Wirbelsäule zugewandten Seite der Niere befindet sich das Nierenhilum, der Nierennabel, an dem die wichtigen Blutgefäße, Nerven und der Ureter in die Niere ziehen, beziehungsweise aus ihr entspringen. Wie im vorherigen Thema bereits angedeutet, liegt die Niere zusammen mit der Nebenniere in einem lockeren Fettgewebskörper, die auch Capsula adiposa genannt wird. Dieser schützt die Niere vor 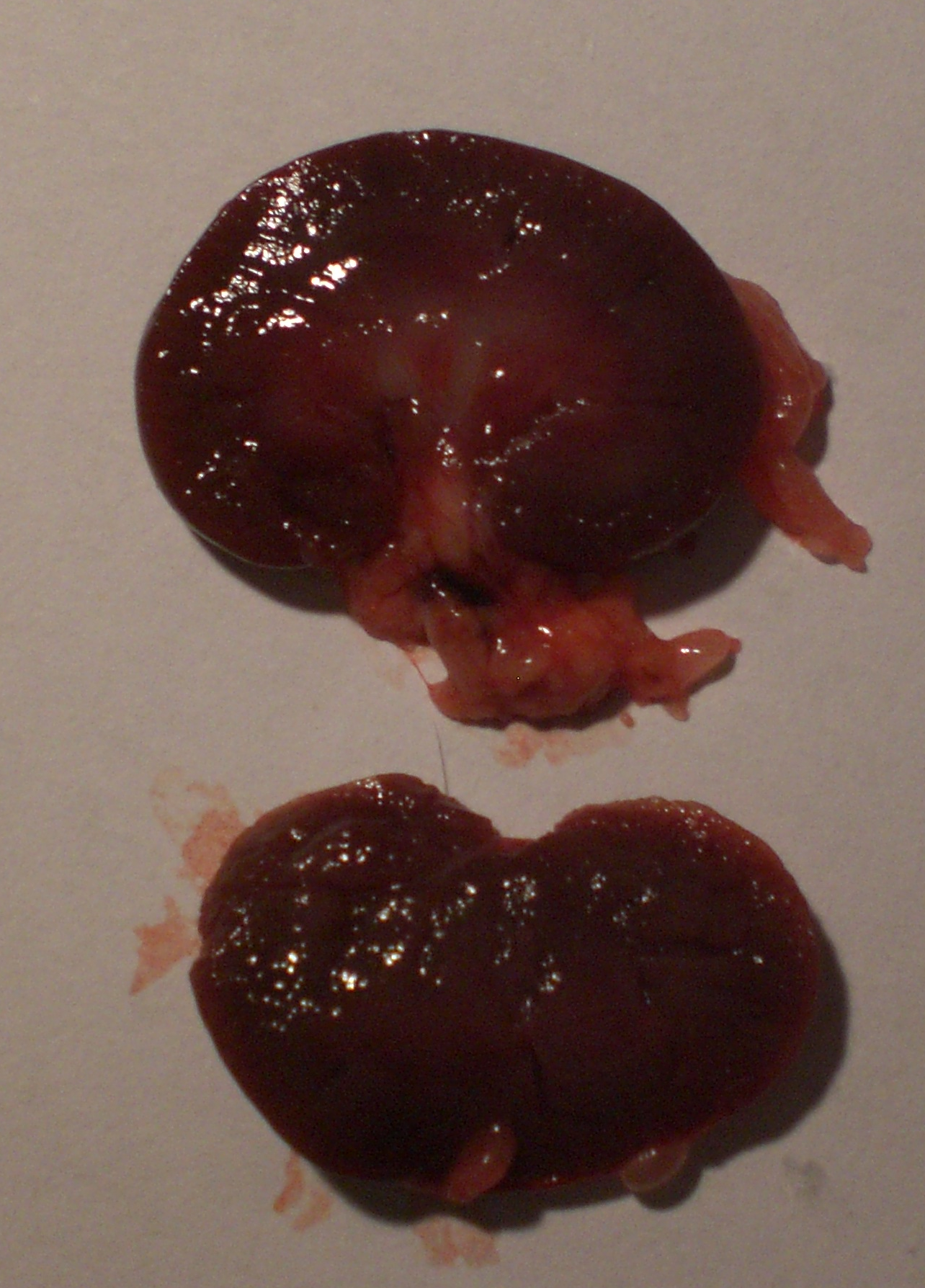 Erschütterungen und Stößen und stabilisiert ihre Lage im Körper. Die Niere selbst ist von einer bindegewebigen Schicht der Capsula fibrosa umgeben. Um die Capsula fibrosa und Capsula adiposa herum liegt die Fascia renalis, die die Aufhängung der Niere an die Bauchwand sicherstellt. Im Schnittbild sind Cortex (Nierenrinde) und Medulla (Nierenmark) bereits deutlich zu erkennen. Im Mark, der Medulla, ziehen die Nierenkanäle von der Papille zur Cortex, in der sich die Nierenkörperchen befinden. Die Nierenkörperchen sind die funktionelle Einheit der Niere und ihre Tätigkeit wird näher im Thema Funktion der Rattenniere erläutert. Diese sind als dunkle Punkte auszumachen. In der Mitte des Schnittbildes befindet sich das Nierenbecken (Pelvis renalis). Aus diesem geht der Ureter hervor. Auf weitere Einzelheiten zum Aufbau der Niere wird im Thema Funktion der Rattenniere gesondert eingegangen.[2,5]
Erschütterungen und Stößen und stabilisiert ihre Lage im Körper. Die Niere selbst ist von einer bindegewebigen Schicht der Capsula fibrosa umgeben. Um die Capsula fibrosa und Capsula adiposa herum liegt die Fascia renalis, die die Aufhängung der Niere an die Bauchwand sicherstellt. Im Schnittbild sind Cortex (Nierenrinde) und Medulla (Nierenmark) bereits deutlich zu erkennen. Im Mark, der Medulla, ziehen die Nierenkanäle von der Papille zur Cortex, in der sich die Nierenkörperchen befinden. Die Nierenkörperchen sind die funktionelle Einheit der Niere und ihre Tätigkeit wird näher im Thema Funktion der Rattenniere erläutert. Diese sind als dunkle Punkte auszumachen. In der Mitte des Schnittbildes befindet sich das Nierenbecken (Pelvis renalis). Aus diesem geht der Ureter hervor. Auf weitere Einzelheiten zum Aufbau der Niere wird im Thema Funktion der Rattenniere gesondert eingegangen.[2,5]
Blutversorgung der Niere
Die Niere erhält ihr Blut aus der Arteria renalis, die direkt aus der Aorta abdominalis entspringt. In der Niere teilen sich die Blutgefäße in die Arterien zwischen den Lappen (Aa. Interlobares), die Arterien zwischen den einzelnen Läppchen (Aa. Interlobularis) und den Aa. Arcuatae, die Bogenarterien. Die einzelnen Nierenkörperchen werden über die Vas afferens versorgt. Der venöse Abfluss der Niere beginnt bei den Vas efferens , geht dann über in die Vv. Interlobalis und Vv. Arcuatae, um dann über die Vena reanlis in die hintere Hohlvene, die Vena cava caudalis ,zu münden.[6]
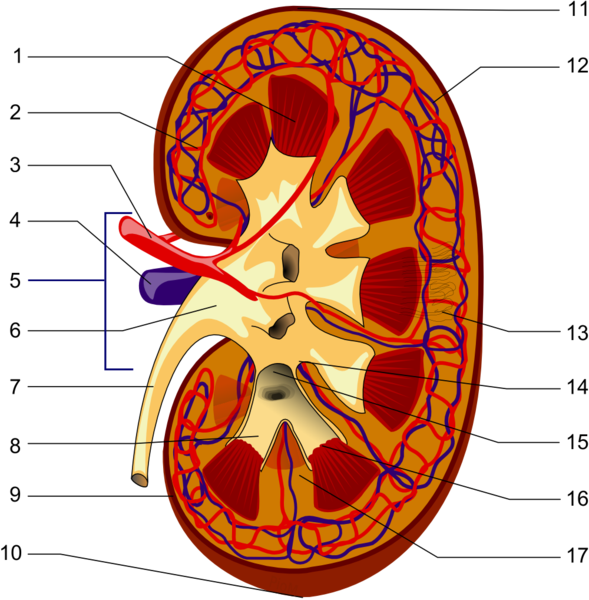
1. Nierenmark mit Markkegeln (Pyramides renales) 2.Vas afferens 3. Nierenarterie (Arteria renalis) 4. Nierenvene (Vena renalis) 5.Hilum renale 6.Nierenbecken (Pelvis renalis) 7.Harnleiter (Ureter) 8.kleine Nierenkelche (Calices minores renales) 9.Nierenkapsel (Capsula fibrosa renalis) 10.unterer Nierenpol (Extremitas inferior) 11.oberer Nierenpol (Extremitas superior) 12.Vas efferen 13.Nephron 14.Nierenbucht (Sinus renalis) 15.große Nierenkelche (Calices majores renales) 16.Spitzen der Markkegel (Papillae renales) 17.Bertini-Säulen (Columna renalis)
Aufbau des Nephron
Das Nephron ist die funktionelle Einheit der Niere. Es besteht aus dem Nierenkörperchen und dem daran angeschlossenen Tubulussystem. Die Unterteilung des Nephrons im Einzelnen schaut wie folgt aus. Das Nierenkörperchen besteht seinerseits wiederum aus dem Glomerulus und der Bowman-Kapsel. Der Nierentubulus besteht aus dem proximalen Tubulus mit seinen Pars convolute und Pars recta, dem Intermediärtubulus mit dem Pars descendens und Pars ascendens und dem distalen Tubulus, der wiederum aus dem Pars recta und dem Pars convoluta besteht. Die geraden Stücke (Partes rectae) des proximalen und distalen Tubulus werden mit dem Intermediärtubulus zusammen als Henle-Schleife bezeichnet. Der distale Tubulus mündet schließlich in das Sammelrohr. [8,14]
Funktion der Rattenniere
Allgemeiner Überblick Funktion
Die Niere hat im Körper verschiedene Aufgaben. Dazu gehört als erstes die Aufrechterhaltung der Homeostase. Homeostase bedeutet das Aufrechterhalten verschiedener Gleichgewichte im Körper. Hierbei zu nennen sind die Isovolämie, Isotonie, Isoionie und Isohydrie. Zudem ist die Niere auch an der Aufrechterhaltung des Blutdrucks beteiligt. Eine wichtige Aufgabe ist die Ausscheidung harnpflichtiger Substanzen wie Harnsäure, Harnstoff und Keratinin sowie giftiger Substanzen, z.B. Medikamente. Eine weitere Funktion der Niere liegt in der Endokrinologie. Hierbei werden Hormone wie das Erythropoetin abgesondert, welches eine wichtige Rolle in der Blutbildung hat. Zusätzlich wird in der Niere Vitamin D in seine aktivierte Form dem Calcitriol umgewandelt, welches die Kalziumaufnahme steigert und so die Knochenstabilität erhöht. Ein Hormon, das den Blutdruck regelt, ist das Renin, das einen Prozess in Gang setzt, an dessen Ende sich die Gefäße verengen und weniger Wasser und Salze ausgeschieden werden, was den Blutdruck erhöht.[7,8,9,10]
Funktion eines Nephrons
Das Blut gelangt durch die Vas afferens der Arteria interlobularis ins Nephron. Im Blut sind neben den Blutzellen auch andere Stoffe wie Wasser, Salze, Glukose und Giftstoffe enthalten. Das Blut fließt durch das Glomerulum der Bowmankapsel. Die glomeruläre Filtrationsbarriere ist aus den Poren der glomerulären Endothelzellen, der glomerulären Basalmembran und aus den Schlitzen zwischen den Fortsätzen der Podozyten aufgebaut. Wegen der Größe der Poren und der elektrischen Ladungen der einzelnen Elemente besteht eine hohe Permeabilität für Wasser und kleine wasserlösliche Stoffe, aber eine niedrige Permeabilität für Plasmaproteine. Dabei entsteht der sogenannte Primärharn, der in seiner Zusammensetzung stark dem eiweißfreien Primärharn entspricht. Makromoleküle sind, wie bereits erwähnt, auf Grund der kleinen Porengröße nicht vorhanden. Andere enthaltene Stoffe sind hauptsächlich Ionen, Elektrolyte sowie Aminosäuren. Dieser Primärharn fließt nun über die Henlesche Schleife in den distalen Tubulus. Dort wird nun der Salzgehalt des Blutes durch Abgabe von Salzen an das Blut reguliert. Mit anderen Stoffen wie Glukose wird ähnlich verfahren, zudem werden 99% des Wasser wieder an die Blutbahn abgegeben. Der nun übriggebliebene Stoff wird als Endharn oder Urin bezeichnet. Er gelangt über das Sammelrohr ins Nierenbecken und von dort über den Urethra in die Blase.[11,12,13]
Die wichtigsten physiologischen Werte der Rattenniere
Um Auskunft über die physiologische Tätigkeit der Niere zu erhalten, bieten sich mehrere Messmethoden an. Mit diesen Messungen kann so auch der Gesundheitszustand der Ratte ermittelt werden. Die wichtigsten Parameter sind hierbei Urinmenge, die Urinkonzentration und die vorhandene Konzentration der harnpflichtigen Stoffe (Kreatinin, Harnstoff, Harnsäure, Kalium) im Blutkreislauf .
Die Kreatinin-Clearance ist das gebräuchlichste Mittel zur Feststellung der Nierenleistung. Um diesen Wert zu vestehen, ist zunächst wichtig, etwas über das Keratinin zu wissen. Es ist das Abbauprodukt des Muskelkeratins, welches Energie speichern kann und bei Bedarf freigibt. Mit diesem Wert kann man Rückschlüsse auf die glomeruläre Filtrationsrate (GFR) ziehen. Veränderungen dieses Wertes lassen zum Beispiel auf Niereninsuffizienz, Diabetes mellitus, Hypertonie oder Gicht schließen.[17,18,19,20,21,22]
Isolierte Perfusion
Die Versuchsbeschreibung nach Hofbauer (1973)
Die perfundierte Rattenniere ist für Untersuchungen über die Elektrolytausscheidung und die Regulation der Reninsekretion sehr gut geeignet. Im folgendem wird die Versuchsvorgehensweise beschrieben nach Hofbauer 1973. Als Versuchstiere werden männliche Albinoratten des Stammes Sprague- Dawley , Farbratten (Rattus norvegicus forma domestica) oder alternativ Wistar-Kyoto-Ratten, die zum Zeitpunkt der Operation 360-400g wiegen, verwendet. Die Tiere haben bis zur Narkose freien Zugang zu Wasser und Futter.
Die Perfusionsapparatur besteht aus einem doppelwandigen Glaskondensor, welcher senkrecht in einem Stativ befestigt ist und mit Hilfe eines Durchflussthermostates durch einen Wasserstrom zwischen Innen- und Außenwand auf 37°C erwärmt wird. Am unteren Ende wird der Kondensor durch einen Stopfen mit eingeschmolzener Glasfritte verschlossen. Von dort führt ein Schlauch zu einem Filter mit einer Membran, welche eine Porengröße von 12,0 µm hat. Vor dem Filter befindet sich im Seitenschluss ein Dreiwegehahn, über den während des Versuchs ohne Unterbrechung der Perfusion Proben entnommen werden können. Um die Verschleppung kleinster Luftbläschen aus den Poren der Filtermembran zu vermeiden, muss der Filter stets mit der Zuflußseite nach oben befestigt werden. 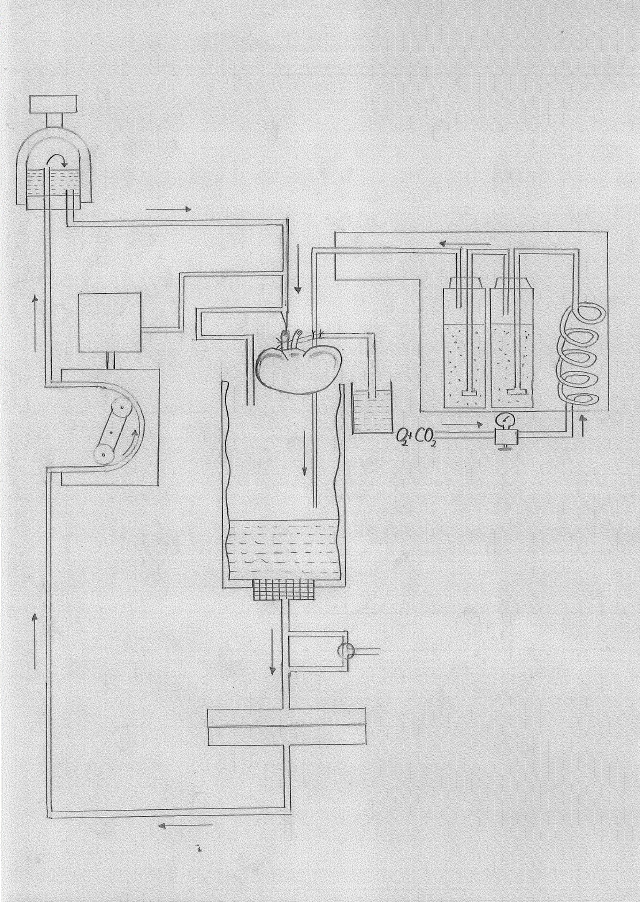
Vom Filter führt ein Schlauch zu einer Rollenpumpe, die einen fluß- oder druckkonstanten Betrieb erlaubt, und von dort weiter zu einem doppelwandigen Blasenfänger, der, wie der Kondensor, temperiert wurde. Über ein Entlüftungsventil wird der Flüssigkeitsspiegel im Blasenfänger so eingestellt, dass dieser ca. 6 ml Luft enthält und damit zugleich als Windkessel fungiert. Der zuführende Schlauch reicht im Inneren des Blasenfängers bis über den Flüssigkeitsspiegel, während der abführende Schenkel direkt über dem Boden des Blasenfängers beginnt, sodass der Eintritt eventuell vorhandener Luftbläschen in den abführenden Schlauch vermieden werden kann. Vom Blasenfänger führt ein weiterer Schlauch zur Nierenkanüle. Unmittelbar vor der Nierenkanüle befindet sich ein Dreiwegehahn, von dem ein weiterer Schlauch direkt in den Kondensor führt, sodass das Perfusat entweder durch die Nierenkanüle oder durch diesen Schlauch in den Kondensor zurückfließen kann. Unmittelbar vor dem Dreiwegehahn wurde über ein Y-Stück ein Druckaufnehmer angeschlossen. Über der oberen Öffnung des Kondensors wird eine Halterung angebracht, mit der die Nierenkanüle im oberen Teil des Kondensors befestigt werden kann. Der Druckaufnehmer befindet sich dabei auf gleicher Höhe mit der an der Nierenkanüle hängenden Niere und dem Operationstisch. Der Druckaufnehmer wird mit der Rollenpumpe über einen Verstärker verbunden. Nach Abgriff vom Druckaufnehmer und der Pumpe werden Druck- und Flußrate mit einem Schreiber fortlaufend registriert.
Durch einen dünnen Schlauch, der kurz über dem Flüssigkeitsspiegel am Boden des Kondensors endet, wird das Perfusat während des Versuchs pro Minute mit 0,4 l eines Gasgemisches aus 95 % Sauerstoff und 5 % Kohlendioxid begast. Das Gas wurde zuvor durch eine Wärmeschlange und zwei Waschflaschen mit destilliertem Wasser geleitet und ist dadurch beim Eintritt in den Kondensor mit Wasserdampf gesättigt und auf 37°C erwärmt. Durch einen dünnen Schlauch, der kurz über dem Flüssigkeitsspiegel am Boden des Kondensors endet, wird das Perfusat während des Versuchs pro Minute mit 0,4 l eines Gasgemisches aus 95 % Sauerstoff und 5 % Kohlendioxid begast. Das Gas wurde zuvor durch eine Wärmeschlange und zwei Waschflaschen mit destilliertem Wasser geleitet und ist dadurch beim Eintritt in den Kondensor mit Wasserdampf gesättigt und auf 37°C erwärmt. Ca. 15 Minuten vor Beginn des Perfusionsexperiments werden 150 ml Perfusat in den Kondensor eingefüllt, die Pumpe bei flußkonstantem Betrieb in Gang gesetzt und die Luft aus dem gesamten System, abgesehen vom Windkessel und Kondensor, entfernt. Über den Dreiwegehahn vor der Nierenkanüle kann das Perfusat nun unter Umgehung der Kanüle rezirkulieren, wobei durch eine Schlauchklemme zwischen Dreiwegehahn und Kondensor der Druck im System bei einer Flußrate von ca. 25 auf 100 mg Hg angehoben wird. Anschließend wird auf druckkonstante Perfusion bei 100 mm Hg umgeschaltet.
Aminosäuren, Kreatinin und Glucose werden in bestimmten, zuvor festgelegten Mengen dem Perfusat nach Erwärmung und Äquilibrierung unmittelbar vor Versuchsbeginn zugegeben.
Alle von Perfusat durchflossenen Teile der Apparatur werden vor jedem Versuch mindestens 30 Minuten in Desinfektionslösung eingelegt und danach gründlichst mit demineralisiertem und anschließend mit destilliertem Wasser gespült. Alle Glasteile werden außerdem sterilisiert.[A, G, 23, 24]
Operation
Die Ratten werden an Hals und Bauch rasiert und auf einen beheizbaren Operationstisch gelegt. Nach Durchschneiden der Haut des Halses wird zuerst die Vena jugularis externa dargestellt und stumpf freipräpariert, anschließend distal unterbunden und leicht gespannt. Durch einen kleinen Einschnitt in der Venenwand wird ein Schlauch eingeführt, bis kurz vor den rechten Vorhof vorgeschoben und eingebunden. Mit Hilfe einer Infusionspumpe erhalten die Tiere über diesen Venenkatheter primär 0,9 % NaCl Lösung.
Dann wird die Trachea freipräpariert und zwischen zwei Knorpelspangen eingeschnitten. Nach vorsichtigem Austupfen der Trachea wird eine Trachealkanüle eingelegt und durch Ligatur fixiert. Anschließend wird die Halswunde mit einer Klammer verschlossen. Darauf wird die Bauchdecke in der Linea alba in ganzer Länge eröffnet, Magen und Darm aus dem Bauchraum herausverlagert und mit Kochsalzlösung getränkt.
Nach Darstellung der rechten Niere und der großen Gefäße wird die rechte Niere stumpf aus dem umgebenden Fett und Bindegewebe freipräpariert und wiederrum mit Kochsalzlösung vor Austrocknung geschützt.
Stellen sich im Verlauf der Operation Polarterien oder andere Gefäßanomalien dar, wird der Versuch abgebrochen. Nach Ligatur und Durchtrennung der Ateria suprarenalis caudalis dextra wird die Ateria renalis dextra mit einem und die Ateria mesenterica cranialis mit drei Fäden locker angeschlungen. Anschließend wird der rechte Ureter in seinem proximalen und mittleren Abschnitt vorsichtig freipräpariert und durch Einlegen eines Nylonschlauches katheterisiert.
Während das Perfusat zu diesem Zeitpunkt, wie oben beschrieben, unter Umgehung der Nierenkanüle bereits rezirkuliert, wird die Nierenkanüle in einer festen Halterung über der Ateria mesenterica cranialis angebracht und so fixiert, dass ihre Spitze in Richtung Ateria renalis dextra weist. Dann wird die Ateria mesenterica cranialis distal unterbunden. Anschließend erhalten die Ratten 250 E Heparin intravenös. Nun wird der proximal um die Ateria mesenterica cranialis geschlungene Faden leicht angehoben und dadurch die Arterie an dieser Stelle zeitweilig verschlossen. Ohne Blutverlust konnte jetzt die Nierenkanüle durch einen kleinen Einschnitt in die Ateria mesenterica cranialis eingeführt und dort fixiert werden. Durch Vorschieben der Nierenkanüle in der Halterung wurde ein stärkerer Zug an den Gefäßen vermieden.
Vor dem Einführen der Kanüle wird der Dreiwegehahn kurz umgelegt und die Bauchhöhle der Ratte dadurch mit Perfusat aufgefüllt, sodass das Einführen der Nierenkanüle unter dem Flüssigkeitsspiegel ohne die Gefahr von Luftembolisation erfolgt. Die Nierenkanüle wird anschließend in die Aorta vorgeschoben und mit einem zweiten Faden fixiert, dabei bleibt die Kanüle weiter in der Halterung befestigt. Die Arteria mesenterica cranialis wird nun durchtrennt und das Perfusat aus dem Bauchraum abgesaugt. Anschließend wird der Dreiwegehahn umgelegt und damit der Weg für das Pefusat durch die Nierenkanüle freigegeben.
Wegen des höheren Blutdrucks der Ratte fließt zu diesem Zeitpunkt allerdings noch kein Perfusat. Die Nierenkanüle wird jetzt aus ihrer Halterung gelöst und bis in die Ateria renalis dextra vorgeschoben. Mit dem Eintritt der Kanüle in die Ateria renalis beginnt das Perfusat zu fließen. Im selben Augenblick wird der Venenkatheter in der rechten Vena jugularis möglichst weit proximal durchschnitten, sodass ein freier Abfluss aus dem venösen System besteht. Dadurch kann ein Anstieg des Venendrucks verhindert werden.
Die Nierenkanüle wird nun fest in der Ateria renalis eingebunden. Anschließend werden die großen Gefäße durchschnitten, sodass die Niere aus dem Tier entfernt werden kann. Nach Durchfluss von ca. 50 ml Perfusat wird die Nierenkanüle in die Halterung an der oberen Öffnung des Kondensors eingesetzt, sodass die Niere frei im Kondensor hängt. Der Ureterkatheter wird durch eine Kerbe in der Wand des Kondensors nach außen geleitet und so weit gekürzt, dass er ca. 2cm unter dem Niveau des Nierenhilus endet. Der Kondensor wird darauf mit einem feuchten Tupfer abgedeckt. Sofort nach Entnahme der rechten Niere wird auch die linke Niere vom umgebenden Gewebe befreit, gewogen und eingefroren. [A, B, G, 24, 25]
Ablauf eines Perfusionsversuchs
Nach Einbringen der Niere in den Kondensor befindet sich eine gewisse Perfusatsmenge im System. Anschließend wird dem Perfusat radioaktives Inulin zugegeben. 10 Minuten nach der Zugabe des Radioinulins beginnt zum Zeitpunkt t °die Probenentnahme. Dazu werden in regelmäßigen Abständen am besten geringe Mengen ( ca. 1,5 ml) Perfusat entnommen, von denen jeweils ein Teil zur Reninbestimmung eingefroren wird, und die restliche Menge zur chemische Analyse dient. Der Urin wird in 30 Minuten Portionen gesammelt. Die Bestimmung des Urinvolumens erfolgt gravimetrisch.
Am Ende des Versuchs wird der Gefäßstiel unmittelbar über der Niere abgeklemmt. Falls die Pumpe dann nicht stehen bleibt, kann der Versuch wegen undichter Einbindung nicht verwertet werden. Nach Entfernen der Gefäßstümpfe wird die Niere anschließend gewogen und tiefgekühlt aufbewahrt.
Die chemische Zusammensetzung des Perfusats ist individuell an den durchzuführenden Versuch angepasst. Beispielkomponenten hierfür sind: Glucose, Kreatinin, Aminosäuren, Acetat uvm. [A, 23, 24, 25]
Schlussfolgerung
Die in diesem Artikel beschriebenen Informationen sollen dazu dienen, die Rattenniere anatomisch und physiologisch zu verstehen und mit diesem Wissen eigene Versuche durchzuführen.
Literaturverzeichnis
[A]Die isoliert perfundierte Rattenniere: Perfusionstechnik und Funktionskontrolle des Organes, Irene Leidner-Götze, 1979
[B]Pflüger's Archiv für die gesamte Physiologie des Menschen und der Tiere, Th. Dume, K. M. Koch, H. H. Krause, B. Ochwadt, 1966
[C]Harnstoff- und Inulin-Clearance der Rattenniere bei osmotischer Diurese unter Reinfusion des Urins, Hans-Werner Callsen, Kiel, 1974
[D]Messungen des Ammoniakdruckes in den corticalen Tubuli der Rattenniere
- Hellmut Oelert, Eike Uhlich, A. Gorman Hills
[E]Physiologie der Haustiere 2te Auflage herausgegeben von Prof.Dr.Dr.h.c. Wolfgang von Engelhardt und Prof. Dr. Gerhardt Breves Seite 277-300 2005
[F]König Liebich Anatomie der Haustiere, 5. Anlage , 389- 404, 2012
[G]Hofbauer KG, Zschiedrich H, Rauh W, Gross F: Conversion of angiotensin I into angiotensin II in the isolated perfused rat kidney. Clin Sci 44:447-456, 1973
Weblinks
[1]http://www.medizinfo.de/urologie/anatomie/nierenlage.shtml
[2]http://de.wikipedia.org/wiki/Niere
[3]http://www.biowin.at/all/Mikroskopie/tierisch/ausscheidung/niere/ratte/Niere%20ratte.html
[4]http://www.biowin.at/all/Mikroskopie/tierisch/ausscheidung/niere/ratte/Niere%20ratte.html
[5]http://www.histonet2000.de/praeparat.php?pzid=029_012
[6]http://www.pflegewiki.de/wiki/Niere#Blutversorgung
[7]http://medizin-fuer-kids.de/bibliothek/koerperfunktionen/flash/harnsystem.swf
[8]http://www.pharma.ethz.ch/scripts/external_student/wagner_Niere_1_HS_2010.pdf
[9]http://www.pharma.ethz.ch/scripts/external_student/wagner_Niere_2_HS_2010.pdf
[10]http://www.pharma.ethz.ch/scripts/external_student/wagner_Niere_3_HS_2010.pdf
[11]http://flexikon.doccheck.com/de/Primärharn
[12]http://flexikon.doccheck.com/de/Prim%C3%A4rharn]]
[13]http://www.transplantation-verstehen.de/organe/niere/einleitung/aufbau-und-funktion.html
[14]http://flexikon.doccheck.com/de/Nephron
[12]http://flexikon.doccheck.com/de/Prim%C3%A4rharn]]
[13]http://www.transplantation-verstehen.de/organe/niere/einleitung/aufbau-und-funktion.html
[14]http://flexikon.doccheck.com/de/Nephron
[16]http://edoc.hu-berlin.de/oa/degruyter/cclm.1963.1.3.92.pdf
[18]http://de.wikipedia.org/wiki/Proteinurie
[19]http://flexikon.doccheck.com/de/Proteinurie
[20]http://de.wikipedia.org/wiki/Mikroalbuminurie
[21]http://www.medizinfo.de/diabetes/kontrolle/albumin.htm
[22]http://www.med4you.at/laborbefunde/lbef2/lbef_kreatinin_clearance.htm
[24]http://www-brs.ub.ruhr-uni-bochum.de/netahtml/HSS/Diss/WesthoffTimmHenning/diss.pdf
[25]http://epub.uni-regensburg.de/10807/1/Doktorarbeit_Druckversion_A5.pdf
http://edoc.hu-berlin.de/oa/degruyter/cclm.1963.1.3.92.pdf
Bildnachweise
Sämtliche Bilder mit Ausnahme des Nierennephrons(http://commons.wikimedia.org/wiki/File:Kidney_PioM.png) sind geistiges Eigentum der Verfasser
