Peroxisom-Proliferator-aktivierter Rezeptor Gamma
Peroxisom -Proliferator-aktivierter Rezeptor Gamma, auch genannt „Glitazon Rezeptor“ oder NR1C3 (englisch: „nuclear receptor subfamily 1, group C, member 3), gehört zu den Typ 2 Kernrezeptoren. Diese werden im menschlichen Körper von dem PPARG-Gen codiert. (1,2,3,4)
Contents
Peroxisom-Proliferator-aktivierte Rezeptoren
PPARs sind intrazelluläre Kernrezeptoren, die über einen physiologischen und pharmakologischen Liganden aktiviert werden. Sie sind die Signalgeber für die Transkription verschiedener Genexpressionen. (1,2).
Es gibt drei Subtypen, die allesamt zur Superfamilie der zytosolischen Steroidrezeptoren gehören: PPAR- α, PPAR-β/δ und PPAR- ɣ. PPAR- α wird in der Leber, Niere, im Darm und im Herz exprimiert und deren Aktivierung hat vordergründig Einfluss auf die Blutfettwerte. (17,18,19,20) PPAR-β/δ gibt es in nahezu allen Geweben im Körper und reguliert hauptsächlich die Expression von Genen und hat Wirkung auf den Fettstoffwechsel. (16,18,19,20)
Im Allgemeinen aktiviert sich ein PPAR durch die Bindung eines spezifischen Agonisten und es bildet sich ein heterodimerer Komplex. (21)
Vorkommen im Gewebe
PPARG findet man hauptsächlich in Fettgewebe, im Kolon und in Makrophagen. Im menschlichen Körper und im Körper der Maus findet man außerdem zwei isomere Formen: PPAR- ɣ 1, welchen man beinah in jedem Gewebe außer in den Muskeln findet, und PPAR- ɣ 2, welcher im Fettgewebe und in den Organen zu finden ist. (5)
Funktion
|
Die Hauptfunktion von PPARG ist die Regulierung der Fettsäure-Speicherung und des Glukosestoffwechsels. Die von PPARG aktivierten Gene stimulieren die Lipidaufnahme und Adipogenese von Fettzellen. Mäuse, denen PPARG fehlt, können beispielsweise kein Fettgewebe erzeugen, wenn ihnen fettreiche Ernährung zugeführt wird. (6)
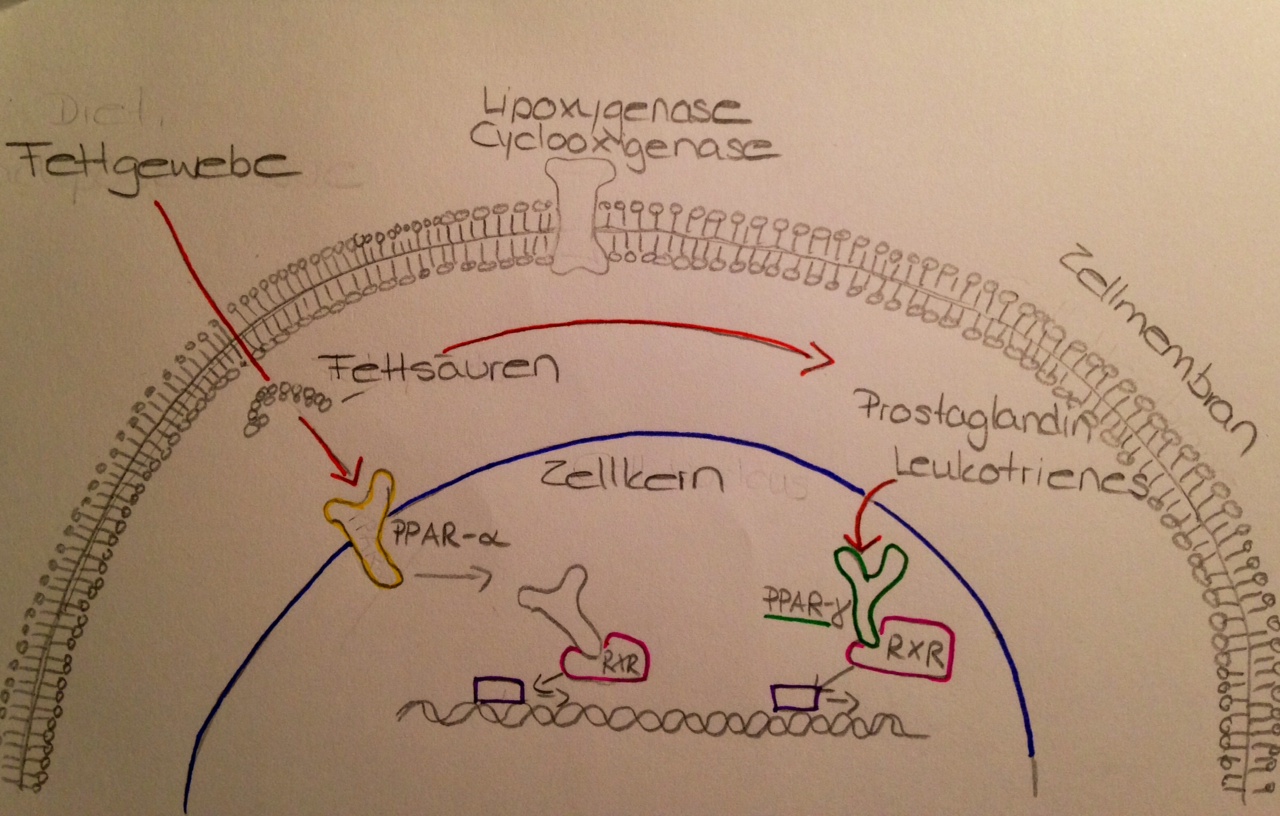
Das Gen codiert Peroxisom-Proliferator-aktivierte Rezeptoren, die zur Unterfamilie der Kernrezeptoren gehören. PPARs formen Heterodimere mit Retinoid-X-Rezeptoren (RXRs), welche die Transkription verschiedener Gene regulieren (Bild 1). Das Protein PPAR-ɣ steuert die Adipozytendifferenzierung. Es gibt außerdem auch isomere Formen dieses Rezeptors, die durch alternativ gepleißte/verbundene Transkriptionsvarianten entstehen. (7)
PPAR- ɣ wird durch natürliche Liganden aktiviert, oder beispielsweise durch Prostaglandin-Derivate, welche entzündliche Prozesse durch die Reduzierung der Expression von proinflammatorischen Cytokinen regulieren. Zu den natürlichen Liganden gehören in erster Linie Eicosanoide und spezielle Fettsäuren. Aktivierung durch einen sogenannten Agonisten, beziehungsweise Liganden führt unter anderem zur Regulation der Sekretion von Insulin und ist somit ein entscheidendes Ziel von Medikamenten gegen Krankheiten wie Diabetes. Darauf wird im Folgenden näher eingegangen. (7)
Klinische Bedeutung
PPAR-Gamma wurde in der Pathologie verschiedener Krankheiten bedeutend, unter anderem Fettsucht, Diabetes, Arteriosklerose und Krebs.
Agonisten von PPAR-gamma werden bei der Behandlung von Hyperlipoproteinämie und Hyperglykämie verwendet. (8) PPAR-Gamma verringert die Entzündungsreaktion vieler kardiovaskulärer Zellen, insbesondere Endothelzellen. (9) Es aktiviert außerdem das PON1-Gen, welches die Neubildung und Freisetzung von Paraoxonase 1 in der Leber vorantreibt. Dadurch wird Arteriosklerose reduziert. (10)
Viele Insulin-sensibilisierte Medikamente (Thiazolidindione), die bei der Behandlung von Diabetes mellitus Typ 2 eingesetzt werden, nutzen PPARG, mit dem Zweck den Blutglukosespiegel zu senken, ohne die Insulinsekretion im Pankreas zu steigern.
Verschiedene Arten von Verbindungen, die PPAR- ɣ schwächer aktivieren als Thiazolidindione (die so genannten „partiellen Agonisten von PPAR-Gamma“) werden momentan getestet, in der Hoffnung, dass diese Verbindungen ebenfalls effektive hypoglykämische Stoffe sein können, dafür aber mit weniger Nebenwirkungen. (11,12) Interessanterweise sind unter diesen partiellen Agonisten viele Verbindungen, die diätischen Ursprungs sind, oder aus in der traditionellen Medizin verwendeten Pflanzen bestehen. (13)
Die ersten Vertreter der PPAR-Agonisten waren Muraglitazar und Tesaglitazar. Diese konnten die in sie gesetzten Erwartungen nicht erfüllen und mussten aufgrund ihrer Nebenwirkungen in ihrer Entwicklung gestoppt werden. Heute befindet sich Aleglitazar in klinischen Studien, was mit nahezu gleicher Affinität an PPARα- und PPARγ-Rezeptoren bindet. Sie alle gehören zu den sogenannten Glitazonen, welche den Rezeptor aktivieren und Genexpression von Genen des Glucose- und Lipidstoffwechsels ankurbeln. So wird also der Blutzuckerspiegel gesenkt, demnach die physiologische Insulinfunktion verbessert. Was, wie oben angedeutet, das Krankheitsbild von Diabetes mellitus Typ 2 verbessert. (18,22,23)
Weiter fördert es die neuronale Differenzierung und axonale Polarität. Außerdem verbessert PPAR-y die mitochondrielle Funktion, reduziert Neuronenentzündungen und überträgt Schmerzsignale. Desweiteren fördert die Aktivierung von PPAR- ɣ die Fähigkeit zur Memorisierung, durch die Modulation neuroinflammatorischer und neurodegenerativer Mechanismen. Das hat große Bedeutung in der Alzheimerforschung. (21)
Ein Fusionsprotein aus PPAR- ɣ 1 und dem Schilddrüsen-Transkriptions-Faktor PAX8 kommt in etwa einem Drittel aller follikulären Schilddrüsen-Karzinomen vor. Um genauer zu sein: Bei den Krebsarten mit einer chromosomalen Translokation von t(2;3)(q13;p25), die ermöglicht, dass beide Gene nebeneinander existieren können.(14,15)
Studien
In der Vergangenheit, sowie auch heute, werden klinische Studien durchgeführt um die Bedeutung von PPAR-gamma und seinen Agonisten in der Bekämpfung sowie auch in der Entstehung von Krankheiten nachzuweisen und zu erforschen. Im Folgenden sind einige Beispiele erläutert.
|
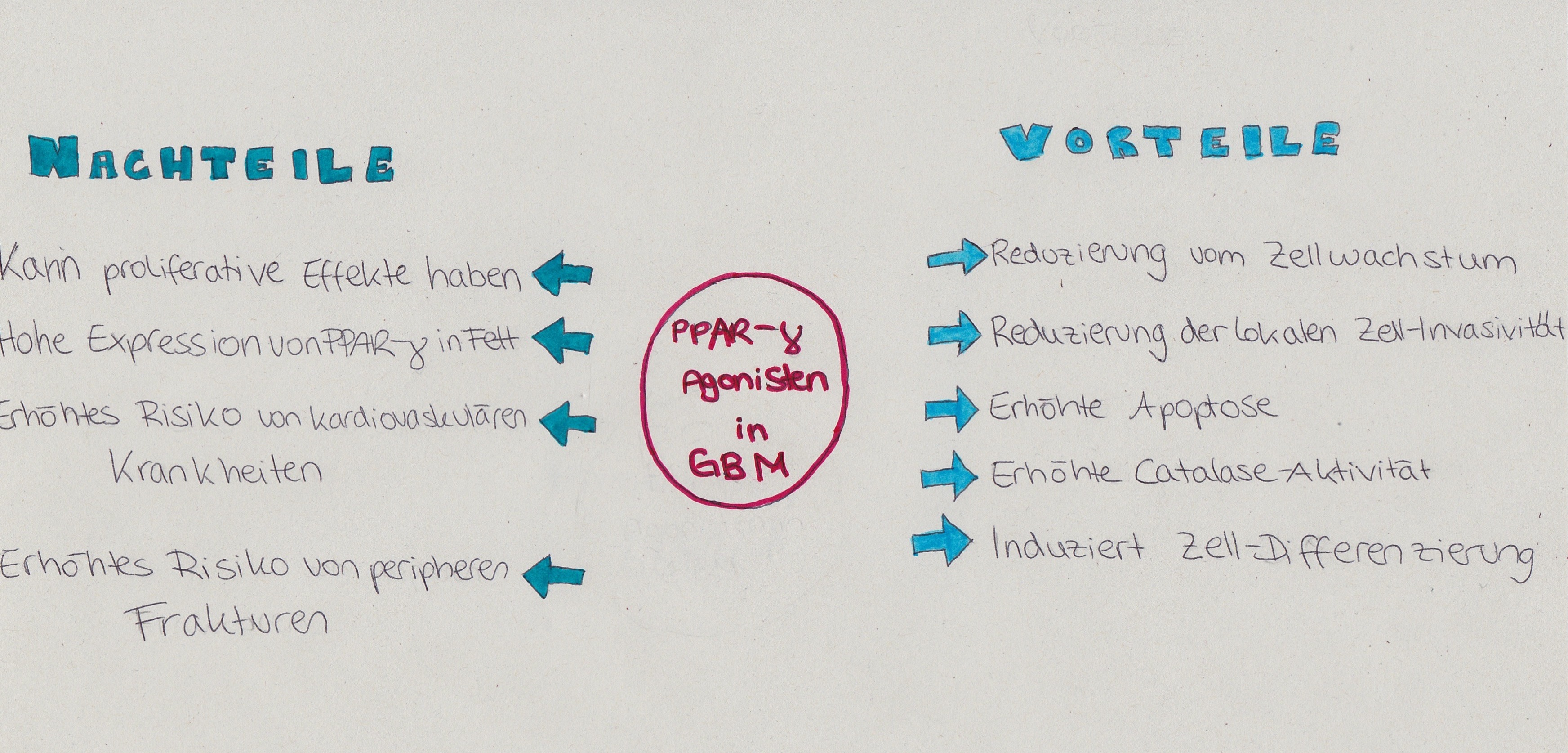
Es gibt interessante vorläufige Hinweise, dass Diabetes-Typ-2 Patienten, die mit PPAR-gamma Agonisten, Thiazolidindion, behandelt wurden, eine erhöhte Überlebenszeit bei einer Glioblastom-Erkrankung vorweisen. In diesem Fall wurden die Gehirntumorwachstumshemmung, die Gliom-Zelldifferenzierung und die Hemmung der Apoptose untersucht. Das Potenzial zur Verwendung dieser Mittel ist vorerst eingeschränkt, da Thiazolindindion zu der Gruppe von Agonisten gehört, die starke Nebenwirkungen hervorrufen. Es wurden sowohl Vorteile als auch Nachteile der untersuchten Agonisten von PPAR-gamma in Glioblastoma (GBM) aufgedeckt. Es wurde erwiesen, dass sie proliferative Effekte haben können. Außerdem wird die Expression von PPAR-gamma in Fettgewebe gesteigert und somit auch das Risiko von kardiovaskulären Krankheiten und peripheren Frakturen erhöht. Da aber der Nutzen dieses Verfahrens in der GBM- Heilung überwiegt, wird die genannte Behandlungsweise weiter erforscht. Beispielsweise wird neben den bereits erwähnten vorrangigen Vorteilen, die Catalase-Aktivität gesteigert und im Gegenzug die lokale Zell-Invasivität reduziert. Sämtliche Pro- und Contra-Argumente für die Verwendung von PPAR-gamma Agonisten sind in der obigen Abbildung (Bild 2) zusammengefasst. (24,25)
Günstige Wirkungen von PPAR- gamma wurden auch in Versuchen an Mäusen in der Alzheimerforschung entdeckt.
Alzheimer ist eine neurodegenerative Erkrankung, die einen großen Teil der älteren Bevölkerung betrifft und klinisch zu einer fortschreitenden Gedächtnisabnahme führt. Im Verlauf der Krankheit kommt es zu einer Ansammlung von Aggregaten des Proteins Amyloid-beta im Gehirn. Einige Studien erforschten, dass die PPAR-gamma Aktivierung durch Thiazolidindion (TZD), die Amyloid- Ablagerung reduziert. Zusätzlich verringert die Behandlung mit Pioglitazon (PPAR-gamma Agonist) die Expression von inflammatorischen Cytokinen und verbessert die Phagozytose des Proteins Amyloid-beta. (21)
Auch in der Dermatologie wird die Anwendung von PPAR-gamma Agonisten zur Heilung von chronischen und entzündlichen Hautwunden und zur Reduzierung von Narbenbildung getestet. (26)
Quellen
Fachartikel
1.Chandra, V.; Huang, P.; Hamuro, Y.; Raghuram, S.; Wang, Y.; Burris, T. P.; Rastinejad, F. (2008). "Structure of the intact PPAR-γ–RXR-α nuclear receptor complex on DNA". Nature 456 (7220): 350–356. doi:10.1038/nature07413. PMC 2743566. PMID 19043829. edit
2.Greene ME, Blumberg B, McBride OW, Yi HF, Kronquist K, Kwan K, Hsieh L, Greene G, Nimer SD (1995). "Isolation of the human peroxisome proliferator activated receptor gamma cDNA: expression in hematopoietic cells and chromosomal mapping". Gene Expr. 4 (4–5): 281–99. PMID 7787419.
3.Elbrecht A, Chen Y, Cullinan CA, Hayes N, Leibowitz M, Moller DE, Berger J (July 1996). "Molecular cloning, expression and characterization of human peroxisome proliferator activated receptors gamma 1 and gamma 2". Biochem. Biophys. Res. Commun. 224 (2): 431–7. doi:10.1006/bbrc.1996.1044. PMID 8702406.a cDNA: expression in hematopoietic cells and chromosomal mapping". Gene Expr. 4 (4–5): 281–99. PMID 7787419.
4.Michalik L, Auwerx J, Berger JP, Chatterjee VK, Glass CK, Gonzalez FJ, Grimaldi PA, Kadowaki T, Lazar MA, O'Rahilly S, Palmer CN, Plutzky J, Reddy JK, Spiegelman BM, Staels B, Wahli W (December 2006). "International Union of Pharmacology. LXI. Peroxisome proliferator-activated receptors". Pharmacol. Rev. 58 (4): 726–41. doi:10.1124/pr.58.4.5. PMID 17132851.
5.Fajas L, Auboeuf D, Raspé E, Schoonjans K, Lefebvre AM, Saladin R, Najib J, Laville M, Fruchart JC, Deeb S, Vidal-Puig A, Flier J, Briggs MR, Staels B, Vidal H, Auwerx J (July 1997). "The organization, promoter analysis, and expression of the human PPARgamma gene". J. Biol. Chem. 272 (30): 18779–89. doi:10.1074/jbc.272.30.18779. PMID 9228052.
6.Jones JR, Barrick C, Kim KA, Lindner J, Blondeau B, Fujimoto Y, Shiota M, Kesterson RA, Kahn BB, Magnuson MA (April 2005). "Deletion of PPARγ in adipose tissues of mice protects against high fat diet-induced obesity and insulin resistance". Proc. Natl. Acad. Sci. U.S.A. 102 (17): 6207–12. doi:10.1073/pnas.0306743102. PMC 556131. PMID 15833818.
7."Entrez Gene: PPARG peroxisome proliferator-activated receptor gamma" on NCBI, 23.Nov..214
9.Hamblin M, Chang L, Fan Y, Zhang J, Chen YE (June 2009). "PPARs and the Cardiovascular System". Antioxid. Redox Signal. 11 (6): 1415–52. doi:10.1089/ARS.2008.2280. PMC 2737093. PMID 19061437.
10.Khateeb J, Gantman A, Kreitenberg AJ, Aviram M, Fuhrman B (January 2010). "Paraoxonase 1 (PON1) expression in hepatocytes is upregulated by pomegranate polyphenols: a role for PPAR-gamma pathway". Atherosclerosis 208 (1): 119–25. doi:10.1016/j.atherosclerosis.2009.08.051. PMID 19783251.
11. Atanasov AG, Wang JN, Gu SP, Bu J, Kramer MP, Baumgartner L, Fakhrudin N, Ladurner A, Malainer C, Vuorinen A, Noha SM, Schwaiger S, Rollinger JM, Schuster D, Stuppner H, Dirsch VM, Heiss EH. "Honokiol: a non-adipogenic PPARγ agonist from nature". Biochim. Biophys. Acta 1830 (10): 4813–9. doi:10.1016/j.bbagen.2013.06.021. PMC 3790966. PMID 23811337.
12. Atanasov AG, Blunder M, Fakhrudin N, Liu X, Noha SM, Malainer C, Kramer MP, Cocic A, Kunert O, Schinkovitz A, Heiss EH, Schuster D, Dirsch VM, Bauer R (2013). "Polyacetylenes from Notopterygium incisum--new selective partial agonists of peroxisome proliferator-activated receptor-gamma". PLoS ONE 8 (4): e61755. doi:10.1371/journal.pone.0061755. PMC 3632601. PMID 23630612.
13.Wang L, Waltenberger B, Pferschy-Wenzig EM, Blunder M, Liu X, Malainer C, Blazevic T, Schwaiger S, Rollinger JM, Heiss EH, Schuster D, Kopp B, Bauer R, Stuppner H, Dirsch VM, Atanasov AG. Natural product agonists of peroxisome proliferator-activated receptor gamma (PPARγ): a review. Biochem Pharmacol. 2014 Jul 29. pii: S0006-2952(14)00424-9. doi: 10.1016/j.bcp.2014.07.018. PubMed PMID: 25083916.
14.Kroll TG, Sarraf P, Pecciarini L, Chen CJ, Mueller E, Spiegelman BM, Fletcher JA (August 2000). "PAX8-PPARgamma1 fusion oncogene in human thyroid carcinoma [corrected]". Science 289 (5483): 1357–60. doi:10.1126/science.289.5483.1357. PMID 10958784.
16. Michalik L, Auwerx J, Berger JP, et al.:International Union of Pharmacology.LXI.Peroxisome-Proliferator-activated-Receptors. In Pharmacol. Rev. 58,Nr.4 Dezember 2006.S.726-41.doi:10.1124/p.58.4.5., PMID 17132851
17.Berger J, Moller DE: The mechanisms of action of PPARs. In: Annu. Rev. Med. 53,202, S.409-35
18.Balakumar P, Rose M,Ganti SS, Krishan P, Singh M:PPAR dual agonists: are they opening Pandora`s Box? In Pharmacol. Res.. 56,Nr.2,August 2007,S.91-8doi:10.1016/j.phrs.2007.03.002. PM
19.Staels B, Fruchart JC: Therapeutic roles of peroxisome proliferator-activated receptor agonists. In: Diabetes. 54,Nr.8, August 2005, S.2460-70. doi:10.2337/diabetes.54.8.2460.PMID 16046315
20.Tenenbaum A, Motro M. Fisman EZ: Dual and pan-peroxisome proliferator-activated receptors (PPAR) co-agonism: the bezafibrate lesson. In:Cardiovasc. Diabetol. 4, 2005, S.14 doi:10.1186/1475-2840-4-14. PMID 16168052. PMC:1236941
21.Quintanilla R., Uteraras E, Cabezas-Opazo F., "Role of PPAR-y in the Differation and Function of Neurons", In: PPAR Research, 26.08.2014
22.Cavender MA, Lincoff AM: Therapeutic potential of aleglitazar, a new dual PPAR-Alpha/Gamma agonist: implications for cardiovascular disease in patients with diabetes mellitus(PDF) In:Am J Cardivascular Drugs. 10, Nr. 4 2010, S.209-16. doi:10:102165/11539500-000000000-00000. PMID 20653327
23.Henry RR, Lincoff AM, Mudaliar S,Rabbia M, Chognot C, Herz M: Effect of the dual peroxisome proliferator-activated receptor-alpha/gamma agonist aleglitazar on risk of cardiovascular disease in patients with type 2 dibetes (SYNCHRONY): a phase II, randomised, dose-ranging study. In: Lancet. 374, Nr. 9684, Juli 2009, S.126-35 doi:10.1016/S0140-6736(09)60870-9. PMID 19515415
24.Siersbæk MS, Loft A, Aagaard MM, Nielsen R, Schmidt SF, Petrovic N, et al. Genome-wide profiling of peroxisome proliferator-activated receptor γ in primary epididymal, inguinal, and brown adipocytes reveals depot-selective binding correlated with gene expression. Mol Cell Biol (2012) 32:3452–6310.1128/MCB.00526-12 PMC free article] PubMed] Cross Ref]
25.Nielsen R, Mandrup S. Genome-wide profiling of transcription factor binding and epigenetic marks in adipocytes by ChIP-seq. Methods Enzymol (2014) 537:261–7910.1016/B978-0-12-411619-1.00014-8 PubMed] Cross Ref]
26.Leask A., "The Contribution of Peroxisome Proliferator–Activated Receptor Gamma to Cutaneous Wound Healing", In: Adv Wound Care (New Rochelle), 03/2013
Fachbücher
8. Wiley Online Library Li Y, Qi Y, Huang TH, Yamahara J, Roufogalis BD (January 2008). "Pomegranate flower: a unique traditional antidiabetic medicine with dual PPAR-alpha/-gamma activator properties". Diabetes Obes Metab 10 (1): 10–7. doi:10.1111/j.1463-1326.2007.00708.x. PMID 18095947.
15.Robbins Basic Pathology,Chapter 20 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson. Philadelphia: Saunders. ISBN 1-4160-2973-7 8th edition.
Hilfreiche Websites
-http://en.wikipedia.org/wiki/PubMed#PubMed_identifier
-http://www.ncbi.nlm.nih.gov/
-http://www.sciencedirect.com/
-https://www.wikipedia.de/
Abbildungsverzeichnis
Bild 1: "Wirkungsweise des PPAR-Gamma im Körper." Süggeler, Ninon ; November 2014
Bild 2: "Vor- und Nachteile der Agonisten von PPAR-gamma bei Glioblastoma (GBM)." Tillenburg, Roxana ; November 2014