A Parkinson-kór kialakulásának gastrointestinalis háttere
Contents
Bevezetés
A Parkinson-kór (PK) egy, a középkorú és idős embereket érintő neurodegeneratív betegség, mely a központi idegrendszerben (KIR), pontosabban a mesencephalon substantia nigra pars compacta területén okozza a dopaminerg neuronok progresszív degenerációját, aminek következtében a betegekben zavart szenvednek az alapvető motoros funkciók. Leggyakoribb klasszikus tünetei a lelassult mozgás, a nyugalmi remegés, az izommerevség és az instabil testtartás. Megjelennek egyéb, nem motorikus tünetek is, mint az álmatlanság, a depresszió vagy az időskori demencia. (Jost , 2010)
A betegséghez társuló gastrointestinalis tüneteket is nagyon fontos megemlítenünk, ugyanis ezek már a motorikus zavarok és neurológiai elváltozások előtt megjelenhetnek. Ezt kihasználva lehetőség nyílhat a későbbiekben a nagyon korai stádiumban való diagnosztizálásra és ennek révén a hatásos kezelésre. Ezért ezen tünetek hátterének felderítése kiemelt figyelmet kapott az utóbbi években. Kutatások alapján jelenleg az a hipotézis áll fenn, hogy a Parkinson-kór nem központi idegrendszeri eredetű, hanem a perifériás idegrendszerből, méghozzá az enterális idegrendszerből indulnak ki a rá jellemző patológiás elváltozások. (Chung és Pfeiffer, 2021)
Patológiai háttér
A dopaminerg neuronok patológiás elváltozása működésbeli zavarokat okoz a motoros funkciókban, illetve a vagus ideg diszfunkciója is ebből következik. Ennek eredményeképpen az emésztőtraktus nervus vagus által beidegzett része (a nyelőcsőtől egészen a vastagbél kezdeti szakaszáig) sem működik megfelelően, gastrointestinalis tüneteket okozva. (Jost, 2010)
A PK hátterében abnormális képződményeket, méghozzá az úgynevezett Lewy-testeket is leírták, amelyek citoplazmatikus, kóros alfa-synuclein fehérjét tartalmazó aggregátumokként ismertek. Ezeket az aggregátumokat a központi idegrendszerben figyelték meg először, azonban ma már tudjuk, hogy perifériásan is megtalálhatóak. (Chung és Pfeiffer, 2021)
Az alfa-synuclein a szervezetben nem patogén formában is előfordul, szerkezetét tekintve egy 140 aminosavból álló fehérje. Olyan abnormális szerkezetváltozásokra is képes, aminek következtében az idegsejteken sejtről sejtre tovább tud terjedni,eközben modifikálja egyre több alfa-synuclein szerkezetét, és végül Lewy-testek képződéséhez vezet. A neuronok nagyon összetett sejtek, az alfa-synuclein továbbítását ez is nagyban segíti, különösen igaz ez a hosszú, többszörösen elágazó axonnal rendelkező idegsejtek esetében. A PK által érintett dopaminerg neuronok vizsgálata során kimutatták az egyéb endogén tényezők befolyásoló szerepét is. Például ilyen a magas mitokondriális aktivitásuk, illetve a citoplazmájukban a megemelkedett kálciumionszint, melyek szintén hozzájárulhatnak az alfa-snyuclein aggregációjához. (Liddle, 2018)
Anatómiai háttér
A perifériás idegrendszerhez tartozó enterális idegrendszer (EIR) és a központi idegrendszer közötti kapcsolatnak megfelelően az agy és a bélcsatorna szoros összefüggésben állnak.
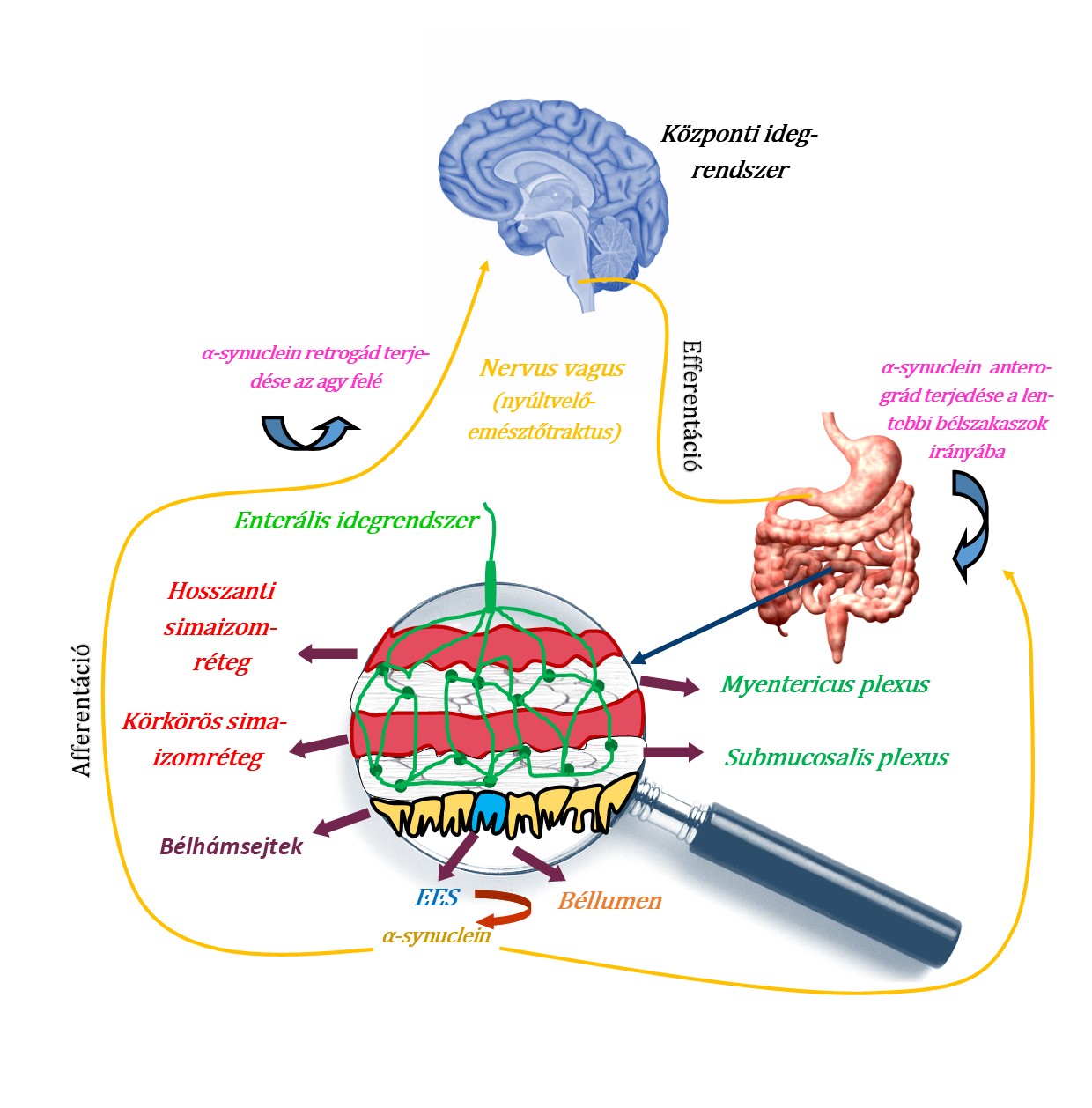
Ahogy azt az 1. ábra is prezentálja, az EIR bonyolult, összefonódó neuronhálózata két plexusba rendeződik. A mélyebben elhelyezkedő mienterikus plexus ( Auerbach-féle plexus) a bélcsatorna körkörös és hosszanti simaizomrétegeinek aktivitásátbefolyásolja. A béllumenhez közelebb eső submucosalis plexus ( Meissner-féle plexus) felelős a mucosalis szekrécióért és a vérkeringés szabályozásáért. A bélcsatorna motilitása ezen neuronhálózat segítségével szabályozható, (például helyi reflexek a bélfal összehúzódásának befolyásolására). Az irányításban fontos szerepük van még a neurotranszmitter anyagoknak, például simaizomgátlóként hat a VIP (vazoaktív intestinalis peptid) vagy serkentőként az acetilkolin. Relatívan kis mennyiségben az enterális dopaminerg neuronok a bélben is részt vesznek a visceromotoros szabályozásban. (Jost, 2010; Lebouvier és mtsai, 2009)
A plexusban a neuronok mellett enterogliasejteket (EGS) is találunk nagy mennyiségben, ezek borítják az idegsejttesteket és azok axonjait egyaránt. Az EGS-ek fő feladata a támasztás, mechanikai védelem, legújabb tanulmányok szerint hozzájárulhatnak a bélmozgások kialakításához és epitheliális barrier funkciójuk is jelentős. (Lebouvier és mtsai, 2009)
Az EIR afferens és efferens pályákon keresztül tartja a kapcsolatot a centrális idegrendszerrel. Tanulmányunk szempontjából a legfontosabb a paraszimpatikus nervus vagus, ez összeköttetést jelent a KIR és EIR között, rajta keresztül az kóros alfa-synuclein retrográd és anterográd irányban is képes továbbterjedni. A bélfalban találhatunk továbbá enteroendokrin sejteket (EES), amelyek képesek alfa-synucleint expresszálni. Ezek egyrészről a bél lumenével érintkeznek, másrészről különböző enterális neuronokkal is kapcsolatban állnak, így a hibás fehérjét továbbítani képesek. Alfa-synuclein kóros megváltozásának oka nem teljesen tisztázott, de szerepet kaphatnak benne a lumenben történő változások, mint például a különböző toxinok megjelenése. Az utóbbi évek kutatásai jelentős szerepet tulajdonítanak a bél mikrobiom-változásainak is. (Liddle, 2018)
|
1. ábra: A központi és az enterális idegrendszer kapcsolata a bélfal egy részletének felnagyításával |
Mikrobiomváltozás: ok vagy okozat?
A közelmúltban bebizonyosodott, hogy a bél mikrobiomjának összetétele eltér az egészséges egyének és a PK-s betegek között. Elmondható továbbá az is, hogy a PK-ral diagnosztizált betegek enterális idegeiben kiterjedtebb alfa-synuclein-felhalmozódás volt látható, illetve ezen kívül a bél mikrobióta összetétele korrelált a PK-tünetekkel. Arról azonban nem tudunk, hogy a betegek mikrobiomjában bekövetkező változások szerepet játszanak-e a kór patogenezisében vagy csak a betegség következményei: az a felvetés is napvilágot látott, hogy a bél mikrobái befolyásolják a PK kialakulását, azonban előfordulhat, hogy a kezelt betegek mikrobiomja az adott gyógyszerek hatására változik meg. (Sampson, 2018)
Erre a kérdésre Sampson (2018) egy egérmodellel próbálta megkeresni a választ, mely segítségével Parkinson-kórban szenvedő egyénekből vett mikrobiomot ültetett egerekbe. A vizsgálat eredményeként Parkinson-szerű motoros diszfunkció jelentkezett a beoltott egerekben. Abban az esetben, ha csíramentes egereket használt, melyek szervezetében nem élnek mikroorganizmusok, azt figyelte meg, hogy a bélben található baktériumok elengedhetetlenek az alfa-synuclein-rendellenességek megjelenéséhez, valamint a motoros funkciók csökkent működéséhez. Tehát a kísérletek eredményével bizonyítható, hogy a bélben élő mikroorganizmusok, illetve azok metabolitjai (pl. rövid láncú zsírsavak) szoros összefüggésben állnak a PK kialakulásával; azonban azok a mechanizmusok, melyek révén a bélbaktériumok hozzájárulnak az alfa-synuclein által kiváltott patogenezishez egészen komplexek.
Egy másik kísérletben Sampson és mtsai (2016) szintén a mikrobiom-PK-összefüggést vizsgálták. Ennek során alfa-synucleint túltermelő (ASO) egereket hasonlítottak össze „vad” típusú egerekkel. Ezen összevetéseket különböző korú állatokon végezték, tehát szerepet játszott az egerek bélrendszerében előforduló mikrobiom fejlettsége is. A teszt során az egereket különböző motoros funkciókat igénylő feladatoknak vetették alá. 12 hetes kor előtt a motoros működésben bekövetkező csökkenés nem volt jelentős. Mivel 12-13 hetes korban a mikrobiom fejlettségét tekintve komplex, így az ilyen idős ASO állatoknak szignifikánsan több időre volt szükségük az akadályok teljesítésére, mint a vad egyedeknek. Ezek után a két vizsgált csoportba tartozó egereket csíramentes környezetbe helyezték, ekkor az ASO egerek kevésbé teljesítettek rosszul, mint az előző alkalommal. A későbbi életkorban (24-25 hetesen) a normál körülmények között tartott ASO állatok csökkent motoros funkciót mutattak, amely visszaesés a vad egyedekben jelentősen késett. Nem volt megfigyelhető különbség azonban a motoros feladatokban azok közt a vad és az ASO állatok között, melyek csíramentes környezetben voltak tartva.
A mikrobiom összetételét tanulmányozva Han-Lin Chiang és Chin-Hsien Lin (2019) kimutatták, hogy egyes bélben található baktériumok (Verrucomicrobiaceae család, Akkermansia nemzetség és a Lactobacillusok) száma a betegségben szenvedőknél emelkedett volt, míg néhány típusú baktérium (Lachnospicaceae család, Prevotelleaceae család) száma ezzel szemben lecsökkent.
A PK összefüggésbe hozható a gyomorfekély és a gyomorrák kialakulását is elősegítő Helicobacter pylori kórokozóval is. A gyomorban megtelepedő, krónikus fertőzést okozó prokarióta szerepe a betegség patogenezisében még nem tisztázott, de legvalószínűbb, hogy a baktérium által kibocsátott toxinok a felelősek a negatív hatásért. (Han és Chin, 2019)
Lehetséges, hogy az enterogliasejtek is érintettek, ezen kívül a bél falában megtalálható enteroendokrin sejtek is kapcsolatba hozhatóak a PK patogenezisével. Ezek az alfa-snyuclein hibáit idézhetik elő, hiszen közvetlenül ki vannak téve a bélmikrobáknak, illetve azok metabolitjainak. A tudomány jelenlegi állása szerint nem egyértelmű az ok-okozati összefüggés a PK és a bélmikrobiom megváltozása között. Az viszont bizonyos, hogy a megváltozott mikrobiális viszonyok következtében megváltozott bélnedvösszetételt a kemoszenzitív enteroendokrin sejtek érzékelik, tehát ezen szempontból a bélmikrobiom egészséges keretek közötti működése igen fontos lehet. (Liddle, 2018)
Gastrointestinalis tünetek
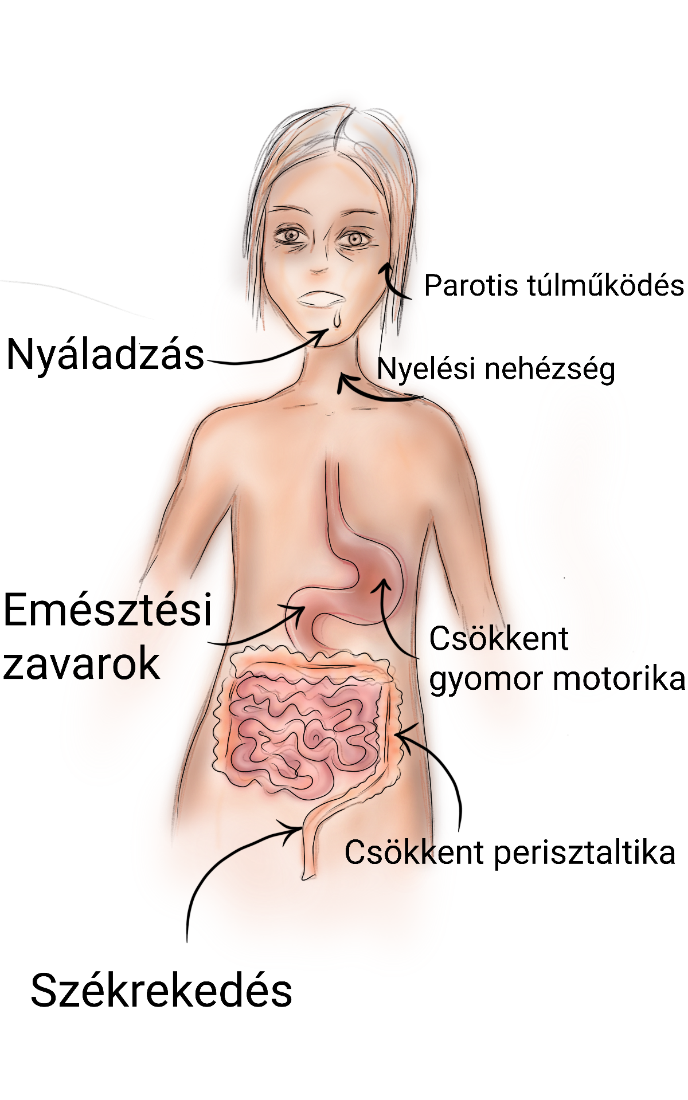
A betegek 30%-nál előfordulhatnak gastorintestinalis tünetek is, leggyakrabban székrekedés, émelygés, nyáladzás és hányás, amelyeket alább (2. ábra) szemléltettünk. A kutatások, illetve az eredmények alapján elmondható, hogy a Parkinson-kór eme tüneteit a bél elváltozásai okozhatják. Klinikailag a gyomor-bélrendszeri tünetek gyakran hamarabb megjelennek, mint a neurológiai tünetek, illetve minthogy alfa-synuclein-aggregátumokat találnának az idegsejtekben. (Sampson, 2018)
A Parkinson-kór tüneteként kialakulhat tehát nyáladzás (10-84%-ban fordul elő) mely a nyelési nehézségekkel, továbbá a glandula parotis túlműködésével hozható összefüggésbe; ezt az állapotot az önkéntelenül nyitva lévő száj helyzete is rontja. Megemlíthetők még az emésztési zavarok is, melyek szintén nagy százalékban fordulhatnak elő, főként az előrehaladott stádiumban lévő betegeknél. A gastroparesis, más néven gyomorizom-bénulás megjelenése 70-100%-os előfordulást mutat, amit a motoros funkciók csökkenése eredményez. Tehát a gyomortartalom félig történő kiürítésének az ideje jóval hosszabb, mint egy egészséges embernél; minél előrehaladottabb a betegség, annál több idő szükséges, hiszen az izmok egyre kevésbé képesek ellátni a feladatukat, a gyomorban lévő chymust keverni és üríteni. Nem meglepő tehát, hogy a betegségben szenvedő egyéneknél a székrekedés is jellemző tünet lehet, ugyanis a bél működésében kulcsfontosságú szerepet játszik a megfelelő perisztaltika; ha ez a továbbító mozgás kevésbé képes létrejönni a motoros diszfunkciók miatt, akkor a béltartalom ’elakad’, és így kialakulhat a székrekedés. (Han és Chin, 2019)
|
2. ábra: A Parkinson-kór esetén előforduló gastrointestinalis tünetek |
Nutritív hatások
A PK kialakulásában a genetikai tényezők mellett környezeti faktorok is szerepet játszanak. Több kutatás ezen a nyomvonalon vizsgálta a táplálkozás – mint az egyik legfontosabb környezeti behatás - szerepét a fent említett betegség előidézésében. Ez annál is inkább kulcsfontosságú, hiszen amennyiben szignifikáns összefüggés mutatható ki a kór kockázata és bizonyos étkezési szempontok közt, elsősorban a betegség megelőzésére helyezhető a hangsúly meghatározott táplálkozási szempontok betartásával.
A táplálkozás során felvett, az agy véráramába is bejutó különböző elemek a betegségben érintett dopaminerg neuronrendszerre is számottevő hatást gyakorolhatnak, persze nem elhanyagolható az egyéb tényezők (nem, fizikum stb.) figyelembe vétele sem – több kísérlet ezeknek a számba vételére is igényt fordított, melyeknek sokszor növelő (peszticidek, oldószerek, hím nem), máskor csökkentő (kávé, dohányzás, bizonyos vitaminok, edzés) behatásáról számoltak be a betegség kialakulásának kockázatára vonatkozóan.
Vitaminok és mikroelemek
Sherzai és mtsai (2016) több PK-ral kapcsolatos kutatás összesített eredményét vették számba a vitaminokra és mikroelemekre nézve.
Az A-vitamin fontos antioxidáns tulajdonságú, a látás mechanizmusában központi vitamin. Kész vitaminként állati eredetű termékekből (tejtermékek, hús), előalakjai, a különböző karotinoidok (alfa-, béta-karotin, béta-kriptoxantin) növényi táplálékból vehetők fel elsődlegesen. Mindkét formája egy komplex jelátviteli útvonal része, amely a KIR-ben a génexpresszióra gyakorol hatást. A retinoilsavak fő célpontja pedig a PK-ban jellemzően károsodott dopaminerg rendszer; annak homeosztázisáért felelősek ezek az A-vitamin-származékok. Egyértelmű összefüggés meglétét ennek ellenére a legtöbb kutatás cáfolta az A-vitamin – PK-kialakulás kapcsolata közt.
A C-vitamin-felvétel mennyisége igazoltan az oxidatív stresszbeli hatásától független módon növeli a PK kockázatát. Vízoldhatósága miatt a vér-agy gáton aktív transzporttal könnyen átjutva manipulálhatja az idegrendszeri folyamatokat.
Az E-vitaminnal, egy másik fontos természetes antioxidánssal kapcsolatos kísérletek legtöbbje a PK-kockázat erős csökkentését tulajdonította a vitaminnak. Ez viszont csak a táplálék által felvett vitaminra volt jellemző, a táplálékkiegészítőként alkalmazottra nem.
A B-vitamin-hiánnyal a homocisztein rendszeren keresztül a dopaminerg sejtek neurotoxikus úton való elhalását hozták összefüggésbe.
A D-vitaminnal összefüggésben bizonyos kutatások nem találtak korrelációt a betegség kialakulását tekintve, más vizsgálat viszont pl. a férfiaknál kifejezett kockázatnövekedést közölt le nagy mennyiségű tejtermék fogyasztása esetén.
A húgysav- mint a purin emberben való lebontásának végterméke- potenciális antioxidáns funkciójú: aszkorbátstabilizáló hatásának következtében segíti az oxidatív stressznek, ezen keresztül a neurodegenerációnak a megelőzését. Emiatt a tulajdonsága miatt a PK kockázatának csökkentését írták le róla mindenekelőtt.
A nyomelemek közül az egyik legfontosabb fémet, pl. a hemoglobin alkotásában is nélkülözhetetlen vasat is vonatkozásba hozták a PK-ral. S bár az összvastartalom és a betegség kialakulása közt nem találtak releváns kapcsolatot, a magas nem hem formájában felvett szervezetbeli vasszint jellemzőbbnek bizonyult a PK-s betegek közt, mint az alacsony nem hemalapú vasmennyiség-bevitel.
Probiotikumok
A probiotikumoknak a PK-ra irányuló hatását kutatva (Borzabadi és mtsai, 2018) egy 50-80 éves korosztálybeli csoportot vizsgáltak. A gyulladás, illetőleg az oxidatív stressz biomarkereire, illetve a gyulladás, a lipid- és inzulinmetabolizmus génexpressziós hátterére vonatkozólag szerették volna a probiotikumok hatását vizsgálni a PK-s betegekben. A részvétel kritériuma volt, hogy egyik tag sem szedhetett előzetesen probiotikumot, antiinflammatorikus szereket, nem dohányozhatott, szenvedhetett depresszióban, hypo-, hyperthyreoidismusban stb. A résztvevők sokszínűnek számítottak gyógyszeres kezelésüket, pontos korukat, BMI-jüket tekintve, s ugyanúgy a nemüket illetően is: férfiak és nők változatosan, random módon lettek összeválogatva, s ez alapján két csoportba osztva (25-25 fő). Az egyik csoport placebo csoportként működött a kísérletben, a másik ezzel szemben 12 hétig probiotikumok szedése alatt állt.
A tesztben a vérben lévő metabolitok (pl.glutation, mint az oxidatív stresszel kapcsolatos egyik fontos molekula) mérésének segítségével; limfocita kinyeréssel, annak örökítőanyag-vizsgálatával, majd ennek PCR-technikával megvalósuló elemzésével vizsgálták az anyagcsere- és génexpressziós változásokat.
Az eredmények a perifériás vérkeringés makrofágjaiban lévő IL-1, IL-8 (mint gyulladási faktorok) és a TNF-α (tumor nekrózis faktor) génexpressziós szinten való kifejeződésének csökkenését; míg a TGF-β mint multifunkcionális citokin, valamint a PPAG-ϒ (perixosome proliferator-activated receptor) növekedését tapasztalták a probiotikummal kezelt csoportnál a placebo-csoportéhoz képest. Az LDL-receptorokra ezzel szemben nem detektáltak a probiotikumok által előidézett hatást.
A PPAG-ϒ az inzulinérzékenység mellett a lipid- és szénhidrátmetabolizmusban is kulcsvegyület, probiotikumos kezelés révén való szintemelkedése emiatt is számottevő. Továbbá szintén bizonyított más neurodegeneratív betegségekben való jótékony hatása (pl. Alzheimer-kór). Fontos megemlítendő, hogy az inzulinjelpálya hatékonyságjavulásában a TGF-β is szerepet játszik.
Az omega-3 zsírsavak hatása
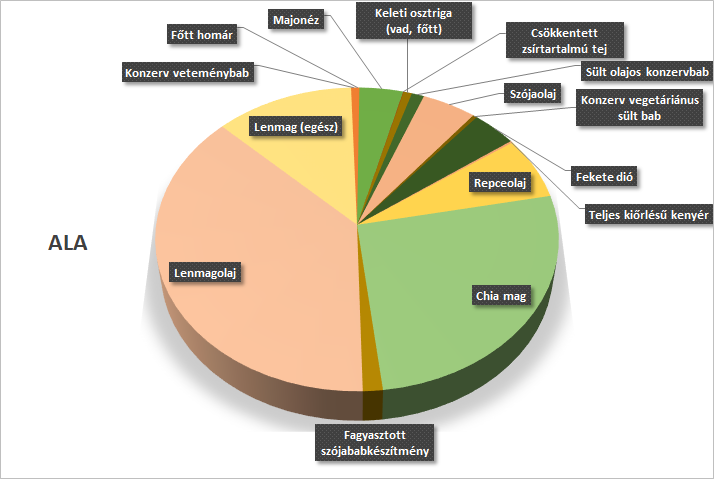
Egy másik kutatás alkalmával Avallone és mtsai (2019) a többszörösen telítetlen zsírsavak nutritív hatásait vizsgálták a PK-ban szenvedő betegekre nézve: mégpedig kimondottan az omega-3 típusú zsírsavakra irányult az elemzés. Ezek a vegyületek azért tekinthetők szintén számottevőeknek az idegrendszeri kórokra nézve, hiszen a membránfluiditáson át a sejtbeni jeltovábbbító rendszereken keresztül a génexpresszióig szerteágazó biokémiai folyamatokat befolyásolnak. A szinapszisok integritásának fokozása révén a legfelsőbb idegrendszeri irányítást szabályozhatják. Előzetesen kimutatták, hogy az agyban az arachidonsav (omega-6) és a DHA (omega-3) bizonyulnak a legjelentősebb PUFA-vegyületnek. Az utóbbit gyakorta membránalkotó foszfatidokba csomagolva találhatjuk meg (foszfatidil-szerin, -etanol-amin), ezáltal a szinaptikus végbunkók neurotranszmitter-kibocsátást moduláló tulajdonsággal rendelkezik. Emellett a mielinizációban és még sok egyéb központi idegi folyamatban is élenjáró szereppel rendelkezik. Az emberi szervezet csak telített vagy egyszeresen telítetlen zsírsavakat képes előállítani, omega-3-zsírsavakból a legtöbbet például nem, emiatt fontos azok táplálékkal való felvétele. A 3. ábra pl. az egyik nagy jelentőségű omega-3 zsírsav,az alpha-linolénsav különböző élelmiszerekben való mennyiségét szemlélteti. (Megjegyzendő, hogy az azonos omega csoportba tartozó zsírsavak egymásba átalakulni képesek az emberben enzimatikus folyamatok révén).
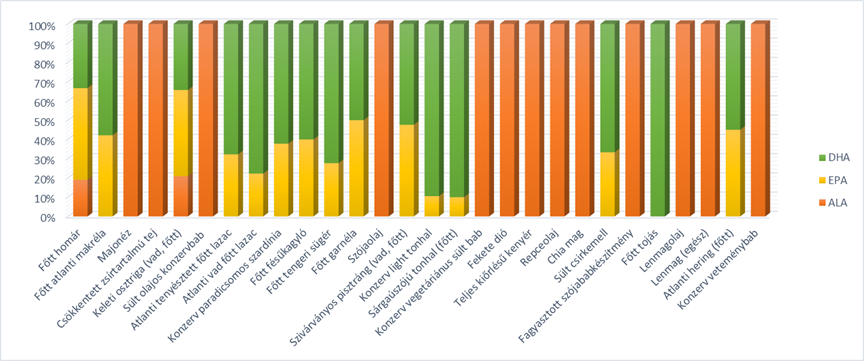
A kísérletben 6 hónapon keresztül a PK-os páciensek fele omega-3-zsírsavban bőséges diétát követett, a vizsgálati személyek másik fele placebo csoportnak számított. Arra az eredményre jutottak, hogy a fent említett, egyébiránt halolajból származó jótékony zsírsavakat nagy mennyiségben fogyasztók közt akár 50%-kal csökkent a depresszió kialakulásának esélye a placebo csoportéhoz képest, akik másfajta gabonaeredetű zsírsavakat vettek fel ez idő alatt. Ezzel egyértelmű pozitív hatását bizonyították ezeknek a molekuláknak, sőt többek közt azt is megállapították, hogy bár az állati eredetű olajok tűntek ilyen szempontból előnyösebbnek, a növényi olajok közül a lenmagolaj E-vitamin-fogyasztással kombinálva szintén jótékony hatásokkal rendelkezett a PK-os idegrendszeri tünetekre nézve. Továbbá az inzulinmetabolizmus, valamint az antioxidánstevékenység szervezetszintű aktivációfokozását is előidézte. A 4. ábra más és más állati és növényi eredetű termékeknek a különböző omega-3-zsírsav-tartalmáról és azok egymáshoz viszonyított arányáról ad számot.
|
3. ábra: α-linolénsav (ALA) - egy omega-3 zsírsav - tartalma különböző élelmiszerekben |
|
4. ábra: α-linolénsav (ALA), eikozapentaénsav (EPA) és dokozahexaénsav (DHA) aránya az ezeket tartalmazó élelmiszerekben |
Áttekintés
Napjainkban a Parkinson-kór gastrointestinalis hátterének jelentőségét érzékelteti az a tény, hogy a témában egyre nagyobb számban találunk tudományos publikációkat, illetve számos kísérlet és kutatás zajlik, hogy minél jobban feltérképezhessük a kór táplálkozással kapcsolatos részleteit. Ennek pontos megismerése kiszélesíthetné többek közt a kezelés eszköztárát, ezzel egy egészen új fejezetet nyitna a terápiás lehetőségek szempontjából. Bár már az is számottevő, hogy korábbi diagnosztizálásra adhat lehetőséget az emésztőrendszeri tünetek széleskörű monitorozása, de a betegség felismerése után egyaránt megnyilvánulhat a táplálkozás lényegessége: a témában született legnaprakészebb adatok segítségével összeállított speciális diéta segíthet akár az idegrendszeri károsodások késleltetésében is.
Forrás
- Avallone R.; Vitale G.; Bertolotti M. (2019): Omega-3 fatty acids and neurodegenerative diseases: new evidence in clinical trials. International Journal of Molecular Sciences 20: (17) 4256
- Borzabadi S.; Oryan S.; Eidi A.; Aghadavod E.; Kakhaki R. D.; Tamtaji O. R.; Taghizadeh M.; Asemi Z. (2018): The effects of probiotic supplementation on gene expression related to inflammation, insulin and lipid in patients with Parkinson’s disease: a randomized, double-blind, placebo-controlled trial. Iranian Medicine 21: (7) 289-295
- Chung K. A.; Pfeiffer R. F. (2021): Gastrointestinal dysfunction in the synucleinopathies. Clinical Autonomic Research 31: (1) 77-99
- Han L.C.; Chin H.S. (2019): Altered Gut Microbiome and Intestinal Pathology in Parkinson’s Disease. Journal of Movement Disorders. 12: (2) 67-83
- Jost W. H. (2010): Gastrointestinal dysfunction in Parkinson's Disease. Journal of the Neurological Sciences 289: (1-2) 69-73
- Lebouvier T.; Chaumette T.; Paillusson S.; Duyckaerts C.; Bruley des Varannes S.; Neunlist M.; Derkinderen P. (2009): The second brain and Parkinson’s disease. European Journal of Neuroscience 30: 735-741
- Liddle R. A. (2018): Parkinson’s Disease from the Gut. Brain Research 1693: (Pt B ) 201-206
- Sampson T.R.; Debelius J.W.; Tyron T.; Janssen S.; Shastri G.G.; Ilhan Z.E.; Challis C; Schretter C.E.; Rpcha S.; Gradinaru V.; Chesselet M.F.; Keshavarzian A.; Shannon K.M.; Brown R.K.; Stafshede P.W.; Knight R.; Mazmanian S.K. (2016): Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s. Cell 167: (6) 1469-1480
- Sherzai A. Z.; Tagliati M; Katherine P.; Pezeshkian S.; Sherzai D. (2016): Micronutrients and Risk of Parkinson’s Disease: A Systematic Review. Gerontology and Geriatric Medicine 2: 1-11
Ábrajegyzék
- Saját, Lebouvier és mtsai (2009) alapján
- Saját, Han és Chin (2019) alapján
- Saját, Avallone és mtsai (2019) alapján
- Saját, Avallone és mtsai (2019) alapján