Itt írjon a(z) Parkinson_Darmtrak-ról/ről
Beginnt die Parkinson-Krankheit im Darmtrakt?
Contents
- Beginnt die Parkinson-Krankheit im Darmtrakt?
- Einleitung
- Pathologische Merkmale der Parkinson-Krankheit
- Darmbakterien
- Prä-Parkinson-Krankheit
- Auslöser Darm-Hirn-Schranke
- Faktoren bei der Pathogenese von Parkinson und Magen-Darm-Erkrankungen
- Auswirkung von COVID-19 auf die Parkinson-Krankheit
- Quellenverzeichnis
- Abbildungsverzeichnis
Einleitung
Mehr und mehr wird von der Wissenschaft bestätigt, dass ein enger Zusammenhang zwischen Darmtrakt und Gehirn besteht. Die Parkinson-Krankheit ist ein Beispiel von vielen für die Verbindung der beiden Organe. Wissenschaftlichen Artikeln zufolge gibt es zahlreiche Studien, die belegen, dass fehlgefaltete Proteine aus dem Verdauungstrakt sich ins Gehirn ausbreiten. Die Theorie, dass die Parkinson-Krankheit im Darmtrakt beginnt, ist jedoch nicht vollständig belegt. Es besteht definitiv die Notwendigkeit auf diesem Gebiet weiterhin zu forschen, da die Krankheit einen Großteil der Bevölkerung betrifft.
Pathologische Merkmale der Parkinson-Krankheit
Alpha-Synuclein-Aggregate, Lewy-Körperbildung und der Verlust von dopaminergen Neuronen in der Substantia nigra sind pathologische Merkmale der Parkinson-Krankheit.
Alpha-Synucleine
Im physiologischen Zustand bei denAlpha-Synucleine werden aus den Proteinen unlösliche Fibrillen phosphoryliert und entwickeln sich zu einem Teil der pathologischen Struktur. Einerseits können Alpha-Synuclein-Aggregate eine Schutzfunktion aufweisen und andererseits sind prä-fibrilläre Alpha-Synucleine toxisch, diese können GI-Entzündungen auslösen. Aktuell wird mit Hilfe verschiedener Modelle untersucht, wie sich die Alpha-Synucleine pathologisch verändern, verbreiten und anlagern können. Umstritten ist auch die Frage welche Rolle die Alpha-Synucleine bei Darmbeschwerden haben. Es wird aber vermutet, dass eine größere Ansammlung an Alpha-Synucleinen sich negativ auf den Stuhlgang auswirkt und die Darmpassage verlangsamt. (Harsanyiova et al., 2020)
Lewy-Körperchen
Es wird davon ausgegangen, dass sich die Proteinstrukturen der Lewy-Körperchen in Fibrillen umwandeln und sie nach ihrer Entstehung noch weiter ihre Form verändern und auch Zellorganellen wie Mitochondrien miteinbinden, wodurch blasenartige Einschlüsse sichtbar werden. Es wird vermutet, dass auch weitere Proteine in diesen Einschlüssen eingebunden werden und es zu einer fehlerhaften Energieversorgung durch die Mitochondrien kommt. Dies hat weitere Folgen auf die Funktionsweise der Signalwege und wirkt sich neurodegenerativ auf die Nervenzelle aus. (Mahul-Mellier et al., 2020)
Dopaminerge Neuronen
Die Überexpression von Alpha-Synuclein bewirkt die Degeneration von dopaminergen Neuronen was zu motorischen Einschränkungen führt. (Chao et al., 2020b) Es wird vermutet, dass im Dopaminstoffwechsel Störungen auftreten, wobei es zur Entstehung von 3,4-Dihydroxyphenylacetaldehyde (DOPAL) kommt. DOPAL ist sehr reaktiv und führt zur Veränderung von Proteinresten, wodurch sich die Anlagerungen erhöhen, und der oxidative Stress steigt. Es gilt zu erwähnen, dass DOPAL auch auf die Alpha-Synuclein Oligomerisierung fördernd wirkt. Das bedeutet: Je mehr Dopamin in die Zelle eintritt, desto höher ist die DOPAL-Produktion, welche wiederum durch seine Funktion in der Zelle zu Fehlfunktion und Zelltod führt. (Masato et al., 2019)
Darmbakterien
Helicobacter pylori
Helicobacter pylori steht im Zusammenhang mit unterschiedlichen Erkrankungen, wie Gastrointestinal-, Lebererkrankungen und Mangelerkrankungen von Vitamin B12 und Eisen. Auch die Verbindung zu PD (Parkinson-Disease) wurde Helicobacter pylori nachgewiesen mit Hilfe von Metaananalyse. (Santos et al., 2020) Obwohl die genauen Zusammenhänge und Ursachen noch nicht vollständig geklärt sind, wurde mit vergleichenden Versuchen herausgefunden, dass in Patienten, die an PD erkrankt sind, eine erhöhte Konzentration des Darmbakteriums zu finden ist. Die Symptome von Parkinson-Patienten verbessert sich bei der Behandlung des Darmbioms und Reduzierung der Helicobacter pylori. Obwohl Helicobacter pylori verschiedene Toxine produziert, ist der genaue Zusammenhang zu PD nicht ganz klar. (McGee et al., 2018)
Prä-Parkinson-Krankheit
Vor Ausbruch von Parkinson gibt es mehrere Marker und Krankheiten, die ihm vorausgehen. Deshalb ist es wichtig zu verstehen, wie die Kommunikation zwischen dem Gastrointestinaltrakt (GIT) und dem Zentralnervensystem (ZNS) abläuft und wie man die möglichen Frühsymptome und Marker erkennen kann.
Gastrointestinale Erkrankungen spielen wichtige Rolle
Da das gastrointestinale System sehr dicht mit dem ZNS verbunden ist, können gastrointestinale Erkrankungen das ZNS durch verschiedene Faktoren beeinflussen. Die Bedeutung liegt darin, die beeinflussenden Faktoren zu erkennen und ihre Wirkungsweise zu verstehen, um wichtige Schlussfolgerungen und Erkenntnisse über ihre Wirkungsweise im ZNS zu erlangen.
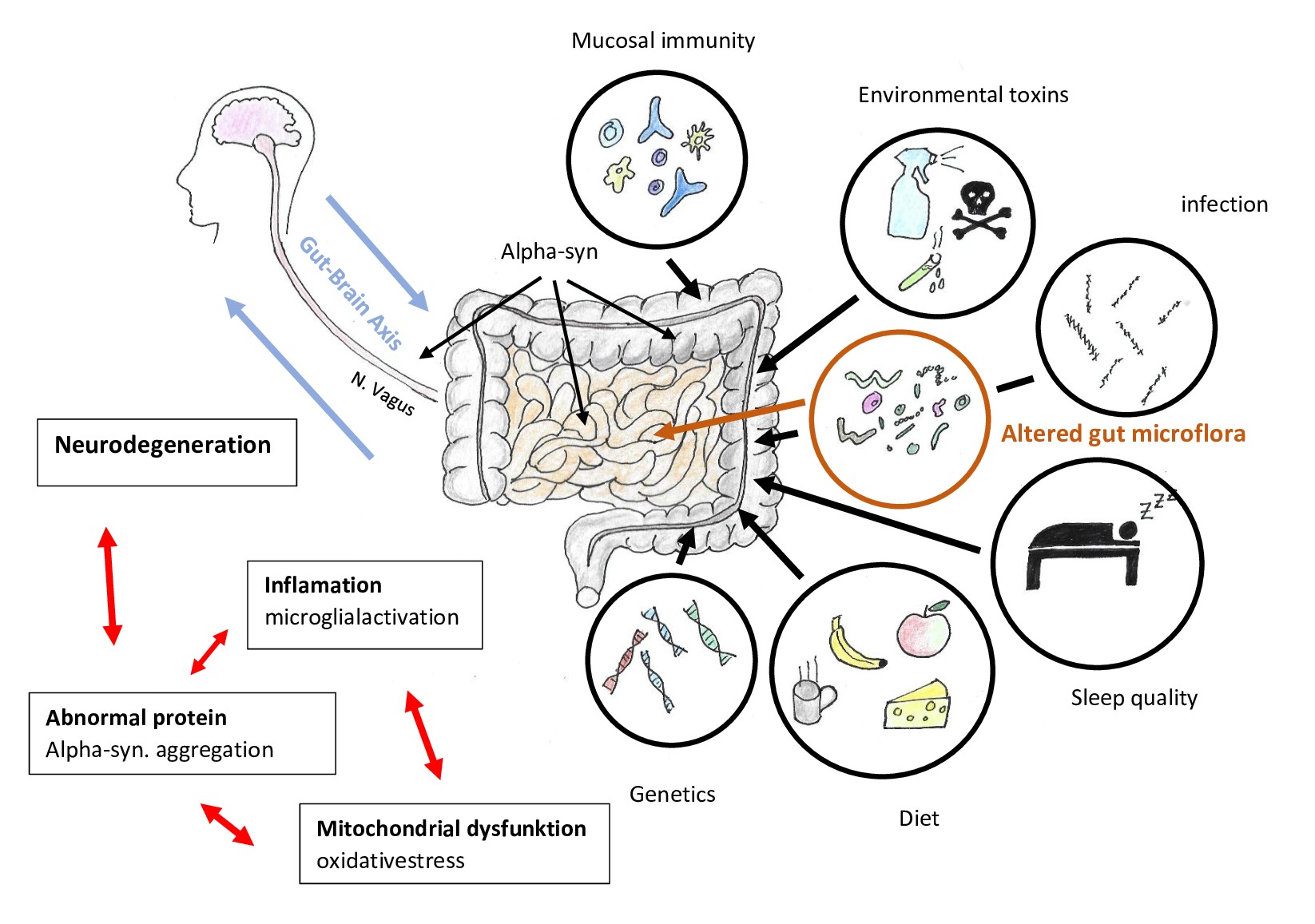
Abbildung 1 |
|
Braak´sches Dual-Hit Modell |
Braak´sches Dual-Hit Modell
Das sogenannte Braak´sche Dual-Hit Modell wird sehr häufig im Bezug mit Parkinson erwähnt. Heiko Braak, ein Neuroanatom aus Frankfurt, hat durch zahlreiche Untersuchungen an obduzierten Leichen eine Reihe an Erkenntnissen formuliert. Hierfür studierte er neuronale Veränderungen in den wichtigsten Organen bezüglich PD. Er untersuchte das Gehirn, das olfaktorische System und das Verdauungssystem vor allem durch die Reaktion auf Alpha-Synuclein. Darüber hinaus stellte er Vergleiche bezüglich des Schweregrades der Parkinson Erkrankung und den Post-Mortem-Befunden in den wichtigsten Organsystemen her. Er bezieht sich außerdem auf die mittlerweile anerkannte Nox/Agens Hypothese und beschreibt den Verlauf dieser vom gastrointestinalen Trakt ausgehend (Abbildung 1). So gehen die Nox/Agens von dem Darmtrakt über das olfaktorische System schließlich zum ZNS. Daraufhin beschreibt er, dass sich neuronale Schädigungen in den Organen manifestieren und darüber hinaus in direkter Verbindung zu prämotorischen Symptomen von PD, sowie den Stadien von der Lewy-Körper-Demenz stehen. Als Schlussfolgerung seiner Erkenntnisse teilt er idiopathisches Parkinson-Syndrom (IPS) in 6 Stadien ein. Braak beschreibt, dass erste klinische Symptome für PD zwischen Stadium 3 und 4 auftreten und sich bereits dort in Teilen des Vorder- und Mittelhirns schwere Schäden bilden und die Hirnrinde bereits erste Veränderungen aufweist. (Holz, 2019)
Prodromalphase
Die Prodromalphase ist von nicht unerheblicher Wichtigkeit in Bezug auf eine mögliche Früherkennung der Parkinson Erkrankung. Diese Phase bezieht sich auf nicht-motorische Symptome im Zusammenhang mit Parkinson. Wenn die sogenannten prämotorischen Symptome vor den eigentlichen motorischen Symptomen auftreten, bezeichnet man diese als Prodromalmarker. Diese Marker sind bereits durchschnittlich 10,2 Jahre vor der IPS erkennbar, welche in der Phase die Zerstörung von Neuronen im wichtigsten motorischen Zentrum anzeigen, der Substantia nigra. Anfangs kommt es nicht unbedingt zur Ausbildung motorischer Symptome aufgrund von weniger kranken als gesunden Neuronen, die die Funktion der Substantia nigra gewährleisten. Zu den prämotorischen Symptomen zählen Gedächtnisprobleme, Despression, autonome Regulationsprobleme, sowie Störungen des REM Schlafes. Zu der Prodromalphase können auch leichte motorische Auffälligkeiten gezählt werden, wie milde motorische Defizite und ein reduzierter Armschwung. Hier können auch die Agens/Noxen bereits nachgewiesen werden. Die Prodromalmarker haben allerdings auch Defizite bezüglich der Früherkennung von Parkinson, wie unspezifische Symptome und die Tatsache, dass einige der Symptome auch bei Menschen auftreten können, die kein Parkinson bekommen. Laut einer Studie von Alexandra Gaenslen et al., konnte allerdings beobachtet werden, dass Probanden, die an IPS erkrankten, in der Regel mehrere Prodromalmarker-Symptome aufweisen. (Harsanyiova et al., 2020)
Beteiligung vom mukosalen Immunsystem
Das mukosale Immunsystem ist eines der bedeutendsten Immunsysteme im gesamten Organismus. Es gilt als umfangreichste Umwelt-Wirt-Schnittstelle im Körper und hat deshalb eine relativ hohe Antigenbelastung. Das mukosale Immunsystem ist ständiger Ernährungsumstellungen, daraus resultierenden Begleiterkrankungen, und Krankheitserregern ausgesetzt. Die wichtigsten Bestandteile dieses Immunsystems sind das GALT, sowie die Epithelbarriere. Darüber hinaus auch die Peyer´schen Platten, lymphoide sowie auch mesenteriale Follikel. Diese Abteilungen des Immunsystems bestehen aus bedeutenden Zellkomponenten, wie den dendritischen Zellen, Makrophagen, entzündungshemmende Zytokine, intraepitheliale Lymphozyten und den B- und T-regulatorischen Zellen. Das GALT nimmt eine besondere und einzigartige Rolle in der PD Pathogenese ein, da sie durch die enge Monoschicht eine physikalische Barriere bildet und IgA und antimikrobielle Peptide enthält. Dadurch ist sie eines der wichtigsten Bestandteile des Immunsystems, welches ein Eindringen von Keimen und Bakterien verhindert. Falls es zu einer Beschädigung der Monoschicht kommt, kann es zu einer epithelialen Dysfunktion kommen, welches zu einer Veränderung von Proteinen der Tight-Junctions, ZO-1-, und Occludin führt. Des Weiteren kann es zu einer gestörten Signalübertragung von T-Zellen kommen. Belegt werden diese Annahmen durch Biopsien aus dem Kolon von PD Patienten. Bei den Colon Biopsien konnte man außerdem einen erhöhten Entzündungswert mit einer erhöhten Konzentration an proinflammatorischen Molekülen finden (IL-5, IFN gamma, IL-1ß, TNF). Die ursprüngliche Aufgabe des Immunsystems, also das Aufrechterhalten einer Homöostase, vor allem durch Antikörper produzierende Zellen und regulatorische B-Zellen, sogenannte Bregs, sowie Immunabwehr und Entzündungskontrolle wird dadurch massiv gestört. Die gestörte Produktion und Funktion der Zytokine ist sehr problematisch. Zytokine sind allgemein entzündungshemmend und sind für die Reaktion, Migration, Differenzierung und Reifung der Zellen zuständig. Eine wichtige Beteiligung eines geschwächten mukosalen Immunsystems und eine dadurch resultierende Gastrointestinaltrakt-Entzündung ist bereits in den ersten Stadien der Parkinson-Krankheit belegt worden. Allerdings ist bis heute noch ungeklärt, welche Moleküle dadurch aufsteigen können. (Chao et al., 2020)
Früherkennung durch Darmuntersuchungen als Zukunftsperspektive
Die größte Hoffnung in der präventiven Behandlung von Parkinson liegt in der Früherkennung, um das Voranschreiten der Krankheit zu unterbinden oder sogar komplett entgegenzuwirken. Durch die Untersuchungen zur Verbindung zwischen dem GIT und dem ZNS liegt es nahe, dass man versucht bestimmte Parameter festzulegen, um durch bestimmte Darmuntersuchungen eine Früherkennung der Krankheit zu gewährleisten. Hierzu lässt sich sagen, dass das Mittel der Wahl zur Untersuchung auf diese Parameter nach neusten Erkenntnissen eine Biopsie der Enterozyten darstellen sollte. Bei einem gestörten Mikrobiom kann es bereits zu einer lokalen Immunantwort kommen, welche weitergehend die Schleimhautbarriere schwerwiegend stören kann. Eine Folge hieraus ist eine Entzündungsreaktion und somit kann das Aufsteigen von Partikeln und Stoffen aus dem Darm erleichtert werden. Des Weiteren kann eine gesteigerte Expression von Glia-Markern und entzündlichen Zytokinen Aufschluss über das Vorhandensein und auch über den Fortschritt der Krankheit geben. So wurde deutlich, dass je weiter die Krankheit fortgeschritten ist, auch die Expression weiter gestiegen ist. Ein weiterer Faktor, der bei einer Biopsie untersucht werden sollte, ist das Bakterium Helicobacter pylori, dessen Konzentration bereits 8-10 Jahre bevor es zum Ausbruch von PD kommt, erhöht ist. Das Bakterium Enterobacteriaceae kann auch Aufschluss geben, da es im Zusammenhang mit den motorischen Symptomen steht und im Fall einer bevorstehenden Erkrankung signifikant erhöht ist. Ein niedriger Prevotellaceae Spiegel in der Biopsie weist auf eine erhöhte Darmpermeabilität hin, sowie einen Vitamin B1 und B9 Mangel, welche eine Parkinson Erkrankung deutlich begünstigen. Darüber hinaus sollte auf einen niedrigen Lactobacillaceae Spiegel geachtet werden, da es entzündungshemmend wirkt und bei einer niedrigen Konzentration zur Entwicklung von Entzündungsprozessen kommen kann. Eine erniedrigte Konzentration von Lachnospiraceae, Lactobacillaceae und Prevotellaceae kann eine Senkung der neuroprotektiven Funktion bewirken, da diese die Konzentration von Ghrelin und den Spiegel von kurzkettigen Fettsäuren senken. In bestimmten Geweben kann außerdem pathologisches Alpha-Synuclein nachgewiesen werden. Hierfür ist noch nicht gänzlich geklärt, welches Entnahmeorgan sich am besten für diese Untersuchung eignet. (Harsanyiova et al., 2020)
Auslöser Darm-Hirn-Schranke
Aufgrund der Verbindung des ENS und ZNS ist es wichtig die genaue Verbindung zu erläutern und zu verstehen, damit die verschiedenen Auslöser der Parkinson-Krankheit besser aufgefasst werden. Die Gut-Brain-Axis(GBA) ist ein Kommunikationsnetzwerk zwischen ZNS und Darm, welches sehr komplex und bidirektional ist. Die Barrierefunktion besteht aus physikalischen Barrieren, durch Tight Junctions zum Beispiel, und einer Kombination mit Transporter Prozessen für bestimmte Stoffe, die diese Schranke sonst nicht überwinden könnten. Darüber hinaus gibt es dort auch eine Stoffwechselbarriere, welches Enzyme beinhaltet, die Stoffe beim Transport metabolisieren können. Spezifische Transporter und Ionenkanälesorgen dafür, dass die Ionenzusammensetzung im ZNS für die synaptische Signalfunktion optimal ist. Die GBA unterbindet außerdem den Transport von Neurotoxinen und Makromolekülen, um das ZNS vor toxischen oder neurodegenerativen Prozessen zu schützen. Permeabel ist die Schranke allerdings für wasserlösliche, essenzielle Nährstoffe sowie Metaboliten. Dies geschieht teilweise durch passiven Transport oder bestimmte Transporter Systeme.(Abbott et al., 2010) Inhalt dieser Achse ist unter anderem auch das enterische und autonome Nervensystem, sowie das endokrine System und die Hypothalamus-Hypophysen-Nebennieren-Achse. Auch das Mikrobiom, deren Metaboliten, sowie das Immunsystem spielen eine wichtige Rolle in der GBA. Die wichtigsten Stoffe, die auf dem Weg zur Schranke zu finden sind, sind Neurotransmitter, essentielle Aminosäuren, Vitamine, Metaboliten, kurzkettige Fettsäuren und sekundäre Gallensäure. Diese Stoffe können wiederum viele Funktionen des ZNS beeinflussen, wie zum Beispiel das Verhalten, jedoch können sie in bestimmten Konzentrationen und Verhältnissen an neurodegenerativen Störungen mitwirken. (Rutsch et al., 2020)
Der Weg vom Darm zum Gehirn
Im Organismus gibt es verschiedene Neurosysteme, die in Zusammenhang stehen. Bei den afferenten Neuronen kann man zwischen vagale, spinale und intrinsische Neuronen unterscheiden. Zu den efferenten Neuronen gehören sympathische und parasympathische Neuronen. Der GIT und das Gehirn kommunizieren über Zytokine, Hormone und neuronale Signale. Deshalb können emotionale und kognitive Vorgänge im Darm das Gehirn beeinflussen, genauso wie eine Dysbiose des Mikrobioms oder die Aktivierung desSchleimhaut-assoziierten-Immunsystems (MALT). Eine weitere bedeutende Verbindung stellt die Ähnlichkeit der Neurotransmitter und Transmitterrezeptoren im Gehirn und GIT dar. Zu erwähnen sind hier Neuropeptide, Stickstoffmonoxid (NO) sowie Acetylcholin, wodurch das ZNS Verdauungsprozesse steuern kann. Ein bedeutender Faktor ist auch die Rolle der Mediatoren, die zentrale Funktionen im Darmtrakt regulieren wie die Motorik, Sekretion, Durchblutungssteuerung der lokalen Abschnitte und Regeneration gestörter Barrierefunktionen. Zu erwähnen sind hier noch die grundlegenden Aufgaben des efferenten Schenkels der parasympathischen und sympathischen Neuronen, welche für die Signalübertragung vom ZNS zum GIT zuständig sind. (Bückendorf, 2016)
Faktoren bei der Pathogenese von Parkinson und Magen-Darm-Erkrankungen
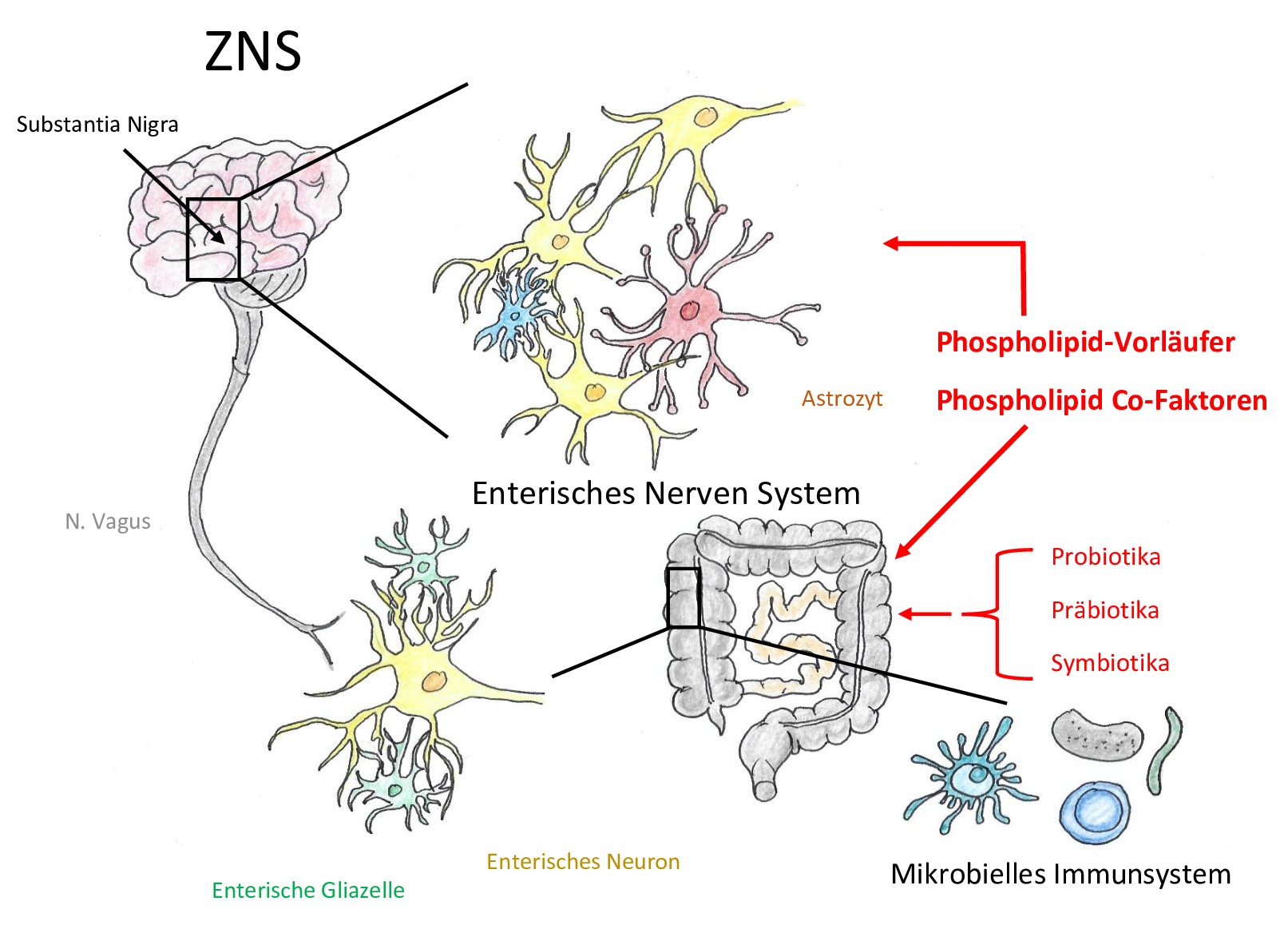
Abbildung 2 |
|
Diätetische Eingriffe beeinflussen die neuronale Funktion im ENS und ZNS |
Ernährung
Schon Hippokrates machte darauf aufmerksam, wie wichtig die Ernährung in Bezug auf Vorbeugung und Behandlung verschiedenster Krankheiten ist, deshalb sagte er damals schon: „Die Nahrung sei deine Medizin, und die Medizin sei deine Speise“. Die Wissenschaft kann dies heutzutage nur bestätigen. Die Ernährung lässt sich als Risikofaktor bei der Entwicklung der Parkinson-Krankheit einordnen und kann aber auch im Gegenzug als therapeutischer Ansatz zur Behandlung beitragen. Darmbakterien, bakterielle Metabolite und Hormone im Darm beeinflussen neurodegenerative Prozesse, daher können Veränderungen der Darm-Mikrobiota Struktur durch diätetische Methoden die Pathogenese der Parkinson-Krankheit verändern. (Jackson et al., 2019) Nahrung Phospholipid-Vorläufer (Ausgangsstoffe) und Cofaktoren können die Funktion und Bildung der neuronalen Membran erhöhen, was wiederum Entzündungen hemmt und positive Wirkungen auf das ENS und ZNS hat. Präbiotika, Probiotika und Synbiotika können die Integrität des Darmepithels fördern, die Zusammensetzung der Darm-Mikrobiota (Darmflora) verbessern und auch Entzündungen minimieren (Abbildung2). Die drei Lebensmittelzusätze können eine bedeutende Wirkung erzielen, indem sie die Entwicklung des neurodegenerativen Prozesses beeinflussen. Zu den Phospholipid-Vorstufen gehören Uridin(UMP), Docosahexaensäure (DHA), Omega-3-Fettsäuren und Cholin. Diese Substanzen dienen der Funktion neuronaler Membran und erhöhen die Substratsättigung der Enzyme, die für die Phospholipid-Synthese notwendig ist. Phospholipid-Vorläufer werden zum Großteil aus dem Kreislauf gewonnen, jedoch könnte man durch Ernährung diese Menge positiv anregen. Cofaktoren wie Vitamin B, C, E und Selen können in der Phospholipid-Synthese die Produktion der Membranvorläufer erhöhen, indem sie deren Aufnahme und den Stoffwechsel verstärken.(Perez-Pardo et al., 2017)
Die Mittelmeer-Diät kann in vielerlei Hinsicht das Risiko der Parkinson-Krankheit vermindern. Wenn man die westliche Ernährung mit der mediterranen vergleicht, ist der größte Unterschied wohl die Aufnahme von Ballaststoffen. Die westliche Bevölkerung nimmt sehr wenig Ballaststoffe zu sich – genauer gesagt unter 10-15g/Tag. Im Gegensatz zur mediterranen Diät, wo der Ballaststoffanteil bei 25-30g/Tag liegt. Das Mikrobiom bei Personen mit mediterraner Ernährung ist durch eine hohe Fülle an Bakterien gekennzeichnet, die Fasern als Energiequelle nutzen können, wie zum Beispiel die SCFA (Kurzkettige Fettsäuren) -produzierenden Bakterien. Tatsächlich werden Mikrobiota-Gemeinschaften von Probanden, die eine Mittelmeerdiät konsumieren, mit SCFA-produzierenden Bakterien angereichert. Zusätzlich wird eine ballaststoffreiche Diät die Darmbarrierefunktion und die Insulinresistenz verbessern. Wenn jedoch der Faserverbrauch gering ist, wird Eiweiß als Energiequelle genutzt, das wiederum das Wachstum von gram-negativen Bakterien (Dysbiose) und die Bildung von Metaboliten wie verzweigtkettige Fettsäuren einschließlichIsovaleratund 2-Methylbutyrat, die mit Insulinresistenz in Verbindung stehen, begünstigt. Neben den Ballaststoffen zeigt die mediterrane Diät auch Vorteile in Bezug auf die Aufnahme von antioxidativenFlavonoidenund Polyphenolen in Lebensmitteln. Es liegt ebenfalls die Vermutung vor, dass der Konsum von Flavonoiden zur Erhöhung der SCFA-Produktion beiträgt. Polyphenol-Flavonoide, die in Kaffee und Fischöl enthalten sind, werden in Verbindung mit der Hemmung des NLRP3-Inflammasoms gebracht. Aus diesen Informationen geht hervor, dass eine mediterrane Ernährung auf die Entwicklung der Parkinson-Krankheit durchaus positiv einwirkt. Es ist allgemein bekannt, dass diese Ernährung die Mikrobiota auf eine bestimmte Art und Weise verändert, die die SCFA-Produktion begünstigt. SCFA fördert relevante Mechanismen wie die Mitochondrien-Funktion, die NLRP3- und intestinale Peptid Produktion und die Barrierefunktion für die Parkinson-Krankheit. (Jackson et al., 2019)
Des Weiteren geben das intermittierende Fasten und eine Kalorienbeschränkung große Versprechungen in Bezug auf entzündungshemmende Prozesse. Intermittierendes Fasten ist eine Ernährungsform, bei der in bestimmten Perioden gefastet wird und in anderen eine normale Nahrungsaufnahme herrscht. Dieses Fütterungsregime führt in Tiermodellen zur Kenntnis, dass Tiere mit eingeplanten Fastenzeiten eine höhere Lebenserwartung und ein geringeres Risiko an altersbedingten Erkrankungen zu erwarten haben. Nager, die intermittiert fasten, zeigen im Vergleich zu Nager mit konventioneller Ernährung auch seltener neurale Dysfunktionen und weniger Symptome, die der Parkinson-Krankheit ähneln. Diese Effekte sind höchstwahrscheinlich auf die Ketose zurückzuführen. Im Fettstoffwechsel können neurotrophe Faktoren wie der Wachstumsfaktor BDNF („Brain-derived neurotrophic factor“) und die Antioxidantien-Konzentration erhöht werden und zusätzlich wird die proinflammatorische Produktion von Zytokinen reduziert. Ketonkörper werden durch das Fasten und eine ketogene Diät (55-60% Fett, 30-35% Eiweiß, 5-10% Kohlenhydrate) gebildet. Dieser Prozess beginnt erst, wenn der Glukosespiegel für eine längere Zeit niedrig ist und die Ketogenese zur pimären Energiegewinnung eingesetzt wird. Ketonkörper zeigen bei Tiermodellen und Menschen mit Parkinson-Krankheit viele Vorteile in Bezug auf Hyperketonämie und der positiven Wirkung auf das NLRP3-Inflammasom, deren Aktivität durch Fasten gehemmt wird. Intermittierendes Fasten kann die sekundäre Gallenproduktion anregen und die Darmbarrierefunktion fördern, indem das Mikrobiom umstrukturiert und mehr SCFA produziert wird. Ernährung ist ein weitaus umfangreicheres Themengebiet als es im Zuge dieser Arbeit dargestellt wurde. Beispielsweise ist der Verzehr von mehrfach ungesättigten Fettsäuren auch sehr wichtig in Bezug auf Neurodegeneration bei Parkinson, aber das würde über das Ziel hinausgehen. (Jackson et al., 2019)
Umweltgifte
Umweltgifte wie Pestizide stellen für viele Krankheiten ein erhöhtes Erkrankungsrisiko dar, so auch für die Parkinson-Krankheit. Eine Metaanalyse von über 30 Studien mit beruflicher Exposition zu Pestiziden zeigt Zusammenhänge mit den Risikofaktoren der Parkinson-Krankheit. In Tiermodellen induzierenEndotoxine von LPS das Absterben von dopaminergen Neuronen. (Chao et al., 2020) Braaks Theorie unterstützte die Tatsache, dass ein mögliches Toxin/Pathogen aus der Umwelt über den Magen-Darm-Trakt oder die Nase in den Körper gelangt und über den Nervus Vagus ins Gehirn wandert. Um Braak´s Theorie nochmals zu befürworten, werden agrochemische Stoffe wie Pestizide, Herbizide und Metalle durch Inhalation in den Körper gebracht. Diese Substanzen lösen als Initiator weitere Entzündungen und Funktionsstörungen aus. Das führt wiederum zu Alpha-Synuclein-Ablagerungen und Dopamin-Anreicherung. Der Nachweis von dem Zusammenhang zwischen Agrochemikalien und Parkinson stellt sich als problematisch heraus, da solche Studien eine lange Latenzzeit (15-20 Jahre) zwischen Exposition und dem Auftreten von Symptomen beanspruchen. (Chao et al., 2020)
Auswirkung von COVID-19 auf die Parkinson-Krankheit
Die Virusinfektion, die von einem neu entdeckten Coronavirus ausgelöst wird, verursacht seit 2019 weltweite Krisen. Die Infektionskrankheit kann ein Ungleichgewicht der Darmbakterien (Darmdysbiose) begünstigen. Dies führt zur Beschädigung der Schleimhaut. Auf eine beeinträchtigte Darmschleimhaut kann die Freisetzung von Lipopolysacchariden (LPS) folgen, was wiederum die Bildung von Alpha-Synuclein-Ablagerungen in den Darmnerven stimulieren kann. Ebenfalls können die Lipopolysaccharide eine Neuroinflammation durch Mikroglia aktivieren. Bei erkrankten COVID-19 Patienten kann sich die Alpha-Synuclein-Expression in den Neuronen des Darms als Immunreaktion auf die Virusinfektion erhöhen. Diese Immunantwort begünstigt wiederum die Bildung von Alpha-Synuclein-Aggregaten. Diese können über den Nervus Vagus vom Darmtrakt zum Gehirn gelangen. (Follmer, 2020)
Quellenverzeichnis
Fachartikel
(1) Abbott, N.J., Patabendige, A.A.K., Dolman, D.E.M., Yusof, S.R., Begley, D.J. (2010) Structure and function of the blood-brain barrier. Neurobiol Dis 37:13–25.
https://pubmed.ncbi.nlm.nih.gov/19664713/
(2) Bückendorf, C-H. (2016) Umweltbelastung, Dysbiose und Schleimhautimmunität. :5.
(3) Chao, Y.X., Gulam, M.Y., Chia, N.S.J., Feng, L., Rotzschke, O., Tan, E.K. (2020) Gut–Brain Axis: Potential Factors Involved in the Pathogenesis of Parkinson’s Disease. Front Neurol 11.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7477379/
(4) Follmer, C. (2020) Gut Microbiome Imbalance and Neuroinflammation: Impact of COVID-19 on Parkinson’s Disease. Mov Disord 35.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7461175/
(5) Harsanyiova, J., Buday, T., Kralova Trancikova, A.(2020) Parkinson’s Disease and the Gut: Future Perspectives for Early Diagnosis. Front Neurosci 14.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7313629/
(6) Holz, D. (2019) Milde Parkinson Zeichen im Alter-Begleiterscheinungen des normalen Alterns oder Hinweise auf eine neurodegenerative Erkrankung? 16-17.
(7) Jackson, A., Forsyth, C.B., Shaikh, M., Voigt, R.M., Engen, P.A., Ramirez, V., Keshavarzian, A. (2019) Diet in Parkinson’s Disease: Critical Role for the Microbiome. Front Neurol 10.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6915094/
(8) Mahul-Mellier, A.L., Burtscher, J., Maharjan, N., Weerens, L., Croisier, M., Kuttler, F., Leleu, M., Knott, G.W., Lashuel, H.A. (2020) The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proc Natl Acad Sci U S A 117:4971-4982.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7060668/
(9) Masato, A., Plotegher, N., Boassa, D., Bubacco, L. (2019) Impaired dopamine metabolism in Parkinson’s disease pathogenesis. Mol Neurodegener 14:35.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6728988/
(10) McGee, D.J., Lu, X-H., Disbrow, E.A. (2018) Stomaching the Possibility of a Pathogenic Role for Helicobacter pylori in Parkinson’s Disease. J Parkinsons Dis 8:367–374.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6130334/
(11) Perez-Pardo, P., Kliest, T., Dodiya, H.B., Broersen, L.M., Garssen, J., Keshavarzian, A., Kraneveld, A.D. (2017) The gut-brain axis in Parkinson’s disease: Possibilities for food-based therapies. European Journal of Pharmacology 817:86–95.
https://www.sciencedirect.com/science/article/pii/S0014299917303734?via%3Dihub
(12) Rutsch, A., Kantsjö, J.B., Ronchi, F. (2020) The Gut-Brain Axis: How Microbiota and Host Inflammasome Influence Brain Physiology and Pathology. Front Immunol 11.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7758428/
(13) Santos, M.L.C., de Brito, B.B., da Silva, F.A.F., Sampaio, M.M., Marques, H.S., Oliveira e Silva, N., de Magalhães Queiroz, D.M., de Melo, F.F. (2020) Helicobacter pylori infection: Beyond gastric manifestations. World J Gastroenterol 26:4076–4093.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7403793/
Abbildungsverzeichnis
Abbildung 1: selbstangefertigtes Bild von Elias Schwab, nach der Vorlage von
Abbildung 2: selbstangefertigtes Bild von Elias Schwab, nach der Vorlage von
https://ars.els-cdn.com/content/image/1-s2.0-S0014299917303734-gr2.jpg
Verfasser/innen: Annelie Wohlert, Elias Schwab, Franziska Reinthaler