A portoszisztémás sönt idegrendszeri következményei
Contents
I. A betegségről általában
A portoszisztémás sönt (PSS) egy érrendszert érintő anomália, minek jelenlétekor a hasüregi szervektől a vér a máj megkerülésével közvetlenül a szívbe jut, így a felszívott tápanyagok a szisztémás keringésbe kerülnek. A máj végzi a tápanyagok későbbi felhasználás céljából történő raktározását, bizonyos, szervezetre káros anyagok biztonságossá alakítását, illetve fehérjéket és más molekulákat szintetizál. PSS esetén a máj nem képes elvégezni ezen feladatait, minek következtében toxinok szaporodnak fel a véráramban. Ezen kívül az állat hiányt szenved azokban a tápanyagokban, amelyek alapvető fontosságúak a növekedés energiaszükségletének biztosításában.
Különböző típusú portoszisztémás söntöket különböztetünk meg attól függően, hogy mikor alakulnak ki, a májon belül vagy kívül, és hány ér alkotja a söntöt.
Egyszeres sönt
Általában veleszületett, a vena portae-t a vena cava caudalishoz köti.
extrahepatikus - a veleszületett söntök közül a leggyakoribb, elsősorban kistestű fajtákra jellemző (yorkshire terrier, schnauzer, uszkár, máltai, shih tzu, tacskó)
intrahepatikus – nagyobb testű kutyákra jellemző (ír farkas, golden és Labrador retriever, szamojéd)
Máltaiban és ír farkasban örökletes, feltételezések szerint yorkie-ban is, míg macskákban mindkét típus előfordulhat.
Többszörös sönt
Szerzett, a vena portaeban uralkodó tartósan magas nyomás hatására és cirrhosis esetén alakul ki. A német juhászok és a dobermannok hajlamosak a betegségre, ez a rendellenesség műtéttel nem korrigálható.
Minden emlős magzat rendelkezik ductus venosussal, ami a magzat májából a szívbe továbbítja a vért (az anyai máj látja el a feladatokat). Ez fiziológiás esetben zárul az utód születése után, ha ez nem történik meg, intrahepatikus sönt alakul ki (patent ductus venosus). Veleszületett extrahepatikus sönt esetén egy májon kívüli ér abnormálisan fejlődik, és a ductus venosus zárulása után is nyitott marad.
Veleszületett portoszisztémás sönt (CPSS) által érintett kutya klinikai tünetei
CPSS-el bíró kutyák esetén a tünetek fiatal korban jelentkeznek, kivéve, ha a vér megszakításokkal áramlik és a sönt kisméretű. Az ilyen egyedek kisebb testűek, alulfejlettek, gyenge izomzattal és egészségtelen küllemű bundával rendelkeznek. Viselkedésbeli problémák is előfordulnak, mint a gyengeség, csendes magatartás, apátia. Az idegrendszeri tünetek általában súlyosabbak, főleg alacsony vércukorszint és nagy mennyiségű protein bevitele esetén. Előfordulhat fel-alá járkálás, körözés, látászavar, a fej falhoz való odanyomása és rohamok. Mivel a máj nem dolgoz fel fehérjéket és ammóniát, utóbbi nagy mennyiségben kerül a kiválasztórendszerbe, ahol kristályokat képezhet (ammónium-biurát, urát kövek). Ez húgyúti gyulladáshoz és fertőzéshez vezethet. Az érintett kutyák képtelenné válnak vizeletük koncentrálására, így több vizeletet ürítenek, ezáltal többet is isznak. A tünetek között előfordulhat továbbá szédülés, étvágyvesztés, hányás, nyálzás, illetve gyomorfekély is kialakulhat (Tobias, 2013).
Többszörös, szerzett portoszisztémás sönt által érintett kutya klinikai tünetei
Ezen rendellenesség esetén idősebb korban lépnek fel a tünetek, néha kölykökben is kialakulhatnak. Sok esetben a máj károsodásának következménye a sönt kialakulása, például egy bizonyos méreg fogyasztása komoly májbetegséghez vezet, a májnak megnő az ellenállása. A kutya szemfehérje, bőre, ínye sárgás színelváltozást mutat, ha az epeutak is érintettek. Nagyon magas portális nyomás vagy hypoproteinaemia esetén a filtráció mértéke nő, pangó hasűri folyadék keletkezik (ascites). A máj kiesett működése miatt véralvadási zavarok, bevérzések jelenhetnek meg (Tobias, 2013).
II. Hepatikus encefalopátia
A hepatikus encefalopátia (HE) úgy definiálható, mint a máj működésbeli zavarának következtében kialakuló neurológiai tünet együttes, mely tulajdonképpen a központi idegrendszerben a csökkenő neuron aktivitás által létrehozott abnormális mentális státusz. A HE leggyakrabban PSS következménye. A patogenezis nem teljesen tisztázott, inkább csak teóriák vannak a kialakulásával kapcsolatban. A csökkenő neuron aktivitást lényegében az okozza, hogy a toxikus anyagcsere termékek akkumulálódnak az agyban, mivel valamilyen okból kifolyólag nem bomlanak le a májban.
Csoportosítás
- A HE a májjal kapcsolatos megbetegedések és a klinikai tünetek alapján csoportokba sorolható.
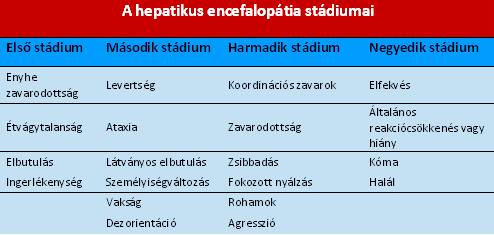
1. Klinikai tünetek alapján. Ezt a csoportosítást az alábbi táblázat szemlélteti. (1. Táblázat)
|
2. A humán orvostudomány 3 fő típusba sorolja a HE-t a máj diszfunkciói alapján, és ezt a csoportosítást az állatorvoslás is átvette.
- Az A típusú HE májelégtelenséggel van kapcsolatban.
- A B típus PSS jelenlétével van összefüggésben, azonban májelégtelenséggel nem társul.
- A különböző máj parenchima elégtelenséggel és portális vérnyomás emelkedéssel kapcsolatos C típus gyakran társul szerzett PSS-el. Ez a leggyakoribb humán esetekben, míg állatoknál a B a leggyakrabban előforduló HE típus.
Patogenezis
Egy egyedüli máj vagy idegrendszeri abnormális metabolizmus sem magyarázza teljesen a HE összes tünetét, bár a hyperammonaemia valószínűleg kulcsszereppel bír a HE kialakulásában.
Teóriák
Megváltozott ammónia metabolizmus
|
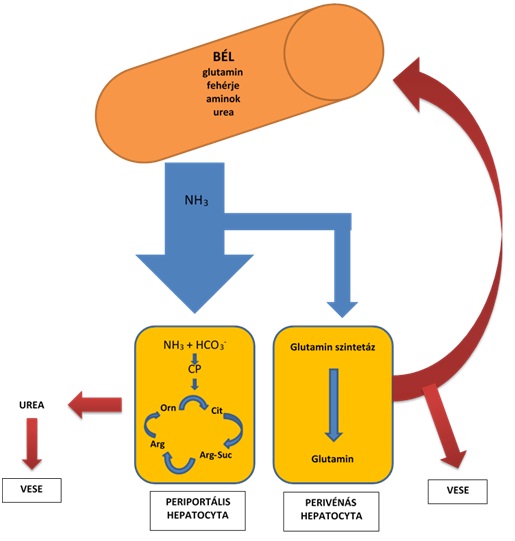
Az ammónia négy mechanizmus során keletkezik a szervezetben: (1) ureázt termelő mikroorganizmusok által a vastagbélben, amelyek a bélben lévő fehérjéket és az ureát bontják, (2) a táplálékból felvett aminosavak májban végbemenő metabolizmusa, (3) a glutamin enterocytákban zajló metabolizmusa, és (4) perifériás szövet (izom) katabolizmusa. A vérben található ammónia több, mint 50 %-a a bélben történő fehérje- és ureabontásból származik. Normál ammónia metabolizmus során (1. Ábra) az ammónia eléri a májat a portális keringésen keresztül. Az ammónia nagy része az urea ciklusba kerül majd a vesék által exkretálódik. A maradék felhasználódik a glutamát-glutamin átalakulás során a glutamin szintetáz segítségével. A végtermék a keringésbe kerül és metabolizálódik a bél mucosájában, illetve a vesében, így újra felszabadítva az ammóniát. Az első tézis a túlzott ammónia akkumuláción alapszik. A különböző eredetű máj elégtelenségek következtében csökken az ammónia detoxifikáció, míg PSS során az ammóniában gazdag vér közvetlenül a szisztémás keringésbe jut, így okozva hyperammonaemiát. Az agy mentes az urea ciklustól, helyette a hatékony ammónia eltávolítás érdekében glutamin szintézis folyik az astrocytákban. Normális esetben a folyamat a következő: Az idegi stimuláció glutamát felszabadulást eredményez, ami egy, a preszinaptikus sejtekből származó, serkentő neurotranszmitter. Az astrocyták felveszik a felesleges glutamátot a szinaptikus résből, majd a vérből származó ammóniával együtt glutaminná alakítják azt. A glutamin ezután aktívan kiválasztódik az astrocytából és a preszinaptikus idegvégződés veszi fel, ahol ismét glutamáttá alakul, így újra felhasználhatóvá válik a neurotranszmissziós folyamatokban. Az astrocyta ezáltal megvédi az agyat a túlzott ingerületátviteltől. Hyperammonaemia esetén fokozódik a glutamin termelés, a leadás viszont gátlódik, ezáltal felhalmozódik a sejtekben. Az ozmotikusan aktív glutamin vizet vonz a sejtbe, agyi ödémát okozva.
A sejten belüli ödémát súlyosbítja az astrocyta ammónia metabolizmusa, ezt „Trójai faló” hipotézisként ismerjük. A hipotézis szerint amikor az ammónia reagál a glutamáttal az astrocytán belül, glutamint alkotva, a glutamin a mitokondriumokba kerül. A mitokondrium ammóniaszint-emelkedése reaktív nitrogén és oxigén gyökök kialakulásához vezet, ami meggátolja az astrocytát a hatékony intracelluláris térfogatszabályozásban. Ez további cytotoxikus agyi ödémához vezet. Az ammónia felhalmozódásának eredményeképp csökken az agyi glükóz és oxigén metabolizmus, nő a vérkeringés redisztribúciója a kérgi területről a szubkortikális régiókhoz, és a vér-agy gát permeabilitása emelkedik ammóniára nézve. Az astrocyták megduzzadása az akut HE kritikus komponense. Az A típusú HE során fellépő agyi ödéma növekvő intrakraniális nyomáshoz, agysérvhez és halálhoz vezet. Kismértékű agyi ödéma rendszerint a B és C típusú HE során jelentkezik. A hyperammonaemia számos agyra gyakorolt hatása ellenére a vérammónia szint nincs szoros összefüggésben a HE klinikai tüneteivel, ami arra enged következtetni, hogy az ammónia nem az egyedüli tényező a HE kialakításában.
Az ammóniával kapcsolatos teória rengeteg tünetet megmagyaráz, de így is sok a patogenezis lefedetlen területe.
Gyulladás
Egyes kutatások igazolták, hogy összefüggés van a gyulladásos folyamatok, mediátoraik (pl.: citokinek, tumor nekrózis faktorok vagy interleukin-6) és a HE kialakulásában. Lehetséges teóriák magyarázzák, hogyan befolyásolja a gyulladás a citokinek által irányított változásokon keresztül a vér-agy gát permeabilitását, így megváltoztatva a glutamát felvételt és a GABA receptor expressziót.
Glutamát transzmisszió megváltozása
A központi idegrendszer glutamáterg neurotranszmitter szisztémája megváltozik akut és krónikus HE során. Ahogy azt a fentiekben leírtuk az astrocyták védik az agyat a túlzott neurotranszmissziótól, úgy, hogy gátolják a glutamát kiszabadulását a preszinaptikus idegvégződésekből. A hyperammonaemia csökkenti az astrocyták glutamát felvételét, ami a megemelkedett extracelluláris glutamát szinthez vezethet.
A glutamát transzporter GLT-1 „down-regulációja” (A GLT-1 egy esszenciális transzporter a szinapszisban lévő gultamát inaktivációja során) volt megfigyelhető hyperammonaemiás patkányok esetében, mind PSS-el rendelkezőkben, mind kísérletesen indukált máj elégtelenségben szenvedő egyedekben. IV-es fokozatú HE során a magas ammónia koncentráció inaktiválja a neuronokból klorid iont eltávolító ionpumpát, depolarizálva ezzel a neuronokat és előidézve a neurológiai izgatottságot és a roham előtti státuszt.
Továbbá az idegrendszer emelkedő glutamát koncentráció általi stimulálása rohamokat is okozhat A és B, ritkábban C típusú HE-ben szenvedő állatokban.
GABA agonisták szintjének megemelkedése
|
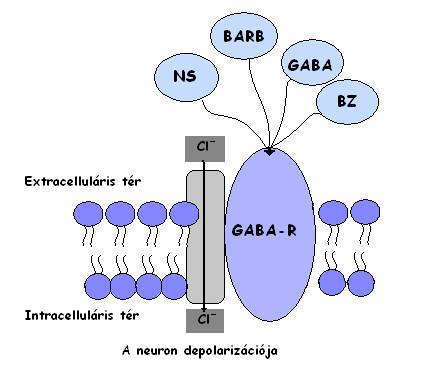
A GABA hipotézis a megnövekedett, vagy lecsökkent érzékenységre alapul GABA-val (GABA: gamma aminobutric acid - egy gátló neurotranszmitter) szemben. A GABA a béltraktusból származik. HE esetén a plazma GABA szintje nő, mivel a máj kiválasztó funkciója csökken. Ez esetben a vér-agy gát átjárhatósága nő, így a GABA bejut az agyba és aktiválja a receptor komplexet. A klorid csatornák nyitnak, és az így fellépő hyperpolarizáció miatt gátlás alakul ki a központi idegrendszerben. Kialakítva a HE tüneteinek egy részét. Ez magyarázza a következő jelenséget:
Egy akut májelégtelenség miatt kómában lévő nyúl modellben vizuális ingerek által keltett akciós potenciál kialakulást mértek. Az eredmények megegyeztek a drogokkal indukált kómában mérhető potenciál értékekkel. A drogok a GABA receptor komplexet aktiválták úgy, mint benzodiazepin, vagy barbiturát agonisták. (2.Ábra)
Benzodiazepin szerű ligandok növekedése
A máj csökkenő filtrációs funkciójának következtében a benzodiazin szerű anyagok koncentrációja megemelkedik a plazmában. A benzodiazin receptorok az astrocyták mitokondriumainak külső membránján helyezkednek, és a számuk megemelkedik mind az akut, mind a krónikus HE esetén. A receptoroknak szerepe van a neuroszteroidok szintézisében, ezen anyagok pedig GABA agonisták.
A GABA és az ammónia teória nem kizárólagosak. Egyes tanulmányokban az ammónia közvetlenül emeli a GABA általi neurotranszmissziót illetve növeli a benzodiazepin agonisták hatását.
Megváltozott szerotoninerg szisztéma
Megfigyelhető emberek és állatok HE-je esetében szerotonin, Ser receptor és monoamin oxidáz szintjének emelkedése. Humán kísérletek során leírták egy szerotonin praecursor, a triptofán koncentrációjának megemelkedését a plazmában májelégtelenség során. Az összefüggés a plazma triptofán szintje és a HE között még nem teljesen bizonyított, de feltehetően nem jelentős a szerepe a patogenezisben.
Megváltozott aminosav metabolizmus
HE során az aromás aminosavak szintje nő, míg az elágazó láncú aminosavak plazmakoncentrációja csökken. Ennek a jelentősége abban rejlik, hogy aromás láncú aminosavak hatására a központi idegrendszerben a dopamin és a noradrenalin által indukált neurotranszmisszió blokkolása következik be. Így a központi idegrendszer gátlás alá kerül.
Mangán mérgezés
Mivel a máj felelős a mangán (Mn) exkréciójáért, a máj betegségek együtt járhatnak a plazma Mn-szint emelkedésével illetve az agy Mn akkumulációjával. Ez pedig jelentős befolyással bír a glutamát és a dopamin-függő neurotranszmisszióra.
A kevert neurotranszmitterek megváltozása
Kísérletesen indukált HE esetében a taurin (gátló neurotranszmitter) szint nő, ez pedig korrelál a HE súlyosbodásával. Egyéb neurotranszmitterek hatásában is változás figyelhető meg: így az opioidok, a melatonin, a merkaptán illetve a rövid láncú zsírsavak szintje is megváltozik HE esetén. Összegezve tehát, a HE minden anyagra hatással van, ami a bélflóra produktumból származtatható. Ezek hatását egyes tanulmányok tagadják, mások alátámasztják.
Végeredményben a HE patogenezise legjobban úgy magyarázható, mint több összefüggő faktor hatás együttese. A megfelelő kezelés kiválasztásához szükséges a HE klinikai tüneteit kialakító tényezők alapos megértése. A HE patogenezisének legfontosabb aspektusait a jövőbeni kutatások tovább tisztázhatják, emellett újabb teóriák bevezetésére is mód nyílhat, amelyek hozzájárulhatnak a szindróma mélyebb megértéséhez. (Salgado és Cortes, 2013)
A HE hatása a tanulásra
Egy, az Oviedoi Egyetemen végzett kutatás eredményeként kiderült, hogy a HE hatással van a koncentrációs képességre és a memóriára is, ezáltal csökkentve a tanulás hatékonyságát. A megállapítást egy fordított tanulásra alapozott kísérlet, és az agy tanulásért felelős területein végbemenő metabolikus változások vizsgálata alapján tették.A kísérletben 14 hím patkány teljesítményét figyelték meg a Morris-féle vízi útvesztő tesztben, közülük 8 rendelkezett PSS illetve az ennek következményeként kialakult HE-val, és 6 egészséges egyed alkotta a kontrollcsoportot.
A teszt során az állatoknak egy négy, egyforma kvadránsra felosztott, vízzel teli medencében kellett az adott kvadránsban elhelyezett víz alatti kilépőt megtalálni.(3. Ábra) A medence körül több, a tájékozódást elősegítő tárgy is található volt. Egy kísérleti szekció alatt minden egyednek 4db egyperces, azonos időközökkel elválasztott próbálkozási lehetősége volt, hogy megtalálja a kilépőt. A fent leírtakat 4 napon keresztül ismételték, majd a kilépőt áthelyezték a medence pontosan átellenes részére, és a patkányok ismét 4 próbálkozási lehetőséget kaptak a kilépő új helyeződésének megtanulására. A kilépő megtalálásának időtartama, az időtartam csökkenése a kísérlet előrehaladtával, az egyes kvadránsokban eltöltött idő, a sebesség és a megtett távolságok feljegyzésre kerültek. A kísérlet után 90 perccel az állatokat lefejezték, agyukat érintetlenül lefagyasztották, majd a megfelelő kezelési eljárások után hisztokémiai vizsgálatnak vetették alá. A vizsgálat, és a feljegyzett adatok alapján az alábbi következtetések vonhatóak le:
- a PSS csoportba tartozó patkányok lassabban tanulták meg a kilépő helyeződését
- a kilépő fordított helyeződését pedig képtelenek voltak memorizálni
Eredmény: Az új körülményekhez szükséges adaptációs készség csökken, amit az ezen funkcióért felelős agyterületekben mérhető citokróm-oxidáz koncentrációjának csökkenése is mutat (a kontroll csoportnál mért koncentrációhoz képest). (Méndez és mtsai, 2011)
|
III. Egyéb idegrendszeri hatások
A fent leírtak mellett egyéb neurológiai tünetek is jelentkezhetnek, akár az állapot műtéti kezelése után is.
Egyes tanulmányok szerint a CPSS beavatkozásos csökkentése után a vizsgált kutyák 12%-a mutatott idegrendszeri tüneteket, melyek nem voltak összefüggésben sem a HE-val, sem pedig a hypoglycaemiával, mivel a vizsgált kutyák vérében mind az ammónia, mind a vércukorszint közel állt a normálishoz.A tapasztalt tünetek súlyossága változó, előfordult közöttük ataxia, dezorientáció, de motorikus rohamok is, melyek egyes esetekben epilepsziás státuszig fejlődtek. A szövődmények megjelenésének oka nem bizonyult egyértelműnek, de felismertek bizonyos faktorokat (fajta, nem, kor), melyek növelhetik a kialakulás kockázatát. (Tisdall és mtsai, 2000)
Egyéb kutatások, melyek az artériás és a portális vérben előforduló belsőleges benzodiazepin receptor ligandok (EBZ) koncentrációját vizsgálták, kimutatták, hogy a kutatásban résztvevő CPSS-el rendelkező kutyák nagy részének vérében jelentősen magasabb az EBZ szint. Mivel a gasztrointesztinális traktus vére az, ami sönt által kikerüli a májat, az emelkedett ligand koncentráció arra enged következtetni, hogy az EBZ termelés ezen szakaszon intenzív. Ha a sönt műtéti úton csökkentésre kerül, a szisztémás keringésbe kerülő gasztrointesztinális vér mennyisége is csökken, így következetesen az EBZ szint is alacsonyabb lesz, ami az EBZ eredeti, gátló hatásának ellentétét, stimulációt vált ki. Ez lehet a műtéti beavatkozások után jelentkező motorikus rohamok előfordulásának lehetséges oka. (Aronson és mtsai, 1997)
IV. Diagnosztika
Amennyiben a kutyában portoszisztémás sönt jelenlétét feltételezik, több módszert alkalmazhatunk ennek igazolására. PSS-el rendelkező kutya esetén a teljes vérkép, vizelet és epesavak analízise során a következő változások figyelhetőek meg:
- vörösvérsejtek méretének csökkenése
- fehérvérsejtek számának emelkedése
- összfehérje szám, albumin, BUN (blood urea nitrogen) mennyiségének csökkenése
- éhgyomri és etetés utáni epesavak mennyiségének emelkedése
- vérammónia szint emelkedése
- Protein C koncentráció csökkenése
A laborvizsgálatok mellett a PSS kimutatható más módszerekkel is. Hasi röntgenfelvételen a máj általában kisebb, zsugorodott. Ultrahangvizsgálattal is megkereshető a sönt. Szcintigráfia során radioaktív anyagokat juttatnak a vastagbélbe vagy a lépbe és egy speciális kamerával követik ezek keringésbeli útját. Ha az anyagok több, mint 5%-a közvetlenül a szívbe jut, PSS jelenléte feltételezhető. Portogram készítése során kontrasztanyagokat injektálnak a hasűri erekbe, majd röntgenfelvételt készítenek a területről. Ez egy invazív eljárás, azonban jól láthatóan bizonyítja a sönt jelenlétét és helyzetét, és megfelelő eszközök segítségével műtét közben is elvégezhető. CT vizsgálattal az intra- és extrahepatikus sönt is jó eséllyel kimutatható (Tobias, 2013).
V. Kezelés
Extrahepatikus sönt esetén lehetséges a sönt műtéti úton történő okklúziója. Ilyenkor a söntöt a lehető legközelebb zárják le a vena cava-ba történő betorkollásához. Az ameroid konstriktor használata hatékony módja a sönt lezárásának, ami egy acélhüvelybe foglalt kazein gyűrű. A kazein folyadékabszorpciója során megduzzad és lezárja az eret. A PSS bármely fajtája esetén fellépő tünetek jó eséllyel enyhíthetők megfelelő diéta megválasztása és táplálékkiegészítők adása segítségével (Tobias, 2013).
VI. Felhasznált irodalom
College of Veterinary Medicine, Tennessee, USA
Salgado M., Cortes Y. (2013): Hepatic Encephalopathy, Etiology, Pathogenesis, and Clinical Signs
Tobias K.M. (2013): Brief Overview of Portosystemic Shunts
(Az ábrák és a táblázat saját készítésűek)