RNA-Therapeutika in der Krebsimmuntherapie
Contents
Einleitung
Corona, eine Pandemie, von der man nicht glauben würde, dass sie uns vielleicht noch etwas Gutes bringt. Doch abgesehen von allen negativen Auswirkungen, welche Covid-19 auf unser aktuelles Leben hat, schafft es auch einen Lichtblick nach vorne, nämlich durch die mRNA Impfstoffe.
Seit Jahren werden sie getestet, seit über 20 Jahren wird sogar schon daran geforscht (Fey, 2020). Zum Einsatz kamen sie allerdings bisher noch nicht, beziehungsweise selten. Doch dies kann sich jetzt ändern. Beispielsweise durch den Impfstoff von Biontech gegen Covid-19 kann der mRNA Forschung endlich ein Durchbruch gelingen. Comirnaty (BNT162b2, Biontech / Pfizer) ist das allererste Präparat, das je zugelassen wurde – bis jetzt mit einer Erfolgsquote von 95%. Damit liegt der Impfstoff an der Spitze der sich im Umlauf befindlichen Corona Impfstoffe.
Corona und mRNA Impfstoffe profitieren voneinander. Durch die aktuellen Corona mRNA Impfungen, die nun endlich auf dem Markt sind und geimpft werden, bekommen auch die mRNA Impfungen gegen Krebs viel mehr Anerkennung als je zuvor. Vielen Menschen war die Methode bisher unbekannt, doch vor allem in der Krebsforschung könnte sie in Zukunft von großer Bedeutung für uns sein. Einerseits hätten wir ohne die bereits vorhandene Forschung in der aktuellen Pandemie vermutlich nicht so schnell einen guten Impfstoff bekommen, andererseits profitieren wir aber auch in der onkologischen Forschung beziehungsweise den mRNA Therapien von der Aufmerksamkeit und den nun in diese Forschung fließenden Geldern (Verbeke et al, 2021).
Durch die Kenntnisse, die wir nun vom Covid-19 Impfstoff ziehen, können wir auch weiterhin in der Krebsforschung profitieren. Ob diesem modernen Ansatz der komplette Durchbruch gelingen kann aufgrund der Corona Pandemie, ist nicht klar, aber er hat bereits wesentlich mehr Aufmerksamkeit bekommen, als vor einem Jahr und könnte in Zukunft in vielerlei Hinsicht bedeutsam für die Menschen und die Tiere sein.
Physiologische Grundkenntnisse
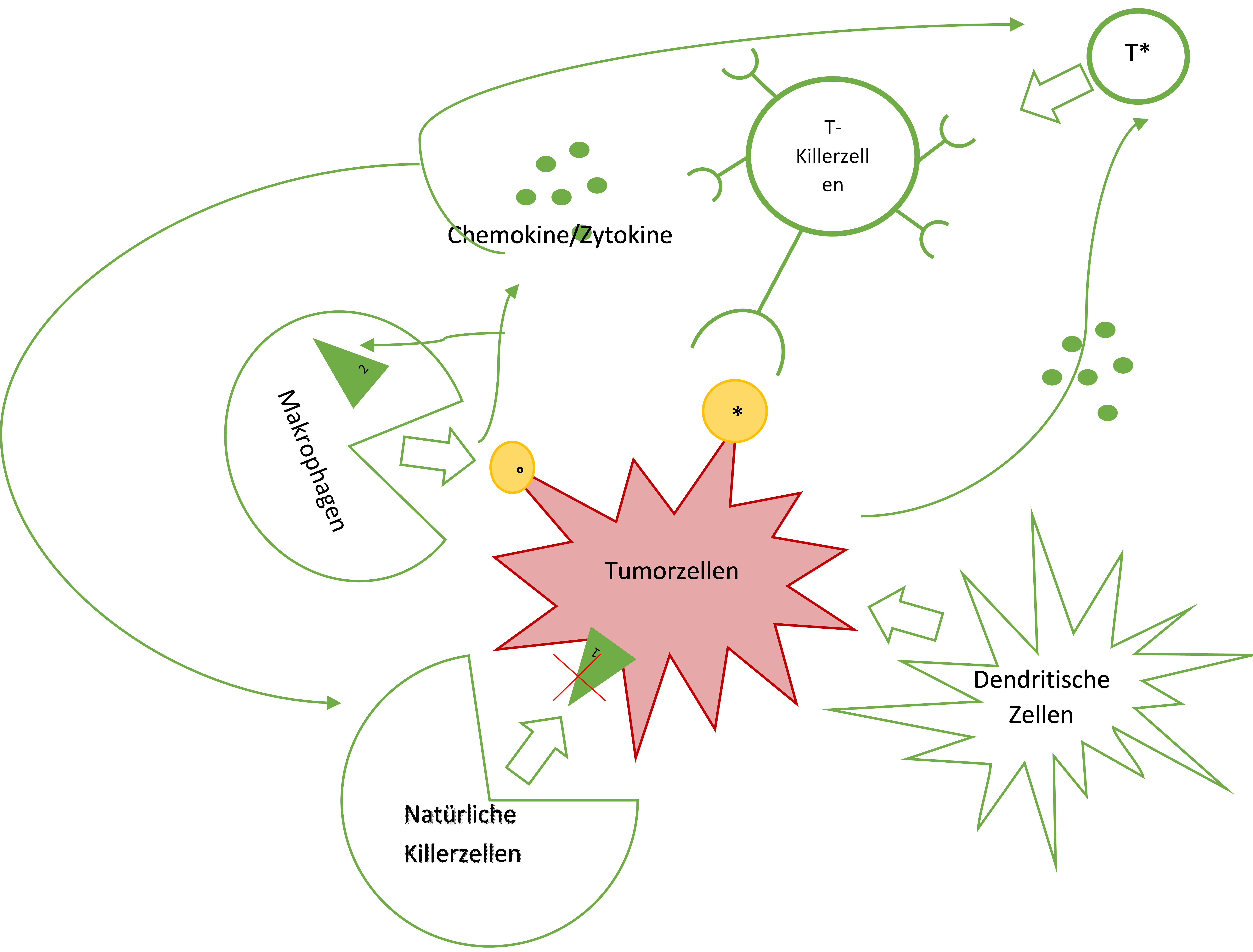
Abbildung 1 |
|
Die wichtigsten Systeme in der Krebsabwehr eigene Abbildung Tamara Schmid basierend auf Bergman, 2018 und Höpken, 2016. *=Tumorantigene, Dendritische Zellen / APC, °=Körperfremdes Protein, Makrophagen, Natürliche Killerzellen, T* = T-Helferzellen, T-Killerzellen/Cytotoxische T-Zelle (CTL) |
Antitumorale Physiologie des Immunsystems
Um zu verstehen, wie die Zukunft der Immuntherapie aussieht, muss man zunächst die grundlegenden antitumoralen Prozesse der Immunabwehr verstehen. Das Immunsystem vernichtet generell diejenigen Substanzen, welche dem eigenen Körper Schaden zufügen beziehungsweise abgebaut werden sollen. Für die Krebsabwehr werden sowohl Prozesse des angeborenen, als auch die der erworbenen Immunantwort benötigt. Die wichtigsten Systeme sollen anhand der folgenden Abbildung kurz ins Gedächtnis gerufen werden (Reinberger et al, 2010).
Das Immunsystem wehrt mit Hilfe dieser Mechanismen die meisten Bedrohungen ab, am wichtigsten dabei sind die MHC-Wege beziehungsweise HLA beim Menschen (Höpken, 2016).
Interessant sind hierbei vor allem die TAA, also Antigene die fast ausschließlich von Krebszellen exprimiert werden und damit wesentlich in deren Erkennung durch das MHC-1-System sind (Bergmann, 2018).
Onkologie im Allgemeinen
Krebs ist eine der gefürchtetsten Krankheiten der Menschheit im 21. Jahrhundert und steht somit auf dem zweiten Platz der Rangordnung von Krankheiten mit den meisten Todesfällen. Eine Studie aus dem Jahr 2012 besagt, dass rund 14,1 Millionen Fälle und davon 8.2 Millionen mit Todesfolge bekannt sind. So errechnete man eine Inzidenz von etwa 100 Krebsdiagnosen pro 100.000 Probanden mit einer Sterberate von 50 Krebstoten pro 100.000 Probanden. Aus der Statistik lässt sich entnehmen, dass nahezu 50% der Menschen mit Diagnose „Krebs“ einen tödlichen Verlauf erleiden. (Lindsey et al, 2016).
Es gibt mehrere Theorie zu Krebsauslösern, die Mutationen auslösen. Ein Beispiel dafür sind Viruserkrankungen wie das Humane Papillomavirus (HPV), welches zu Gebärmutterhalskrebs führen kann. Es ist bekannt, dass sogenannte Onkogene, im Falle einer übermäßigen Aktivierung den Übergang von normalem Wachstumsverhalten, zu ungehemmtem Tumorwachstum führen. Immunsuppressive Gene (z.b. p53) stellen ebenfalls einen Teil des Erbgutes dar. Dies Gene können Proteine exprimieren, die den Zellzyklus kontrollieren und Apoptose auslösen (Abeloff et al, 2013).
Die am häufigsten verwendeten Therapien stellen eine Tumorresektion mit anschließender Bestrahlung und Chemotherapie dar. Diese werden aufgrund ihrer hohen Erfolgsquote verwendet, auch wenn die behandelten Patienten, selbst nach erfolgreicher Tumorentfernung, mit schwerwiegenden Nebenwirkungen und Langzeitfolgen zu kämpfen haben.
An dieser Stelle knüpft die Immuntherapie an, um schonendere, sowie effektivere Methoden zur Bekämpfung von Krebs zu entwickeln.
RNA Therapeutika
Relevanz der RNA in der Krebsimmuntherapie
Seit über 20 Jahren wird sich in der Krebsimmuntherapie mit der mRNA Technik beschäftigt.
Bösartige Zellen sollen mit dieser Methode erkannt und zerstört werden. In der Krebsimmuntherapie kann diese Methode von wertvoller Bedeutung sein, da jede Krebszelle anders ist und eine maßgeschneiderte Therapie entwickelt werden muss. Ziel ist es die Eiweißstücke der Krebszelle zu identifizieren, nachzubauen und zu verimpfen, um das Immunsystem mit der Erkennung zu unterstützen. Nur durch diese Hilfe kann der Körper eine entsprechende Immunantwort geben. Dies erfolgt durch unterschiedliche Methoden.
Einige Mechanismen, die im nächsten Kapitel erläutert werden, führen dazu, dass man Chemotherapien, mit welchem man das Immunsystem sehr schwächt, in Zukunft unterlassen kann und direkt, individuell dem Tumorwachstum entgegenwirken kann beziehungsweise gezielt stoppen kann (Dieterichs, 2010).
Bis jetzt ist das Wissen über diese RNA zu gering, um mehr darüber schreiben zu können. Sie ermöglichen es den Menschen allerdings, den Krankheitsverlauf und vor allem die Mechanismen der Krebsentstehung besser zu verstehen.
Funktion der RNA Therapeutika
Vor dem Jahr 1990 war der Ribonukleinsäure (RNA) allein die Aufgabe als Zwischenprodukt von DNA zur Exprimentierung von Proteinen zugeschrieben. Erst später stellten sich die vielfältigen und effizienten Eigenschaften des Moleküls heraus. Es beteiligt sich an der Regulation von genetischen Funktionen, sowie deren der Zellen in allen lebenden Organismen.
Bei einer positiven Regulation benötigt das Enzym RNA-Polymerase einen Aktivator, der die DNA bindet, damit die Transkription erfolgen kann. Das bedeutet eine Stimulation der Transkription. Andererseits kann auch eine hemmende, negative Regulation erfolgen. Es bindet ein Repressor an die DNA, welcher die RNA-Polymerase daran hindert, das Gen zu transkriptieren.
Diese Funktionen ergaben wichtige Ansätze für neue therapeutische Verfahren in sämtlichen medizinischen Bereichen. Das Wirkungsspektrum reicht von der Heilung genetischer Krankheiten, durch simples Abschalten („Gen-Knockout“) von fehlerhaften Genen, bis zu Heilung von Infektionskrankheiten wie HIV. Aber auch die Behandlung von Krebs mit RNA-basierenden Therapeutika zeigten bereits vielversprechende Ergebnisse. Es gibt aber noch einige Hürden, weshalb der Durchbruch der RNA Therapeutika noch nicht gelungen ist. Diese sind die Instabilität des RNA Moleküls, die kurze Halbwertszeit, sowie die Immunogenität und die Voraussetzung eines Transport- Vehikels für die Übertragung in die Zielzelle. Durch weiteres Forschen und Testen dieser Therapeutika konnten jedoch bereits viele Verbesserungen erzielt werden.
Die RNA-Therapeutika werden durch Ihre Wirkungsmechanismen in verschiedene Gruppen eingeteilt. Dazu zählen zum einen Hemmstoffe für die mRNA Translation, auch „antisense“ benannt.
Außerdem das Zielgerichtete abschalten von bestimmten Genen mit der sogenanntenRNA Interferenz (RNAi). Dabei erfolgt eine Stilllegung („knockout“) des Target-Gens (Ziel-Gens) welche vor allem für Grundlagenforschungen verwendet wird, um die für die jeweiligen Funktionen eines Mechanismus kodierenden Bereiche des Genoms erkenntlich zu machen. Auch katalytisch aktive RNA Moleküle, die Ribozyme, welche eine Enzym ähnliche Wirkungsweise haben, werden als therapeutische Mittel verwendet (Burnett et al., 2012).
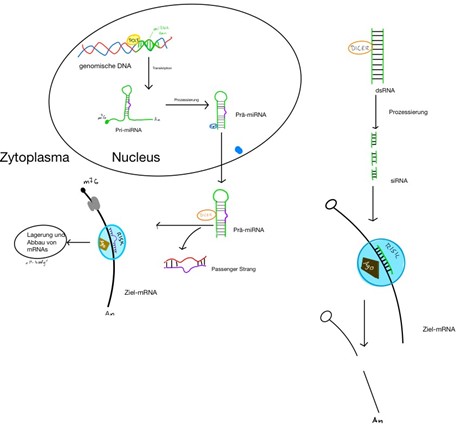
Abbildung 2 |
|
RNA Silencing durch RNA Inteferenz (RNAi) mit miRNA und siRNA Effektormolekülen eigene Abbildung Lucca Wagner basierend auf Grünweller (2015, Seite 265 Abb. 2) |
Nicht nur Gene können beeinflusst werden, sondern auch die Synthese von Proteinen kann gezielt durch RNA gestört werden, in dem sie direkt an das Protein oder molekulare Liganden bindet. Sie werden als Aptamere bezeichnet. Diese Methode könnte Potenzial in der Onkologie finden, in dem sie zur Verringerung des Tumorwachstums beiträgt. Auch in der aktuellen Corona Pandemie, glaubt man den Eintritt des Virions in die Zelle, sowie die weitere Vermehrung des Virus zu verhindern, in dem ein Aptamer an die SARS-COV-2 Spike Proteine bindet (Song, 2020).
Eine Wirkungsweise der RNA soll am Beispiel der RNAi detailierter beschrieben werden: RNA Interferenz ist ein Mechanismus, in dem aus entweder endogenen, oder exogenen (von außen durch zum Beispiel Viren eingedrungenen), doppelsträngigen RNA-Molekülen nach einer Prozessierung kleinere Fragmente entstehen. Man unterscheidet zwischen zwei dieser kurzen doppelsträngigen RNA Fragmente. Zum einen siRNA (smal interfering RNA), welches sowohl körpereigen als auch fremden Ursprung haben kann. Zum anderen miRNA (Micro-RNA), welches von endogener RNA transkriptiert, im Nucleus prozessiert und gefaltet wird. Anschließend wird es in das Zytoplasma abgegeben. Die beiden Fragmente können sich jeweils an das sogenannte DICER Molekül binden, ein Endoribonuklease Protein, welches im Stande ist, RNA in kleine Segmente zu schneiden (Röcken, 2011).
Die siRNA oder miRNA zusammen mit dem DICER-Protein binden an ein sogenanntes Argonaut Protein. Nur einer der beiden Stränge bleibt als „Guide Strang“ daran gebunden. Die Kombination aus Argonaut und Guide RNA mit anderen Proteinen wird als Effektorkomplex RISC (RNA induced slicing complex) benannt. Im Falle von siRNA führt dessen, an den Effektorkomplex gebundene Strang, zur Ziel mRNA (Target mRNA). Diese wird im Folgenden von dem Protein Argonaut katalysiert und die mRNA schneidet an einer spezifischen Stelle, womit dessen Wirkung degradiert. Der Unterschied zu der miRNA besteht hauptsächlich in der Wirkungsweise des Guide Strangs. Die siRNA bindet durch vollständige komplementäre Basenpaarung an die Target-mRNA, wohingegen bei der miRNA nur ein Teil dieses Moleküls (dem sog. „Seed“) mit der Ziel mRNA durch partielle Basenpaarung bindet. Diese ungenaue Übereinstimmung erlaubt das Anzielen von hunderten mRNAs. Daraus kann entweder ebenfalls eine Degradierung zustande kommen oder nur eine Hemmung der Translation der Ziel mRNAs (Grünweller, 2015).
Ein weiters Beispiel ist MALATI 1, welches ursprünglich im Lungenkrebs entdeckt wurde. Es wurde Herausgefunden, dass MALATI 1 als aktiver Regulator bei der Metasierung der Lunge funktioniert. Weitere wichtige neue RNA Klassen sind siRNAs und piRNAs (Diederichs, 2010).
Individuelle Krebsimpfstoffe
Um die Funktion eines Krebsimpfstoffes verstehen zu können, muss man zuerst das Prinzip einer Impfung gegen Infektionskrankheiten erklären. Generell erfolgt eine Aktivierung des Immunsystems gegen spezifische Stoffe. Ziel eines Impfstoffes ist das körpereigene Immunsystem zu befähigen, auf eine Infektion mit einem Erreger oder einer zellfremden Substanz so schnell und wirksam wie möglich zu reagieren, so dass daraus keine oder nur eine abgeschwächte Infektion resultiert. Es wird dem Körper eine bestimmte Menge Antigene zugeführt, die das Immunsystem dazu bringen, spezifische Antikörper gegen die Infektion zu produzieren. Infolgedessen werden die sogenannten Gedächtniszellen gebildet, durch welche die Antikörper bei erneuter Infektion schneller zur Verfügung stehen und die Immunreaktion direkt starten kann. Auf eine ähnliche Weise funktionieren auch die Tumorvakzine.
Grundsätzlich unterscheidet man eine prophylaktische und eine therapeutische Krebsimpfung. Prophylaktische Impfstoffe werden zur Vorbeugung und Risikominimierung für bestimmte Krebserkrankungen, wie zum Beispiel Gebärmutterhalskrebs, welche durch Humane Papillomaviren (HPV) hervorgerufen werden, verwendet (Miao et. al, 2021).
Bei einer bereits bestehenden Krebserkrankung wird seit kurzem an therapeutischen Krebsimpfstoffen geforscht. Im Unterschied zu den Antigenen von pathogenen Erregern, werden die von einem Tumor stammenden Antigene vom Genom des Erkrankten selbst exprimiert. Dadurch können sie teilweise schlechter, oder gar nicht vom Immunsystem erkannt werden. Einige Tumore erzeugen ebenfalls eine Immunsuppression. Demnach kann das Immunsystem durch das gezielte Zuführen von Tumorantigenen in Kombination mit immunogenen Stoffen, zur T-Zell Produktion mit darauffolgender Eliminierung der Tumorzellen trainiert werden.
Zuerst werden Zellen des Tumors von einem bestimmten Patienten entnommen und dessen Antigene extrahiert. Dabei unterscheidet man zwischen verschiedensten Antigenformen. Es gibt tumorassoziierte Antigene (TAA), welche in einigen Tumorzellen und auch normalen Zellen vorhanden sind. Tumorspezifische Antigene (TSA) sind hingegen nur in Tumorzellen aufzufinden.
Erwähnenswert sind außerdem auch die Antigene, welche nur in bestimmten Phasen der Zelldifferenzierung zu erkennen sind, sowie Tumorsusppresorgene (z.B. p53) und tumorspezifische-posttranslationell modifizierte Proteine, welche alle ebenfalls für die Herstellung eines individuellen Krebsimpfstoffes verwendet werden können. Leider reichen diese Antigene allein nicht, um bereits eine ausreichende Immunantwort zu induzieren. Deshalb werden häufig sogenannte Adjuvante hinzugefügt. Dabei handelt es sich um stark immunogene Stoffe, wie antigenpräsentierende Zellen (APC), Dendritische Zellen (DC), Makrophagen oder auch Toll-like-Rezeptor (TLR), welche bereits in Kapitel 2.1 genauer beschrieben worden sind (Cluff, 2010).
Da nicht alle Krebsarten identisch sind und für die gleichen Antigene codieren, sind verschiedene personalisierte Krebsimpfstoffe erforderlich. Es gibt vier Typen von Tumorvaccinen: Tumor- und Immunzellen basierende, Peptid basierende, Virale-Vektor basierende und Nukleinsäuren-basierende Impfstoffe, welche aus DNA- oder RNA-Vorlagen bestehen. Vor allem letztere haben sich als besonders vorteilhaft erwiesen, da sie eine simultane Überlieferung von mehreren Antigenen gleichzeitig ermöglichen und sowohl humerale als auch zelluläre Immunantwort auslösen können. Außerdem wird im Vergleich zu einer Peptid-basierenden Impfung die volle Länge verschiedener Tumorantigene exprimiert. Es können somit mehrere Tumor Epitope gleichzeitig von APCs erkannt und weniger abhängig von deren spezifischen Humanen Leukozyten Antigenen (HLA), eine breitere T-Zellen Reaktion ausgelöst werden. Letztendlich sind Nukleinsäure-Impfstoffe nicht infektiös, frei von Protein- oder Virus-Vektor Kontaminationen und werden dadurch sowohl für die prophylaktische, als auch für therapeutische Anwendungen als gut verträglich eingeordnet (Miao, 2021).
Seit Kurzem stellte sich heraus, dass mRNA eine bessere Alternative zu einer DNA-Impfung für die Prävention von Krankheiten und als anti-Tumor Behandlungsmethode ist. Man verwendet mRNA, da es sowohl in sich teilenden, als auch nicht teilenden Zellen translatiert wird und nur in das Zytoplasma eingeführt werden muss, wo es lediglich eine einstufige Translation mit dem gewünschten Antigen als Produkt zur Folge hat. Außerdem wird die mRNA nicht wie DNA-Stränge in das Genom integriert, womit keine Gefahr einer Insertion Mutation besteht. Eine Hürde bei der Verwendung von mRNA ist der Transport zum Zielgewebe, da RNA in freier Form extrem instabil und immunogen ist. Um dieses Problem zu umgehen, werden bereits Techniken getestet, wie ein Transport mit Lipidnanopartikel (LNP) oder polymeren und Peptid-Vesikeln (Sayour, 2018).
Sonstige RNA Therapeutika
RNA Therapeutika können nicht nur in der Tumortherapie verwenden werden. Die Zahl der Therapieansätze steigt durch die Möglichkeit der RNA Therapeutika bei vielen Krankheiten, für welche wir bisher leider noch keine Behandlungsoptionen zur Verfügung hatten.
Große Bedeutung haben die RNA Therapeutika zum Beispiel bei der Ausschaltung von den defekten Genen bei seltenen Erbkrankheiten, wie zum Beispiel der familiären Amyloid-Polyneuropathie (hATTR). Bei dieser Krankheit wird der unter dem Kapitel 3 beschriebene RNA Interferenz Mechanismus in dem sogenannten Patisiran benutzt, um den Krankheitsverlauf zu stoppen, beziehungsweise sogar Symptome zurückzubilden. Ein weiteres bereits in der EU zugelassenes Medikament, das den obigen Mechanismus nutzt, ist das Inclisiran, welches zur Behandlung der familären Hypercholesterinämie 2020 zugelassen wurde. Obwohl beide auf die Leber wirken, können sie dennoch individuell unterschieden werden (Patisiran wirkt auf TTR, Inclisiran auf PCSK9). Es gibt aber auch RNA Therapeutika, die auf das Auge wirken, wie Barmosiran, welches die okuläre Hyptertension kurieren soll (aktuell Phase 2, Stand April 2021), oder auf die Nieren, wie Teprasiran zur Behandlung eines akuten Nierenschadens (aktuell Phase 3, Stand April 2021) (Crooke, 2019).
Von einer anderen Richtung aus betrachtet, wird an den ASO also „Antisense-Oligonukleotid“-Mechanismen geforscht. Hierbei wird zum Beispiel durch das bereits zugelassene Nusinersen ein defektes Gen der spinalen Muskelatrophie (SMA) so verändert, dass nicht nur ein wieder funktionsfähiges Protein entsteht, sondern die betroffenen Kinder auch überleben können und sich trotzdem normal entwickeln (Müller, 2018).
Auch ein Wirkstoff dieser Gruppe ist das Fornivirsen, welches die CMV-Retinitis bei häufig unter AIDS leidenden Patienten verbessert. Es sind noch über 100 weitere RNA-Therapeutika in Phase 1-3 Testungen, was aber den Rahmen dieser Arbeit sprengen würde. Auch zu erwähnen ist, dass alle diese Medikamente auf unterschiedliche Gene spezialisiert sind und unterschiedlich verabreicht werden. Ebenfalls interessant ist es, dass zum Beispiel für Morbus Huntigten, HIV, Hepatitis B, chronische Migräne, Alzheimer und sogar Diabetes bereits vielversprechende Therapeutika in klinischen Studien vorhanden sind (Crooke, 2019).
Das RNA-Therapeutika also nicht nur eine „Heilung“ gegen Krebs versprechen, sondern auch deren Wichtigkeit im Kampf gegen alle Arten von Krankheiten in den kommenden Jahren, haben wir hoffentlich damit kurz aufzeigen können.
Vor- und Nachteile der RNA Therapeutika
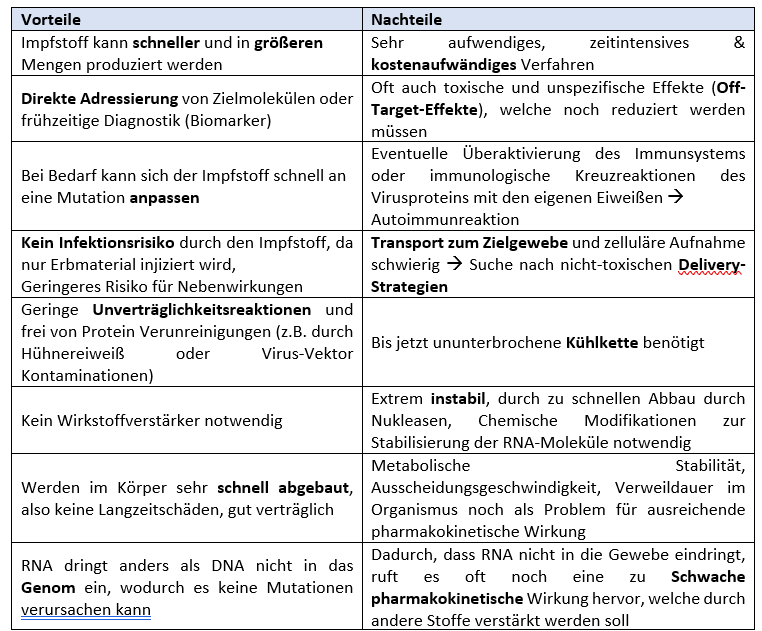
Die Vor- und Nachteile der RNA Therapeutika sollen anhand der folgenden Tabelle kurz aufgezeigt werden:
Tabelle 1 |
|
Vor- und Nachteile der mRNA Impfstoffe basierend auf Miao 2021, Sayour 2018 und Grünweller 2015. |
Möglichkeiten und Grenzen
In den vorangegangenen Kapiteln konnte man bereits erkennen, dass die RNA Therapeutika eine große Revolution in der Bekämpfung von vielfältigen Krankheiten einleiten, aber auch noch einige Hürden überwunden werden müssen. In Deutschland gibt es dabei sowohl ethische Bedenken, die zu strikten Restriktionen führen, als auch einen hohen Kostenaufwand für die Forschung und klinische Studien. In dem vorangegangenen Kapitel 4 wurden schon die Vor- und Nachteile der RNA Therapeutika aufgelistet, was auch die Möglichkeiten beziehungsweise zu überwindende Grenzen der Forschung auftut. Schwierig wird es aber vor allem im Hinblick auf die Einführung von RNA Therapeutika in der Tierwelt. Hier stoßen wir nämlich auf das zusätzliche Problem der Artenvielfalt, nicht nur zwischen den verschiedenen Tierspezies, sondern auch innerhalb deren Rassen (z.B. der Hunderassen) gibt es zahlreiche Unterschiede. Hinzukommt außerdem, dass uns derzeit nur ein begrenztes Wissen über das Immunsystem der Tiere zur Verfügung steht und infolgedessen gar nicht klar wird, welche Immuntherapie überhaupt passend wäre. Durch dieses Unwissen und die Rassenvariabilität entstehen zudem hohe Kosten, die wiederum effektive Studien verhindern. Zusätzlich will auch der Tierbesitzer häufig auf eher kostengünstige, klassische Behandlungen zurückgreifen, oder sogar die Euthanasie vorziehen (Klingemann, 2018).
Um die breiten Möglichkeiten der RNA Therapieansätze erfolgreich anwenden zu können, müssen noch die bestmöglichen Nukleinsäure-Modifikationen erforscht werden, wobei die Entwicklungsansätze rasant ansteigen und vor allem durch Covid19 positiv beeinflusst werden. Die Bedeutung der RNA Therapeutika vor allem in der Krebstherapie wurde durch diesen Artikel deutlich gemacht. Die mRNA Therapeutika in der Krebsimmuntherapie werden die Medizin noch lange begleiten. Sie ermöglicht uns eine individuelle Behandlung der verschiedenen Tumorarten, wodurch maßgeschneiderte Therapien entstehen. Durch sie ist ein elementarer Schritt in der Heilung gegen Krebs erfolgt (Höland, 2021).
All das wird schneller möglich durch die aktuelle Pandemie, die wenigstens auf die Entwicklung noch zahlreicher weiterer RNA Therapeutika einen positiven Einfluss hat.
Quellenverzeichnis
Fachartikel/Fachzeitschriften
- Bergman PJ. (2018). Veterinary Oncology Immunotherapies. Vet Clin North Am Small Anim Pract. Mar; 48(2):257-277.
- Burnett JC., Rossi JJ. (2012): RNA-based therapeutics: current progress and future prospects. Chem Biol. 27;19(1):60-71.
- Cluff CW. (2010): Monophosphoryl lipid A (MPL) as an adjuvant for anti-cancer vaccines: clinical results. Adv Exp Med Biol. 1(667):111-123.
- Crooke ST., Witztum JL., Bennett CF., Baker BF. (2018): RNA-Targeted Therapeutics. Cell Metab 5;29(2):501.
Diederichs S. (2010): Nichtcodierende RNA in malignen Tumoren. Pathologe 31(2):258–262. - Grünweller A. & Hartmann R. (2015): Chemical modifications of nucleic acids for RNA-based therapeutics. Pharmakon 3:(4) 263-270.
Klingemann H. (2018): Immunotherapy for Dogs: Running Behind Humans. Front Immunol. Feb 9(5):133. - Miao L., Zhang Y, & Huang L. (2021): mRNA vaccine for cancer immunotherapy. Molecular Cancer 20(1):41
- Reinberger S., Anders D., Bushe F., Schulte D., Westner L., Kees T., Ohnewald M., Brockschmidt L., Eberhard-Metzger C., Schön A. (2010): Waffen des Immunsystems. Einblick 41(1):40
- Röcken C. (2011): Die Rolle der Mikro-RNA bei der Entstehung onkologischer Erkrankungen. Onkologe 17(1):487–494.
- Sayour EJ., Hector R. M-G, Mitchell DA. (2018): Cancer Vaccine Immunotherapy with RNA-Loaded Liposomes. International Journal of Molecular Sciences 19(10):2890.
- Song Y., Song J., Wei X., Huang M., Sun M. Zhu L., Lin B. Shen H., Zhu Z., Yang C. (2020): Discovery of Aptamers Targeting the Receptor-Binding Domain of the SARS-CoV-2 Spike Glycoprotein. Analytical Chemistry 92(14):9895-9900.
- Verbeke R., Lentacker I., De Smedt SC., Dewitte H.(2021): The dawn of mRNA vaccines: The COVID-19 case. Journal of Controlled Release 333(1):511-520.
Fachbücher
Abeloff M., Armitage J., Neiderhuber J., Kastan M., McKenna W.(2013): Abeloff's Clinical Oncology. 5th Edition, ISBN: 9781455728657
Webquellen
Fey A. (2020): Was Sie jetzt zum mRNA-Impfstoff von Biontech wissen müssen at: https://www.hr-inforadio.de/programm/das-thema/corona-was-sie-jetzt-zum-mrna-impfstoff-von-biontechwissen-muessen,was-ist-mrna-100.html [last accessed April 14, 2021]
Höland C. (2021): mRNA-Technologie: Eine Goldgrube für den Standort Deutschland? at: https://www.rnd.de/wirtschaft/corona-impfstoff-mrna-technologie-eine-goldgrube-fur-deutschland-TM6XNCPD6JEEHNZTEO237NGSVY.html [last accessed April 14, 2021].
Höpken UE. (2016): Immunonkologie: Mit dem Immunsystem den Krebs bekämpfen at: https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/basis-informationen-krebs-allgemeine-informationen/immunonkologie-mit-dem-immunsys.html [last accessed März 15, 2021]
Müller T. (2018): RNA-basierte Therapeutika starten durch at: https://www.aerztezeitung.de/Medizin/RNA-basierte-Therapeutika-starten-durch-230639.html [last accessed April 10, 2021
Abbildungen und Tabellen
- Abbildung 1: eigene Abbildung basierend auf Bergman, 2018 und Höpken, 2016
- Abbildung 2: eigene Abbildung basierend auf Grünweller (2015, Seite 265, Abb. 2)
- Tabelle 1: eigene Tabelle basierend auf Miao 2021, Sayour 2018 und Grünweller 2015.
Autoren: Julia Rüdinger, Lucca Wagner und Tamara Schmid