Immunologischer Hintergrund der RNA Therapie
von Philipp Ivanschitz, Jannes Koch, Anna-Maria Maierhofer
Abkürzungsverzeichnis
RNA |
Ribonukleinsäure |
DNA |
Desoxyribonukleinsäure |
mRNA |
messenger RNA |
rRNA |
ribosomale RNA |
tRNA |
transfer RNA |
siRNA |
small interferring RNA |
RNAi |
RNA Interferenz |
dsRNA |
doppelsträngige RNA |
RISC |
RNA-Induced Silencing Complex |
RLC |
Risc-Loading-Complex |
AS-ONs |
Antisense-Oligonukleotide |
miRNA |
micro RNA |
aRNA |
antisense RNA |
Einleitung
Die vorliegende Arbeit beschäftigt sich mit der Thematik der RNA Therapien. Zunächst werden die Voraussetzungen für das weitere Verständnis der Arbeit geschaffen. Darunter fallen die charakteristischen Merkmale der Ribonukleinsäure, sowie der grundlegende Aufbau. In diesem Zusammenhang werden auch die Unterschiede zur Desoxyribonukleinsäure (DNA) erläutert. Weiters wird der synthetische Vorgang sowie der Abbau der RNA beleuchtet. Die medizinische Wichtigkeit der RNA bildet den Abschluss für den zweiten Gliederungspunkt und somit ist die Voraussetzung für die kommenden Punkte gesetzt.
Das dritte Kapitel beschäftigt sich mit der RNA Therapie an sich. Den Vorgang zum Gen-Silencing empfanden wir hier als besonders wichtig, weswegen wir darauf genau eingehen werden. Man unterscheidet die Genstummschaltung durch RNA-Interferenz, welche auf der Hemmung eines Gens durch doppelsträngige RNA (dsRNA) basiert und durch Antisense Oligonukleotide, welche gezielt im Zuge einer komplementären Basenpaarung an eine mRNA bindet, somit sie in ihrer Funktion gehemmt wird.
Das letzte Kapitel diskutiert den Immunologischen Hintergrund, wobei wir vor allem die RNA-basierte Immunisierung in den Vordergrund stellen. Ferner werden die Anwendungsgebiete einer RNA Therapie besprochen und wie der immunologische Hintergrund bei einer mRNA Krebsimmuntherapie aussieht. Des Weiteren wird ein Vergleich zu den mRNA SARS COVID 19 Impfstoffen gezogen und die unterschiedliche Wirkungsweise dieser immunologischen Therapie aufgezeigt.
Charakteristisches der RNA
Die Ribonukleinsäure gehört zu den Nukleinsäuren. Das bedeutet, die RNA besteht aus einer Kette von vielen Nukleotiden. Diese setzen sich aus einer organischen Base, einer Pentose und einem Phosphat-Rest zusammen. Nukleinsäuren bilden die viert größte Gruppe der Biomoleküle, neben Proteinen, Kohlenhydraten und Lipiden. Sie enthalten bei allen Organismen die genetische Information und kommen in allen lebenden Zellen vor (Marx, 2005). Der bekannteste Vertreter der Nukleinsäuren ist die Desoxyribonukleinsäure auch als DNA bekannt. Bei allen Lebewesen funktioniert die DNA als Speicher der Erbinformationen. Ausnahmen zeigen Viren, bei denen die Ribonukleinsäure in dieser Speicherfunktion vorkommt anstatt der DNA (Könighoff, Brandenburger, 2018). Wie bereits erwähnt ist die RNA ein wichtiges Molekül für die Umsetzung der Erbinformation und dient hierbei als Zwischenspeicher. So werden verschiedene Varianten unterscheiden:
- mRNA (=Messenger RNA): die mRNA ist dafür zuständig die genetische Information aus dem Zellkern zu den Ribosomen zu bringen
- rRNA (= Ribosomale RNA): nimmt an der Strukturbildung der Ribosome teil
- tRNA (= Transfer-RNA): vermittelt in den Ribosomen den Einbau einzelner Aminosäuren in die wachsende Proteinkette
- siRNA (= small interferring RNA) oder miRNA (= micro RNA): beteiligt an der Regulation von zellulären Prozessen (Marx, 2005)
Die Aufgabe der einzelnen RNA Varianten ist nicht vollständig aufgeklärt, dennoch ist bekannt, dass bestimmte RNAs gezielt Gene abschalten und somit die Umsetzung der genetischen Information in Proteinen verhindert, auch bekannt unter RNA Interferenz.
Aufbau und Unterschied der RNA zur DNA
Der Aufbau der Ribonukleinsäure ähnelt jener der DNA. Sie setzt sich aus vier unterschiedlichen Nukleosidmonophosphaten zusammen, welche aus einer Ribose, einer der vier Basen Adenin, Cytosin, Guanin oder Uracil und einem Phosphatrest besteht. Adenin, Cytosin und Guanin kommen auch in der DNA vor, statt Uracil hingegen Thymian als komplementäre Base. Das ringförmige Zuckermolekül bildet hierbei den zentralen Teil des Nukleotids, welches 5 Kohlenstoffatome besitzt. Am ersten Kohlenstoffatom des Zuckermoleküls ist eine Nukleinbase über eine glykosidische Bindung angeknüpft. Am 3. Kohlenstoffatom hat ein Phosphatrest des nachfolgenden Nukleotids mit der Hydroxygruppe des Zuckers eine Esterbindung gebildet. Ein Phosphatrest ist an das 4. Kohlenstoffatom gebunden. Drei OH-Gruppen sind in einer Nukleinsäure verestert, somit ist die Freisetzung eines Protons an diesen Stellen nicht mehr möglich. Bis auf eine Hydroxyl-Gruppe ist die Ribose der RNA mit jener der DNA gleich. Dieser kleine Unterschied verursacht, dass die RNA nicht so stabil wie die DNA ist, da eine Hydrolyse durch Basen ermöglicht werden kann. Ein weiterer Unterschied besteht darin, dass die DNA doppelsträngig und die Ribonukleinsäure in der Regel einzelsträngig ist (Marx, 2005). Die nachfolgende Abbildung zeigt die Ribonukleinsäure im Vergleich mit der Desoxyribonukleinsäure.
Abbildung 1: RNA im Vergleich mit der DNA
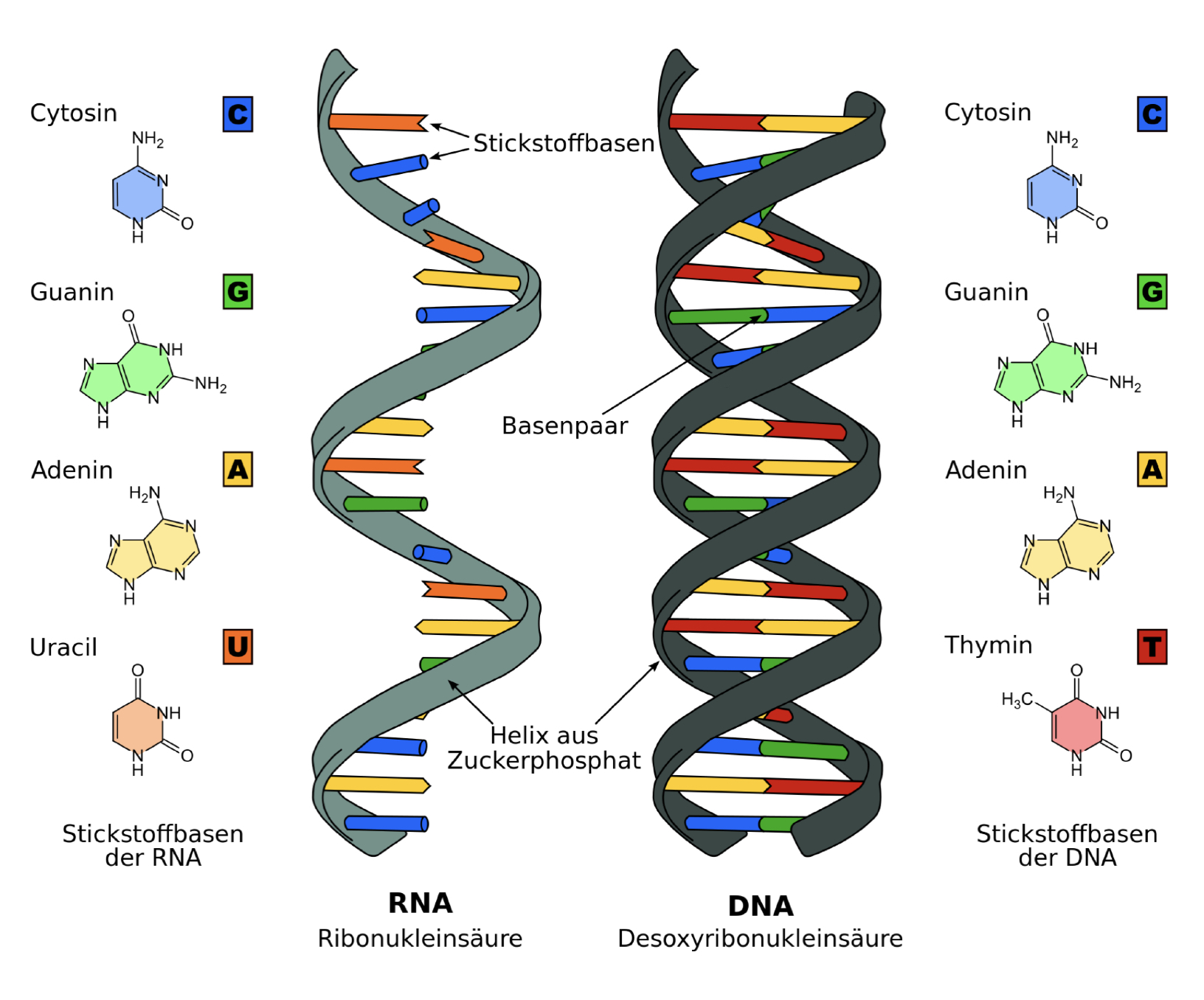
Quelle: Wikipedia.de
Synthese und Abbau von RNA
Das Enzym RNA-Polymerase katalysiert an der DNA seitens den Ablauf der Transkription aus Nukleosidtriphosphat (NTP) die RNA. Das heißt die Information der DNA wird zur RNA umgewandelt. Zu diesem Zweck setzt sich die RNA-Polymerase an eine Promoter genannte DNA-Sequenz (Transkriptionsinitiation). Darauf folgend trennt sie die DNA-Doppelhelix anhand Lösen der Wasserstoffbrücken in einem kurzen Bereich in zwei DNA-Einzelstränge auf. Am codogenen Strang der DNA lagern sich seitens Basenpaarung komplementäre Ribonukleotide an. Sie werden unter Eliminierung eines Pyrophosphats mithilfe einer esterartigen Bindung inmitten von Phosphorsäure und Ribose zusammen verknüpft. Die Ableserichtung der DNA verläuft vom 3´-Ende zum 5´-Ende, die Synthese der komplementären RNA vom 5´- zum 3´-Ende. Die Öffnung der DNA-Doppelhelix geschieht ausschließlich in einem kurzen Bereich, in dieser Art, dass der allemal synthetisierte Teil der RNA aus solcher Öffnung heraushängt und zwar mit dem 5´-Ende der RNA voran. Die Synthese der RNA wird an einer Terminator-Sequenz beendet. Danach wird das RNA-Transkript entlassen und die RNA-Polymerase löst sich von der DNA (Marx, 2005). Abbildung 2 zeigt die drei Phasen der RNA Synthese auf.
Abbildung 2: Synthese der RNA
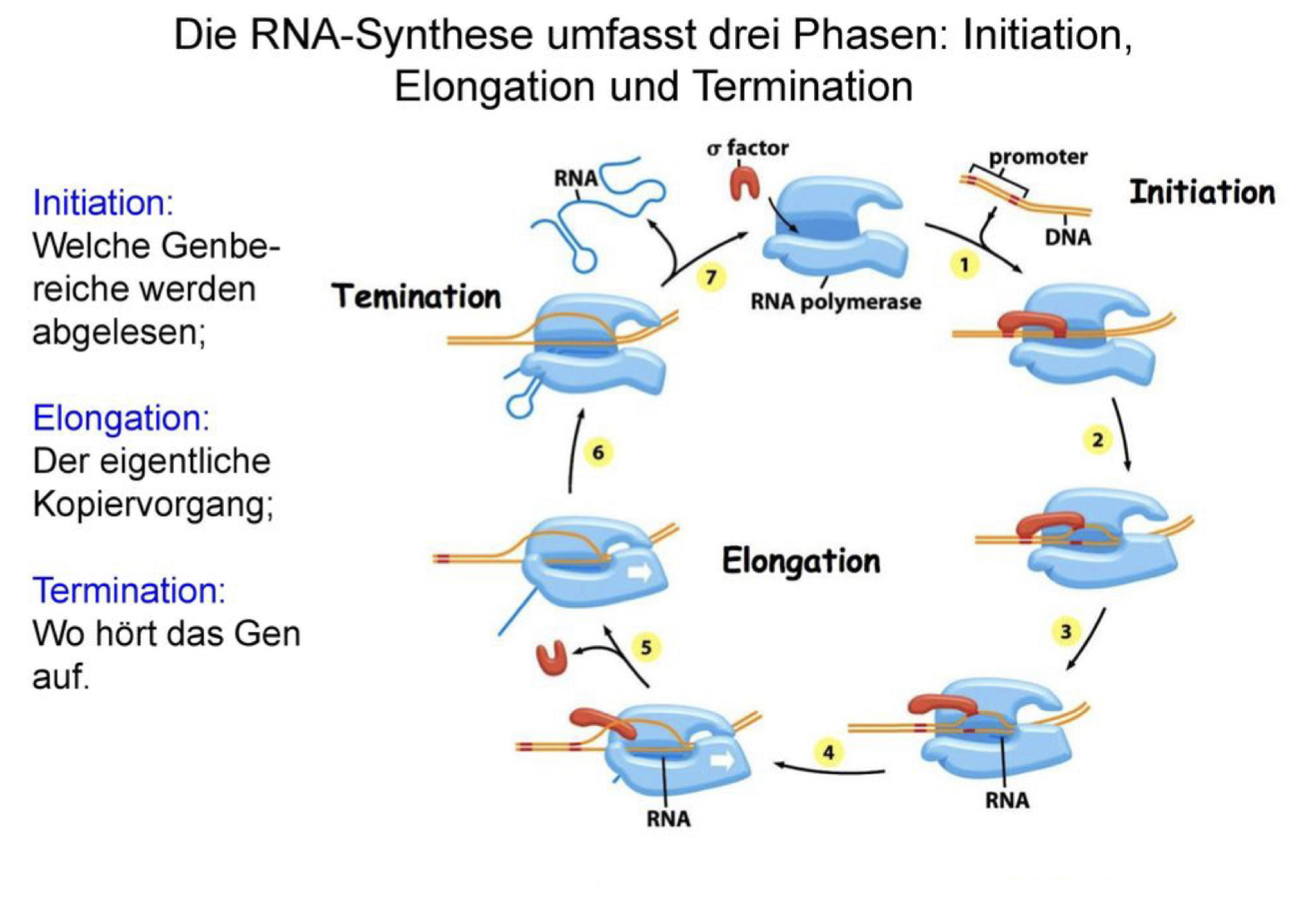
Quelle: Docplayer.org
Da immer neue RNA gebildet wird und hierfür bei unterschiedlichen Zeitpunkten verschiedene Transkripte gebraucht werden (differentielle Genexpression), darf die Stabilität der RNA in einer Zelle nicht zu hoch sein, sondern muss auch abgebaut werden können. Mit Hilfe von RNasen und Enzymen wird dies möglich, da die Verbindungen des Zucker-Gerüstes der RNA getrennt wird und somit Monomere beziehungsweise Oligomere gebildet werden können. Diese Wiederrum können zur Synthese von neuer Ribonukleinsäure verwendet werden. Zeitpunkt eines Abbaus der RNA wird unter anderem durch die Länge des Poly-A-Schwanzes erkannt. Je länger dieser im Cytoplasma verweilt, desto kürzer wird er. Erreicht die Länge einen kritischen Wert wird die RNA schnell degradiert. Eine weitere Regulation ermöglichen die stabilisierenden oder destabilisierenden Elemente einer RNA. Hervorzuheben bei dem Abbau der mRNA von Eukaryoten ist, dass der Abbau in den sogenannten Processing Bodies statt findet, diese besitzen sehr viele RNAsen und RNA turnover beteiligte Enzyme. Im Kombination mit den Stress Granules sind sie für die kurzzeitige Lagerung von mRNA und zeigen die enge Verknüpfung des RNA Metabolismus (Marx, 2005). Der Abbau der RNA wird in der dritten Abbildung nochmal bildlich dargestellt.
Abbildung 3: Abbau der RNA
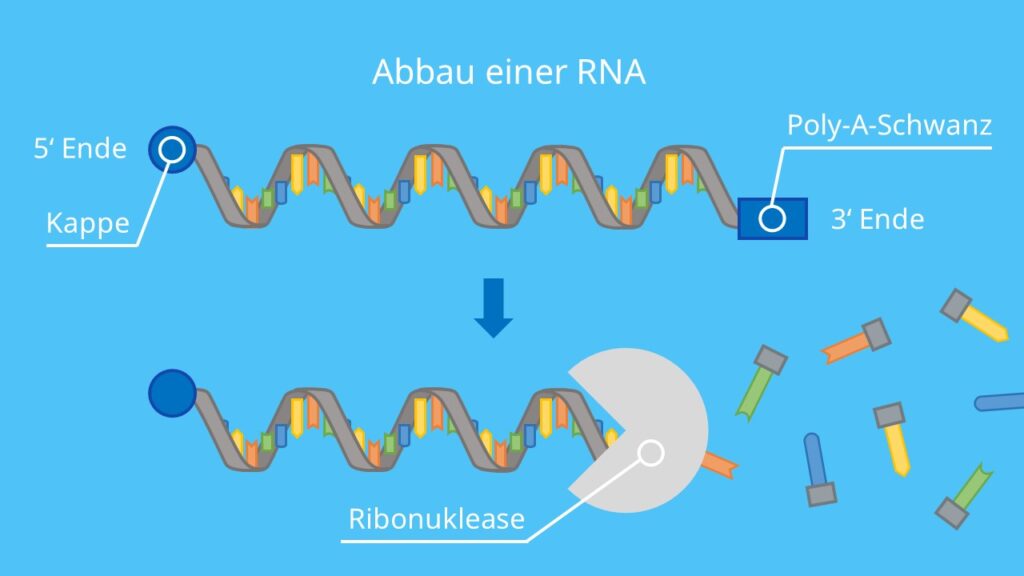
Quelle: Studyflix.de
Anwendungsgebiete und medizinische Relevanz
Obwohl das Konzept der RNA-Therapeutika recht jung erscheint, forscht die Medizin schon seit fast 20 Jahren an diesen. Bestimmte nicht kodierende RNAs (ncRNAs) wurden in den vergangenen Jahren untersucht, welche von Bedeutung für verschiedene Krankheitsprozesse sein könnten. Dazu gehören beispielsweise: miRNA, siRNA und piRNAs. Deren exakter, therapeutischer Mechanismus wird im Zuge der RNA Interferenz und der Antisense Oligonukleotide erläutert (Grünwäller, Hartmann 2015).
Doch nicht nur in der Krebsforschung und der Immunologie zeigen RNA-Therapeutika zunehmend Potential. Seit der Entdeckung der RNA-Interferenz (RNAi) oder der Antisense-RNA (aRNA) taten sich Möglichkeiten auf, in die Genexpression und die Proteinbiosynthese der Zelle einzugreifen. Somit gelingt es zunehmend bessere Therapiemöglichkeiten für selten auftretende Erbkrankheiten zu finden, wie zum Beispiel gegen spinale Muskelatrophie, mit dem Wirkstoff Nusinersen oder zur Senkung des Cholesterinspiegels mit Inclisiran (Overbeck, 2019).
Viele weitere RNA-basierte Medikamente befinden sich in der Entwicklung und andere schon in der klinischen Studie. Somit erhofft man sich bald schon Krankheiten wie Morbus Huntington und Amyloid-Polyneuropathie (FAP) heilen zu können. Doch bei erblich bedingten Erkrankungen endet das Potential der RNA-basierten Therapeutika noch lange nicht. Volkskrankheiten wie Alzheimer, Asthma, HIV oder Diabetes stehen ebenfalls schon im Fokus der Forschung (Müller, 2018).
RNA Therapie
RNA basierte Genstummschaltung
Die spezifische Unterdrückung der Expression bestimmter Gene stellt einen bedeutenden Ansatz bei der Erforschung RNA-basierter Therapien dar. Daher werden im Folgenden Kapitel auf zwei mögliche Mechanismen dazu, sowie auf das therapeutische Potential der RNA basierten Genstummschaltung genauer eingehen.
RNA Interferenz
Bei der RNA-Interferenz, abgekürzt RNAi, handelt es sich um einen „hochgradig konservierten Vorgang post transkriptionaler Genregulation“ (Schaar, 2017). Gemeint ist ein nach der Transkription stattfindender Vorgang in der Zelle, bei dem die Ausprägung eines Gens durch doppelsträngige RNA (dsRNA) sequenzspezifisch gehemmt wird. Heute wird der ebenso natürlich vorkommende Mechanismus zur Identifizierung von Genfunktionen verwendet und als therapeutischer Ansatz unterschiedlicher Krankheiten erforscht (Kreutzer et al, 2006, Kurreck. 2009).
Entdeckung Den Genstummschaltungsprozess, auf dessen Grundlage die RNA-Interferenz beruht, kannte man ursprünglich aus pflanzlichen Zellen, wo er zu Genregulation während der Entwicklung der Pflanzen und zur Virenabwehr dient (Dietz-Pfeilstetter, 2001, Kurrek 2009). Im Jahre 1998 konnten die beiden Wissenschaftler Andrew Fire und Craig Mello richtungsweisende Ergebnisse aus einem RNA-Interferenz-Experiment am Fadenwurm publizieren, wofür sie im Jahr 2006 den Nobelpreis für Medizin und Physiologie erhielten. Dabei injizierten sie lange dsRNA in den Caenorhabditis elegans, worauf eine Inhibition der Expression von Genen erfolgte. Betroffen von der Hemmung waren Gene, deren mRNA-Sequenz komplementär zur injizierten RNA war (Dietz-Pfeilstetter, 2021, Rothe 2011).
Mechanismus Zu Beginn wird die dsRNA in der Zelle durch das Enzym Dicer in kleinere RNA-Fragmente, die sogenannten siRNAs (short interfering RNAs) geschnitten. Diese weisen eine Länge von rund 21 Nucleotiden auf, wobei an den 3´Enden jeweils 2 Nucleotide überstehen. In einem weiteren Schritt belädt sich der Proteinkomplex RISC (RNA - Induced Silencing Complex) der siRNA. Diese Beladung dürfte nach heutiger Kenntnis durch einen weiteren Komplex, den Risc-Loading-Complex (RLC) stattfinden. In dem aus mehreren Proteinen bestehenden RISC wird ein Strang der doppelsträngigen siRNA abgetrennt und abgebaut, während der andere darin bleibt.
Durch den enthaltenen siRNA-Strang findet der RISC zu einer komplementären Ziel-mRNA, welche dann durch das Protein Argonaut 2 (Ago2) gespalten wird und anschließend mit Hilfe von RNasen abgebaut wird. Letztlich wird die Ausprägung des Gens von dem die mRNA stammt, verhindert, da das von ihr zu bildende Protein nicht hergestellt wird (Kurrek, 2009). Neben der siRNA weckten außerdem noch weitere kurze RNAs das Interesse vieler Forscher in den letzten Jahren. Vor allem die endogene miRNA (micro RNA), welche ebenfalls fähig ist, eine RNA-Interferenz auszulösen, wurde dabei genauer untersucht (Kurrek, 2009; Rothe, 2011).
Abbildung 4: Zellulärer Mechanismus der RNA-Interferenz
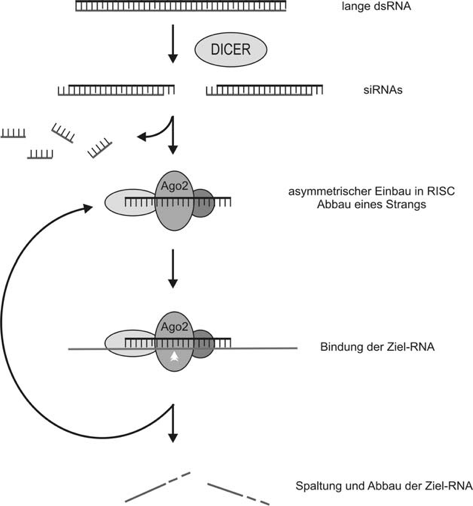
Quelle: Kurrek et al, 2008
RNA Interferenz als therapeutische Möglichkeit Mit der Einbringung von künstlich hergestellten kleinen dsRNA Molekülen, welche man siRNAs nennt, konnte der Vorgang der RNAi auch in Zellen von Säugetieren nachgewiesen werden (Rothe, 2011).
Diese Erkenntnis machte den Mechanismus der RNA-Interferenz medizinisch noch relevanter, da sich bis dahin bei der Anwendung in Säugerzellen Probleme erwiesen. Die lange dsRNA, wie sie im Experiment am Wurm von Fire und Mello verwendet wurde, bewirkt nämlich in den Zellen der Säugetiere eine unspezifische Hemmung der Translation durch Aktivierung der Proteinkinase R (Martens- &Nellen, 2002; Kurrek 2009). Das therapeutische Potential der RNAi wurde daraufhin durch verschiedene in vivo-Studien zum Vorschein gebracht. So konnte beispielsweise eine Studie an Mäusen beweisen, dass die Ausprägung einer Leberzirrhose im Zuge einer Autoimmunhepatitis durch die Behandlung mit kurzer interferierender RNAs verhindert werden kann (Rothe, 2011).
Die Erkrankungen, bei denen RNA-Interferenz als Therapieansatz dienen kann, sind sehr vielfältig. So wird die RNAi als antivitale Strategie im Kampf gegen Adenovirus-Infektionen oder HIV, aber auch als Krebs-Therapeutika erforscht. Darüber hinaus berichteten jüngste Studien über eine siRNA-basierten Arzneistoff namens Inclisiran, welcher in der Lipidtherapie zur Senkung des LDL-Cholesterins eingesetzt werden könnte (Schepers et al, 2005; Schaar, 2017; Hubert, 2021).
Antisense-Oligonukleotide
Eine weitere Möglichkeit der posttranskriptionalen Genstummschaltung bieten neben den Small interfering-RNAs die Antisense-Oligonukleotide (AS-ONs). Es handelt sich um synthetische Nucleinsäuren, welche gewöhnlicher Weise aus 15 - 20 Nucleotiden aus einer frei wählbaren Basenabfolge aufgebaut sind. Sie binden im Zuge komplementärer Basenpaarung an eine gezielte mRNA, wodurch diese in ihrer Funktion gehemmt wird und anschließend das Zielprotein dieser mRNA nicht gebildet werden kann. Die Herstellung anderer Proteine wird dadurch nicht beeinflusst (Hartmann et al, 1998; Kurrek et al, 2008).
Der molekulare Funktionsmechanismus von Antisense-Oligonukleotiden ist nicht immer derselbe, sondern kann grundsätzlich auf drei Arten erfolgen. Einerseits kann das AS-ON bei der Translation ansetzen. Dabei führt die Bindung an die mRNA, zu einer sogenannten streichen Blockade, worauf die Anlagerung von Ribosomen und weiter die Proteinbildung nicht mehr möglich ist. Zudem gibt es eine Variante, bei der die Antisense-Nukleotide durch Unterstützung der Ribonuklease H wirken, indem diese den Komplex, bestehend aus AN-ON und mRNA entdeckt und infolge die mRNA-Komponente spaltet und inaktiviert. Ein letzter Wirkmechanismus der AN-ONs ist ihr möglicher Einfluss auf das Spleißen. So konnten beispielsweise bestimmte Antisense-Oligonukleotide entwickelt werden, die pathogene Spleißmuster bei der Blutkrankheit Beta-Thalasämie korrigieren und somit die Synthesestörung des Globinanteils des Hämoglobins verhindern. Auch in der Krebsforschung bedient man sich dem Mechanismus der AS-ONs mit Erfolg. Sie werden dabei für die Unterdrückung potenzieller Tumorgene verwendet (Kurrek et al, 2009; Uhlmann, 1998; Clark & Pazdernik, 2009).
Im Jahre 2017 wurde darüber hinaus ein Arzneistoff aus der Klasse der Antisense-Oligonukleotide zur Behandlung spinaler Muskelatrophie in Deutschland zugelassen. Er wirkt über seinen Einfluss am Spleißen und sorgt dafür, dass funktionierendes SMN-Protein hergestellt wird (Giese et al, 2018).
Abbildung 5: Wirkmechanismus der Antisense-Oligonucleotide
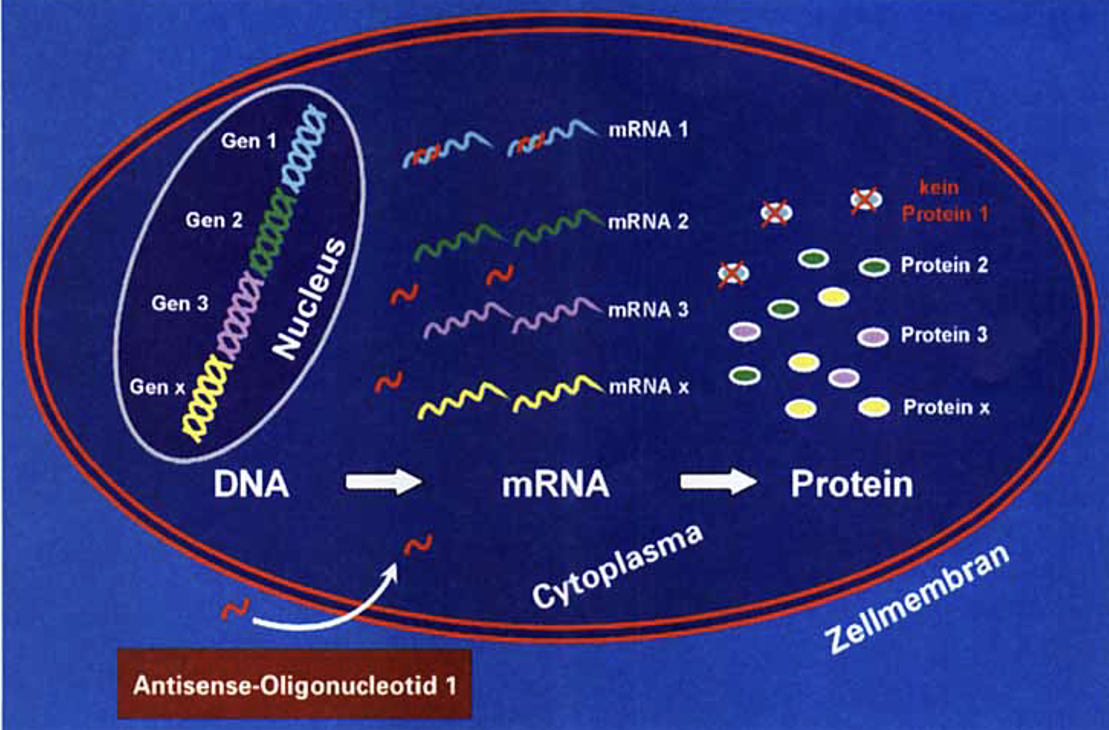
Quelle: Uhlmann, 1998
Immunologischer Hintergrund
Die Lehre von biologischen und auch biochemischen Grundlagen bildet die Grundlage der Immunologie. Nachfolgend wird die Immunologische Tumortherapie, sowie der SARS COVID 19 Vakzine erläutert. Das Immunsystem ist durchweg in der Lage Tumorzellen erkennen zu können und zu eliminieren. Nichts desto Trotz können auch Tumorzellen der Immunüberwachung entkommen. Somit stützt sich der Grundgedanke der Immuntherapie, das körpereigene Abwehrsystem so zu mobilisieren, dass es in der Lage ist maligne Zellen wieder zu erkennen und zu beseitigen. Es wurden bereits in den vergangenen Jahren unterschiedliche immunologische Therapiestrategien entwickelt, darunter auch Tumorvakzinen (Dietrich, Theobald, 2015).
mRNA-Krebsimmuntherapie und mRNA Impfstoff gegen COVID 19
Unter den RNA-Therapeutika gibt es in ihrer Art und Wirkungsweise wesentliche Unterschiede. RNA-Therapeutika können wie erwähnt Einfluss auf die Genexpression und Proteinbiosynthese der Zelle nehmen, indem sie blockierend auf die Translation von Genen wirken. Doch nicht nur dies kann Ziel der RNA-Therapie sein, sondern auch die RNA basierte Immunisierung gegen Krebs und Viren ist dabei von Bedeutung. Wie bereits in den vorherigen Absätzen erwähnt, spielt die RNA Immuntherapie in der Krebsforschung eine wichtige Rolle. Diese Therapieform zielt darauf ab, Tumormutationen zu erkennen, hierbei wird ihr Bauplan entschlüsselt. Die Schwierigkeit bei dieser Therapie ist die genetische Erkennung der Tumorzellen, da diese sehr unterschiedlich sind. Dafür muss für jeden Patienten ein individueller mRNA Impfstoff hergestellt werden. Diese maßgeschneiderte Impfstoff Herstellung ist bei der Bekämpfung von Viren nicht nötig, da das jeweilige zu erkennende Virus unabhängig vom Wirt immer gleich ist (Henschel, 2021).
Bei herkömmlichen Impfstoffen benötigt man Krankheitserreger oder deren Bestandteile, diese werden bei einem mRNA Impfstoff nicht benötigt. Bezüglich des COVID 19 Virus wird ein Teil der Virus-RNA in stabilisierter Form der Zelle zugeführt und dann von Ribosomen in Proteine übersetzt. Das heißt konkret der Bauplan für Virusproteine, so genannte Antigene können gebildet werden. Somit kann der Impfstoff das Spike Protein erkennen und codieren. Das Immunsystem wird somit aktiviert (Moder, 2021). Diese Antikörper können daraufhin beim Kontakt mit dem vollständigen Virus, nur aufgrund der vorherigen Immunisierung durch virusspezifische Proteine, diese erkennen und bekämpfen (Biontech, 2021).
RNA-Therapeutika wirken zwischen Translation und Proteinsynthese. Herkömmliche traditionelle Therapeutika oder Antikörper können dieses Feld nicht erreichen.
Fazit
Die RNA Therapie hat in den letzten Jahren immer mehr an Bedeutung gewonnen. Ihr großes therapeutisches Potential lässt Hoffnung aufwarten unterschiedlichste, schwere Krankheiten effektiver behandeln zu können. Eine Inhibitation der Genexpression bis hin zur mRNA basierten Immunisierung gegen Virusinfektionen sind mögliche Ansätze dieser Therapieform.
Zwar ist es bis heute nicht möglich eine Impfung gegen Krebs zu erhalten, jedoch konnte das Wissen der vorangegangenen Forschungen zügig für die Entwicklung eines mRNA Impfstoffes eingesetzt werden in der aktuellen SARS COVID 19 Pandemie. Zu dem erhofft man sich aus den den gesammelten Daten der aktuellen Impfstoffkampagne neue Erkenntnisse für die weitere Entwicklung eines Krebs Impfstoffes erhalten zu können. Ebenfalls stehen noch mögliche Nebenwirkungen von RNA basierten Therapien ihrem Einsatz als Standardtherapie für bestimmte Krankheiten im Wege.
Bei der RNA Interferenz-Therapie müssen noch Feinheiten bezüglich der Spezifität weiterentwickelt werden und auch der Transport der applizierten siRNAs zur Wirkstelle muss verbessert werden.
Zusammenfassend ist zu sagen, dass das Potential der RNA-Therapie enorm groß ist und man somit erwarten kann, dass in Zukunft die medizinische Relevanz dieser Therapieform weiter steigen wird.
Literatur
Dipl.-Ing. Schaar K. (2017): RNA- Interferenz-basierte Therapien bei Adenosvirusinfektionen im immunsupprimierten Wirt
Dipl.-Biochemikerin Rothe D. (2011): RNA-Interferenz-basierte Strategien zur Inhibition von Picornaviren
Dietrich K., Theobald M. (2015): Immunologische Tumortherapie Martens H., Zellen W. (2015): Epigenetisches Genesilencing RNA Interferenz und Antisense RNA, BIOspektrum 4/02, 8. Jahrgang
Schepers U., Cryns A., Anheuser S. : RNAi 2005: Rückblick und Perspektiven, BIOspektrum, Sonderausgabe, 11. Jahrgang
Hartmann G., Bidlingmaier M. et al (1998): Antisense-Oligonukleotide, Deutsches Ärzteblatt 95, Heft 24
Giese K., Wisch H., Hahn A. (2018): Therapie der 5q-assoziierten Spinalen Muskelatrophie mit Nusinersen - erste Erfahrung, Neuropädiatrie in Klinik und Praxis, 17 Jg. (Nr. 2)
Dietz-Pfeilstetter A. (2021): Die Bedeutung von RNA-Interferenz (RNAi) als neues Wirkprinzip für den Pflanzenschutz mit hoher Spezifität
Hubert M. (2021): Mit RNA-Interferenz gegen hohe LDL-Spiegel
Dr. Uhlmann E. (2004): Antisense-Oligonucleotide - ein universelles Therapieprinzip
Marx J.: P-Bodies Mark the Spot for Controlling Protein Production. Science: 2005; 4 Vol. 310. no. 5749
Könighoff M., Brandenburger T. (2018): Aufbau der DNA und der RNA, Biochemie, Thieme Verlag, 4. Auflage
Overbeck P. (2019): Erste Daten für zwei neue RNA-basierte Therapieansätze bei schwerer Hypertriglyzeridämie
Müller T. (2018): RNA-basierte Therapeutika starten durch Biontech (2021): mRNA-Impfstoffe zur Bekämpfung der COVID 19 Pandemie
Kiss P. (2021): Wie mRNA auch bei der Heilung von Krebs helfen könnte
Abbildungsverzeichnis
Abbildung 1: RNA im Vergleich mit der DNA
Abbildung 2: Synthese der RNA
Abbildung 3: Abbau der RNA
Abbildung 4: Zellulärer Mechanismus der RNA-Interferenz
Abbildung 5: Wirkmechanismus der Antisense-Oligonukleotide
