Az RNS terápia immunológiai háttere
Contents
1. Bevezetés
Az RNS terápia a tudomány fejlődésének köszönhetően egyre szélesebb körben válik alkalmazhatóvá, és ezáltal új lehetőségeket nyit a különböző betegségek kezelésére. Az RNS-terápia számos betegségnek adhat forradalmian új gyógymódot. Rengeteg kutatást végeznek, hogy minél hatékonyabb és biztonságosabb módszert találjanak a klinikai alkalmazására. Kiemelt kutatási irányok a daganatos, a szív-és érrendszeri, illetve immunológiai betegségek kezelése és az ezekkel szembeni hatékony gyógyszerek fejlesztése. Ezek közül különösen ígéretes a módosított mRNS, illetve a kis interferáló RNS (siRNS) alkalmazása, amivel a genetikai információt a megfelelő sejtekhez juttathatjuk el biztonságos módon.
1.1. Az RNS terápia alkalmazási területei
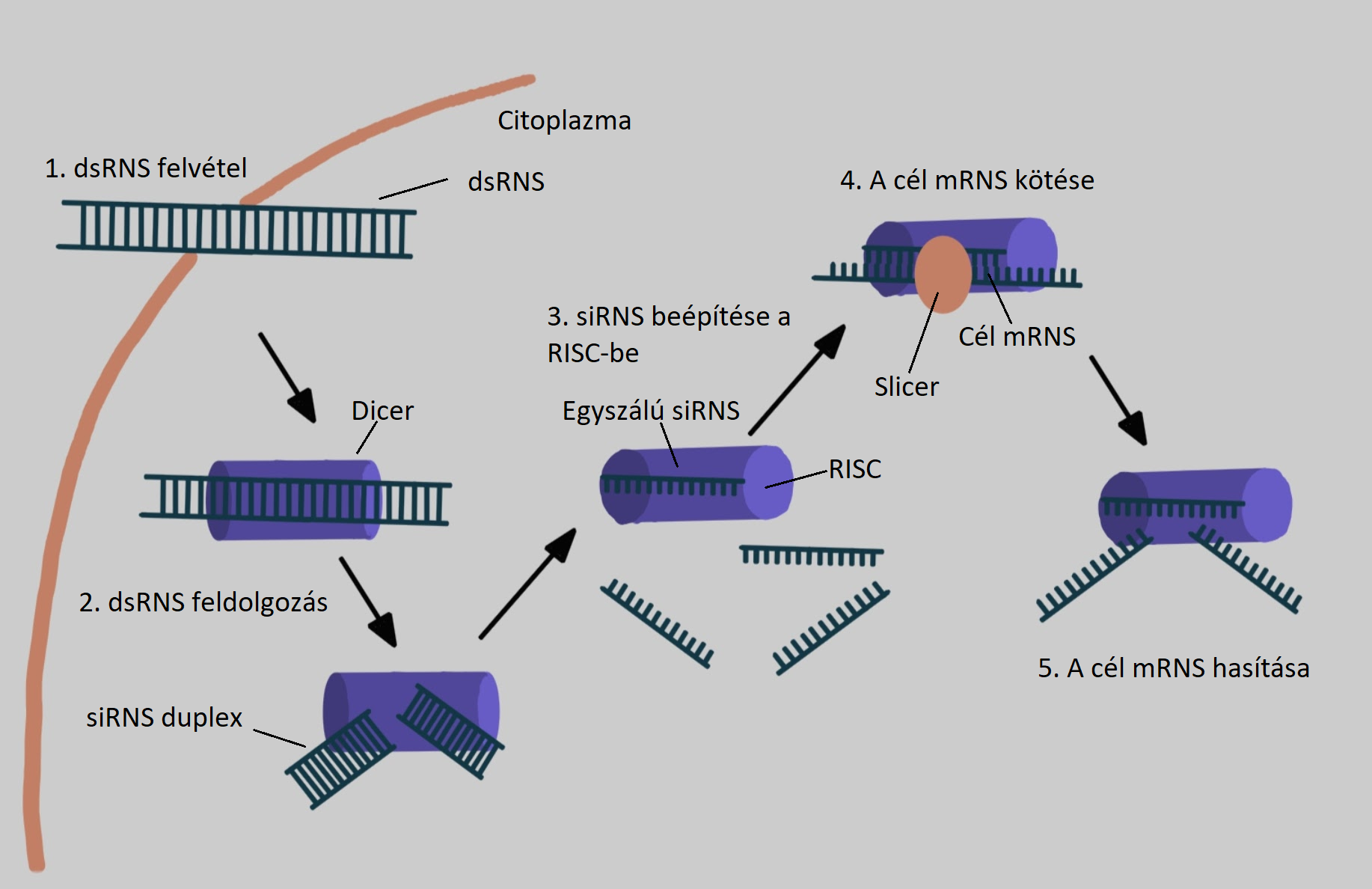
Kijelenthetjük, hogy rengeteg betegség hátterében valamilyen immunológiai elváltozás áll, ezért az RNS terápia fejlesztése során, az egyik fő cél az immunrendszer befolyásolása (legyen szó veleszületett vagy szerzett immunitásról). Ahhoz, hogy hatást gyakoroljunk az immunrendszerre, illetve a különböző betegségek által okozott működésbeli zavarokra, a géneket kell befolyásolni, mivel a gének szabályozzák az immunsejtek fejlődését, differenciálódását. Cél, hogy az RNS terápiával szabályozhassák a daganatok, illetve a kórokozók elleni immunválaszt hogy az adott betegségre, klinikai tünetekre, jó helyen és időben a megfelelő reakciót adja. Emellett autoimmun betegségek, és allergia elleni kezelésekre is irányulnak kutatások. Ezeken a területeken az áttörés az úgynevezett kis interferáló RNS-sel lehetne elérhető, ami a duplaszálú citoplazmatikus RNS két, 21-28 nukleotidos duplexszé történő hasításával jön létre (1.ábra). (Chih-Ping és mtsai, 2007)
|
1. ábra: Kis interferáló RNS kialakulása duplaszálú citoplazmatikus RNS két 21-28 nukleotidos duplexszé történő hasításával. (Chih-Ping és mtsai nyomán) |
2. Az RNS terápia felhasználása daganatos megbetegedéseknél
Az immunrendszer fontos részét képező természetes ölősejtekről (NK) sok információt szerezhetünk az RNS terápia révén. Vizsgálták többek között a hatás- illetve túlélési mechanizmusukat is. Azt fedezték fel, hogy az NK sejtek, egy úgynevezett TRAIL ligandon keresztül képesek lennének elpusztítani a daganatos sejteket, egy halál szignál segítségével, de erre a szignálra, az NK sejtek is érzékenyek a TRAIL receptoraik miatt. Az RNS terápiával, egy enzim segítségével azonban meg tudjuk védeni a természetes ölősejteket, és így csak a tumor sejtek pusztulnak el. A daganatellenes immunterápia arra irányul, hogy a gazdaszervezetben immunválaszt váltson ki, amely a betegekben a tumor zsugorodásához, illetve jobb klinikai eredményekhez vezet.
Az RNS terápia kutatási területén, az elmúlt években rengeteg különböző közvetítő anyagot fejlesztettek, melyek a tumorsejtek elleni immunválaszt növelik. Ezek között találhatóak citokinek, immun ellenőrzőpont-gátlók, adaptív T-sejt terápiák és számos vakcina. (Chih-Ping és mtsai, 2007)
2.1. Vakcinák a daganatok kezelésében
Más típusú daganatellenes immunterápiákhoz viszonyítva, a vakcinák előállítása fáradságos munkának tekinthető, valamint a betegekben mérsékeltebb klinikai választ váltanak ki. Mindazonáltal, így is kiváló kezelésnek bizonyulnak, mivel egy specifikus, biztonságos és jól tolerált terápiát képviselnek, amely által elkerülhető a potenciális gyógyszerrezisztencia, és elérhető egy tartós válasz kialakulása a kezelésre, az immunmemóriának köszönhetően. A vakcinák között négy fő kategóriát különíthetünk el; ezek a peptid vakcinák, sejtes vakcinák (melyek közt tumor- és immunsejtes vakcinákat találunk), virális vektor vakcinák, valamint nukleinsav (DNS vagy RNS) alapú vakcinák. (Megan és mtsai, 2015)
2.1.1. Nukleinsav alapú vakcinák
A nukleinsav alapú vakcinák vonzónak bizonyulnak, mivel egy immunizálással több antigén is könnyen eljuttatható a gazdasejtbe, valamint mind humorális, mind sejtes immunválaszt kiváltására képesek. Mindemellett, nem igényelnek korábbi ismeretet az immunrendszer részéről, és nem korlátozza a használatukat a páciens HLA (humán leukocita antigén) típusa. Szintén kiemelendő, hogy más vakcina típusokhoz hasonlóan, a nukleinsav alapú vakcinák is biztonságosak. (Megan és mtsai, 2015)
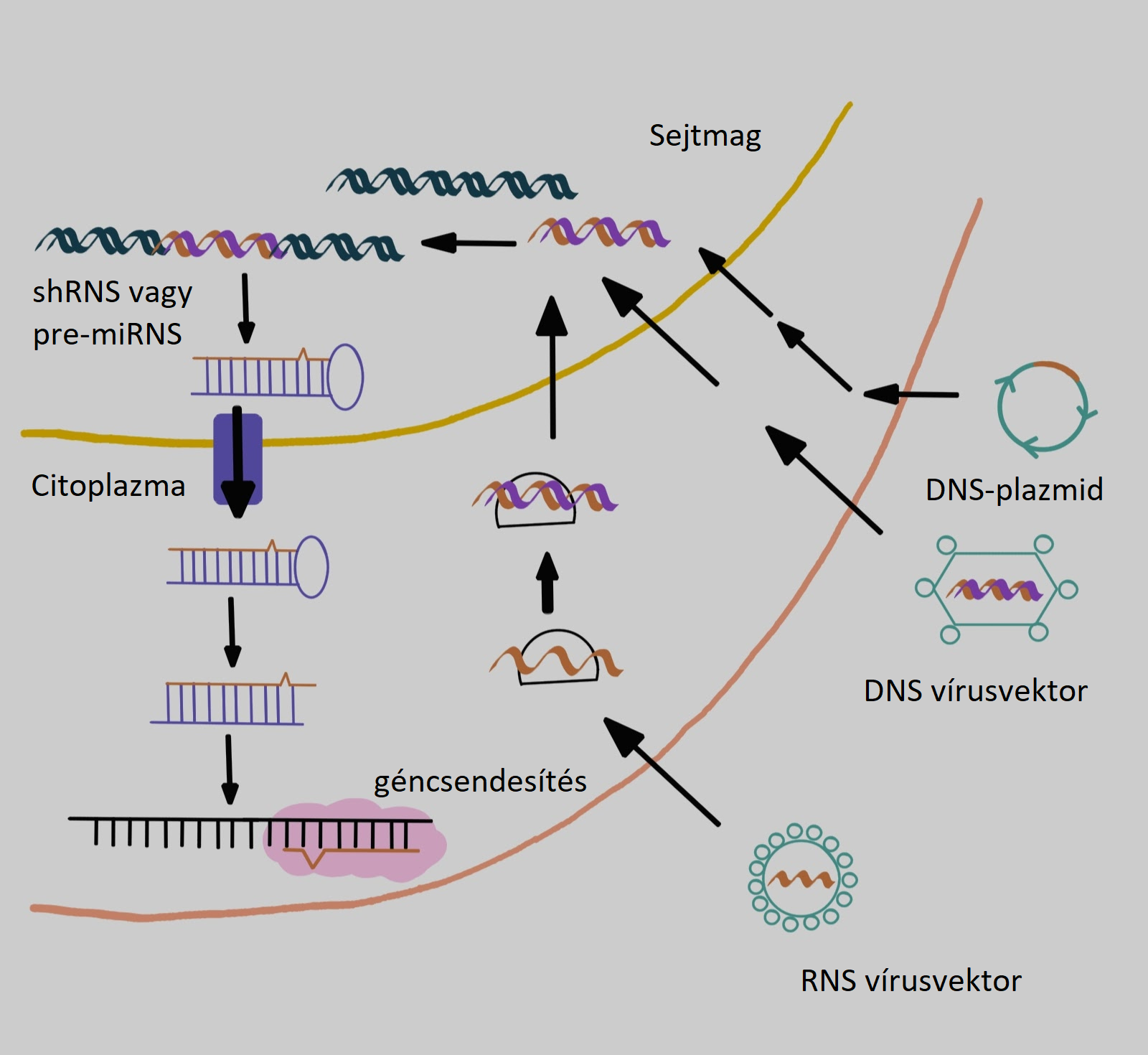
Az ígéretes tulajdonságainak ellenére, a DNS vakcinák kevésbé bizonyultak eredményesnek az immunválasz kiváltásában. Ennek az oka nem teljesen tisztázott, de több lehetséges indok is felmerült. Például, a DNS nem effektív bejutása a humán sejtekbe, valamint, hogy a DNS-nek nem csupán a sejthártyán, hanem a sejtmaghártyán is át kell jutnia és azon belül kell átíródnia, hogy a sejt traszfekciója megtörténhessen (2. ábra). A DNS vakcinák gazdatest genomjába történő integrálódásának, feltételes onkogenetikus hatásai miatti aggályok - együttesen a viszonylag gyenge immunogenitással - a hangsúlyt áthelyezték a DNS vakcinákról, az RNS vakcinák kutatására. (Szabó, 2020)
Az RNS vakcinák kitűnő módszernek bizonyulnak a daganatos megbetegedések elleni immunterápiákban. Ezek a vakcinák mindamellett, hogy ugyanazon kedvező tulajdonságokat mutatják, mint a DNS vakcinák, számos további előnnyel is rendelkeznek. A DNS-től eltérően, az RNS-nek csupán a citoplazmába kell bejutnia, ahol a transzláció zajlik, hogy a sejt transzfekciója megtörténhessen (2. ábra).
Ezenkívül, az RNS nem tud a genomba integrálódni, így nincs feltételes onkogenikus hatása. Kiemelt előnye még, hogy a termelődő fehérje mennyisége és a termelődés ideje, pontosabban és könnyebben kiszámítható és modellezhető, mint a DNS-alapú terápiás megoldásoknál.
Az RNS alapú vakcinák in vitro transzkripció által szintetizált, messenger RNS-ből állnak, melyhez egy bakteriofág RNS polimerázt és egy templát DNS-t használnak, amely kódolja a lényeges antigént vagy antigéneket. Amint a gazdasejt befogadta, az átírt hírvivő RNS-ek transzlációja megkezdődik közvetlenül a citoplazmában, és a keletkező antigének bemutatásra kerülnek antigénprezentáló sejteknek, amelyek immunválaszt váltanak ki. Specifikus immunválasz érhető el, amennyiben tumor asszociált antigén RNS-t vagy teljes tumor RNS-t tartalmazó dendritikus sejteket juttatunk a gazdatestbe. Az in vitro transzkripció mellett, az RNS akár daganat mintából is elkülöníthető és sokszorosítható különböző technikákkal, mint például PCR-rel, amely nagy számú, beteg-specifikus antigének előállítását teszi lehetővé. Mindezek mellett, az RNS kostimuláló jeleken keresztül adjuvánsként is szerepelhet, például toll-like receptorokon keresztül. (Megan és mtsai, 2015)
Ezen felsorolt tulajdonságai miatt, az RNS vakcinák iránt növekvő érdeklődés figyelhető meg kutatás és fejlesztés területén is. Kutatások alapján feltételezhető, hogy bizonyos esetekben siRNS használatával, hatékonyabb vakcina fejleszthető ki.
|
2. ábra: DNS-plazmid, DNS vírusvektor és RNS vírusvektor bejutásának különbségei. (Ai-Ming és mtsai nyomán) |
3. Az RNS interferencia
Az RNS beavatkozás vagy interferencia (RNSi), egy specifikus megközelítése a gén elnémítási technikáknak, amely óriási lehetőséget jelenthet különböző kóros elváltozások, mint például szív- és érrendszeri betegségek, vírusos fertőzések, valamint daganatos megbetegedések kezelésében. Annak ellenére, hogy preklinikai modellekben széleskörűen használt, a klinikai alkalmazása kihívásokkal teli, főként egy effektív bejuttatási rendszer kidolgozásának nehézségei miatt, mely elengedhetetlen az RNS beavatkozás teljes gyógyászati potenciáljának eléréséhez. (Xiuhui és mtsai, 2017)
3.1. Az RNS interferencia hátrányai és kihívásai
Az RNS molekulák serkentő hatása az immunrendszerre, erősítheti az RNSi kezelési hatását vírusos fertőzésekkel szemben. Azonban nagy mennyiségű siRNS (small interfering RNS), veleszületett immunválaszt vált ki, valamint citokinek termelését is indukálja. Az RNS beavatkozás nem kívánt hatásokat is kiválthat, melyek elkerülése fontos kihívást jelent. Váratlan fenotípusok megjelenése, megnehezíti a terápiás előnyök kiértékelését. Az siRNS szabályozása alatt, végbemehetnek nem kívánt transzkripciók, és az miRNS feldolgozása és funkcionálása feltételesen gátlódhat az endogén RNSi telítődésével, exogén siRNS-ek által. Így az RNSi indukálta veleszületett immunválasz, alááshatja az RNSi biztonságos és effektív használatát, főként klinikai területen.
Nagy ígérete ellenére, az RNSi-alapú terápia kihívást jelent az siRNS stabilitásával és bejuttatásával kapcsolatos kérdések miatt. Az siRNS alkalmazása egyrészt azért nehéz, mert a citoszolba kell bejuttatni, másrészt pedig mert beadása függ az adagolás módjától és a megcélzott szervtől is.
Számos akadály vár még leküzdésre, mielőtt a technológiát biztonságosan és hatékonyan alkalmazhatják az orvosi gyakorlatban. A siRNS hatékonyságát korlátozza, hogy a bizonyos esetekben a géncsendesítés átmeneti, azaz a hatása nem mindig tartós, illetve az, hogy a bejuttatott RNS-molekula instabil. Kimutatták, hogy az extracelluláris siRNS lebomlása, általában a beadást követő két napon belül bekövetkezik. Emellett, a gének inaktiválásának hatékonysága kiszámíthatatlan, mivel a különböző sejtek siRNS-felvételének hatékonysága változik. Ezen akadályok leküzdésére, kémiailag módosított siRNS-eket fejlesztettek, amelyek fokozott stabilitással rendelkeznek és védettek a lebomlástól. Az siRNS-molekulákat lipid-komplexekbe vagy kationos liposzómákba foglalják védelmük érdekében, amelyek ellenállnak az RNáz-aktivitásának. A siRNS specifikus sejtekbe történő bejuttatása még várat magára, de jelentős előrelépést fog jelenteni. Az in vivo siRNS beadásának kérdése, továbbra is jelentős kihívás a kísérletek során. Legfőképpen akkor, amikor adaptív immunitást vizsgálnak, mivel az érett limfociták különösen nehéz célpontok. Az siRNS hatékony, specifikus és biztonságos állatokba és emberekbe juttatásához, még mindig nagy fejlesztésekre van szükség. (Xiuhui és mtsai, 2017)
4. Az RNS sejtbe juttatásának lehetőségei
Az RNSi alkalmazását nagyban megnehezíti, hogy maga az siRNS és a célsejt membránja is negatív töltésű, ami miatt az RNS nem tud passzívan bejutni a sejtbe. Az siRNS bejuttatását megkönnyíthetik a lipidekel és sejtbehatoló peptidekkel történő modifikációt. Egy másik megoldást jelentett a problémára az RNS-ek extracelluláris vezikulákba csomagolása, amelyek révén endocitózissal a célsejtbe juthatnak.
Az in vivo siRNS beadási módszerek, bár egyre szélesebb spektrumú, még fejlesztést igényelnek, hogy hatékonyan eljuthassanak a nukleinsavak a meghatározott helyekre. Az in vivo siRNS szállítás a legnagyobb akadály az RNS terápia emberekben történő alkalmazásában. (Xiuhui és mtsai, 2017)
4.1. Az RNS szállítása
A szállítási problémákat különböző szállítórendszerek kifejlesztésével igyekeznek kiküszöbölni. Ezek az RNS hordozók lehetnek vírusos és nem vírusos vektorok. A vírusvektorok hatékony, genetikailag módosított vírusokat alkalmazó szállító rendszerek, amelyek olyan előnyöket kínálnak, mint a tartós géncsendesítés és az egyszerű transzkripcióból származó RNSi-molekulák több példányának expressziója. Akadályt jelent a vírusgenom beillesztése a beteg kromoszómáiba, a vírusvektorok immunogenitása, valamint a drága előállítás. Ezért nagy erőfeszítések történtek szintetikus vivőanyagok bevezetésére.
A szállítórendszerek megtervezésekor fontos kritériumokat kell figyelembe venni. Többek között biztosítanunk kell a szérum stabilitását, valamint magas szerkezeti és funkcionális tartósságot. Emellett mérsékeljék a nem célsejtekkel való kölcsönhatásokat, fokozzák a sejtbe jutást és az endoszóma menekülését, ellenálljanak a vese clearance-nek illetve alacsony toxikus és immunogén hatásuk legyen.(Xiuhui és mtsai, 2017)
4.1.1. A lipid alapú szállítási rendszer
Különböző szállítórendszerek közül, a lipid illetve polimer alapú rendszert használják leggyakrabban. A lipid alapú nanorészecskék (LNP) a legtöbbet alkalmazott és kutatott szállítórendszerek. Mivel a sejtmembrán főként lipidekből és foszfolipidekből áll, az LNP-k természetes módon hajlamosak a sejtmembránnal kölcsönhatásba lépni, hogy a sejtbe bejuthassanak. Több különféle LNP-t fejlesztettek ki az RNS szállításhoz, melyek közül kiemelkedő fontosságúak a liposzómák.
A liposzóma egy gömb alakú vezikulum, ami egy víz alapú magból és kétrétegű lipidmembránból áll. Ezeket a liposzómákat, mivel a plazmamembrán analógjai, a sejtek fel tudják venni endocitózissal, így szállított anyag a citoplazmába kerül. A negatív töltésű siRNS-ek a pozitív töltésű liposzómákkal komplexet alkotnak. Viszont a pozitív töltésük miatt, ezek a kationos liposzómák citotoxikusak, valamint gyulladásos választ indukálhatnak. Emellett maga a komplex nem specifikusan kölcsönhatásba léphet a negatív töltésű szérumfehérjékkel. Ennek megoldása érdekében vezették be a semleges lipidek alkalmazását is.
A toxicitás csökkentésének másik megközelítése a pH-érzékeny liposzóma használata. A pH-érzékeny liposzómák a normál szövethez képest alacsonyabb pH-értékű szövetekben, például a tumor környezetében szabadíthatják fel a gyógyszereket. (Xiuhui és mtsai, 2017)
4.1.2. A polimer alapú szállítási rendszer
Egy másik kiemelten tanulmányozott szállítórendszer a polimer alapú rendszer. Ebben az esetben negatív töltésű siRNS-eket és pozitív töltésű polimereket kapcsolnak össze, amik úgynevezett poliplexeket képeznek. Ezek a katinons polimerek általában természetes DNS-kötő fehérjék, szintetikus polipeptidek, polietilén-imin és szénhidrát alapú polimerek. Utóbbiak közé tartozik a kitozán, amit ha antitesttel konjugálnak, képes az siRNS-t specifikus célsejtekhez juttatni.
A polimer és a lipid alapú nanorészecskék felmerülő problémáinak kiküszöbölésére megalkották a lipid-polimer hibrid nanorészecskéket (LPN). Ezek szerkezete egyedi, mert polimer magokat és lipid héjakat tartalmaznak, így mindkét anyag komplementer tulajdonságait mutatják. (Xiuhui és mtsai, 2017)
5. A gyógyszeres terápiák
A gyógyszeres kezelés egyéb kezelési formáktól - mint például műtétek, sugár-, vagy fizikoterápia - eltérően, gyógyászati célra használt vegyületek felhasználásával képes betegségek gyógyítására. A gyógyszerek általában egy bizonyos biológiai molekulára hatva fejtik ki a hatásukat. Az mRNS-ről fordított fehérjék gyakran célpontjai a jelenleg használt gyógyszereknek. Noha a fehérje alapú terápiák - például az antitestek gyógyászati használata - forradalmasította a farmakoterápiát és gyógyszerfejlesztést, még mindig a fehérjék a fő célpontok, annak ellenére, hogy a humán genom által kódolt fehérjék többsége hagyományos gyógyászati eljárásokkal nem célozhatóak meg. Továbbá a már létező fehérje célpontok genetikai, vagy epigenetikai módosulása csökkentheti a már használt gyógyszer hatékonyságát, vagy akár rezisztenciát is kialakíthat vele szemben.
Az emberi genomban a DNS-szál több mint 95%-a nem fehérjét kódoló szekvencia, amely átírható a sejtekben, és feldolgozható funkcionális nem kódoló RNS-ekre (ncRNS-re). (Beleértve a transzfer RNS-eket (tRNS-eket), riboszomális RNS-ek (rRNS-ek), mikroRNS-ek (miRNS-ek vagy miR-ek) és hosszú, nem kódoló RNS-ek (lncRNS-ek)). A funkcionális ncRNS-ek legnagyobb része azonban továbbra is gyógyszer nélküli, vagy felderítetlen célpont marad a farmakoterápiában, ami így új lehetőségeket kínál a gyógyszerfejlesztésre. (Ai-Ming és mtsai, 2019)
5.1. RNS alapú gyógyszeres kezelés
Az RNS-molekulák alkalmazása a gyógyszeres kezelések új osztályaként jelent meg, amely lehetővé teheti a mutált célpontok újbóli megcélzását, így nem csak fehérjék, hanem akár RNS molekulák és maga a genom is megcélozhatóvá válik. Először is, megfelelő RNS molekulák - nevezetesen aptamerek - gátolhatják a jelen fehérje célpontokat, valamint az olyan fehérjéket, amelyeket korábban nem tudtak megcélozni, hogy kiváltsák a kívánt farmakológiai hatásokat. Másodszor, az mRNS-ek és az ncRNS-ek közvetlenül megcélozhatóak különféle RNS-ekkel, (például antiszensz RNS-ek (asRNS-ek), miRNS-ek, kis interferáló RNS-ek (siRNS-ek) és más kis RNS-ek (sRNS-ek)), hogy elnémítsák a célgén expresszióját, vagy a betegség irányításában játszanak szerepet. Harmadszor, a betegség kezdetét vagy lefolyását irányító gén szekvenciája közvetlenül módosítható egy megfelelő vezető RNS (gRNA) és egyéb komponensek használatával a betegség teljes felszámolásának érdekében.
Az RNS alapú gyógyszeres kezelés lehetőségei az elsőként mRNS-t célzó patisiran elfogadásával kerültek előtérbe. Az RNS-en alapuló gyógyszerek nemcsak különböző hatásmechanizmusokkal rendelkeznek, hanem kémiai és farmakokinetikai tulajdonságaik is eltérőek, összehasonlítva a hagyományos kis molekulájú és fehérje gyógyszerekkel. Mint ilyen, az új RNS gyógyszerek kifejlesztése nagy kihívást jelentett, és az elmúlt két évtizedben csak korlátozott mennyiségű nukleinsav alapú gyógyszert engedélyeztek klinikai alkalmazásra. Mivel a megfelelő szállítási módszerek megtalálása az RNS-kutatás és a gyógyszerfejlesztés egyik legnagyobb kihívása, a megfelelő RNS felhasználása eddig nem volt központi kérdés.
Jelenleg kémiailag szintetizált oligonukleotidok vagy RNS „utánzók” dominálnak az RNS kutatásban és a gyógyszerfejlesztésben. Néhányukat az FDA (Élelmiszer- és gyógyszerfelügyelet) sikeresen jóváhagyta a klinikai gyakorlatok számára. Azonban ezeket a „utánzókat” különféle kémiai módosításokkal egészítik ki, aminek hatására a természetes RNS-ektől - melyek csak minimális mennyiségű poszttranszkripciós módosításokon esnek át - eltérővé válnak.
A vegyi úton előállított RNS-utánzatok használata kutatás és fejlesztés terén is szöges ellentétben áll a fehérje-kutatással és fehérje alapú gyógyszeres kezeléssel. Ez utóbbi nagyon sikeresnek bizonyult azáltal, hogy előnyben részesítették az élő sejtekben termelt biológiai vagy rekombináns fehérjéket, a polipeptidek vagy szintetizált fehérjék in vitro peptidkémiai útja helyett. Ezért a közelmúltban nagy erőfeszítéseket tettek új biotechnológiák kifejlesztésére biológiailag módosított RNS ágensek (BERA) előállítására élő sejtben, amelyek az RNS kutatás és gyógyszerfejlesztés új osztályát képviselhetik. (Ai-Ming és mtsai, 2019)
5.1.1. A klinikai gyakorlatban jelenleg alkalmazott RNS alapú terápiák
Számos RNS-alapú gyógyszert hagyott jóvá az FDA az emberi betegségek különféle típusainak kezelése. A Fomivirsen az első antiszensz oligonukleotid (ASO) gyógyszer, amelyet az FDA 1998-ban hagyott jóvá cytomegalovírus (CMV) retinitis kezelésére immunhiányos betegek körében. Ide tartoznak a szerzett immunhiányos szindrómában (AIDS) szenvedő is, akiknek vírusellenes védekezése a CMV mRNS közvetlen célzása révén jön létre. 2013 óta számos más ASO gyógyszert sikeresen forgalmaznak az Egyesült Államokban, amelyek mindegyike a sejtekben lévő mRNS molekulákat célozza meg. Ezenkívül a pegaptanib jóváhagyása a neovaszkuláris korral-kapcsolatos makula degeneráció (AMD: age-related macular degradation) kezelésére támogatja az RNS aptamer alkalmazásának lehetőségét a fehérje makromolekulák gátlására a betegség szabályozásában. Továbbá az FDA által legfrissebben jóváhagyott duplaszálú siRNS-patisiránról kimutatták, hogy javítja az örökletes transztiretin-amiloidózis többféle klinikai megnyilvánulását, amely ösztönzést nyújt az RNSi-alapú gyógyszeres kezelések fejlesztésére. (Ai-Ming és mtsai, 2019)
Rengeteg RNS terápás módszer van klinikai vizsgálat alatt, melyek várhatóan a közeljövőben szintén hasznos és biztonságos eredményeket hoznak.
6. Összegzés
Összességében elmondhatjuk, hogy az RNS alapú terápia már most is nagyon fejlett technológia, ami az elmúlt években szinte robbanásszerűen fejlődött a molekuláris biológiával együtt. Ugyan sok nehézség előtt állnak még a kutatók, hogy teljes biztonságban alkalmazható legyen a klinikai gyakorlatban, de már így is sok problémára találtak megoldást, ezért reménykedhetünk, hogy a közeljövőben már rendelkezésre fog állni és rutinszerűen alkalmazható lesz az orvostudományban. Számos olyan betegség kiegészítő kezeléseként, vagy akár teljes gyógyításában használhatnánk, amelyekkel szemben eddig tehetetlenek voltunk, vagy csak részleges megoldást tudtunk biztosítani. Forradalmasítaná az orvostudományt, ha sikerülne olyan gyógyszereket fejleszteni, melyek kellő hatékonyságúak lennének ezen betegségek ellen. Mindemellett nem csak a gyógyításban, hanem a betegségek megismerésében is nagy segítségünkre lenne az RNS alapú terápia. Elképzelhető az is, hogy ha kellő ismereteket szerzünk bizonyos betegségekről, azok kialakulásáról a hozzá szükséges tényezőkről, immunrendszeri hátterükről, akár preventív gyógyszerek, eljárások is kifejleszthetőek lesznek. A már használatos vírusellenes vakcinák is azt mutatják, hogy egyre közelebb jutunk ahhoz, hogy az RNS-alapú terápia bevett gyakorlattá váljon és megoldást biztosítson számos ember vagy állat számára.
Irodalomjegyzék
Képjegyzék
1. ábra: Chih-Ping M; Yen-Yu L; Chien-Fu H; T-C. W (2007) Immunological research using RNA interference technology. Blackwell Publishing Ltd, Immunology 121: (3) 295–307
2. ábra: Ai-Ming Y; Chao J; Allan HY; Mei-Juan T (2019): RNA therapy: Are we using the right molecules? Pharmacology & Therapeutics 196: 91-104