Retinális implantátumok és fizikai hátterük
Contents
A fényérzékelés élettana
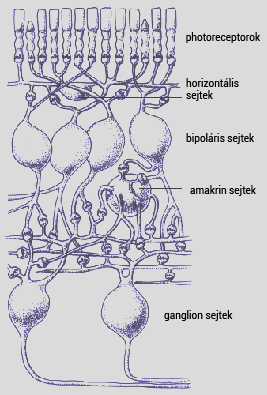
A látás két fő összetevőből áll. A mechanikai fénytörő közeget és a kép retinára vetítését a szaruhártya, a szemlencse, az üvegtest és a szem egyéb részei biztosítják, a fényingerek feldolgozását és továbbítását az agyi képalkotó központ felé pedig a retinában található fotoreceptorok és a retina további sejtjei. A retina fő sejttípusai a fotoreceptorok, amik a fényingert kémiai szignállá alakítják, az ingerületet továbbító ganglion sejtek, ill. a fenti sejttípusok közt kapcsolatot teremtő amakrin, bipoláris és horizontális sejtek (összefoglaló néven interneuronok). A sejtípusokat az 1. ábra mutatja be.
|
Fényből impulzus – a fotoreceptorok
A fotoreceptor sejtek két fő típusa a pálcikák és a csapok. A pálcikák akromatikusak, nem alkalmasak a különböző hullámhosszúságú fény elkülönítésére, de minimális fényintenzitás mellett is képesek érzékelni, már egy foton hatására is hiperpolarizációval válaszolnak. Ezen sejtek működése biztosítja az éjszakai látást, az úgynevezett scotopiás látást, de nappali megvilágításban nem működőképesek. A fényérzékenységet növeli, hogy egy-egy ganglionsejthez több pálcika is közvetít ingerületet. A pálcikák külső és belső szegmentumból, azokat összekötő ciliumból, és synapticus végződésből állnak. A külső szegmentumban zárt, a külső plazmamembránnal nem érintkező saccusok találhatók, amik a jodopszin fotopigmenteket tartalmazzák. A belső szegmentumban helyezkednek el a sejt fenntartásáért felelős sejtorganellumok (sejtmag, Golgi-készülék, riboszómák stb.).
A csapok kromatikus sejtek, képesek a színérzékelésre és a nappali, photopiás látás kialakításában vesznek részt, mivel nagyobb fényintenzitás tartományban képesek működni, mint a pálcikák. Térbeli felbontóképességük jobb, mint a pálcikáké, de fényérzékenységük sokkal kisebb. Felépítésük nagyon hasonló a másik fotoreceptor sejthez, de a külső szegmentumukban a plazmamembrán lefűződéseiben találhatók a rodopszin fotopigmentek, nem különálló sacculusokban.
A fotoreceptorok feladata a fototranszdukció, vagyis a fényinger kémiai szignállá való átalakítása. A rodopszin fotopigment egy 7 transzmembrán molekula (vagyis hétszer fúrja át a sejtplazmát), aminek opszin része molekulánként különböző, más-más abszorpciós spektrummal rendelkezik, aminek következtében más hullámhosszú fotonra lesz érzékeny. Ezáltal válik lehetővé a színek megkülönböztetése.
A fototranszdukció első lépéseként a pálcikákban a becsapódó fotonok hatására a fotopigment molekula oldalláncához kapcsolódó retinál (ami a fotopigment prosztetikus csoportja) cisz-transz konfigurációváltozáson megy keresztül. Ezt a rodopszin molekula konformációváltozása követi, aminek eredményeképp metarodopszin II keletkezik. A metarodopszin II transzducinnal reagálva aktiválja a cGMP-foszfodiészteráz enzimet, ami a sejtben lecsökkenti a cGMP szintet. A sejtmembránon cGMP függő Na+és Ca2+ csatornákat találhatók, amik a csökkent cGMP szint hatására záródnak. Ennek következtében az állandóan nyitott K+ csatornák segítségével a sejt hiperpolarizálódik. A hiperpolarizáció következtében a fotoreceptorok glutamát-leadása (transzmitter-leadása) csökken. A hiperpolarizáció és a csökkent transzmitter leadás jelenti az interneuronok számára a továbbítandó szignált.
A szem alkalmazkodóképességének, pontos képközvetítésének elengedhetetlen feltétele, hogy ezen folyamatok rövid időn belül le is állnak. Ezért a fotoreceptorokban inaktiválódik a rodopszin és a transzducin is. A metarodopszin II transz-retinállá és opszinná alakul. A transz-retinál a pigmentsejtekben alakul vissza újra felhasználható cisz-retinállá.
Impulzusból kép – a szignál továbbítása a csapokban
A fotoreceptorok szignálja nem egyformán hat az interneuronokra: van, amelyikben előjelváltást, és van, ahol előjelmegőrzést idéz elő (ON-OFF pályák). A csapok szignálját egy-egy előjelváltó és előjelmegőrző bipoláris sejt továbbítja. Ezen sejtek eltérően reagálnak a glutamát transzmitterre, mivel más típusú glutamát receptorokat tartalmaznak (ON sejtekben metabotrop glutamát receptor, az OFF sejtekben AMPA receptorok találhatók). A receptorok eltérő működésének következménye, hogy az ON sejt a fényinger hatására jön ingerületbe, az OFF sejt pedig a fényinger megszűnésétől. A bipoláris sejtek és a ganglion sejtek között szintén a glutamát a neurotranszmitter.
A ganglionsejtekben ingerület hatására akciós potenciál alakul ki, ellentétben a bipoláris idegsejtekkel. A ganglionsejtek működésének fontos szabályozója a receptiv mező, amit az egy ganglionsejthez – a bipoláris sejteken keresztül kapcsolódó fotoreceptorok alkotnak. Magasabb rendű emlősöknél a receptív mező koncentrikus. Ha a neuron receptív mezejének egy részén megváltozik a fény erőssége, hullámhossza, akkor a ganglionsejtek a bipoláris sejtekhez hasonlóan ON reakcióval (a ganglionsejt fény hatására hiperpolarizálódik) vagy OFF reakcióval (sötétség hatására hiperpolarizálódik). Ritka esetekben mind a megvilágítás, mind annak hiánya okozhat hiperpolarizációt egy sejten belül. Fontos, hogy a fotonok a receptív mező mely részén csapódnak be: a centrumba érkező fény erősebb reakciót okoz (mind az OFF, mind az ON sejtekben), míg a perifériára beeső fotonok módosítják ezt a hatást. Ezt nevezzük laterális gátlásnak.A ganglionsejtek kb. 50%-a ON-központú, vagyis a sötét háttér előtti világos tárgyakat érzékelik (a centrum megvilágított, a periféria sötét, így a kettő határán fény-sötétség kontraszt keletkezik) Az OFF-központú sejtek a világos háttér előtti sötét tárgyakról közvetítenek információt, itt a fény-sötétség viszonyok ellentétesek az ON-sejtekénél leírtakkal.
A ganglionsejtek két fő típusát különböztetjük meg, az M-, és P-sejteket. Az P-sejtek receptív mezője kisebb, a corpus geniculatum parvocelluláris részének szállítanak információt, fő funkciójuk a nagyobb kontúrok felismerése. A nagyobb receptív mezővel rendelkező M sejtek a magnocelluláris résszel vannak összeköttetésben, és a színlátásban, részletek felismerésében játszanak szerepet.
Impulzusból kép – a szignál továbbítása a pálcikákban
A pálcikák csak olyan bipoláris sejtekhez kapcsolódnak, melyek a pálcikák megvilágításának hatására depolarizálódnak (ON-típusú, előjelváltásos kapcsolódás). A bipoláris idegsejtek nem kapcsolódnak közvetlenül a ganglionsejtekhez, hanem amakrin (II típusú) sejteken keresztül ingerlik az ON-típusú ganglionsejteket. Az amakrin sejtek réskapcsolaton keresztül adják át az ingerületet az ON ganglionsejteknek, és ezzel egyidejűleg glicin transzmitter felszabadításával gátolják az OFF ganglionsejteket. A ganglionsejtek axonjai alkotják a nervus opticust, ami a papilla nervi opticiben (vakfolt) lép ki a szemből, és szállítja az ingerületet a felsőbb agyi központokba.
A retina betegségei
Ha a fent részletezett működési sorban valamely inger-ingerülettovábbító lépés sérül vagy kiesik, úgy a látás érzete természetesen nem jön létre az occipitális lebenyben. Kialakul a vakság, amely az esetek kb. 50%-ában retina károsodásának köszönhető. A leggyakoribb ilyen jellegű megbetegedés a retinitis pigmentosa. Ez azoknak az öröklődő betegségekenek az összefoglaló neve, amelyek a csap-és pálcikasejtek degenerációját okozzák. A név onnan származik, hogy a fotoreceptor sejtek károsodásán kívül a retina pigmentrétegének rendellenességét okozhatja, ezért a retinán pigmentált foltok jelenhetnek meg. Lényege a fényérzékelő sejtek működésének fokozatos kiesése illetve romlása. A betegség egyesével teszi tönkre a sejtek fényérzékelését, a látás romlását illetve teljes kiesését okozva ezzel.
Gyakori altípusa az RCD (rod-cone disease), amikor először a pálcikák fényérzékelése romlik. A másik fő altípus a CRD(cone-rod disease), ebben az esetben a csapsejteket érinti először a kór (Hamel, 2006). Ma már tudjuk, hogy a hasonló tünetek mögött jelentős genetikai heterogenitás áll, vagyis többféle kiváltó ok állhat a betegség hátterében. Okozhatja pl. a rodopszint kódoló gén mutációja, ami azért jár ilyen súlyos következményekkel, mert a rodopszin a fotonok ingerületté való alakításának legfontosabb fehérjéje. Egy másik lehetséges ok a pre-mRNS-t mRNS-sé alakító enzimek génjeinek mutációja. Ez minden szervet érint, de a retinát fokozottan, mert ott erőteljes génexpresszió szükséges a rodopszin termelése miatt. A mai napig több mint 100 féle mutációt azonosítottak, amely a betegséget okozhatja (Hartong és Berson,2006). Az elsődleges hiba is más és más, ennek megfelelően különböző az öröklődés menete illetve valószínűsége, a progresszió gyorsasága és a tünetek is. Kialakulását tekintve leggyakoribb forma az ún. sporadikus előfordulás. Ebben az esetben a beteg családjában (szülők, nagyszülők, testvérek) hasonló tünetek korábban nem fordultak elő.
A retinitis pigmentosa leggyakoribb tünete a szürkületben való látási nehezítettség (ún. szürkületi vagy "farkasvakság"), és a perifériás látás foltokban való kiesése, amit általában az oldalirányú tájékozódás beszűkülése követ. Előrehaladott esetben ún. "csőlátás" alakul ki. Ez az RCD altípus, amikor a pálcikasejtek érzékelése esik ki először. Ritkább esetben (CRD altípusnál) előbb a centrális látás károsodik, és csak utána a perifériás fényérzékelés. Itt a csapsejtek pusztulásával kezdődik a kór. Előfordul az is, hogy foltokban károsodik a retina, és a foltokból terjed tovább a sejtelhalás.
A betegség lassan, néha alig észrevehetően kezdődik, és progresszív jellegű, végül minden altípus vakságot okoz. Kialakulása elkezdődhet gyerekkorban vagy akár időskorban is. Lehet gyors lefolyású, ami pár év alatt teljes látásvesztést okoz, vagy lassabban kifejlődő, ami esetleg nem is éri el a vakságot. Az esetek nagyobb részében csak szemészeti érintettség áll fenn, ritkán azonban más érzékszervi (pl.: hallás) károsodás, vagy más szervrendszer működészavara is kimutatható, illetve bizonyos esetekben fényérzékenység is jelentkezik.
Annak ellenére, hogy a tudomány mai állása szerint nem gyógyítható és lefolyása érdemben nem befolyásolható, az utóbbi évtizedekben kialakulásának mechanizmusáról számos fontos új ismeret látott napvilágot és több terápiás próbálkozásról is beszámol a tudományos irodalom, utóbbi elsősorban kísérleti állatok esetében. Ezek között van gyógyszeres és genetikai kezelés, valamint az implantátumok beillesztése is. Fontos leszögezni, hogy a szem ingerületvezető rendszerét a betegség nem károsítja, ezért ha a fotoreceptor-sejtek funkcióját pótolni tudjuk, a látás bizonyos mértékig helyreállítható.
Retinaimplantátumok
A fent részletezett károsodásokat hivatottak orvosolni és kijavítani a különböző látásjavító implantátumok. Az ilyesfajta protéziseket elhelyezkedésük szerint csoportosítani is lehet, így megkülönböztetünk extraocularis és intraocularis implantátumokat.
Az extraocularis implantátumok, ahogyan nevük is mutatja, a szemen kívüli látópályák károsodásait javítják. A teljesség kedvéért itt említhetjük az extraocularis, de intraorbitalis nervus opticusra felhelyezhető, gyűrűszerű elektródarendszert; a talamusban lévő átkapcsolási hely mikrostimulációját; valamint az occipitalis corticalis régióban a látóközpontra helyezett elektródákat. Jelenleg mindhárom területen folynak kísérletek, melyek nagyrészt a biokompatibilitást és a megfelelő elektróda kiképzést, valamint az azokon véghezvihető ingerlési mintázatokat kutatják.
Az intraocularis implantátumok a szemgolyón belül helyezkednek el, megnevezésük az ideghártyához viszonyított helyzetük alapján történik. Ez alapján megkülönböztetünk epiretinális és subretinális típusú protéziseket. Ezek közül az epiretinális implantátumokról egy kisebb áttekintő tájékoztatást adunk, dolgozatunkban a subretinális implantátumokat mutatjuk be részletesebben (Kusnyerik és mtsai, 2011).
A retinális implantátumok általános felépítése
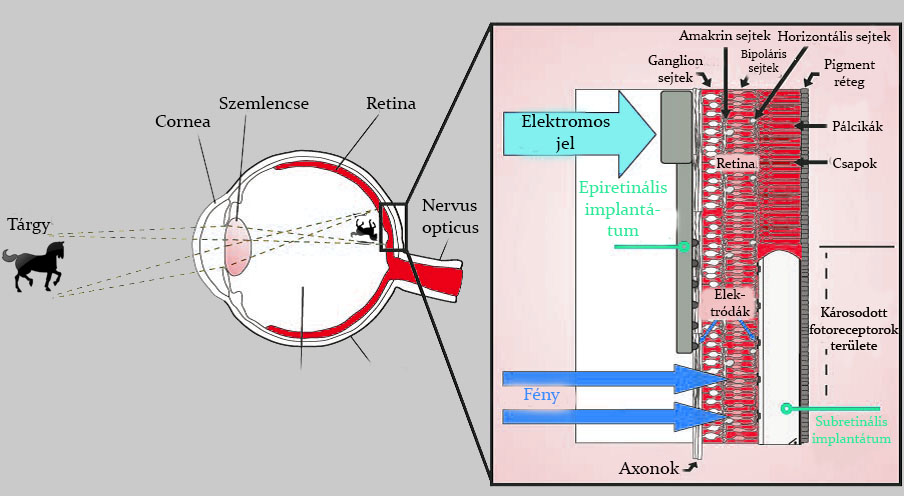
A retinális implantátumok alapját egy biokompatibilis anyagból készült miniatűr hordozó egység adja, amely a megmaradó retinához kapcsolódik (epiretinális implantátum esetén a ganglion sejtekhez, subretinális protézis esetén a pigmentosus réteghez és a horizontális, valamint a bipoláris sejtek nyúlványaihoz). Ezen felül az eszköz lényegi részét a subminiatűr elektródák és elektromos hálózatok képezik, amelyeknek az ingerülettovábbító sejtekkel bonyolult kapcsolatokat kell létrehozniuk. Mindezek mellett természetesen az implantátum elhelyezésére kifejlesztett sebészi beavatkozásoknak is nagy, ha nem a legnagyobb a jelentőségük, melyeket szintén hosszas kutató munka és állatkísérletek előznek meg (Eberhart, 2002). Az implantátumok működési elvét a 2. ábra mutatja be.
|
Epiretinális implantátumok
Az epiretinális implantátumok rögzítése az ideghártyára az üvegtesti felszín felől történik (Kusnyerik és mtsai, 2011). Fontos különbség a subretinális eszközzel szemben, hogy itt nem alkalmaznak fényérzékeny területet a szemgolyón belül. Egy külső kamera a szemen kívül helyezkedik el, általában egy szemüvegbe építve. A kamerából érkező információ, amelyet egy külön, a kamerához kapcsolódó számítógép dolgoz fel, a retinális ganglionoktól centrálisabban elhelyezkedő vevő egységnek, magának az implantátumnak közvetítődik. Az itt elhelyezkedő aktivált elektródák stimulálják a tőlük perifériásabban lévő ganglion sejteket, melyeknek axonjai a nervus opticuson keresztül távoznak, majd a fent említett úton az információ eljut egészen a corticalis területig. Fontos még megemlítenünk, hogy ez a fajta implantátum nem használja a megmaradt és még ép retinális elemeket, a fotoreceptor sejteket. Esetleges alkalmazása súlyos szürkehályog (cataracta) esetén vezethet látásjavuláshoz. Használatának pillanatnyilag gátat szab, hogy az implantátum fixálása a retinális felületre nehézkes, és biztonságosan még nem sikerült megoldani, valamint fennáll még az akkomodáció, a nagy mennyiségű fényhez való alkalmazkodás megoldásának kérdése is (Eberhart, 2002). A kétféle retinaimplantátum elhelyezkedését a 3. ábra szemlélteti.
|
Subretinális implantátumok
A kezdeti próbálkozások során fényérzékeny szelént ültettek a retina mögé és az így kísérletesen kezelt vak pácienseknél fényérzékelés volt megfigyelhető. A jelen időben is folyó kutatások viszont már nem ilyen kezdetleges megoldásokkal dolgoznak, hiszen a mikroelektronikai újítások, melyhez a nanotechnológia és a számítástechnika ugrásszerű fejlődése is hozzájárult, valamint a cochlearis implantátumok sikeres alkalmazása lehetővé tette ezen technikák alkalmazását a szemben is (Sachs és Gabel, 2004).
A subretinális implantátumok beépítése az epithelialis pigment réteg és a retina külső rétege közé történik, tulajdonképpen a fotoreceptor sejteket helyettesítik (Kusnyerik és mtsai, 2011). Ez utóbbi kijelentés azért fontos, mert ezáltal a protézis beilleszthető a megmaradt retina szerkezetbe és tökéletesen kiegészítheti azt, a sérült területek pótlásával (Eberhart, 2002).
Alapja egy vékony szilíciumhordozó egység, melynek vastagsága 50-100 µm, átmérője 2-3 mm. Rajta az implantátum lényegét képező több mint ezer mikrofotodiódával/mikroelektródával. Ezek olyan mikroszkópikus méretű diódák, melyekben fény hatására a zárórétegben (pozitív-negatív előfeszített záróréteg) a belső fényelektromos hatás miatt töltéshordozók szabadulnak fel, így a fotodióda vezetővé válik. Az így létrejövő fotoáram a megvilágítás erősségétől függ. Anyaguk arany-, illetve titánium-nitrit. [3] A biokompatibilitás elérése végett ezeket a mikrofotodiódákat glükoproteinekkel, elsősorban lamininnel vonják be (Eberhart, 2002). A fotoreceptorok tehát mikrofotodiódákkal helyettesítődnek, melyek képesek a maradék ganglion sejt stimulálására, így a szomszédos idegi kapcsolatok még felhasználhatóak információfeldolgozásra, az ingerület továbbhaladhat a belső retina irányába (Sachs és Gabel, 2004).
A megfelelő szerkezet kialakítása mellett szükség van az egyes stimulációs paraméterek meghatározására is. Ennek érdekében állatkísérletekben az elektródákat külső stimulációnak vetették alá. Így meghatározták, hogy a megfelelő stimulációs paraméter 0,4 nanoCoulomb, ami hozzávetőlegesen 10µA áramerősségnek felel meg. Ilyen mértékű ingererősség felfogásával, a mikrofotodióda már ingerelni képes a retinális neuronokat. Patkányban végzett kísérletek kimutatták már azt is, hogy az egymástól 50-150µm-re elhelyezett elektródák használatával a neuronok számára már felfogható elektromos jel indukálódik. Kutatások során az is kiderült, hogy az önálló (single) mikrofotodiódák nem tudják stimulálni a szomszédos neuronokat a környezetből érkező fénnyel, ezért a kutatókban megfogalmazódott egy külső energia egység beépítésének a szükségessége is. Így kialakították az aktív implantátumokat, melyek természetes körülmények között, természetes fénnyel ingerelve is működnek (Eberhart, 2002).
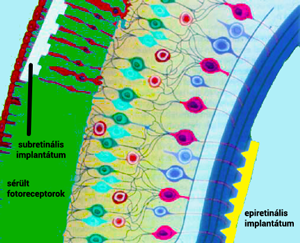
Viszont ahhoz, hogy ezt a külső energiaforrást el tudják helyezni, az implantátum helyigénye is megnövekedett. Ezzel az implantátum a chorioideába és a sclerába is belenyúlik. Az ilyen subretinális implantátumok makroszkópikus egységei s következők: I. a stimulációért felelős chipet tartalmazó rész; II. intraocularis kábel; III. extraocularis kábel, amely a tápegységgel áll kapcsolatban. Az implantátum egységeit a 4. ábra mutatja be. A hely szűkössége miatt tehát ez a kérdés is megoldásra vár (Kusnyerik és mtsai, 2011).
|
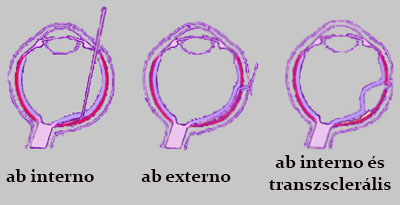
Ahogyan az implantátumokról szóló általános bevezetésben is említettük, egy ilyen protézis kifejlesztése mellett szükséges a megfelelő sebészeti beavatkozás, az implantátum elhelyezésének kikutatása is. Ebben az esetben az ide vonatkozó megfigyelések az állatkísérletek folyományaként folyamatosan új lehetőségeket tártak fel. Ezek a sebészeti megoldások az alábbiak (5. ábrán láthatóak):
- ab interno: Az implantátum a sclerán, majd az üvegtesten (corpus vitreum) keresztül, a retinán át vezetve helyezhető subretinális pozícióba.
- ab externo: Külső bevezetés a sclerán és a chorioideán át.
- ab interno és transzsclerális: Tulajdonképpen az ab interno és az ab externo eljárás vegyítése, melynek során az üvegtesten át a retina perifériás oldalára egy mikroszkopikus eszközzel viscoelasztikus folyadékot juttatnak, melynek során a retina kis mértékben eltávolodik a chorioideától. Ez a kiegészítő folyamat megvédi a retinát a sclerán és chorioideán át bevezetett elektródahordozó általi sérüléstől.
|
Mint minden protézisnél, ebben az esetben sem elhanyagolható kérdés az implantátum időtállósága. Állatkísérletek tanúsága szerint macskában és sertésben az implantátum 2 évig, míg patkányban 16 hónapig működött. Ennek oka, hogy bizonyos esetekben korrózió léphet fel, és a szilícium felületén szilícium-oxid keletkezhet, mely az elektródákat működésképtelenné teszi. Ennek elkerülése végett felmerül egy passziváló bevonó réteggel való kiegészítés lehetősége is, mely a hosszú távú használhatóságot tenné lehetővé (Sachs és Gabel, 2004).
Emberi alkalmazás
Embereken is végeztek már el kísérletes implantációkat, melyek során csupán néhány esetben volt sikeres a geometriai alakok megkülönböztetése. Viszont bizonyították azt a feltételezést, hogy a belső retina ganglionsejtjei több évnyi vakság után is működnek.
Nem utolsó sorban megállapíthatjuk, hogy a subretinális implantátumok sok tekintetben előnyösebbek epiretinális társaiknál:
- helyettesítik a fotoreceptor sejteket, így beilleszthető, a megmaradt szerkezetbe
- pozícionálás és a fixálás nem okoz nagy gondot, külön rögzítést a retinára nem igényel
- nem szükséges külső kamera vagy képfelvevő egység
- követni képes a szem mozgásait.
A további célok között szerepel a subretinális elektromos összetevők hosszú távú stabilizálása, valamint annak felmérése, hogy pácienstől függően milyen képmegjelenítési változásokat lehet majd tapasztalni. Továbbá még kérdéses az is, hogy a neuronok kibírják-e a folyamatos elektronikus stimulációt. A páciensek vizsgálata olyan pácienscsoportokra terjedhet ki, akik olyan degeneratív betegségben szenvednek (pl. retinitis pigmentosa), mely nem okoz teljes károsodást a szem retinális rétegeiben, tehát esetükben még fellelhetőek intakt (még ép) belső retinális rétegek (Sachs és Gabel, 2004).
Irodalomjegyzék
Eberhart, Z. (2002): Will retinal implants restore vision?. Science 295: 1022-1025
Hamel, C. (2006): Retinitis pigmentosa. Orphanet Journal of Rare Disease 10: 1186/1750-1172
Hartong, D.T., Berson, E.L., Dryja, T.P. (2006): Retinitis pigmentosa. Lancet 368: 1795–809
Kusnyerik, Á., Resch, M., Roska, T. és mtsai (2011): Látásjavító implantátumok látóhártya-degenerációkban. Orvosi Hetilap, 152: 537-545.
Sachs, H. G., Gabel, V. (2004): Retinal replacement – the development of microelectronic retinal prostheses – experience with subretinal implantsand new aspects. Graefe’s Archive for Clinical and Experimental Ophtalmology 242: 717-723
A képek saját munkák.