Die Wirkung von schmerzstillenden und narkotisierenden Mitteln auf das ZNS
Einleitung
Jeder von uns hat schon einmal Schmerzmittel genommen, egal ob nur leichte, wegen kleinen Verletzungen, oder stärkere. Die meisten hatten bestimmt auch schon eine Operation und ansonsten zumindest bei jemandem in seinem Umfeld gesehen, wie es einem nach einer Narkose geht. Hat sich jedoch schon jemand gefragt, wie sich diese ganzen Mittel auf unseren Körper, speziell auf unser zentrales Nervensystem auswirken? Diese Arbeit liefert Antworten genau auf diese Frage, in dem auf physiologische Wirkungsmechanismen aber auch Allgemeines eingegangen wird.
Schmerzmittel am Beispiel der Opioide
Unter der Wirkstoffgruppe der Opioide werden alle Medikamente mit morphinähnlicher Wirkung zusammengefasst (Maurice et al, 2001).
Rezeptoren: Funktionsweise, Aktivierung
Die Rezeptoren der Opioide binden sich abhängig von ihrer Affinität unterschiedlich gut an die entsprechenden Liganden des ZNS. Man spricht auch von einem Schlüssel-Schlossprinzip, erst wenn Rezeptor und Ligand perfekt ineinanderpassen kann eine Wirkung ausgelöst werden (Freye, 2002).
Die Bindungsstelle für den Liganden tragen die Rezeptoren nach außen, nach Innen haben sie die Möglichkeit an das G-Protein zu binden. Das G-Protein spielt eine entscheidende Rolle bei der Signalübertragung zwischen Rezeptor und Second Messenger (Stein, 2015; Waldhoer et al, 2004).
Opioidrezeptoren können die Hemmung des Enzyms Adenylatcyclase wirken und was zur Aktivierung der Proteinkinasen führt. Es kommt zur Öffnung und Schließung von Ionenkanälen. Sowohl geschlossene als auch geöffnete Kaliumkanäle führen zu einer gehemmten Übermittlung der nozizeptiven Informationen (Waldhoer et al, 2004).
Opioidrezeptoren können in 3 Typen unterteilt werden (δ-μ- κ-Rezeptor)
- δ- Rezeptor ist verantwortlich für die Wirkung der supraspinalen Analgesie
- μ- Rezeptor ist verantwortlich für die Atemdepression und Abhängigkeit
- κ-Rezeptor ist verantwortlich die Wirkung einer Sedierung und der spinalen Analgesie (Stein, 2015)
Topographische Verteilung der Opioid Rezeptoren
Die Opioidrezeptoren befinden sich im Zentralennervensystem vor-allem im limbischen System, dem Hypothalamus, der Pons, dem Ductus mesencephali Sylvii, Substantia grisea, Substantia gelatinosa und in der Darmwand (Freye, 2002).
Zentral Wirkende Opioide
Opioide können in zentral und peripher wirkende eingeteilt werden.
Tabelle 1: Zentral Wirkende Opioide (nach Maurice et al, 2001)
Wirkung |
Wirkungsmechanismus |
|
Spinale Analgesie |
Hemmung der Snaptischen Übertragung im Hinterhorn |
|
Supraspinale Analgesie |
Hemmung der neuronalenen Aktivität im Thalamus und Aktivierung hemmender deszendierender Bahnen |
|
Euphorie |
Aktivierung mesolimbischer dopaminerger Neurone |
|
Sedation/Hypnose |
Hemmung der Formatio reticularis |
|
Muskelrigidität |
Aktivierung nigrostriataler dopaminerger Neurone |
|
Anxiolyse |
Hemmung der neuronalen Aktivität im Locus coeruleus |
|
Krämpfe |
Hemmung inhibitorischer Interneurone |
|
Hypothermie |
Hemmung des hypothalamischen Temperaturzentrums |
|
Atemdepression |
Empfindlichkeit des medullären Atemzentrums |
|
Antitussive Wirkung |
Hemmung des medullären Hustenzentrums |
|
Antiemetische Wirkung |
Hemmung des medullären Brechzentrums |
|
Blutdrucksenkung |
Hemmung des medullären Vasomotorenzentrums |
|
Bradykardie |
Aktivierung des Nucleus dorsalis nervi vagi |
|
Vor- und Nachteile der Anwendung von Opioiden
Die wichtigste Wirkung der Opiate in der Medizin ist die Schmerzstillende Wirkung. Opioide bewirken die Hemmung der Schmerztransmitter im Rückenmark. So wird die Erregungsbahn unterbrochen bzw. vermindert. Auch die Afferenzen werden gestoppt was dafür sorgt das der Schmerz nicht mehr wahrgenommen wird (Corder et al, 2018).
Da Opioide aber sehr viele Nebenwirkungen haben werden sie hauptsächlich bei schweren Erkrankungen eingesetzt wie z.B bei Tumorerkrankungen (Plötz, 2013).
Der größte Nachteil bei der Anwendung von Opioiden ist ohne Zweifel die Abhängigkeit.
Der regelmäßige Konsum von Opioiden macht Konsumenten durch die Ausschüttung von Dopamin schon nach kurzer Zeit Abhängig (Barnett et al, 2001). Anfängliche Nebenwirkungen wie Schwindel, Übelkeit und Verwirrung lassen bei regelmäßigem Konsum bald nach und so steht die Stimulation des Behlohnungssystems durch Euphorie und Wohlbefinden im Vordergrund (Maurice et al, 2001).
Die Abhängigkeit von Opioiden hat wahrscheinlich mit verschiedenen Neurotransmittersystemen wie z.B Dopamin, Glutamat, Serotonin und GABA zu tun. (Freye, 2002).
Andere Nebenwirkungen die sich auf das ZNS beziehen können folgende sein:
- Abnahme des Bewusstseins
- Hyperreflexizitabilität
- Beinträchtigung der kognitiven und psychmotorischen Fähigkeiten
Wobei die meisten der aufgelisteten Nebenwirkungen nur vorübergehend sind (Maurice et al, 2001).
Narkosemittel
Allgemeines über Narkose
In der medizinischen Praxis wird unter Narkose eine Vollnarkose verstanden, die mit einem vollständigen Verlust der Sensibilität, einer Entspannung der Skelettmuskulatur und dem Fehlen willkürlicher Bewegungen einhergeht. Jedoch ist das Hauptziel der Narkose die vollständige Schmerzausschaltung des Patienten während einer chirurgischen Operation (Mattusch, 2012).
Narkosestadien
Funktionelle Veränderungen im Körper während der Anästhesie sind sehr komplex, da die Unterdrückung des ZNS nicht sofort auftritt und zuerst verschiedene Stadien durchlaufen muss.
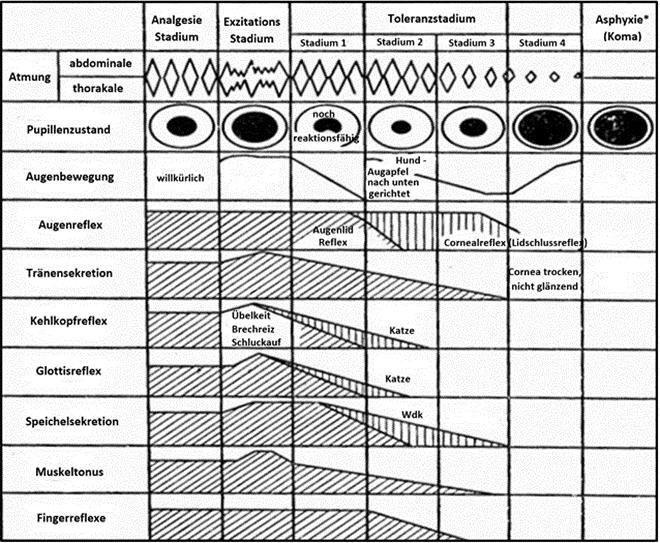
Im ersten Stadium, auch Analgesiestadium genannt, verringert sich die Schmerzempfindlichkeit, doch der Patient ist noch bei vollem Bewusstsein. Es können bereits kleine chirurgische Eingriffe durchgeführt werden. Danach folgt das Exzitationsstadium, in welchem die Reflexe auf äußere Reize erhöht sind und es durchaus zu Erbrechen und Übelkeit kommen kann. Zunächst folgt das sich in vier Unterstadien einteilende Toleranzstadium. Operiert darf bereits im zweiten oder dritten Unterstadium werden. Schlussendlich bricht der Kreislauf zusammen und die Anästhesie erreicht das Asphyxiestadium. Ebenfalls erlischt in diesem Stadium die Atmung, weshalb der Patient künstlich beatmet werden muss (Micallef, 2020). Dafür eignen sich hervorragend neuere Beatmungsmethoden wie die volumenkonstante flussadaptive Beatmung, Volume Autoflow (Arnold, 2014).
Abb.1. Physiologische Zustände von Tieren in verschiedenen Narkosestadien
Inhalationsnarkotika und Injektionsnarkotika
Je nach ihrer Applikationsart werden Narkosemittel in Inhalations- und Injektionsnarkotika eingruppiert. Zu den volatilen bzw. inhalierbaren Narkotika gehören Gase und dampfförmige Stoffe, welche dem Patienten entweder mit der Exspirationsluft (geschlossene Systeme) oder nur frisch (halboffene Systeme) zugeführt werden. Man unterscheidet die in der Human- und Veterinärmedizin verwendeten Inhalationsnarkotika. Während in der Humanmedizin Gase wie Isofluran, Desfluran, Sevofluran, Xenon und Stickoxydul verwendet werden, benutzen Tierärzte vor allem Isofluran, Sevofluran und, in Kombination, Stickoxydul zum Anästhesieren der Tiere (Deile et al, 2013).
Die gebräuchlichsten Anästhesiemittel werden den Tieren intravenös (IVA) verabreicht. Diese Methode ermöglicht eine schnelle Betäubung des Tieres und erzeugt den gewünschten Narkosegrad für lange Zeit. Aufgrund ihrer schnellen Absorbanz, gleichmäßigen Verteilung im Körper und dem leichten Eindringen in das ZNS zählen Barbiturate wie Pentobarbital und Thiopental zu den am häufigsten verwendeten Narkotika in der Veterinärmedizin. Für Kurznarkosen werden Thiobarbiturate und N-Methylbarbiturate eingesetzt. Daneben finden auch Substanzen wie Chloralhydrat, vor allem für Großtieranästhesien, Althesin, Alfaxan, Etomidat, bei Kleintier-Anästhesien, Ketamin und Propofol eine Anwendung in der Anästhesie (Loscar und Conzen, 2004).
Neurologische Wirkungsmechanismen und Rezeptorfunktionsweise
Anästhetika können in Neurotransmittersysteme eingreifen und die Signalübertragung im ZNS behindern. Vor allem wird die Wirkung der Narkosemittel durch eine Modulation membranständiger Ionenkanäle hervorgerufen. Narkosemittel können sowohl ligandengesteuerte Neurotransmittersysteme als auch spannungsabhängige Ionenkanäle beeinflussen (Eckle et al, 2009).
Synaptische Signalübertragung kann den ligandengesteuerten Ionenkanälen zugeordnet werden. Aufgrund seiner Bindung an verschiedene glutamaterge Rezeptoren, wie NMDA, AMPA oder Kainat, zählt Glutamat zu dem bedeutendsten Neurotransmitter. Auch müssen Serotonin-(5-HT3)-Rezeptoren erwähnt werden, wenn man von anästhetikasensitiven ligandengesteuerten Ionenkanälen spricht. In Folge der Rezeptoren-Bindung werden die Ionenkanäle geöffnet. Dieser Prozess bewirkt die Depolarisation der Zellmembran und löst das Aktionspotential aus, sobald ein Schwellenwert überschritten wird. Im Gegensatz zu den exzitatorischen können inhibitorische Transmitter eine Hyperpolarisation der Zellmembran hervorrufen, weshalb die zelluläre Erregbarkeit abnimmt bzw. gehemmt wird. Zu diesen zählen GABAA-Rezeptoren und Glyzinrezeptoren, welche ebenfalls für die Steigerung der Cl- -Leitfähigkeit sorgen (Hemmings, 2009). Zusätzlich zu den bereits genannten Rezeptoren sind die den zentralen Ionenkanal umschließenden nikotinergen Acetylcholinrezeptoren (AcChoR) zu erwähnen. Narkotika verfügen über eine hemmende Wirkung auf die Aktivität dieser Rezeptoren, die durch verschiedene Mechanismen hervorgerufen wird: „1. durch eine direkte Blockade des Ionenkanals, 2. durch eine allosterische Inhibition des Ionenkanals sowie 3. durch Veränderung in der den AcChoR umgebenden Zellmembran“ (Miller und Tonner, 1992).
Je nach Spannungsänderung in der Zellmembran können spannungsabhängige Ionenkanäle entweder geöffnet oder geschlossen werden. Somit wird die Regulierung der Erregbarkeit und der Aktivität der Zellen durch diese Kanäle übernommen. Die Umschaltung von Wachheit zu Bewusstlosigkeit geschieht durch die Modulation von HCN- und T-Typ-Kalzium-Kanälen, welche unter anderem durch ihre neuronale Schrittmacheraktivität die thalamokortikalen Rhythmen generieren. Zugleich werden die HCN-Kanäle durch zyklische Nukleotide gesteuert und stimulieren die Depolarisation. Schlussendlich sind die spannungsabhängigen Kalium-2P-Kanäle zu erwähnen. Diese haben die Funktion, das Ruhemembranpotenzial zu generieren und modulieren (Eckle et al, 2009).
Dennoch wirken nicht alle Kanäle auf jedes Narkosemittel gleich (siehe Tablle 2).
Tabelle 2: Wirkung von Isofluran, Propofol und Ketamin auf verschiedene Ionenkanäle (nach Eckle et al, 2009)
Substrat |
Isofluran |
Propofol |
Ketamin |
|||
GABAA-Rezeptoren |
↑↑ |
↑↑ |
↑/○ |
|||
Glyzinrezeptoren |
↑↑ |
↑ |
○ |
|||
Neuronale nikotinische ACh-Rezeptoren |
↓↓ |
↓ |
↓↓ |
|||
NMDA-Rezeptoren |
↓ |
↓ |
↓↓ |
|||
AMPA-Rezeptoren |
↓↓ |
○ |
○ |
|||
Kainatrezeptoren |
↑↑ |
○ |
○ |
|||
Serotonin-(5-HAT3)-Rezeptoren |
↑↑ |
↓ |
○ |
|||
T-Typ-Kalzium-Kanäle |
↓ |
↓ |
↓ |
|||
Kalium-2P-Kanäle |
↑ |
○ |
─ |
|||
HCN-Kanäle |
↓ |
↓ |
↓ |
|||
↑ Verstärkung, ↓ Verminderung, ○ kein Effekt, ↑↑/↓↓ gesicherte Datenlage für Verstärkung/Verminderung in klinisch relevanten Konzentrationen
Inhalationsnarkotika
Wirkungen in den verschiedenen Arealen des zentralen Nervensystems
Die genaue Bedeutung bestimmter Gegenden im Gehirn bzw. im ZNS für die Wirkung und deren Weiterleitung sind bis jetzt noch nicht wirklich bekannt. In der Forschung wurden aber immer mehr die „Areale mit Anästhetika-sensitiven Funktionen“ untersucht. Beispiele dafür sind unter anderem Reaktionen auf Schmerzen, deren Zentrum im Rückenmarksbereich liegt. Auch das retikuläre-aktivierende System, welches für Wahrnehmung, Schlaf usw. verantwortlich ist, zählt zu solchen Gebieten ( Campagna et al, 2003). Genauere Areale und deren Funktionen werden im Folgenden erläutert.
Basolaterale Amygdala
Als ein Teil des limbischen Systems, kümmert sich die Amygdala – auch als Mandelkern bekannt – um unsere Emotionalität (Campagna et al,2003). Die basolaterale Amygdala ist eines der drei Hauptgebiete in welche der Mandelkern sich zweckmäßig einteilen lässt (Sah et al, 2003). Sie steuert nicht nur unsere emotionalen Reaktionen auf ankommende Reize, sondern ist auch für die Nozizeption und die Aufarbeitung der Schmerzen zuständig. Daher ist die Amygdala womöglich auch an der durch Anästhetika hervorgerufenen Amnesie sowie der Schmerzlinderung beteiligt (Neugebauer et al, 2003; Dutton et al, 2001).
Präfrontaler Kortex
Der Präfrontale Kortex gehört dem Frontallappen an und hängt mit keinem der motorischen Systeme zusammen. Zu seinen Hauptaufgaben zählen das Planen zukünftiger Handlungen, sowie deren Anpassung auf eine bereits gegebene Situation. Außerdem bezieht sich sein Aufgabengebiet auch auf das Bewusstsein. Es ist erdenklich, dass Anästhetika „über eine Desintegration der kortikalen Informationsverarbeitung“ zum Verlust des Bewusstseins führen können. Des Weiteren ist der präfrontale Kortex für den hypnotischen Teil einer allgemeinen Narkose mitverantwortlich, weswegen er auch für eine Anästhesie induzierte Amnesie erwähnenswert ist (Rudolph und Antkowiak, 2004).
Hinterhorn des Rückenmarks
Das Hinterhorn ist ein Teil der grauen Substanz des Rückenmarks. Diese kann man in zehn sogenannte Laminae einteilen, von welchen nur die ersten sechs das Hinterhorn bilden. In diesem Kontext ist die zweite Lamina, die Substantia gelatinosa, als wichtigste zu nennen. Informationen über Schmerzen gelangen über dicke Aδ-Fasern und dünnere langsamere C-Schmerzfasern hierhin. Für die Schmerzverarbeitung auf spinaler Ebene ist die Substantia gelatinosa das Gebiet, welches die größte Rolle spielt (Kohama et al, 2000). Werden hier neuronale Funktionen unterdrückt, kann ein schmerzstillendes Mittel seine Wirkung entfalten. Manche Narkosemittel – wie z.B. das später beschriebene Xenon – haben zusätzlich zu ihren eigentlichen Wirkungen auch analgetische, wodurch eine eben beschriebene Unterdrückung über eine Veränderung der neuronalen Erregbarkeit in der zweiten Lamina ausgelöst werden kann (Campagna et al, 2003).
Xenon
Das Edelgas Xenon ist eines der seltensten und das stabilste schwere Gas dieser Gruppe. Darüber hinaus ist es das einzige dass anästhetische Eigenschaften unter normobaren Bedingungen besitzt. Erstmals entdeckt wurde es 1898 „als Restsubstanz bei der Zerlegung von Luft“ durch Ramsay und Travers. Im Griechischen lautet Xenon „der Fremde“, was auf die Anästhesie bezogen gut passt, da es noch eher selten eingesetzt wird und wenig erforscht ist (Reyle-Hahn und Rossaint, 2000). Dieses Gas ist viermal dichter als die Luft und auch kompakter, als die anderen Inhalationsanästhetika, wie beispielsweise Lachgas (Deile et al, 2013).
Wirkung auf Neurotransmittersysteme
Vorab lässt sich sagen, dass die Wirkung von Xenon auf die verschiedenen Neurotransmittersysteme kritisch zu betrachten ist, da sich viele Arbeiten nicht einig sind. „Glutamat ist der wichtigste exzitatorische Neurotransmitter, glutamaterge Stromantworten werden durch Xenon vermindert.“ Welcher Typ jedoch genau involviert ist, ist strittig (Preckel et al, 2006). Einige Studien belegen die alleinige Wirkung auf den NMDA-Rezeptor, hier hatte Xenon reduzierenden Einfluss (Franks et al, 1998). Dies wird durch andere Arbeiten wiederlegt, welche herausgefunden haben, dass es ebenfalls hemmend auf non-NMDA-Rezeptoren wirkt (Plested et al, 2004). Des Weiteren gibt es eine Analyse, die eine Unterdrückung durch Xenon an den AMPA-Rezeptoren, aber nicht an NMDA-Rezeptoren aufweist (Nagele et al, 2005).
Auch die Wirkung auf den wichtigsten Inhibitorischen GABAA-Rezeptor ist umstritten. Es gibt Ergebnisse welche die Wirkung von Xenon auf Gabaerge synaptische Transmission komplett verneinen (Franks et al, 1998). Jedoch zeigen andere wieder, dass diese Rezeptoren doch einen Angriffsort für Xenon darstellen. Die Wirkung anderer Inhalationsanästhetika darauf fallen dagegen stärker aus (Hapfelmeier et al, 2000).
Wirkung an Ionenkanälen
In Bezug auf Kaliumkanäle beispielsweise konnte Xenon unter Modulation dieser mit NDMA ein neuroprotektiver Einfluss nachgewiesen werden (Fahlenkamp et al, 2015). An spannungsabhängigen Ca2+-Kanälen zeigt Xenon keine Auswirkungen, dafür aber eine Unterdrückung auf die Plasmamembran-Ca2+-ATPase. Dadurch wird die intrazelluläre Kalziummenge gesteigert und die Verarbeitung der neuronalen Signale modifiziert und somit eine Narkose ausgelöst (Franks und Lieb, 1994).
Vor und Nachteile der Anwendung
Xenon hat überwiegend Vorteile, da es vielen Ansprüchen an ein optimales Inhalationsnarkotikum genügt. Sehr gut wirkt es sich auch auf das Herz-Kreislauf-System aus: „Xenon senkt weder die myokardiale Kontraktilität noch den Blutdruck oder den systemischen Gefäßwiderstand in Gesunden oder kardial vorerkrankten Patienten.“ Eher nachteilig zeigt es sich in Bezug auf den zerebralen Blutfluss – dieser wird erhöht (Deile et al, 2013). Andere Forschungen zeigen hingegen eine Verminderung des zerebralen Blutflusses. Angesichts seiner hohen Viskosität kann Xenon eine Erhöhung des Atemwegswiderstandes auslösen, was aber klinisch keine große Bedeutung hat. „Derzeit ist der entscheidende limitierende Faktor für den Einsatz der hohe Preis, bedingt durch die teure Herstellung und das geringe Vorkommen“ (Mattusch, 2012).
Abgrenzung Analgetika und Anästhetika
Egal ob Schmerzmittel oder Narkosemittel: beide haben Auswirkungen auf die Nozizeption. Jedoch wirken sie unterschiedlich. Zentralanalgetika beispielsweise beeinflussen das Schmerzempfinden direkt durch eine Beeinflussung im zentralen Nervensystem. Allgemeinanästhetika wiederum stillen den Schmerz in dem sie das Bewusstsein durch Angriff im ZNS ausschalten (Plötz, 2013). Opioid Analgetika und Anästhetika haben nicht nur verschiedene Wirkungsmechanismen, sondern auch andere Wirkungsorte. Wie früher schon erklärt wirken Opioide an den G Protein-gekoppelten mü-, delta- und k-Opioid Rezeptoren. All diese tragen ihre Wirkung im Rückenmark aus und sorgen für Schmerzstillung und verhindern die Schmerzweiterleitung bzw. Verarbeitung. Die zuvor ebenfalls schon beschriebenen Anästhetika wirken an verschiedenen Loki wie den Glutamat Rezeptoren, GABA Rezeptoren und an den Ionenkanälen. Sie führen zu hypnotischen Zuständen, Bewusstseinsverlust, Schmerzlinderung, Amnesie usw. (Rivera-Arconada et al, 2016). Es zeigt, dass Analgetika und Anästhetika zwar nicht auf die gleiche Art und Weise funktionieren, sich jedoch in ihrer Wirkung und Anwendung gut ausgleichen und es somit auch sehr schwer ist eine genaue Grenze zu ziehen.
Fazit
Zusammenfassend lässt sich sagen, dass vor allem bei Opioiden die Dosierung und die Einnahmezeit streng eingehalten werden sollte, da es ansonsten zu einer Abhängigkeit kommt. Damit alle physiologischen Wirkungsmechanismen auch richtig funktionieren und umgesetzt werden, ist die Einhaltung aller Vorgaben natürlich auch bei Anästhetika stets zu beachten. Auch wenn bei der Einnahme alles richtig gemacht wird, darf man jedoch nie vergessen, dass jedes Medikament auch Nebenwirkungen mit sich bringt. Bezüglich des Inhalationsnarkotikums Xenon lässt sich anmerken, dass es trotz seiner vielen Vorteile noch sehr selten eingesetzt wird und man somit auch weniger Erfahrungs- bzw. Vergleichswerte hat.
Quellenverzeichnis
Fachbücher
Freye, E. (2002): Opioide der Medizin, Auflage 5, Springer Verlag, Berlin Heidelberg Online: https://books.google.at/books?hl=de&lr=lang_de&id=iVXyBQAAQBAJ&oi=fnd&pg=PA52&dq=wirkung+von+opioiden+auf+das+nervensystem&ots=5T8PUweyHv&sig=hgf1Px0k8v3mZ7xz22Uycva6Kco&redir_esc=y#v=onepage&q&f=false (11.04.2020)
Plötz, H. (2013): Kleine Arnzeimittellehre, Auflage 6, Springer Verlag, Berlin Heidelberg
Fachartikel
Arnold, T. (2014): Generation intelligentes, grenzenloses Beatmen – neuere Beatmungsformen in der Anästhesie. Anästhesie Journal 63(1): 10 Online: https://siga-fsia.ch/files/Anaesthesie_Journal/Anaesthesie_Journal_1-14_Web.pdf (11.04.2020)
Barnett, P. G.; Rodgers, J. H.; Bloch, D. A. (2001): A meta-analysis comparing buprenorphine to methadone for treatment of opiate dependence. Addiction 96(5): 683-90 Online: https://www.ncbi.nlm.nih.gov/pubmed/11331027 (12.04.2020)
Campagna, J. A.; Miller, K. W.; Forman, S. A. (2003): Mechanisms of actions of inhaled anesthetics. New England Journal of Medicine 348(21): 2110-24 Online: https://www.ncbi.nlm.nih.gov/pubmed/12761368 (11.04.2020)
Corder, G.; castro, D. C.; Bruchas M. R.; Scherrer G. (2018): Endogenous and Exogenous Opioids in Pain. Annu Rev Neurosci 41: 453-473 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6428583/ (12.04.2020)
Deile, M.; Damm, M.; Heller, A. R. (2013): Inhalative Anästhetika. Der Anaesthesist 62: 493-504 Online: https://link.springer.com/article/10.1007%2Fs00101-013-2175-9 (11.04.2020)
Dutton, R. C.; Maurer, A. J.; Sonner, J. M.; Fanselow, M. S.; Laster, M. J.; Eger, E. I. 2nd. (2001): The concentration of isoflurane required to suppress learning depends on the type of learning. Anesthesiology 94(3): 514-9 Online: https://www.ncbi.nlm.nih.gov/pubmed/11374614 (11.04.2020)
Eckle, V.-S.; Hucklenbruch, C; Todorovic, S.M. (2009): Was wissen wir über Narkosemechanismen? Der Anaesthesist · 58 (11): 1144–1149 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2823130/ (11.04.2020)
Fahlenkamp, A. V.; Rossaint, R.; Cobrun, M. (2015): Neuroprotektion durch Edelgase. Neue Entwicklungen und Erkenntnisse. Der Anaesthesist 64: 855-858 Online: https://link.springer.com/article/10.1007/s00101-015-0079-6 (11.04.2020)
Franks, N. P.; Dickinson, R.; de Sousa, S. L.; Hall, A. C.; Lieb, W. R. (1998): How does xenon produce anaesthesia? Nature 396(6709): 324 Online: https://www.nature.com/articles/24525 (12.04.2020)
Franks, N. P.; Lieb, W. R. (1994): Molecular and cellular mechanisms of general anaesthesia. Nature 367(6464): 607-14 Online: https://www.ncbi.nlm.nih.gov/pubmed/7509043 (12.04.2020)
Hapfelmeier, G.; Zieglgänsberger, W.; Haseneder R.; Schneck, H.; Kochs, E. (2000): Nitrous oxide and xenon increase the efficacy of GABA at recombinant mammalian GABA(A) receptors. Anesth Analg 91(6): 1542-9 Online: https://www.ncbi.nlm.nih.gov/pubmed/11094015 (12.04.2020)
Hemmings Jr. H. C. (2009): Sodium channels and the synaptic mechanisms of inhaled anaesthetics. British Journal of Anaesthesia 103 (1): 61–9 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2700013/ (11.04.2020)
Kohama, I.; Ishikawa, K.; Kocsis, J. D. (2000): Synaptic Reorganization in the Substantia Gelatinosa After Peripheral Nerve Neuroma Formation: Aberrant Innervation of Lamina II Neurons by Aβ Afferents. J Neurosci 20(4): 1538-1549 Online: https://www.jneurosci.org/content/20/4/1538.full (11.04.2020)
Loscar M.; Conzen P. (2004): Volatile Anästhetika. Der Anaestesist 53: 183-198 Online: https://link.springer.com/article/10.1007%2Fs00101-003-0632-6 (11.04.2020)
Mattusch, C. (2012): Der Einfluss des Inhalationsanästhetikums Xenon auf die neuronale Aktivität im hippocampalen und thalamokortikalen Schnittpräparat, Technische Universität München, München Online: http://nbn-resolving.de/urn/resolver.pl?urn:nbn:de:bvb:91-diss-20121005-1098264-0-8 (05.04.2020)
Maurice, T.; Urani, A.; Phan, V. L.; Romieu, P. (2001): The interaction between neuroactive steroids and the sigma1 receptor function: behavioral consequences and therapeutic opportunities. Brain Res. Brain Res Rev. 37(1-3): 116-132 Online: https://www.ncbi.nlm.nih.gov/pubmed/11744080 (12.04.2020)
Micallef, P. (2020): Sevofluran auf der Intensivstation. SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 20 (15–16): 268–270 Online: https://medicalforum.ch/article/doi/smf.2020.08362 (11.04.2020)
Miller, K. W.; Tonner, P. H. (1992): Cholinerge Rezeptoren und Anästhesie. Georg Thieme Verlag Stuttgart · New York. Anästhesiol. Intensivmed. Notfallmed. Schmerzther. 27(2): 109-114 Online: https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-2007-1000263 (11.04.2020)
Nagele, P.; Metz, L. B.; Crowder, C. M. (2005): Xenon acts by inhibition of noon-N-methyl-D-aspartate receptor-mediated glutamatergic neurotransmission in Caenorhabditis elegans. Anesthesiology 103(3): 508-13 Online: https://anesthesiology.pubs.asahq.org/article.aspx?articleid=2025922 (11.04.2020)
Neugebauer, V.; Li, W.; Bird, G. C.; Bhave, G.; Gereau, R. W. 4th. (2003): Synaptic plasticity in the amygdala in a model of arthritic pain: differential roles of metabotropic glutamate receptors 1 and 5. J Neurosci 23(1): 52-63 Online: https://www.ncbi.nlm.nih.gov/pubmed/12514201 (11.04.2020)
Plested, A. J., Wildman, S. S.; Lieb, W. R.; Franks, N. P. (2004): Determinants oft he sensitivity of AMPA receptors to xenon. Anesthesiology 100(2): 347-58 Online: https://www.ncbi.nlm.nih.gov/pubmed/14739810 (11.04.2020)
Preckel, B.; Weber N. C.; Sanders, R. D.; Maze, M.; Schlack, W. (2006): Molecular mechanisms transducing the anesthetic, analgesic, and organ-protective actions of xenon. Anesthesiology 105(1): 187-97 Online: https://www.ncbi.nlm.nih.gov/pubmed/16810011 (11.04.2020)
Reyle-Hahn, M.; Rossaint, R. (2000): Xenon – ein neues Anästhetikum. Der Anaesthesist 49: 869-874 Online: https://link.springer.com/article/10.1007%2Fs001010070039 (11.04.2020)
Rivera-Arconada, I.; Roza, C.; Lopez-Garcia, J. A. (2016): Spinal Reflexes and Windup In Vitro: Effects of Analgesics and Anesthetics 22(2): 127-134 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6492782/ (7.04.2020)
Rudolph, U.; Antkowiak, B. (2004): Molecular and neuronal substrates for general anaesthetics. Nat Rev Neurosci 5(9): 709-20 Online: https://www.ncbi.nlm.nih.gov/pubmed/15322529 (11.04.2020)
Sah, P.; Faber, E. S.; Lopez De Armentia, M.; Power, J. (2003): The amygdaloid complex: anatomy and physiology. Physiol Rev 83(3): 803-34 Online: https://www.ncbi.nlm.nih.gov/pubmed/12843409 (11.04.2020)
Stein, C. (2015): Opioid Receptors. Annu Rev Med 67: 433-51 Online: https://www.ncbi.nlm.nih.gov/pubmed/26332001 (12.04.2020)
Waldhoer, M.; Bartlett, S. E.; Whistler J. L. (2004): Opioid receptors. Annu Rev Biochem 73: 953-90 Online: https://www.ncbi.nlm.nih.gov/pubmed/15189164 (12.04.2020)
Abbildungen
Abb. 1: Physiologische Zustände von Tieren in verschiedenen Narkosestadien: Student der Veterinärmedizinischen Universität Omsk (1998): Auf das zentrale Nervensystem wirkende Medikamente. Physiologischer Zustand von Tieren in verschiedenen Anästhesiestadien. Übersetzt von Irina Kacharovskaya. Online: https://www.docsity.com/ru/lekarstvennye-veshchestva-ugnetayushchie-centralnuyu-nervnuyu-sistemu/1217300/ [04.04.2020]
Tabellen
Tabelle 1: Zentral Wirkende Opioide: Maurice, T.; Urani, A.; Phan, V. L.; Romieu, P. (2001): The interaction between neuroactive steroids and the sigma1 receptor function: behavioral consequences and therapeutic opportunities. Brain Res. Brain Res Rev. 37(1-3): 116-132 Online: https://www.ncbi.nlm.nih.gov/pubmed/11744080 (12.04.2020)
Tabelle 2: Wirkung von Isofluran, Propofol und Ketamin auf verschiedene Ionenkanäle: Eckle, V.-S.; Hucklenbruch, C; Todorovic, S.M. (2009): Was wissen wir über Narkosemechanismen? Der Anaesthesist · 58 (11): 1144–1149 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2823130/ (11.04.2020)