Schrittmacherzellen
Die Schrittmacherzellen geben den Rhythmus des Herzens und des Gastrointestinal-Traktes vor und bilden somit eine sehr wichtige Zellgruppe im Körper. Bei Störungen der Schrittmacherzellen kann es teilweise zu schwerwiegenden Erkrankungen kommen. Die Rollen der Zellen und die Folgen einer Störung werden in diesem Artikel näher bearbeitet.
Contents
Was sind Schrittmacherzellen?
Allgemeine Definition
Als Schrittmacherzellen werden Zellen bezeichnet, die in der Lage sind durch Veränderung ihrer Membranpermeabilität eigenständig ein Aktionspotential auszulösen. Diese Zellen befinden sich vor allem im Herzmuskelgewebe wie auch in der glatten Muskulatur, zum Beispiel im Darm. Im Herzen sind sie für einen normalen Herzrhythmus verantwortlich, im Darmtrakt beeinflussen sie die Darmmotilität (Sander et al., 2006);(Quinn und Kohl, 2012).
Funktionsweise der Schrittmacherzellen
Die Funktion der Schrittmacherzellen ist, wie schon erwähnt, eigenständig ein Aktionspotential auszulösen. Dies ist ihnen wegen mehrerer spezieller Ionenkanäle möglich. Die Schrittmacherzellen besitzen kein definierbares Ruhepotential, da die Repolarisation bei einem bestimmten Schwellenwert wieder in die Depolarisation übergeht. Beim Erreichen dieses Potentials kommt es zu einem geringen Na+-Einstrom und die Zellmembran beginnt zu depolarisieren (Varró und Papp, 1992). Diese Kanäle werden auch als HCN-Kanäle bezeichnet. Die Aktivität der Kanäle wird sowohl durch die Membranspannung als auch durch die Bindung von cAMP gesteuert (Kusch et al., 2010)4. Vor Erreichen des Schwellenpotentials öffnen sich die Calcium-Kanälen vom Typ-T und Typ-L. Das Calcium strömt in die Zelle und führt so automatisch zum Erreichen des Schwellenpotentials. Bei einem Wert von +15mV schließen sich die langsamen Natrium-Kanäle und gleichzeitig öffnen sich Kalium-Kanäle. Das Kalium strömt aus der Zelle und es kommt zur Repolarisation (Varró und Papp, 1992).
Welche Arten von Schrittmacherzellen gibt es?
Herzschrittmacher Zellen
Im Herzmuskel finden wir zwei Gruppen von Fasern. Zum einen das Arbeitmyokard für die Pumparbeit, zum anderen das spezifische Erregungsbildungs- und Erregungsleitungssystem. Zu letzterem zählen auch die Schrittmacherzellen, die auf Grund ihrer Lokalisation in 3 Gruppen unterteilt werden können:
Die primären oder auch aktuellen Schrittmacherzellen findet man im Sinuatrialknoten (SA-Knoten). Der SA-Knoten wird somit zum primären Schrittmacherzentrum des Herzens und ist an der komplexen Regulation der Herzfrequenz beteiligt. Die Zellen depolarisieren ungefähr 60- bis 80-mal pro Minute und leiten die elektrische Erregung auf das Myokard der Vorhöfe weiter.
Die sekundären oder auch potenziellen Schrittmacherzellen befinden sich im Atrioventrikularknoten oder abgekürzt AV-Knoten. Er bildet das sekundäre Reizzentrum des Herzens und ist für die Depolarisation der Ventrikel verantwortlich. Er empfängt die fortgeleitete Depolarisation der Vorhöfe und leitet diese mit einer kleinen zeitlichen Verzögerung an die Ventrikel weiter. Bei einem Ausfall des Sinusknoten oder einer gestörten Weiterleitung springt der AV-Knoten als Reizzentrum ein. Die Spontanfrequenz der Schrittmacherzellen ist hier etwas langsamer, sie liegt in etwa bei 40 bis 50 Erregungen pro Minute.
Die dritte Gruppe bilden die tertiären Schrittmacherzellen, die im His-Bündel zu finden sind. Sie erhalten die Erregung aus dem AV-Knoten und leiten diese weiter bis zur Herzspitze. Die Weiterleitung erfolgt zunächst durch einen gemeinsamen Stamm, der sich nach wenigen Millimetern in die Tawara-Schenkel aufteilt. Diese teilen sich wiederum an der Herzspitze in die Purkinje-Fasern auf, welche mit den Myokardzellen in Kontakt treten. Die Spontanaktivität der Schrittmacherzellen ist hier am langsamsten und liegt bei 20 bis 40 Erregungen pro Minute (Thews und Vaupel, 1997).
Cajal Zellen in der glatten Muskulatur des GIT
Im Gastrointestinaltrakt (GIT) finden wir eine weitere Art der Schrittmacherzellen, die interstitiellen Cajal Zellen (ICC). Die ICC gelten als spezialisierte glatte Muskelzellen und es werden zwei Arten der ICC unterschieden: Die intramuskulären ICC (ICC-IM) sind spindelförmige Zellen, die sich in der longitudinalen Muskelschicht befinden. Sie dienen als Vermittler zwischen erregenden/hemmenden Nervenfasern und den glatten Muskelzellen. Die zweite Art der ICC hat eine dreieckige, leicht unregelmäßige Form mit mehreren Fortsätzen, die ein Verzweigungsgeflecht zwischen den longitudinalen und kreisförmigen Muskelschichten bilden. Ihre Hauptaufgabe ist die Erzeugung des Schrittmacherrhythmus. Da sie mit dem Auerbach Plexus verbunden sind, bezeichnet man sie als ICC-AP (Huizinga, 2001).
Die ICC zeigen ständig rhythmische Schwankungen des Membranpotentials und geben diese mit Hilfe der Gap junctions passiv an die glatten Muskelzellen weiter. Es kommt jedoch noch nicht zu einer Kontraktion, da die Depolarisation nicht über -40mV steigt und somit nur „stille“ elektrische Wellen produziert werden. 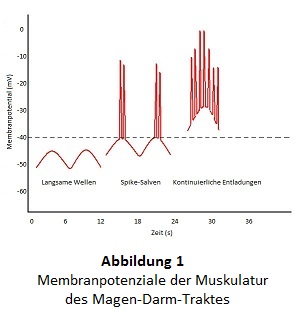 Diese Wellen werden als „slow waves“ bezeichnet und haben eine Frequenz von ca. 3-10 Minuten-1.
Diese Wellen werden als „slow waves“ bezeichnet und haben eine Frequenz von ca. 3-10 Minuten-1.
Überschreitet die Depolarisation den Schwellenwert von ca. -40mV, zum Beispiel aufgrund einer Dehnung oder durch Acetylcholin, werden weitere Ca2+-Kanäle vom Typ-L aktiviert und es entsteht ein Ca2+-Aktionspotential, welches auch auf die glatte Muskulatur übertragen wird. Durch den Anstieg der zytosolischen Ca2+-Konzentration wird eine Kontraktion ausgelöst. Wird das Schwellenpotential nur kurz überschritten und nur eine begrenzte Anzahl an Aktionspotentialen ausgelöst, nennt man dies eine „Spike-Salve“. Die Salven führen zu phasischen Kontraktionen, welche eine sehr wichtige Rolle bei der Segmentation und der Peristaltik spielen.
Liegen die wellenförmigen Schwankungen über dem Schwellenpotential werden ununterbrochen Spikes entladen und es kommt zu einer tonischen Dauerkontraktion. Diese Art der Kontraktion ist bei den Sphinktern sehr wichtig (Klinke et al., 2009). Auf der Abbildung 1 sind die verschiedenen Membranpotenziale der Muskulatur des Magen-Darm-Traktes dargestellt.
Folgen einer Störung
Unter den Störungen kann man folgende Arten unterscheiden:
- Fehlen oder verminderte Ausbildung der Schrittmacherzellen
- Gestörte Entwicklung der Schrittmacherzellen
- Fehlerhafte Funktionsweise der Schrittmacherzellen
- Defekte Reizweiterleitung
Diese Störungen können weitreichende Folgen auf das Herz und den GI-Trakt haben.
Herzrhythmusstörungen
Unter einer Arrhythmie oder auf Deutsch Herzrhythmusstörung versteht man im Allgemeinen eine Unregelmäßigkeit in der Herzaktion. Die Herzaktion setzt sich aus Systole (Kontraktionsphase) und Diastole (Erschlaffungsphase) zusammen und ist die physiologische Grundlage für die Arbeit des Herzens. Eine Unregelmäßigkeit kann sowohl ein zu langsamer wie auch ein zu schneller Herzschlag sein (Bradykardie bzw. Tachykardie)(von Engelhardt und Breves, 2009). Die häufigsten Symptome einer Arrhythmie sind Brustschmerzen, Benommenheit oder Schwindel, Ohnmacht und Kurzatmigkeit (A.D.A.M. Medical Encyclopedia, 2012).
Die Arrhythmien werden in drei verschiedene Gruppen eingeteilt:
Nach der Herzfrequenz, dem Ort und der Art der Entstehung. Bei der Unterteilung nach der Herzfrequenz unterscheiden wir zwischen der Bradykardie und der Tachykardie. Als Bradykardie wird eine Herzrhythmusstörung bezeichnet, bei der die Herzfrequenz unter 60 Schläge pro Minute fällt. Bei der Tachykardie liegt die Herzfrequenz über 100 Schlägen pro Minute.
Der Ort der Entstehung kann ventrikulär oder supraventrikulär sein. Dies bedeutet die Störungen treten entweder in Höhe der Ventrikel oder in Höhe der Vorhöfe (Atrium) auf. Die Art der Arrhythmie kann eine Reizbildungs- oder Reizleitungsstörung sein.
Als erste Diagnostikmethode kommt meist die einfache Auskultation zum Einsatz und die Palpation des Pulses. Weiterführend ist das EKG (Elektrokardiogramm) die wichtigste Diagnostikmethode, dieses kann auch über einen längeren Zeitraum getragen werden (Langzeit-EKG) (A.D.A.M. Medical Encyclopedia, 2012).
Sinusknotendysfunktion (Sick Sinus Syndrom)
Definition
Die Sinusknotendysfunktion (SND) fasst verschiedene Herzrhythmusstörungen zusammen, die auf eine Störung mit abnormaler Reizbildung beziehungsweise abnormaler Fortpflanzung des Reizes zurückzuführen sind. Die folgenden Herzrhythmusstörungen werden unter der SND zusammengefasst:
Sinusbradykardie bis hin zu einer Pause oder auch Stillstand des Herzschlages
Chronotrope Inkompetenz (keine adäquater Anstieg der Herzfrequenz unter Belastung)
- Bradykardie-Tachykardie-Syndrom: es kommt abwechselnd zu einer supraventrikulären Tachykardie und einer Bradykardie
Entstehung
Eine häufige Ursache des Sick Sinus Syndroms ist eine fibrotische Narbenbildung. Da Kardiomyozyten nur eine begrenzte Fähigkeit zur Regeneration besitzen, entsteht, nach ihrem Tod (infolge von einem Infarkt oder von Myokardischämie) fibröses Gewebe. Fibroblasten sind keine elektrischen Leiter und setzen somit sowohl die Leitfähigkeit des Gewebes im SA-Knoten, als auch im umliegenden Gewebe herab (Xiao, 2011). Man nimmt an, dass die Ausschüttung des Signalstoffs der Fibrose (TGFβ-1), durch die Aktivität der Na+- Kanäle reguliert wird. Mit zunehmender Aktivität der Na+-Kanäle werden Signalstoffe ausgeschüttet, welche die Fibroblasten stimulieren. Es kommt zu einer Fibrose im SA Knoten (Hao et al., 2011).
Eine andere Ursache kann in den spannungsabhängigen Na+ - Kanälen des Herzens liegen. Durch das Zusammenspiel von K+, Ca2+ und Na+ Ionen wird das Aktionspotential generiert. Wird dieser Einstrom verhindert, bzw. gibt es zu wenige Kanäle, dauert es länger bis sich ein AP ausbildet. Eine Besonderheit des SA-Knoten ist, dass sowohl kardiale (TTX-resistent) als auch neuronale (TTX-sensitiv) Na+- Kanäle vorhanden sind. Schon eine sehr geringe Menge an TTX reicht aus, um die neuronalen Kanäle zu blockieren. Gibt es nun weniger der kardialen Kanäle und im Verhältnis mehr von den neuronalen, wird der Reiz gehemmt und das Herz schlägt langsamer.
Das Gen SCN5A codiert den Na V 1.5 Kanal, den Hauptkanal im SA Knoten. Eine Verletzung dieses Gens kann zur Folge haben, dass die Anzahl der Na+ - Kanäle abnimmt. Es wurde beobachtet, dass sich das Potential für die Aktivierung und für die Inaktivierung nicht geändert hat. Jedoch sind die Na+ Ströme um bis zu 30% vermindert. Hinzu kommt eine verlangsamte Reizweiterleitung und eine längere Regenerationsphase durch die geringere Anzahl an Kanälen (Lei et al., 2005).
Außerdem wird die Krankheit häufig auf eine Degeneration der Arterie des SA-Knotens, autoimmune Antikörper und auch eine fehlerhafte neuronale Innervation zurückgeführt. Die SND wurde bisher nur bei Menschen und Hunden entdeckt (Burrage, 2012).
Therapie von Arrhythmien
Für die Therapie von Arrhythmien gibt es viele verschiedene Möglichkeiten. Konventionell beugt man einer Bradykardie mit der Implantation eines permanenten elektronischen Herzschrittmachers vor, der die Aufgabe der herzeigenen Schrittmacherzellen übernimmt. Eine weitere, häufig angewandte Möglichkeit ist die Katheterablation. Hierbei wird das Gewebe, welches falsche Impulse liefert, mit Hilfe von Strom zerstört. Auch gibt es Medikamente, die die elektrische Aktivität modifizieren, die jedoch signifikante Nebenwirkungen, wie Magen-Darm-Störungen, haben.
Problem bei den genannten Therapien ist, dass sie die Reizerzeugung und Reizleitung nicht verbessern und Defekte nicht reparieren. Die Therapien wirken nur symptomatisch und nicht ursächlich. Zudem gibt es einige Nachteile bei den Therapien, wie Materialermüdungen oder Fehlfunktionen bei den Herzschrittmachern, starke Nebenwirkungen der Medikamente, Blutungen, Infektionen oder sogar die Perforation der Herzwand bei der Katheterablation (A.D.A.M. Medical Encyclopedia, 2012).
Deshalb versucht die moderne Wissenschaft nun durch Zell- und Gentherapie eine Heilung der Arrhythmien zu erreichen.
Durch die Transplantation von embryonalen Stammzellen oder auch primären Myoblasten konnte in einem in vivo Versuch ein AV blockiertes Herz stimuliert werden. Dies ist möglich, weil die Zellen Verbindungen mit dem umgebenden Gewebe herstellen können.
Bei einer Implantation von mesenchymalen Stammzellen (hMSCs) in ein ischämisches Herz konnte eine regionale Regeneration des Herzmuskelgewebes und eine daraus resultierende Verbesserung der Herzfunktion beobachtet werden. Der zugrunde liegende Mechanismus ist noch nicht aufgeklärt. Jedoch konnte bei einem Versuch mit Ratten festgestellt werden, dass die hMSCs Verbindungen durch Gap junctions zwischen den Kardiomyozyten herstellen. Eine lokale Implantation im AV-Gebiet verbesserte die AV-Überleitung auch bei einem kompletten AV-Block. Zusätzlich konnte eine Reduzierung an Kollagenablagerung festgestellt werden. Diese Reduzierung ist möglicherweise auf die antifibrotische parakrine Wirkung von MSCs zurückzuführen.
Es wurde auch versucht durch genetische Mutation die elektrischen Eigenschaften von Fibroblasten zu verändern. Durch eine geförderte Expression des Myocardin (MYOC) Gens in ventrikulären Fibroblasten (hVSFs) konnte die Erregungsleitung verbessert werden. Auch nicht-kardiale Fibroblasten können genetisch so verändert werden, dass sie elektrische Impulse weiterleiten. In dem Versuch wurden Hautfibroblasten mit dem MyoD und dem Cx43 Gen versehen. Zudem wurde auch die Transplantation von Fibroblasten mit speziellen K+ -Kanälen (K V 1.3) untersucht. Hierbei kam es zu einer signifikanten Reduzierung der Herzrate. Es konnte die AV-Funktion verändert werden ohne dass ein AV-Block erzeugt wurde.
Bei den genannten Zelltherapien gibt es jedoch immer viele Herausforderungen und Probleme (Zellquellen, Implantationsstelle, Immunantwort, usw.) die dazu führen, dass es noch keine klinischen Erfolge gibt.
Bei den Versuchen mit Gentransfer konnte häufig die Reduktion von Tachykardien erreicht werden. Dies geschah beispielweise bei dem Gentransfer von mutierten Connexin-Genen. Hierbei wurde die interzelluläre Kommunikation reduziert und somit eine 3-fache Verlangsamung der Leitungsgeschwindigkeit erreicht. Weitere Möglichkeiten wären eine Therapie mit Genen des Na+-, K+-Kanals oder des G-Protein. Allerdings trifft man auch hier noch auf zu viele Hindernisse, sodass die Forschung noch Zeit braucht um die Therapien klinisch testen zu können (Xiao, 2011).
Stromatumoren
Was ist ein Stromatumor?
 Stromatumore sind Bindegewebstumore des Gastrointestinaltrakts. Es sind mesenchymale (nicht epitheliale) Tumore myogenen Ursprungs (Schütte und Bauer, 2011). Am häufigsten treten sie im Bereich des Magens auf (Abbildung 2). Sie verursachen unspezifische Beschwerden, wie Bauchschmerzen oder Verdauungsstörungen. Die Behandlung erfolgt üblicherweise durch die Entfernung des Tumors und zusätzlicher Medikamentengabe von Tyrosinkinase-Inhibitoren. Die Größe, der Metastasierungsgrad und die mitotische Aktivität des Tumors bestimmen die Heilungschancen.
Stromatumore sind Bindegewebstumore des Gastrointestinaltrakts. Es sind mesenchymale (nicht epitheliale) Tumore myogenen Ursprungs (Schütte und Bauer, 2011). Am häufigsten treten sie im Bereich des Magens auf (Abbildung 2). Sie verursachen unspezifische Beschwerden, wie Bauchschmerzen oder Verdauungsstörungen. Die Behandlung erfolgt üblicherweise durch die Entfernung des Tumors und zusätzlicher Medikamentengabe von Tyrosinkinase-Inhibitoren. Die Größe, der Metastasierungsgrad und die mitotische Aktivität des Tumors bestimmen die Heilungschancen.
Stromatumore treten eher selten auf. Studien zufolge kommen sie bei zehn bis 20 Menschen pro einer Millionen Einwohnern vor. Das durchschnittliche Alter, indem der Tumor auftritt liegt bei 60-70 Jahren. Das Geschlecht spielt eine untergeordnete Rolle, wobei der prozentuale Anteil der erkrankten männlichen Patienten etwas höher ist (Schütte und Bauer, 2011);(Mukherjee et al., 2010).
Entstehung
Dass Stromatumore sich auf die Entwicklung der interstitiellen Cajal-Zellen zurückverfolgen lassen, vermuteten Hirota und Kindblom das erste Mal 1998. Cajal Zellen bilden ein komplexes Netzwerk, welches für die Darmmotilität im Gastrointestinaltrakt verantwortlich ist. Sie stellen eine Verbindung zwischen den autonomen Nerven und der glatten Muskulatur her. Dieses typische Muster konnte bei Stromatumoren im Omentum und im Mesenterium nachgewiesen werden. Da sich Cajal-Zellen normalerweise aber weder im Omentum, noch im Mesenterium befinden, haben Hirota und Kindblom, darauf geschlossen, dass sich Gastrointestinale Stromatumore aus den Vorläuferzellen der Cajal-Zellen entwickeln (Gradistanac und Wittekind, 2005). Bei ihnen ist eine Mutationen des C-Kit-Protoonkogens gefunden worden (Hirota et al., 1998). Das ist eine genetische Mutation, die zur Bildung defekter Wachstumsfaktor-Rezeptoren an der Zelloberfläche führt. Meistens ist der Kit-Rezeptor defekt, seltener tritt eine Mutation des PDGFA (Platelet derived growth factor A) oder der Proteinkinase C auf. In einem gesunden Organismus werden die Wachstumsfaktor-Rezeptoren der pluripotenten Stammzellen erst nach der Bindung eines Liganden, dem Stammzellfaktor (SCF) aktiviert. Daraufhin wird ein Signal zum Zellwachstum und zur Proliferation übermittelt. Nachdem sich der Ligand wieder gelöst hat, wird das Signal zur Zellteilung unterbrochen und das Zellwachstum stoppt. Durch die Mutation kommt es zur dauerhaften Aktivierung der Rezeptoren, auch in Abwesenheit des SCF. Das führt dazu, dass es kein Gleichgewicht zwischen Zellwachstum/Proliferation und Apoptose (Zelltod) gibt. Dadurch kommt es zum abnormalen Zellwachstum, also zur Tumorbildung (Kindblom et al., 1998).
Symptome
Die Symptome äußern sich unspezifisch und weisen nicht direkt auf einen Stromatumor hin. 35% der Patienten leiden unter Bauchschmerzen und bei 25% kommt es zu gastrointestinalen Blutungen. Eine Verschlechterung des Allgemeinzustandes kann bei 24% der Patienten festgestellt werden, Verdauungsstörungen bei 16%. Zu Eisenmangelanämie kommt es bei 15% der Patienten und 12% leiden unter Übelkeit und Erbrechen. Obstipation und Diarrhoe können bei 12% der Patienten festgestellt werden. Dass der Stromatumor tastbar in der Bauchhöhle liegt ist nur bei 8% der Patienten der Fall (Mucciarini et al., 2007).
Diagnostik
Es gibt zurzeit keine wegweisenden laborchemischen Untersuchungen die klar auf einen Stromatumor hinweisen. Ebenfalls sind keine Blutfaktoren bekannt, durch die ein Stromatumor eindeutig nachweisbar oder auszuschließen ist. Nur durch endoskopische Untersuchungen und gegebenenfalls eine Biopsie kann eine sichere Diagnose gestellt werden. Eine sichere Aussage zur Tumorbildung und Ausbreitung liefern bildgebende Verfahren wie die Sonografie, Kontraströntgen, die Computertomografie wie auch die Magnetresonanztomografie. Zum Nachweis von Metastasen kann ein PET-Scan durchgeführt werden. Die eigentliche Diagnose wird aber im Labor in histologischen Untersuchungen des Operationspräparates oder einer Biopsie gestellt (Mukherjee et al., 2010).
Therapie
Die vollständige chirurgische Entfernung des Tumors ist die Grundlage der Mehrzahl der Behandlungen. Kleinere Geschwülste können minimal invasiv durch einen laporoskopischen Eingriff entfernt werden.
Konventionelle zytotoxische Chemotherapien haben keine positiven Ergebnisse, wie die Verkleinerung des Tumors erbracht. Strahlentherapie wird nur palliativ angewendet, da die meisten Stromatumore resistent gegen sie sind (Mukherjee et al., 2010).
Prognose
Die beste Prognose kann bei Patienten gegeben werden, bei denen sich der Stromatumor im Magen befindet. Auch bei Tumoren die kleiner als 2 cm sind und langsam wachsen kann eine positive Prognose gestellt werden. Die Heilungschancen der Patienten mit Stromatumoren sind am größten, wenn der Tumor restlos entfernt werden kann. Bei nicht metastasierenden Tumoren kann man eine 5 Jahre-Überlebensrate bei 30-60% der Patienten geben, wobei diese abhängig davon ist, ob der Tumor lokalisiert ist oder rezidivierend ist. Bei nicht oder nur teilweise entfernten Tumoren ist eine schlechte Prognose zu stellen. (Mukherjee et al., 2010)(15) Durch eine Tumorruptur und die mögliche Tumoraussaat in die Bauchhöhle verschlechtert sich die Prognose noch weiter. Tritt der Fall ein, dass der Stromatumor an der peritonealen Bedeckung des befallenden Hohlorgans heranwächst besteht die Gefahr, dass der Tumor diese durchbricht. Schlechte Prognosen müssen auch gestellt werden, wenn der Tumor eine hohe Zelldichte vorweist (Rutkowski et al., 2007)(Fletcher, 2007).
Literaturverzeichnis
Einzelnachweise
A.D.A.M. Medical Encyclopedia (2012): Arrhythmias: Abnormal heart rhythms; Bradycardia; Tachycardia
http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0002091/
Burrage H (2012): Sick sinus syndrome in a dog: Treatment with dual-chambered pacemaker implantation. The Canadian Veterinary Journal 53(5): 565–568
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3327600/
Gradištanac T, Wittekind C(2005): Gastrointestinale Stromatumoren. Ärzteblatt Sachsen. 1: 17-19
http://www.slaek.de/50aebl/2005/archiv/01/pdf/0105_017.pdf
Hao X, Zhang Y, Zhang X, Nirmalan M, Davies L, Konstantinou D, Yin F, Dobrzynski H, Wang X, Grace A, Zhang H, Boyett M, Huang C L-H, Lei M (2011): TGF-β1-mediated fibrosis and ion channel remodeling are key mechanisms in producing the sinus node dysfunction associated with SCN5A deficiency and aging. Circulation. Arrhythmia and Electrophysiology 4 (3): 397-406
http://www.ncbi.nlm.nih.gov/pubmed/21493874
Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M, Muhammad Tunio G, Matsuzawa Y, Kanakura Y, Shinomura Y, Kitamura Y (1998): Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 279(5350):577-580
http://www.ncbi.nlm.nih.gov/pubmed/9438854
Huizinga JD (2001): Physiology and Pathophysiology of the Interstitial Cell of Cajal: From Bench to Bedside: II. Gastric motility: lessons from mutant mice on slow waves and innervation. American Journal of Physiology 281 (5): 1129-1134 http://ajpgi.physiology.org/content/281/5/G1129.full
Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM: Gastrointestinal pacemaker cell tumor (GIPACT) (1998): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. American Journal of Pathology 152(5): 1259-1269
http://www.ncbi.nlm.nih.gov/pubmed/9588894
Kusch J, Biskup C, Thon S, Schulz E, Nache V, Zimmer T, Schwede F, Benndorf K (2010): Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels. Neuron 67 (1): 75-85
http://www.ncbi.nlm.nih.gov/pubmed/20624593
Lei M, Goddard C, Liu J, Léoni A-L, Royer A, Fung S, Xiao G, Ma A, Zhang H, Charpentier F, Vandenberg JI, Colledge WH, Grace AA, Huang C L-H (2005): Sinus node dysfunction following targeted disruption of the murine cardiac sodium channel gene Scn5a. Journal of Physiology 1; 567(Pt 2): 387–400
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1474188/
Mucciarini C, Rossi G, Bertolini F, Valli R, Cirilli C, Rashid I, Marcheselli L, Luppi G, Federico M (2007): Incidence and clinicopathologic features of gastrointestinal stromal tumors. A population-based study. BMC Cancer;7: 230
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2241631/
Quinn TA, Kohl P (2012): Mechano-sensitivity of cardiac pacemaker function: Pathophysiological relevance, experimental implications, and conceptual integration with other mechanisms of rhythmicity. Progress in Biophysics and molecular biology 110 (2-3): 257-268
http://www.ncbi.nlm.nih.gov/pubmed/23046620
Rutkowski P, Nowecki ZI, Michej W, Debiec-Rychter M, Woźniak A, Limon J, Siedlecki J, Grzesiakowska U, Kakol M, Osuch C, Polkowski M, Głuszek S, Zurawski Z, Ruka W (2007): Risk criteria and prognostic factors for predicting recurrences after resection of primary gastrointestinal stromal tumor. Annals of Surgical Oncololgy 14(7): 2018-2027
http://www.ncbi.nlm.nih.gov/pubmed/17473953
Sander KM, Koh SD, Ward SM (2006): Interstitial cells of cajal as pacemakers in the gastrointestinal tract. Annual review of physiology 68: 307-343
http://www.ncbi.nlm.nih.gov/pubmed/16460275
Sanders KM, Ward SM (2006): Interstitial cells of Cajal: a new perspective on smooth muscle function. The Journal of Physiology 576(Pt 3): 721–726
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1890422/
Varró A, Papp JG (1992): The impact of single cell voltage clamp on the understanding of the cardiac ventricular action potential. Cardioscience 3 (3): 131-144
http://www.ncbi.nlm.nih.gov/pubmed/1384746
Xiao Y-F (2011): Cell and gene therapy for arrhythmias: Repair of cardiac conduction damage. Journal of Geriatric Cardiology 8(3): 147–158
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3390069/
Fachbücher
von Engelhardt W, Breves G(2009): Physiologie der Haustiere, 3. Auflage, Enke Verlag: 141-142
Fletcher CDM (2007): Diagnostic Histopathology of Tumors, 3. Auflage, Churchill Livingstone Verlag: 356-390
Klinke R, Pape H-P, Kurtz A, Silbernagl S (2009): Physiologie, 6. Auflage, Thieme Verlag: 420-421
Thews G, Vaupel P (1997): Vegetative Physiologie, 3. Auflage, Springer Verlag: 94-103
Webseiten
Mukherjee S, Sawyer MAJ, Decker RA (2010): Gastrointestinal Stromal Tumors.
http://emedicine.medscape.com/article/179669-overview
Schütte J, Bauer S (2011): Gastrointestinaler Stromatumor
http://www.onkologie-duesseldorf.de/subpages/gist_gastrointestinaler_stromatumor.htm
Abbildungen
Abbildung 1: selbst angefertigt von Jan Gregor Heider
Abbildung 2: http://de.wikipedia.org/w/index.php?title=Datei:GIST_2.jpg&filetimestamp=20061008143659
