Contents
Was sind Schrittmacherzellen?
Allgemeine Definition
Als Schrittmacherzellen werden Zellen bezeichnet, die in der Lage sind durch Veränderung ihrer Membranpermeabilität eigenständig ein Aktionspotential auszulösen. Diese Zellen befinden sich vor allem im Herzmuskelgewebe wie auch in der glatten Muskulatur, zum Beispiel im Darm. Im Herzen sind sie für einen normalen Herzrhythmus verantwortlich, im Darmtrakt beeinflussen sie die Darmmotilität. (Sander et al., 2006)(Quinn und Kohl, 2012)
Funktionsweise der Schrittmacherzellen: Entstehung eines Aktionspotentials
Die Funktion der Schrittmacherzellen ist, wie schon erwähnt, eigenständig ein Aktionspotential auszulösen. Dies ist ihnen wegen mehrerer spezieller Ionenkanäle möglich. Die Schrittmacherzellen besitzen kein definierbares Ruhepotential, da die Repolarisation bei einem bestimmten Schwellenwert wieder in die Depolarisation übergeht. Beim Erreichen dieses Potentials kommt es zu einem geringen Na+ Einstrom und die Zellmembran beginnt zu depolarisieren. (4) Diese Kanäle werden auch als HCN-Kanäle bezeichnet. Die Aktivität der Kanäle wird sowohl durch die Membranspannung als auch durch die Bindung von cAMP gesteuert. (5) Vor Erreichen des Schwellenpotentials öffnen sich die Calcium-Kanälen vom Typ-T und Typ-L. Das Calcium strömt in die Zelle und führt so automatisch zum Erreichen des Schwellenpotentials. Bei einem Wert von +15mV schließen sich die langsamen Natrium-Kanäle und gleichzeitig öffnen sich Kalium-Kanäle. Das Kalium strömt aus der Zelle und es kommt zur Repolarisation. (4)
Welche Arten von Schrittmacherzellen gibt es?
Herzschrittmacher Zellen
Im Herzmuskel finden wir zwei Gruppen von Fasern. Zum einen das Arbeitmyokard für die Pumparbeit, zum anderen das spezifische Erregungsbildungs- und Erregungsleitungssystem. Zu letzterem zählen auch die Schrittmacherzellen, die auf Grund ihrer Lokalisation in 3 Gruppen unterteilt werden können: (3)
Die primären oder auch aktuellen Schrittmacherzellen findet man im Sinuatrialknoten (SA-Knoten). Der SA-Knoten wird somit zum primären Schrittmacherzentrum des Herzens und ist an der komplexen Regulation der Herzfrequenz beteiligt. Die Zellen depolarisieren ungefähr 60- bis 80-mal pro Minute und leiten die elektrische Erregung auf das Myokard der Vorhöfe weiter.
Die sekundären oder auch potenziellen Schrittmacherzellen befinden sich im Atrioventrikularknoten oder abgekürzt AV-Knoten. Er bildet das sekundäre Reizzentrum des Herzens und ist für die Depolarisation der Ventrikel verantwortlich. Er empfängt die fortgeleitete Depolarisation der Vorhöfe und leitet diese mit einer kleinen zeitlichen Verzögerung an die Ventrikel weiter. Bei einem Ausfall des Sinusknoten oder einer gestörten Weiterleitung springt der AV-Knoten als Reizzentrum ein. Die Spontanfrequenz der Schrittmacherzellen ist hier etwas langsamer, sie liegt in etwa bei 40 bis 50 Erregungen pro Minute.
Die dritte Gruppe bilden die tertiären Schrittmacherzellen, die im His-Bündel zu finden sind. Sie erhalten die Erregung aus dem AV-Knoten und leiten diese weiter bis zur Herzspitze. Die Weiterleitung erfolgt zunächst durch einen gemeinsamen Stamm, der sich nach wenigen Millimetern in die Tawara-Schenkel aufteilt. Diese teilen sich wiederum an der Herzspitze in die Purkinje-Fasern auf, welche mit den Myokardzellen in Kontakt treten. Die Spontanaktivität der Schrittmacherzellen ist hier am langsamsten und liegt bei 20 bis 40 Erregungen pro Minute. (3)(6)
Cajal Zellen in der glatten Muskulatur des Gastrointestinaltraktes
Im Gastrointestinaltrakt (GIT) finden wir eine weitere Art der Schrittmacherzellen, die interstitiellen Cajal Zellen (ICC). Die ICC gelten als spezialisierte glatte Muskelzellen und finden sich sowohl an den Rändern der Muskelschichten als auch innerhalb der Muskelbündel. Sie treten in engen Kontakt mit den glatten Muskelzellen durch Gap junctions und stehen auch eng mit anliegenden Neuronen in Verbindung. Daher haben diese Zellen nicht nur eine Schrittmacherfunktion, sondern dienen auch der Neurotransmission und fungieren als Dehnungsrezeptoren. (7)
Die ICC zeigen ständig rhythmische Schwankungen des Membranpotentials und geben diese mit Hilfe der Gap junctions passiv an die glatten Muskelzellen weiter. Es kommt jedoch noch nicht zu einer Kontraktion, da die Depolarisation nicht über -40mV steigt und somit nur „stille“ elektrische Wellen produziert werden. 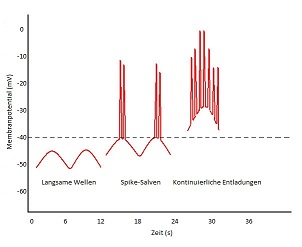 Diese Wellen werden als „slow waves“ bezeichnet und haben eine Frequenz von ca. 3-10 Minuten-1. Überschreitet die Depolarisation den Schwellenwert von ca. -40mV, zum Beispiel aufgrund einer Dehnung oder durch Acetylcholin, werden weitere Ca-Kanäle vom Typ-L aktiviert und es entsteht ein Ca-Aktionspotential, welches auch auf die glatte Muskulatur übertragen wird. Durch den Anstieg der zytosolischen Ca-Konzentration wird eine Kontraktion ausgelöst. Wird das Schwellenpotential nur kurz überschritten und nur eine begrenzte Anzahl an Aktionspotentialen ausgelöst, nennt man dies eine „Spike-Salve“. Die Salven führen zu phasischen Kontraktionen, welche eine sehr wichtige Rolle bei der Segmentation und der Peristaltik spielen. Liegen die wellenförmigen Schwankungen über dem Schwellenpotential werden ununterbrochen Spikes entladen und es kommt zu einer tonischen Dauerkontraktion. Diese Art der Kontraktion ist bei den Sphinktern sehr wichtig. (8) Auf der Abbildung 1 sind die verschiedenen Membranpotenziale der Muskulatur des Magen-Darm-Traktes dargestellt.
Diese Wellen werden als „slow waves“ bezeichnet und haben eine Frequenz von ca. 3-10 Minuten-1. Überschreitet die Depolarisation den Schwellenwert von ca. -40mV, zum Beispiel aufgrund einer Dehnung oder durch Acetylcholin, werden weitere Ca-Kanäle vom Typ-L aktiviert und es entsteht ein Ca-Aktionspotential, welches auch auf die glatte Muskulatur übertragen wird. Durch den Anstieg der zytosolischen Ca-Konzentration wird eine Kontraktion ausgelöst. Wird das Schwellenpotential nur kurz überschritten und nur eine begrenzte Anzahl an Aktionspotentialen ausgelöst, nennt man dies eine „Spike-Salve“. Die Salven führen zu phasischen Kontraktionen, welche eine sehr wichtige Rolle bei der Segmentation und der Peristaltik spielen. Liegen die wellenförmigen Schwankungen über dem Schwellenpotential werden ununterbrochen Spikes entladen und es kommt zu einer tonischen Dauerkontraktion. Diese Art der Kontraktion ist bei den Sphinktern sehr wichtig. (8) Auf der Abbildung 1 sind die verschiedenen Membranpotenziale der Muskulatur des Magen-Darm-Traktes dargestellt.
Folgen einer Störung
Herzrhythmusstörungen
Unter einer Arrhythmie oder auf Deutsch Herzrhythmusstörung versteht man im Allgemeinen eine Unregelmäßigkeit in der Herzaktion. Die Herzaktion setzt sich aus Systole (Kontraktionsphase) und Diastole (Erschlaffungsphase) zusammen und ist die physiologische Grundlage für die Arbeit des Herzens. Eine Unregelmäßigkeit kann sowohl ein zu langsamer wie auch ein zu schneller Herzschlag sein (Bradykardie bzw. Tachykardie).
Die Herzrhythmusstörungen werden in drei verschiedene Gruppen eingeteilt: Nach der Herzfrequenz, dem Ort und der Art der Entstehung. Bei der Unterteilung nach der Herzfrequenz unterscheiden wir zwischen der Bradykardie und der Tachykardie. Der Ort der Entstehung kann ventrikulär oder supraventrikulär sein. Dies bedeutet die Störungen treten entweder in Höhe der Ventrikel oder in Höhe der Vorhöfe (Atrium) auf. Die Art der Rhythmusstörungen kann eine Reizbildungs- oder Reizleitungsstörung sein.
Als erste Diagnostikmethode kommt meist die einfache Auskultation zum Einsatz. Weiterführend ist das EKG (Elektrokardiogramm) die wichtigste Diagnostikmethode. Eine weitere Möglichkeit ist die Benutzung des Ultraschallgeräts.
Als Folge einer bradykarden Herzrhythmusstörung kann es zu einer verminderten Perfusion des Gehirns kommen. Symptome sind dann Schwindel, Kollapszustände oder auch eine vollständige Ohnmacht (Synkope). Bei extremen Tachykardien kann es, wegen der sehr stark eingeschränkten Auswurfleistung des Herzens, zu einem Kreislaufzusammenbruch kommen und die Patienten verlieren das Bewusstsein.
Bradykardie
Bei der Bradykardie fällt die Herzfrequenz unter 60 Schläge pro Minute. Ursache einer Bradykardie kann eine Blockierung des SA-Knotens und/oder des AV-Knotens sein. Hierbei kommt es zu keiner oder einer gestörten Weiterleitung der Erregung von den Vorhöfen auf die Kammern. Eine weitere Ursache kann das Sick-Sinus-Syndrom sein auf das im Folgenden genauer eingegangen wird. Des Weiteren zählt man Vorhofflimmern zu den Gründen der Bradykardie.
Tachykardie
Die Tachykardie ist eine Herzrhythmusstörung, bei der die Herzfrequenz über 100 Schläge pro Minute ansteigt. Die Tachykardie wird je nach Ort ihrer Entstehung unterschieden in die supraventrikuläre und die ventrikuläre Tachykardie. Bei der supraventrikulären Tachykardie liegt der Ursprung der Rhythmusstörung oberhalb der Ventrikel. Genauer gesagt kann der Ursprung im SA-Knoten, in den Vorhöfen oder im AV-Knoten liegen. Die Störung führt dann zu einer erhöhten Herzfrequenz. Ursache hierfür ist eine gestörte Erregungsbildung bei der eine Frequenz von über 150 Erregungen pro Minute erreicht werden kann. Trotzdem gilt diese Form der Rhythmusstörung als meist nicht lebensbedrohlich, da nicht jede Erregung der Vorhöfe auf die Ventrikel übertragen wird. http://kardio.uniklinikum-leipzig.de/ekg/svt.pdf
Die ventrikuläre Tachykardie hat ihren Ursprung in den Ventrikeln. Sie gilt als lebensbedrohliche Störung, da es bei extremen Fällen zum vollkommenen Stillstand des Blutflusses kommen kann. Dies ist möglich wenn das Herz so schnell kontrahiert, dass sich das Blut aus Trägheitsgründen nicht mehr bewegt. Ursache einer ventrikulären Tachykardie ist in den meisten Fällen eine schwere Erkrankung des Herzmuskels zum Beispiel im Rahmen einer koronaren Herzkrankheit oder eines Herzinfarktes. Ebenfalls können Überdosierungen einiger Medikamente eine ventrikuläre Tachykardie auslösen.
Sick Sinus Syndrom (Sinusknotendysfunktion)
Die Sinusknotendysfunktion (SND) ist eine Störung die mit abnormaler Reizbildung beziehungsweise abnormaler Fortpflanzung des Reizes zusammenhängt. Die SND zeigt sich in einer Sinusbradykardie bis hin zu einer Pause oder auch Stillstand des Herzschlages. Außerdem kann eine chronotrope Inkompetenz (kein adäquater Anstieg der Herzfrequenz unter Belastung) beobachtet werden. Das Herz kann die Arrhythmie nicht mit einem Escape-Rhythmus ausgleichen. Wenn es abwechselnd zu einer supraventrikulären Tachykardie und einer Bradykardie kommt, nennt man dies „Bradykardie-Tachykardie-Syndrom“. Eine häufige Ursache der SND ist eine fibrotische Narbenbildung. Da Kardiomyozyten nur eine begrenzte Fähigkeit zur Regeneration haben, entsteht, nach dem Tod (infolge von einem Infarkt oder von Myokardischämie) dieser Zellen, fibröses Gewebe. Fibroblasten setzen sowohl die Leitfähigkeit des Gewebes in dem SA-Knoten, als auch diejenige zum umliegenden Gewebe herab. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3390069/ Eine weitere Ursache des SND kann ein SA-Block sein. Bei dem SA-Block wird zwar ein Reiz im SA-Knoten gebildet, dieser wird jedoch nicht auf die Vorhofmuskulatur weitergeleitet. Ebenfalls Ursache kann eine Veränderung der Natriumkanäle sein. Im Herzen sind spannungsabhängige Na+ - Kanäle, die sich gleichzeitig und für kurze Zeit öffnen für den schnellen Na+ - Einstrom und damit für die Ausbildung eines Aktionspotentials (AP) zuständig sind. Wird dieser Einstrom verhindert, bzw. gibt es zu wenige Kanäle, dauert es länger bis ein AP ausgelöst wird. Ein Grund kann zum Beispiel der Mangel an SCN5A sein. Das SCN5A ist ein Gen, das die Synthese der Na+ - Kanäle steuert. Außerdem wird die Krankheit häufig auf eine Degeneration der Arterie des SA-Knotens, autoimmune Antikörper und auf eine fehlerhafte neuronale Innervation zurückgeführt. Die SND wurde bisher nur bei Menschen und Hunden entdeckt. (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3327600/)
Therapie von Arrhythmien
Für die Therapie von Arrhythmien gibt es viele verschiedene Möglichkeiten. Konventionell beugt man Bradykardie mit der Implantation eines Herzschrittmachers vor, der die Aufgabe der herzeigenen Schrittmacherzellen übernimmt. Eine weitere, häufig angewandte Möglichkeit ist die Katheterablation. Ziel ist es das Gewebe, welches falsche Impulse liefert, zu zerstören. Auch gibt es Medikamente, die die elektrische Aktivität modifizieren, die jedoch signifikante Nebenwirkungen, wie Magen-Darm-Störungen, haben.
Problem bei den genannten Therapien ist, dass sie die Reizerzeugung und Reizleitung nicht verbessern und Defekte nicht reparieren. Die Therapien wirken nur symptomatisch und nicht ursächlich. Die moderne Wissenschaft versucht nun durch Zell- und Gentherapie eine Heilung der Arrhythmien zu erreichen. Eine Möglichkeit der ursächlichen Therapie ist die Implantation von mesenchymalen Stammzellen. Diese haben an Ratten eine verbesserte Leitung des Reizes, infolge einer Erhöhung der Anzahl von Gap Junctions (Connexone) gezeigt und eine Verringerung von Kollagenablagerungen. Doch gibt es bei der Zelltransplantation, aufgrund vieler Sicherheitsrisiken (Anzahl der Zellen, Stelle zur Implantation, Immunantwort, usw.), noch keine klinischen Erfolge vorzuweisen. Mit Gentransfer konnte man häufig die Reduktion von Tachykardien erreichen. So sollen Connexin Gene die Kommunikation über Gap Junctions der Zellen verlangsamen. Weitere Möglichkeiten wären eine Therapie mit Genen des K+-Kanals oder des G-Protein. Allerdings trifft man auch hier noch auf zu viele Hindernisse, sodass es noch eine Zeit der Forschung braucht, bis die Methode angewandt werden kann.
(http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3390069/)
Stromatumoren
Was ist ein Stromatumor?
Stromatumore sind Bindegewebstumore des Gastrointestinaltrakts. Es sind mesenchymale (nicht epitheliale) Tumore myogenen Ursprungs.1 Am häufigsten treten sie im Bereich des Magens auf. Sie verursachen unspezifische Beschwerden, wie Bauchschmerzen oder Verdauungsstörungen. Die Behandlung erfolgt üblicherweise durch die Entfernung des Tumors und zusätzlicher Medikamentengabe von Tyrokinase-Inhibitoren. Die Größe, der Metastasierungsgrad und die mitotaktische Aktivität des Tumors bestimmen die Heilungschancen.
Vorkommen
Stromatumore treten eher selten auf. Studien zufolge kommen sie bei zehn bis 20 Menschen pro einer Millionen Einwohnern vor. Das durchschnittliche Alter, indem der Tumor auftritt liegt bei 60-70 Jahren. Das Geschlecht spielt eine untergeordnete Rolle, wobei der prozentuale Anteil der erkrankten männlichen Patienten etwas höher ist. 1,2
Am häufigsten mit 60% sind die Stromatumoren im Magen lokalisiert. In bis zu 30% der Fälle ist der Dünndarm betroffen, in jeweils 5% der Fälle der Colon oder Mastdarm, im Rectum ist der Tumor seltener zu finden. In der Speiseröhre können auch Tumore vorkommen, allerdings ist der Anteil mit 3% sehr gering.3 Metastasierungen kommen häufig in der Leber und innerhalb der Bauchhöhle vor. Absiedlungen können aber auch in den Knochen, der Haut und den Weichteilgeweben auftreten.4 Bei jungen Patienten werden selten auch Metastasen in den Lymphknoten gefunden.5
Entstehung
Stromatumore stammen von pluripotenten mesenchymalen Stammzellen ab, die die Eigenschaften der interstitiellen Cajal-Zellen zeigen. Bei ihnen ist eine Mutationen des C-Kit-Protoonkogens gefunden worden.6 Das ist eine genetische Mutation, die zur Bildung defekter Wachstumsfaktor-Rezeptoren an der Zelloberfläche führt. Meistens ist der Kit-Rezeptor defekt, seltener tritt eine Mutation des PDGFA (Platelet derived growth factor A) auf. In einem gesunden Organismus werden die Wachstumsfaktor-Rezeptoren der pluripotenten Stammzellen erst nach der Bindung eines spezifischen Moleküls (Ligand) aktiviert. Daraufhin wird ein Signal zum Zellwachstum und zur Proliferation übermittelt. Durch die Mutation kommt es zur dauerhaften Aktivierung der Rezeptoren, auch in Abwesenheit eines Liganden. Das führt dazu, dass es kein Gleichgewicht zwischen Zellwachstum/Proliferation und Zelltod (Apaptose) gibt. Dadurch kommt es zum abnormalen Zellwachstum, also zur Tumorbildung.7 Eine weitere Form der Stromatumore ist die genetisch bedingte familiäre Form. Sie bricht häufig schon im jungen Alter der Patienten aus, da die ursächliche Mutation bereits bei der Geburt und in allen Körperzellen vorhanden ist. Eine Cajal-Zellen-Hyperplasie ist die mögliche Vorläuferläsion zur Entstehung des Stromatumors.8
Symptome
Die Symptome äußern sich unspezifisch und weisen nicht direkt auf einen Stromatumor hin. 35% der Patienten leiden unter Bauchschmerzen und bei 25% kommt es zu gastrointestinalen Blutungen. Eine Verschlechterung des Allgemeinzustandes kann bei 24% der Patienten festgestellt werden, Verdauungsstörungen bei 16%. Zu Eisenmangelanämie kommt es bei 15% der Patienten und 12% leiden unter Übelkeit und Erbrechen. Verstopfungen und Durchfall können bei 12% der Patienten festgestellt werden. Dass der Stromatumor tastbar in der Bauchhöhle liegt ist nur bei 8% der Patienten der Fall.9
Diagnostik
Es gibt zurzeit keine wegweisenden laborchemischen Untersuchungen die klar auf einen Stromatumor hinweisen. Ebenfalls sind keine Blutfaktoren bekannt, durch die ein Stromatumor eindeutig nachweisbar oder auszuschließen ist. Nur durch endoskopische Untersuchungen und gegebenenfalls eine Biopsie kann eine sichere Diagnose gestellt werden. Eine sichere Aussage zur Tumorbildung und Ausbreitung liefern bildgebende Verfahren wie die Sonografie, die Röntgenaufnahme nach der Gabe eines Kontrastmittels, die Computertomografie wie auch die Magnetresonanztomografie. Zum Nachweis von Metastasen kann ein PET-Scan durchgeführt werden. Die eigentliche Diagnose wird aber im Labor in histologischen Untersuchungen des Operationspräparates oder einer Biopsie gestellt.2
Therapie
Die vollständige chirurgische Entfernung des Tumors ist die Grundlage der Mehrzahl der Behandlungen. Kleinere Geschwülste können minimal invasiv durch einen laporoskopischen Eingriff entfernt werden. Der Thyrokinase-Inhibitor Imatinib kann in Tablettenform verabreicht werden. Diese Behandlungsform wirkt jedoch systematisch, das heißt auf den ganzen Körper, und kommt nur bei bereits metastasierenden Tumoren zum Einsatz. 2 Bei Tumoren die auf den Thyrokinase-Inhibitor nicht ansprechen kann man eine Behandlung mit dem Multikinaseinhibitor Sunitinib versuchen. Ein Problem bei Behandlungen mit den Kinase-Inhibitoren kann eine Resistenz der Tumorzellen gegen die Wirkung des Medikaments sein. Die Ursache dafür ist die sekundäre Mutation des KIT-Gens10,11 oder eine rhabdomyosarkomatöse Entartung des Tumors.12 Konventionelle zytotoxische Chemotherapien haben keine positiven Ergebnisse, wie die Verkleinerung des Tumors erbracht. Strahlentherapie wird nur palliativ angewendet, da die meisten Stromatumore resistent gegen sie sind.2
Prognose
Die beste Prognose kann bei Patienten gegeben werden, bei denen sich der Stromatumor im Magen befindet. Auch bei Tumoren die kleiner als 2 cm sind und langsam wachsen kann eine positive Prognose gestellt werden. Die Heilungschancen der Patienten mit Stromatumoren sind am größten, wenn der Tumor restlos entfernt werden kann. Bei nicht metastasierenden Tumoren kann man eine 5 Jahre-Überlebensrate bei 30-60% der Patienten geben, wobei diese abhängig davon ist, ob der Tumor lokalisiert ist oder rezidivierend ist. Bei nicht oder nur teilweise entfernten Tumoren ist eine schlechte Prognose zu stellen.2 Durch eine Tumorruptur und die mögliche Tumoraussaat in die Bauchhöhle verschlechtert sich die Prognose noch weiter. Tritt der Fall ein, dass der Stromatumor an der peritonealen Bedeckung des befallenden Hohlorgans heranwächst besteht die Gefahr, dass der Tumor diese durchbricht. Schlechte Prognosen müssen auch gestellt werden, wenn der Tumor eine hohe Zelldichte vorweist.15,16
Literaturverzeichnis
(1) Sander K.M.; Koh S.D.; Ward S.M. (2006): Interstitial cells of cajal as pacemakers in the gastrointestinal tract. Annual review of physiology 68: 307-343
http://www.ncbi.nlm.nih.gov/pubmed/16460275
(2) Quinn T.A.; Kohl P. (2012): Mechano-sensitivity of cardiac pacemaker function: Pathophysiological relevance, experimental implications, and conceptual integration with other mechanisms of rhythmicity. Progress in Biophysics and molecular biology 110 (2-3): 257-268
http://www.ncbi.nlm.nih.gov/pubmed/23046620
(3) Gerhard Thews, Peter Vaupel (1997): Vegetative Physiologie, 3. Auflage, Springer Verlag: 94-96
(4) Varró A.; Papp J.G. (1992): The impact of single cell voltage clamp on the understanding of the cardiac ventricular action potential. Cardioscience 3 (3): 131-144
http://www.ncbi.nlm.nih.gov/pubmed/1384746
(5) Kusch J, Biskup C, Thon S, Schulz E, Nache V, Zimmer T, Schwede F, Benndorf K. (2010): Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels. Neuron 67 (1): 75-85
http://www.ncbi.nlm.nih.gov/pubmed/20624593
(6) Gerhard Thews, Peter Vaupel (1997): Vegetative Physiologie, 3. Auflage, Springer Verlag: 101-103
(7) Sanders K. M.; Ward S. M. (2006): Interstitial cells of Cajal: a new perspective on smooth muscle function. The Journal of Physiology 576(Pt 3): 721–726
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1890422/
(8) Klinke R., Pape H.-P., Kurtz A., Silbernagl S. (2009): Physiologie, 6. Auflage, Georg Thieme Verlag: 420-421
http://www.aafp.org/afp/2003/0415/p1725.html http://www.ncbi.nlm.nih.gov/pubmed/12180244
1 http://www.onkologie-duesseldorf.de/subpages/gist_gastrointestinaler_stromatumor.htm
2 http://emedicine.medscape.com/article/179669-overview
3 Miettinen M, El-Rifai W, H L Sobin L, Lasota J: Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathologie 2002;33(5):478-83
4 Miettinen, Lasota: Gastrointestinal stromal tumors; review on morphology, molecular pathology, prognosis, and differential diagnosis. Archivs of Pathology and Laboratory Medicine 2006, 130:1466-1478
5 Agaimy, Wünsch: Lymph node metastasis in gastrointestinal stromal tumours (GIST) occurs preferentially in young patients </=40 years: an overview based on our case material and the literature. Langenbecks Archives of Surgery 2009;394(2):375-81
6 Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M, Muhammad Tunio G, Matsuzawa Y, Kanakura Y, Shinomura Y, Kitamura Y: Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279(5350):577-80
7 Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM: Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. American Journal of Pathology 1998;152(5):1259-69
8 Antonescu: Gastrointestinal stromal tumor (GIST) pathogenesis, familial GIST, and animal models. Seminars in Diagnostic Pathology 2006;23(2):63-9
9 Mucciarini C, Rossi G, Bertolini F, Valli R, Cirilli C, Rashid I, Marcheselli L, Luppi G, Federico M: Incidence and clinicopathologic features of gastrointestinal stromal tumors. A population-based study. BMC Cancer. 2007;7:230
10 Zheng S, Pan YL, Tao DY, Wang JL, Huang KE: Secondary C-kit mutation is a cause of acquired resistance to imatinib in gastrointestinal stromal tumor. Scandinavian Journal of Gastroenterology 2008;18:1-4
11 Cassier PA, Dufresne A, Arifi S, El Sayadi H, Ray-Coquard I, Bringuier PP, Scoazec JY, Alberti L, Blay JY: Novel approaches to gastrointestinal stromal tumors resistant to imatinib and sunitinib. Current Gastroenterology Reports 2008;10(6):555-61
12 Liegl, Bernadette MD; Hornick, Jason L. MD, PhD; Antonescu, Cristina R. MD; Corless, Christopher L. MD; Fletcher, Christopher D. M. MD, FRCPath: "Rhabdomyosarcomatous Differentiation in Gastrointestinal Stromal Tumors After Tyrosine Kinase Inhibitor Therapy: A Novel Form of Tumor Progression. American Journal of Surgery and Pathology 2009;33(2):218-226
13 Rubin BP, Heinrich MC, Corless CL: Gastrointestinal stromal tumour. Lancet. 2007;369(9574):1731-41
14 Vallböhmer D, Marcus HE, Baldus SE, Brabender J, Drebber U, Metzger R, Hölscher AH, Schneider PM: Serosal penetration is an important prognostic factor for gastrointestinal stromal tumors. Oncology Reports 2008;20(4):779-83
15 Rutkowski P, Nowecki ZI, Michej W, Debiec-Rychter M, Woźniak A, Limon J, Siedlecki J, Grzesiakowska U, Kakol M, Osuch C, Polkowski M, Głuszek S, Zurawski Z, Ruka W: Risk criteria and prognostic factors for predicting recurrences after resection of primary gastrointestinal stromal tumor. Annals of Surgical Oncololgy 2007;14(7):2018-27
16 Fletcher: Diagnostic Histopathology of Tumors 3rd edition, 2007, Churchill Livingstone Elsevier, S. 356-9
17 Heinrich MC, Corless CL, Demetri GD, Blanke CD, von Mehren M, Joensuu H, McGreevey LS, Chen CJ, Van den Abbeele AD, Druker BJ, Kiese B, Eisenberg B, Roberts PJ, Singer S, Fletcher CD, Silberman S, Dimitrijevic S, Fletcher JA.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. Journal of Clinical Oncology 2003;21:4342-4349
