|
Size: 10171
Comment:
|
Size: 10183
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 63: | Line 63: |
| KO egereken végzett kísérlet során, halotánnal és kloroformmal szemben az egerek csökkent érzékenységet mutattak, holott in vitro körülmények között ezek a TREK-1 csatorna leghatékonyabb aktivátorai. Hasonló eredmény született sevofluránnal és desfluránnal való kezelés után, melyek a legszélesebb körben használt klinikai altatószerek, csakúgy, mint az izoflurán. Ezek az eredmények alátámasztották azt az elképzelést, miszerint a TREK-1 és TREK-2 csatornák egyértelműen részt vesznek az illékony anesztetikumok hatásmechanizmusában. (Heurteaux és mtsai, 2004) | KO (knock out) egereken végzett kísérlet során, halotánnal és kloroformmal szemben az egerek csökkent érzékenységet mutattak, holott in vitro körülmények között ezek a TREK-1 csatorna leghatékonyabb aktivátorai. Hasonló eredmény született sevofluránnal és desfluránnal való kezelés után, melyek a legszélesebb körben használt klinikai altatószerek, csakúgy, mint az izoflurán. Ezek az eredmények alátámasztották azt az elképzelést, miszerint a TREK-1 és TREK-2 csatornák egyértelműen részt vesznek az illékony anesztetikumok hatásmechanizmusában. (Heurteaux és mtsai, 2004) |
A TREK alcsaládba tartozó kálium csatornák szerepe
Contents
A TREK alcsalád besorolása
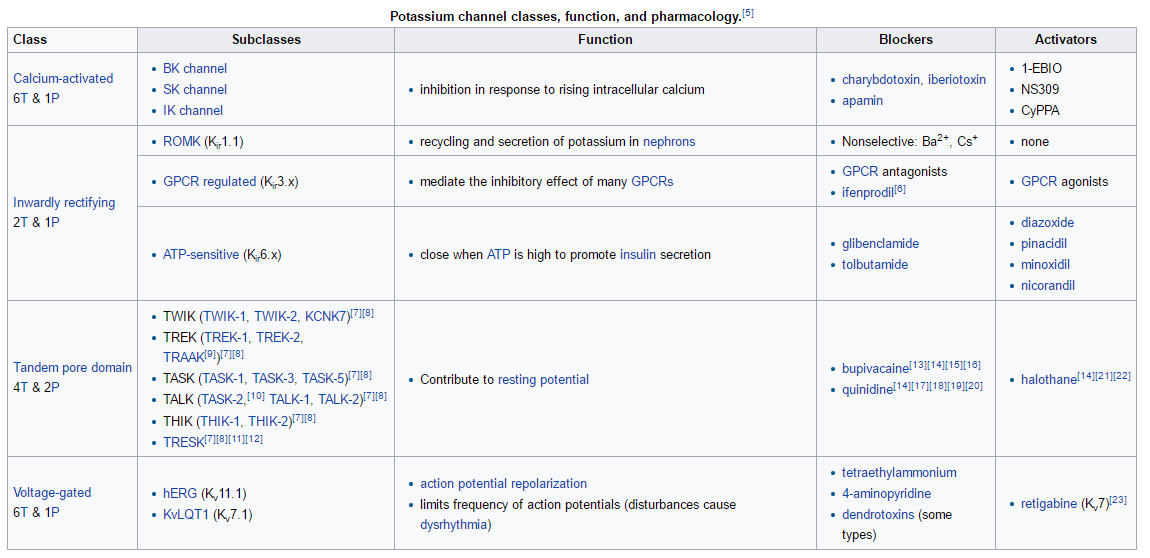
1. Ábra
A kálium csatornák rendszere
Szerkezet, lokalizáció
A káliumion csatornák minden sejttípus, sőt, egyes sejtorganellumok membránjában is megtalálhatók, nem csak az állat- de a növényvilágban egyaránt. Rengeteg élettani folyamatban kulcsfontosságú szerepet játszanak, az ingerületvezetéstől a tápanyagok felszívódásán át egészen a sejtek, illetve az egész szervezet ionháztartásának fenntartásáig. Funkcionális működésük szempontjából meghatározó szerkezeti felépítő elemük a szelektivitási filter. Ezen egység határozza meg a csatornán áthaladni képes részecskék anyagi minőségét. A szűrő kialakításában alapvető szerepet játszik a pórusdomén (a filter azon egysége, ami a csatorna pórusát, illetve legszűkebb kapuját alkotja).
Minden K+-csatorna szelektivitási filterét négy pórusdomén alkotja. A TREK alosztályba tartozó K+-csatornák a K2P (két pórusdoménnal rendelkező) csatornák családjába tartoznak. Mivel ezen család tagjainak alegységei két-két pórusdomént tartalmaznak, csatornáik két alegységből állnak (melyek alkothatnak homo- ill. heterodimert is), szemben a többi csatorna család négy alegységből, (alegységenként csak egy pórusdomént tartalmazó) felépülő csatornáival. Összesen tizenöt különböző alegységet ismerünk, ezeket funkcionalitás és szekvencia alapján a következő hat alosztályba soroljuk: TALK, TASK, THIK, TREK, TRESK, TWIK. A két pórusdoménnal rendelkező K+-csatornák alegységei darabonként 4 transzmembrán szegmensből épülnek föl. Amíg az alegységek N-terminálisa rövid, intracellulárisan helyeződik, és nincs jelentős szabályozásbeli szerepe, addig a szintén intracellulárisan helyeződő C-terminális régión hat szinte minden (kivétel: kívülről befolyásoló hatások, mint a pH) szabályozó tényező. A két alegység extracellulárisan helyeződő hurokrégiója a "cap" (sapka) domént alkotja, melynek belsejében, a csatorna tengelyére merőlegesen fut az ún. extracelluláris ionút (EIP). Ennek közepéből nyílik a csatorna pórusa. Ezen összetett szerkezet határozza meg, milyen méretű és töltésű részecske fér hozzá a pórushoz. Továbbá ezen szerkezet okozza azt is, hogy a K2P családba tartozó csatornák számos K+-csatorna gátlószerrel szemben érzéketlenek. A Human Genom Organization (HUGO) által elfogadott szisztematikus nevezéktan: KCNK1-18 a csatorna alegységet kódoló génekre, ill. K2P1-18 az általuk kódolt csatornafehérjékre. (nincsen 8-as, 11-es, 14-es sorszámú csatorna) Az ioncsatornák megnevezésében inkább a hagyományos nevek használatosak.
A TREK [TWIN-Related K+ channel] /TRAAK [TWIN-Related Aracidonic Acid stimulated K+ channel] alcsalád lokalizációja
Tagjai a TREK-1 (K2P2.1; kódoló gén: KCNK2), TREK-2 (K2P10.1; kódoló gén: KCNK10) és a TRAAK(K2P4.1; kódoló gén: KCNK4) csatornafehérjék. A TREK-1 és TREK-2 aminosav-szekvenciája jelentős mértékben megegyezik, ennek ellenére az expressziójukban nagy eltéréseket figyelhetünk meg, szövetspecifitásuk mértéke nem elhanyagolható. A TREK/TRAAK csatornák kifejeződését mind emberekben, mind rágcsálókban kutatták. A TREK-1/-2csatornák expressziója az egész embrionális egéragyban jelentős volt. Felnőtt egyedekben a TREK-1 kifejeződés inkább a hippocampus, a cortex, az amygdala és a hippothalamus, a TREK-2 esetén pedig a bulbus olfactorius, hippocampus, a kisagy szemcsesejtjei és a striatum területeire korlátozódott. A TRAAK csatornák egér esetében embrionális korban gyakorlatilag nem expresszálódtak, az ellést követő második hétre viszont elérte a maximumot a kifejeződés. A TREK-1-csatornák az idegrendszeren kívül sok más helyen megjelennek: szívizomzat, artériák simaizma, mellékvese, vese, erek endothel sejtjei, hámsejtek, tüdő. A TREK-2 csatornák nagymértékben a pancreasban, herében, lépben, kisebb mértékben a tüdőben, májban , méhlepényben, belekben expresszálódnak. (Braun, 2015)
Szabályozás, mechano- és termoszenzitivitás
A TREK alcsaládba tartozó K+ csatornák alapjártban nem mutatnak nagy aktivitást. Természetes körülmények között stimulálja őket membrán feszülés, a sejtek duzzadása (mechanoszenzitivitás), továbbá a többszörösen telítetlen zsírsavak (polyunsaturated fatty acids-PUFA), lysophospholipidek, phosphatidinositol 4,5-biphosphate. Ezzel szemben gátolja őket a hypoozmózis csakúgy, mint a PKA (proteinkináz-A) és PKC (proteinkináz-C) általi foszforiláció, valamint részlegesen gátolható Ba2+-mal is.
A TREK és TRAAK csatornák fokozatosan aktiválódnak a hőmérséklet növelésével. 14°C –ról 42°C-ra melegítve 7-20-szorosára emelkedik az aktivitásuk. Ez szignifikánsan magasabb, mint a többi K2p csatorna esetében. A maximális aktivitást 30°C-42°C között érik el.
A TREK és TRAAK csatornák érzékenyek az extracelluláris pH változásaira. A extracelluláris savasodás erősen gátolja a TREK-1 K+ csatornát, szemben a TREK-2 csatornával, ami ugyan abban a pH-tartományban aktiválódik.
A klasszikus K+ csatorna-gátló szerekre a TREK és TRAAK csatornák nem érzékenyek, így nem gátolhatók például 4-aminopiridinnel, tetraetil-ammónniummal (kis koncentráció), és Cs+-mal. A TREK-1 csatornát helyi érzéstelenítő szerekkel is lehet gátolni, például lidokainnal és bupivakainnal. (Noël és mtsai, 2011)
Működése és jelentősége
A két pórusú káliumcsatornák - köztük a TREK alcsalád csatornái is - rendkívül sok élettani jelenséget, funkciót befolyásolnak illetve azokra valamilyen szinten hatással vannak. (2. ábra) A zöld és piros nyilak az ábrán arra hivatottak, hogy jelezzék, melyik csatornának kell zárt illetve nyitott állapotban lennie ahhoz, hogy az adott pszichopatológiai jelenség pozitív legyen.
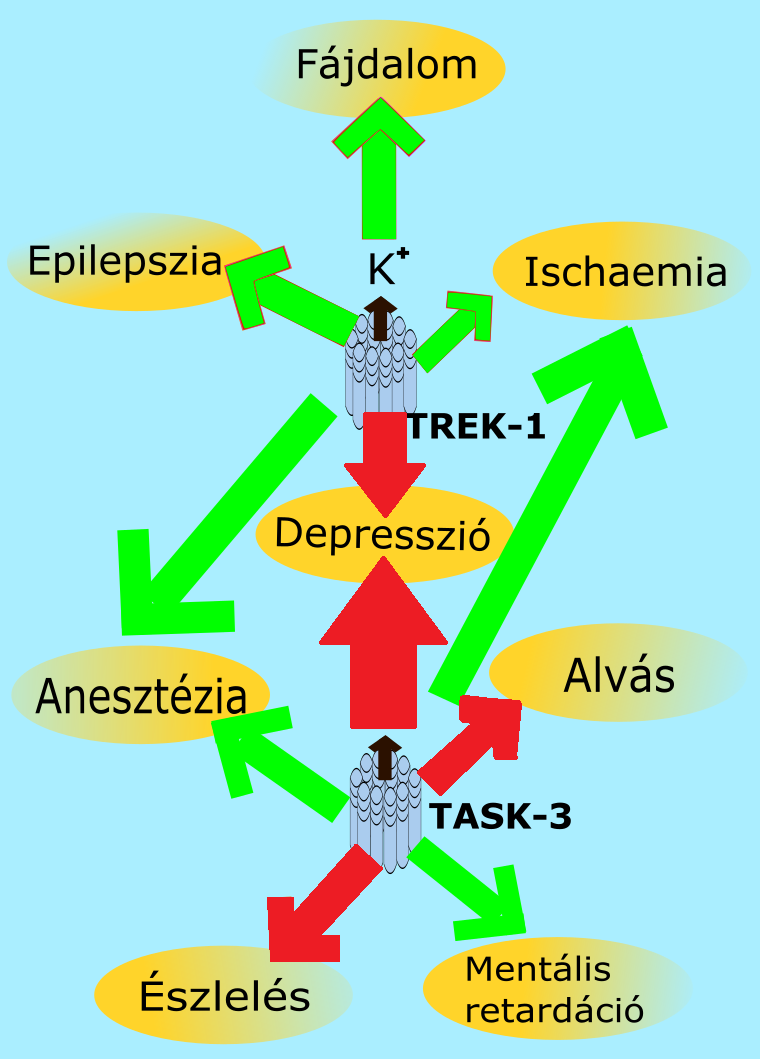
2. Ábra
A K2p csatornák hatásai
Idegrendszerben
Antidepresszáns TREK-inhibítorok
Az utóbbi időben a kutatók KO (knock out) egereket használnak annak bizonyítására, hogy a K2P (két pórusú kálium csatornák) család döntő szerepet játszik a depresszió kialakulásában. Úgy tartják, a TREK-1 és TASK-3 antagonistái egy újfajta antidepresszáns gyógymódhoz vezethetnek.
A közelmúltban fedezték fel a TREK-1 kálium csatorna első azonosított blokkolóját a spadint.
A spadin egy természetes peptid, mely az NTSR-3 (neuortensin receptor-3) érése során szabadul fel, és speciálisan gátolja a TREK-1 csatornákat, így antidepresszáns tulajdonságokat mutat. Gyorsan hat és nincs mellékhatása. Nem okoz keringési rendellenességeket: nem módosítja a szisztolés nyomást és nem növeli a szívfrekvenciát.
A sortilin, más néven-NTSR-3 receptor-egy nemrég felfedezett partnere a TREK-1 csatornának, és úgy tűnik, szabályozza a csatorna plazmamembrán szintjét. Sejt szinten a sortilin köti a neurotensint, ami a „nerve growth factor (NGF)” prekurzora (Az NGF serkenti az idegsejtek proliferációját, részt vesz azok megvédésében), és a lipoprotein lipázt. Élettani szinten részt vesz egy sor kardiovaszkuláris neurológiai folymat szabályozásában. A sortilin funkciója, vagy diszfunkciója felelős lehet a hypercholesterinaemiáért és a szívinfarktusért, csakúgy, mint a neurodegeneratív rendellenességekért. Továbbá részt vehet a diabétesz, az elhízás és a rák kialakulásában. (Borsotto és mtsai, 2015)
Szerepük az anesztéziában
A TREK-1 és TREK2 csatornák az illékony anesztetikumok - isoflurán, kloroform, halotán - klinikai koncentrációjának hatására kinyílnak, nagyfokú aktivitást mutatva. (Hasonló hatást fejt ki a riluzol, ami egy neuroprotektív gyógyszer, amit amiotrófiás laterálszklerózis (ALS, vagy Lou Gehrig-betegség) esetén szoktak alkalmazni.)
KO (knock out) egereken végzett kísérlet során, halotánnal és kloroformmal szemben az egerek csökkent érzékenységet mutattak, holott in vitro körülmények között ezek a TREK-1 csatorna leghatékonyabb aktivátorai. Hasonló eredmény született sevofluránnal és desfluránnal való kezelés után, melyek a legszélesebb körben használt klinikai altatószerek, csakúgy, mint az izoflurán. Ezek az eredmények alátámasztották azt az elképzelést, miszerint a TREK-1 és TREK-2 csatornák egyértelműen részt vesznek az illékony anesztetikumok hatásmechanizmusában. (Heurteaux és mtsai, 2004)
Egyéb szervekben
Irodalomjegyzék
Borsotto, M.; Veyssiere, J.; Moha ou Maati, H.; Devader, C.; Mazella, J.; Heurteaux, C. (2015):Targeting two-pore domain K+ channels TREK-1 and TASK-3 for the treatment of depression: a new therapeutic concept.Br J Pharmacol 2015 Feb; 172: (3) 771–784.
Noël, J.; Sandoz, G.; Lesage, F. (2011):Molecular regulations governing TREK and TRAAK channel functions. Channels (Austin). 2011 Sep-Oct; 5: (5) 402–409.
Heurteaux, C.; Guy, N.;Laigle, C.; Blondeau, N.; Duprat, F.; Mazzuca, M.; Lang-Lazdunski, L.; Widmann, C.; Zanzouri, M.; Romey, G.; Lazdunski, M. (2004):TREK-1, a K+ channel involved in neuroprotection and general anesthesia. EMBO J. 2004 Jul 7; 23: (13) 2684–2695.
Dr. Braun Gariella (2015): A hátsó gyöki ganglionban kifejeződő TREK-2 és TRESK két pórusdoménű K+ csatornák vizsgálata.Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola, Doktori értekezés
Ábra jegyzék
1.ábra: https://en.wikipedia.org/wiki/Potassium_channel
