Viren gegen Krebs
Contents
Onkolytische Viren in der Krebsbehandlung
Die Medizin entwickelt sich ständig weiter, eine wichtige Aufgabe ist es, neue Therapien zur Krebsheilung zu finden. Man sucht ständig nach neuen Methoden und Medikamenten, die malignes Gewebe zerstören können und mit bestehenden Therapien vereinbar sind.
Die Suche nach alternativen Behandlungsmethoden zeigt, dass Viren ein großes Potential im Kampf gegen Krebs besitzen. 1
Obwohl Viren im Normalfall eher als unerwünscht angesehen werden und von Ärzten mit allen Mitteln bekämpft werden, haben sie auch ihre positiven Seiten. Viren können gewissermaßen „umgepolt“ werden, um als Behandlungsmittel gegen Krebs, gezielt dessen Zellen anzugreifen. 2
„Die Anfälligkeit gegen Virusinfekte ist die Achillesferse der Krebszelle." 3
Geschichte der onkolytischen Viren
Erste Beobachtungen gab es 1904 bei einer Patientin mit chronisch myeloischer Leukämie (CML). Nachdem sie an einen mit Grippe vergleichbaren Krankheitsverlauf genesen war, dokumentierte man eine deutliche Reduktion der Tumormasse und eine Leukozytenzahlsenkung. Bei einem Gebärmutterkrebs zeigten mehrmalige Injektionen von Tollwutimpfungen auch eine Tumorregression.
Ein mit akuter lymphatischer Leukämie (ALL) erkrankte Junge, bei dem Symptome einer Windpockeninfektion auftraten, nahm das Leber- und Milzvolumen beinahe auf Normalgröße ab und es kam zu einer physiologischen Leukozytenzahl. Nachdem die Windpocken ausgeklungen waren, kam es wieder zu einer Tumorvergrößerung, woran der Junge verstarb.
Ab den 50er Jahren wurden verschiedene Tumore mit speziellen Viren, wie zum Beispiel dem Adenovirus und dem West Nil Virus, therapeutisch infiziert, um die Tumorzellen anzugreifen und so den Tumor zu reduzieren.
Zu wenige Erfolge führten dann auf die Idee genetisch veränderte Viren zu verwenden. Es wurden Genabschnitte, welche die gesunden Zellen angreifen würden, entfernt. Das sogenannte „selected virus“ hat mit dieser Methode eine höhere Selektivität, jedoch eine geringere zytotoxische Wirksamkeit. Für eine stärkere zytotoxische Wirkung wurden später virenunbekannte Sequenzen in das Virusgenom hinein kloniert, das „selected armed virus“. In der aktuellen onkolytischen Therapie werden die Viren spezifisch genetisch modifiziert, um den Tumor gezielt zu zerstören, jedoch die gesunden Zellen im Körper nicht anzugreifen.4
Biologische Prinzipien der Virotherapie
Verschiedenste Viren, werden heutzutage bereits für laufende und zukünftige klinische Studien getestet und verwendet. Vor allem der Adenovirus und der Herpes simplex-Virus 1 sind für die Virotherapie in Entwicklung und Einsatz am meisten fortgeschritten. 7 Familien der onkolytischen DNA- sowie RNA-Viren die derzeit Anwendung in klinischen Studien finden:
- Adenovirus
- HSV1 (Herpes simplex-Virus 1)
- Vaccina Virus und Myxoma Virus
- Reovirus
- Poliovirus
- VSV (Vesicular stomatitis Virus)
- MV und NDV (Masernvirus und Newcastle-Disease-Virus)
Die onkolytischen Viren müssen eine hohe Tumorspezifität haben und genetisch stabil sein. Sie sollten humane Krebszellen infizieren, sich in diesen vermehren und die letztendlich auch zerstören.Der lytischer Zyklus der Viren kommt den Wissenschaftlern in der Krebstherapie zu Gute. Die Tumorzellen werden also auf diesem Wege als Wirtszellen der Viren verwendet um sich dort weiter zu vermehren. (Siehe Abb. 1)
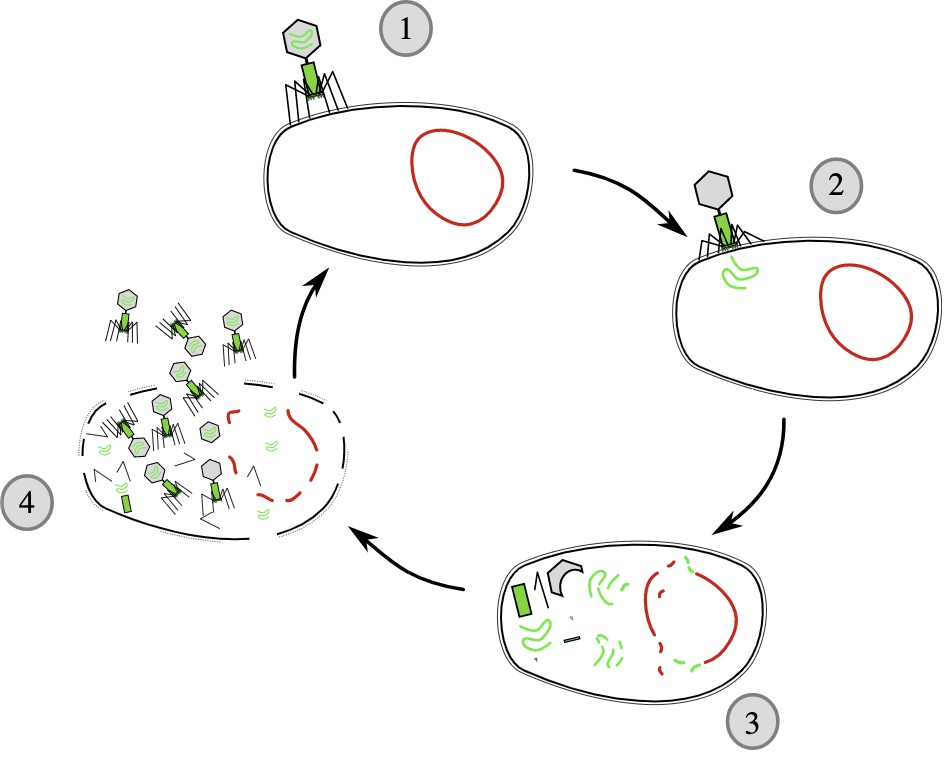
Abbildung 1: Der lytische Zyklus
Es gibt zwei Generationen der onkolytischen Viren, die Tumorspezifität betreffend. Onkolytische Viren der ersten Generation, kennzeichnen sich durch eine natürliche Tumorselektivität. Viren zweiter Generation erlangen diese durch gezielte Deletion von Genen und Genregionen, die in Tumorzellen überflüssig sind, weil sie ausschließlich für eine erfolgreiche Replikation in normalen Zellen zuständig sind. Zusätzlich werden tumorspezifische Promotern für replikationsspezifische Gene verwendet um eine weitere Selektivität zu erhalten. Vor allem bei Adenoviren wird die virale Hülle so modifiziert, dass sie eine selektive Aufnahme in die Tumorzellen begünstigt. Ziel ist es, dass eine gezielte Infektion der Tumorzellen nur eine milde virale Erkrankung bei den Patienten auslösen. 5
Klinische Erprobungen haben gezeigt, dass es Viren mit natürlichen onkolytischen Selektivität gibt. Dazu zählen das Newcastle Disease Virus (NDV), das vesikuläre Stomatitis-Virus (VSV), das Masernvirus (MV), humane Reoviren und das autonome Parvovirus H1. Zu gentechnologisch modifizierten Viren mit onkolytischer Selektivität gehören die rekombinanten Adeno-, Herpes-simplex-, Vaccinia- und Polioviren. 6
Genetische Modifikation
Viren kann man durch Modifikationen ihre immunsuppresive Komponente entnehmen. Hierbei werden Gene abgeschaltet, welche die Proteine, die sonst das Alarmsystem der infizierten Zelle unterdrücken würden, kodieren. Diese veränderten Viren entwickeln eine starke Immunantwort, wodurch sie einen erfolglosen Replikationszyklus ausführen. Tumorzellen besitzen diese Abwehrmechanismen nicht mehr und somit können modifizierte Viren in malignen Zellen gut wachsen. 7 Die Tumorselektivität, die Effizienz und die Sicherheit der Viren wird genetisch modifiziert. Bei der Effizienzerhöhung handelt sich um die Oberflächenproteine der Viren, welche so verändert werden, dass sie danach nur Tumor-spezische Rezeptoren erkennen.
Spezifisch zur Krebsbehandlung verwendete Viren
Vaccinia Virus
Das Vaccinia-Virus gehört zu den Pockenviren (Familie Poxviridae) und bildet die Grundlage aller Pockenimpfungen. Diese Impfung wurde vom englischen Landarzt Edward Jenner 1776 entdeckt. Diesem gelang es den Infektionsverlauf zu mindern und zwar durch eine Infektion mit Kuhpocken. Außerdem besteht dadurch nach Ausheilung der Infektion eine lebenslange Immunität. Die heutzutage genutzten Vaccinia-Virus Isolate weisen eine nahe Verwandtschaft zu Varioila-Virus, Kuhpocken-Virus, Pferdepocken-Virus und andere Mitglieder der Proxviridae auf. Poxviren zählen zu den größten bekannten Viren und besitzen eine doppelsträngige DNA, außerdem kodiert ihr Genom für ca. 200 Gene. 8
Das Vaccinia-Virus gehört zu den Pockenviren (Familie Poxviridae) und bildet die Grundlage aller Pockenimpfungen. Diese Impfung wurde vom englischen Landarzt Edward Jenner 1776 entdeckt. Diesem gelang es den Infektionsverlauf zu mindern und zwar durch eine Infektion mit Kuhpocken. Außerdem besteht dadurch nach Ausheilung der Infektion eine lebenslange Immunität. Die heutzutage genutzten Vaccinia-Virus Isolate weisen eine nahe Verwandtschaft zu Varioila-Virus, Kuhpocken-Virus, Pferdepocken-Virus und andere Mitglieder der Proxviridae auf. Poxviren zählen zu den größten bekannten Viren und besitzen eine doppelsträngige DNA, außerdem kodiert ihr Genom für ca. 200 Gene. 8
Vaccinia-Virus als onkolytische Therapie
Die Applikation von Vaccinia-Viren geht jedoch mittlerweile über die alleinige Verwendung als Impfstoff hinaus, denn durch seine Fähigkeit sich leicht genetisch zu modifizieren, ist dieser Virus ein besonders vielversprechender Kandidat in der onkolytische Virotheraphie und als Gentransfer von Tumorantigenen in Krebstherapie. Pockenviren besitzen gegenüber anderen Viren mehrere Vorteile, wenn es um die onkologytische Therapie geht. Das DNA-Genom ist zwar groß aber relativ einfach zu konstruieren, außerdem besitzt es eine hohe Aufnahmekapazität für fremde Gensequenzen, ohne die Stabilität, Infektiosität oder Replikationsfähigkeit des Virus zu beeinflussen. Weiteres haben Pockenviren einen kurzen und effektiven Replikationszyklus, welcher nach 24 Stunden abgeschlossen ist und dadurch eine schnelle Ausbreitung von Zelle zu Zelle im Tumorgewebe ermöglicht. 9
Es ist bekannt, dass speziell die Vaccinia-Viren eine hohe immunogene Aktivität haben und daher möglicherweise eine starke Antitumor Immunität gegen Tumor Epitope erzeugen können, die aus rekombinierten viralen Genomen experimentiert werden. Erstmal wurde in einem Modell eines Liposarkoms gezeigt, dass die Viren sich in Tumorgeweben besonders schnell replizieren können, was auf sein undichtes Gefäßsystem zurück zu führen ist, wodurch es höchstwahrscheinlich dem relativ großen Virus gelingt in den Tumor einzudringen. Nach mehrfacher Verabreichung in verschiedenen Tumormodellen, hat man herausgefunden, dass sich der Großteil der Vaccinia-Viren in den Tumorgeweben befindet. Es kann jedoch auch festgestellt werden, dass sich das Virus in Geweben mit ähnlichen Gefäßen, wie zum Beispiel in den Eierstöcken, genauso schnell replizieren kann wie in den Tumorgeweben. Aufgrund dessen werden genetisch veränderte Vaccinia-Virusstämme auf die Fähigkeit getestet, sich spezifisch in Tumorzellen zu replizieren. Die Vaccinia- Viren werden schon seit längerem als Modell der Krebstherapie verwendet, an denen sowohl tumorspezifische Antigene als auch immunstimulierende Wirtsmoleküle experimentiert werden.
Vaccinia-Viren wurden schon in klinischen Studien erfolgreich eingesetzt, zum einem gegen ein Leberzellkarzinom mit der Pharmazeutischen Bezeichnung JX-594 (Pexa-vec) und zum anderen gegen Bauchfellkrebs mit der Bezeichnung GL-ONC1. 9
Herpes-simplex-1-Viren
Dr. Gregory Friedman von der Universität Alabama, Birmingham USA, möchte mithilfe von onkolytischen Herpes-simplex-1-Viren gezielt gliale Tumorstammzellen bei malignen Formen von Hirntumoren ausschalten. Da der lytische Zyklus des onkolytischen Herpes-simplex-1-Virus unabhängig von der Wirtszelle ist, kann das Virus die (,durch andere Krebstherapien auftretenden) Schutzmechanismen der glialen Tumorstammzelle umgehen. 10
Es wurden durch Studien mit Mäusen eine Sicherheit der HSV-Vektoren ersichtlich. Das sichere Wirken dieser Vektoren wurde gegen Tumore, wie z.B. Hepatome, Gliome, Prostata-Karzinome und Melanome nachgewiesen. Herpesviren sind in der Lage eine, das ganze Leben, verschleierte Infektion hervorzurufen.Die in der Virotherpie verwendeten Herpes Simplex-Viren gehören zu den Alphaherpesviren, welche eine hohe Wirtsvielfalt zeigen. 11
Masernviren
Virulenzverminderte Masernviren mit dem Oberflächenprotein CD46, welches sie als Andockstelle für die Infektion nutzen, wird an der Oberfläche von Tumorzellen höher exprimiert als bei gesunden Zellen. Wissenschaftler versuchen auch die Tumorstammzellen spezifisch auszuschalten. Es wurden auch Masernviren geschaffen, welche den benötigten Oberflächenmarker CD133 besitzen, um die Tumorstammzellen zuerkennen. 10
Masernviren können multinukleäre Synzytien bilden, was zusätzlich als Tötungsmechanismus wirkt und die Viren dadurch sehr gut in der Virotherapie angewandt werden können. 12
Wirkungsmechanismen von onkolytischen Viren
„Der Gedanke, entartete Zellen mit Viren zu bekämpfen, leuchtet sofort ein: Es ist nichts anderes als biologische Kriegsführung, nachdem die chemische und die atomare (Radiatio) nicht sehr erfolgreich verliefen.“3
Nach jahrelanger Erfahrung mit Strahlentherapie und Chemotherapie im Kampf gegen den Krebs, gibt es unglücklicherweise nach wie vor keine zweifelsfrei gesicherten Wirksamkeitsnachweise im Bezug auf die Überlebenszeit bei Krebsarten, die sich im metastasierten Stadium befinden. An diesem Punkt kommt die Virotherapie zum Einsatz, denn ihr Grundgedanke ist es, Zellen, deren Krankheit genau darin besteht, nicht sterben zu können, durch Viren zu töten. 3
Weltweit gibt es derzeit 35 klinische Studien im Bereich der Tumortherapie, in denen Virotherapie als „Waffe“ gegen Krebs zum Einsatz kommen. Unter Virotherapie versteht man eine neue Therapieoption mit onkolytischen Viren. Bemerkenswert ist, dass sich diese Viren nur in Tumorzellen vermehren, um diese schlussendlich zu zerstören. Außerdem wird das bis dahin inaktive Immunsystem durch das Virus „wachgerüttelt“ und eine Immunreaktion gegen das maligne Gewebe ausgelöst. 13 (Siehe Abb. 2)
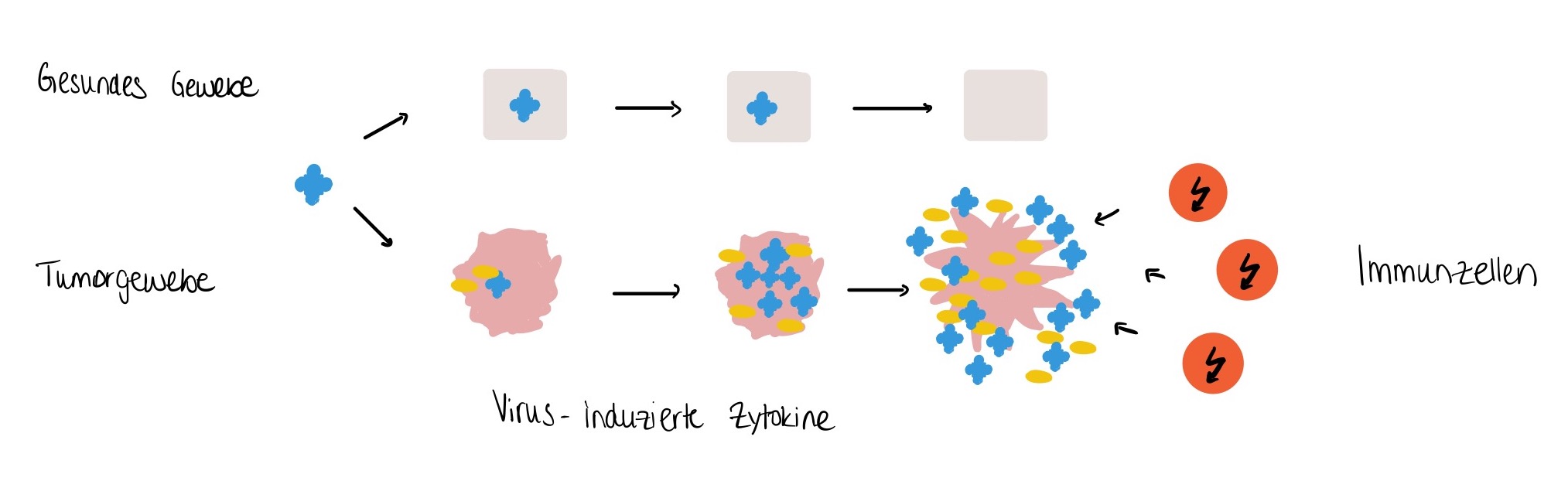
Abbildung 2: Das Prinzip onkolytischer Viren, sie führen zum lytischen Replikationszyklus in Tumorzellen, Zytokine und Immunzellen.
Wird eine Zelle von einem Virus infiziert, werden die Nukleinsäuren und Proteine des Viruses von der infizierten Zelle als gefährlich angesehen. Zu den Proteinen in der Zelle, welche wegen des Virus Alarm schlagen zählen: Retinsäure-induziertes Gen I (RIG-I), Proteinkinase R (PKR), zyklische GMP-AMP-Synthase (cGAS) und Stimulatoren von Interferon-Genen (STING) - sie alle erkennen primär untypische und virale Nukleinsäuren. Das Interferon-(IFN)-Typ-I-System ist in zusammenarbeitend mit diesen Proteinen ein weiterer Abwehrmechanismus. Durch diese Vorgänge kommt es zu einer Blockade der Proteinbiosynthese, wodurch die Viren sich nicht intrazellulär replizieren können. Um sich zu "wehren", damit es doch zu viraler Replikation kommen kann, kodieren die Viren immunsuppresive Proteine. Durch genetische Modifikation kann man den Viren die Möglichkeit immunsuppresiv zu wirken, entziehen. Somit wirken sie abgeschwächt pathogen gegenüber gesunden Zellen, und es kommt zu einer starken Immunantwort. 7
Vor- und Nachteile der Virotherapie
Vorteile der Virotherapie
• Durch rekombinante DNA-Technologie können Viren relativ einfach modifiziert werden, wodurch die Herstellung von neuartigen „Designer-Viren“ möglich ist. 14
• Gene, die toxisch auf Tumorzellen wirken oder auch eine immunstimulierende Eigenschaft besitzen, können den Viren einfach hinzugefügt werden. 14
• Viren besitzen eine natürliche Neigung tumorspezifische Entzündungen auszulösen. 14
• Die Fähigkeit der Viren sich selbständig in Tumorzellen zu replizieren, ist eine einzigartige pharmakokinetische Eigenschaft. 14
• Sowohl inaktivierte als auch vermehrungsfähige Viren, stimulieren das unspezifische Immunsystem. 3
• Das spezifische Immunsystem wird, indem die Viren die Tumorzellen infizieren und sie dadurch immunogen machen, ebenfalls stimuliert. 3
• Durch Nekrose vernichten Viren die Tumorzellen – produzieren infektiöse Replikate und führt zur Senkung der Tumorlast. 3
• Bestimmte Viren können entartete Zellen dazu führen sich wieder zu differenzieren und zur Apoptose fähig zu werden. 3
• Primäre Resistenzen sind beim NC-Virus nicht beobachtet worden. 3
• Viren können Krebs-Stammzellen vernichten – vor allem jene, welche Chemoresistenzen zeigen. 3
• Zellen die sich schnell teilen, werden bevorzugt von Viren angegriffen – bedeutet eine Selektion von eher gutartigen Klonen, da ihre Zellproliferation geringer ist als bei bösartigen. 3
• Durch die Sensibilisierung der Viren für gentoxische Substanzen wird die Chemotherapie effektiver und zusätzlich durch eine Dosisreduktion verträglicher. 3
• Eines Tages können Viren einfach und in großen Mengen herstellbar sein, vor allem aber können sie auch billig produziert werden. 3
Nachteile der Virotheraphie
• Onkolytische Viren werden von Neuraminsäuren absorbiert – diese Säure kommt auf allen Zellen vor, sogar auf den Erythrozyten, dadurch gelangt nur ein kleiner Teil der Viren ans Ziel, wenn sie Intravenös zugeführt werden. 3
• Es ist umstritten, dass ein tiermedizinischer Virus die Tierseuche auslösen könnte, was aber eher unwahrscheinlich gilt. 3
• Die Infektion kann sich nicht so lange ausbreiten bis die letzte Tumorzelle eliminiert ist, weil sich das Immunsystem auch gegen den Virus richtet und so die Ausbreitung eingedämmt wird – deshalb muss der Virus immer wieder infiziert werden. Es gibt jedoch einzelne Fälle, in denen eine Infektion gereicht hat. 3
• Es ist nicht auszuschließen, dass einige onkolytische Viren in gesunde Körperzellen eindringen – Virusgenom muss molekularbiologisch Verändert werden um dies zu verhindern. 3
Strategien zur Verbesserung der Virotherapie
Virogramm
Virogramm ist ein Testsystem, welches bereits entwickelt wurde und der Funktion des Antibiogramms ähnlich ist. Mit diesem Programm ist es möglich, herauszufinden welcher Virus für welchen Tumor am besten geeignet sein könnte. Man braucht dafür jedoch bis zu 2000 In-vitro-Tests, um herauszufinden, welcher Tumor am besten durch welchen Virus bekämpft werden kann. 3
Tumornaher Applikationsort
Ideal wäre es, wenn man die Viren über eine Infusion verabreichen könnte. Jedoch konnte man in einigen Studien beobachten, dass nur einen kleinen Teil der verabreichten Viren auch wirklich den Tumor erreichen.
Um zu vermeiden, dass die benötigten Viren verloren gehen, bevor sie ihren Wirkungsort erreicht haben, müssen diese möglichst nahe an dem gewünschten Wirkungsort injiziert werden. Deshalb muss man den Tumor entweder operativ freilegen oder über besonders lange, speziell geformte Kanülen erreichbar machen. 3
Onkotropismus
Die größte Schwäche der Viren ist es, dass sie sich an jedes Blutkörperchen binden und dadurch ihre eigentliche Aufgabe nicht mehr erledigen können. Forscher versuchen Viren eine „automatische Zielsuche“ einzubauen – dadurch könnte eine einfache intravenöse Injektion genügen um die Tumore zu bekämpfen. Zwei Methoden wurde schon näher in Betracht gezogen, die erste hat sogar schon die Ebene des Tierversuches erfolgreich bestanden. 3
Bispezifische Antikörper
Prof. Schirrmacher hat einen Antikörper konstruiert, der die räumliche Verbindung zwischen Wirtszelle und Virus herstellt. Sie binden mit einem Antikörperarm an die Hämagglutinin-Neuraminidase-Antenne des Virus und blockieren diese unspezifische Andockstelle. Mit dem anderen Arm binden sie an ein tumorspezifisches Epitop – dadurch entsteht die Verbindung der Wirtszelle und des Virus. Durch den zweiten Antikörperarm werden die Viren nur zu den rezeptorpositiven Zellen transportiert, da er an den IL-2-Rezeptor einer leukämischen Zelllinie bindet. 15
Eine neue Generation des bispezifischen Antikörpers kann mittels zwei Antikörperfragmenten Krebs- und Abwehrzelle miteinander in Kontakt bringen. Dieses Schema funktioniert so, dass ein Antikörper auf das Antigen CD3 ausgerichtet werden und sich gleichzeitig auch an T-Zellen binden kann. Die T-Zelle wird letztendlich erst im Fall der Bindung an die Tumorzelle mit dem CD3-Antigen aktiviert (siehe Abb.3.). Dadurch können die T-Zellen etwas gegen maligne Zellen unternehmen. Diese bispezifischen Antikörper sind als „BiTE“ (engl.:bispecific T-cell engager) bekannt. Der erste klinisch zugelassene Antikörper, nach dem Prinzip des BiTE, ist der Blinatumomab.16
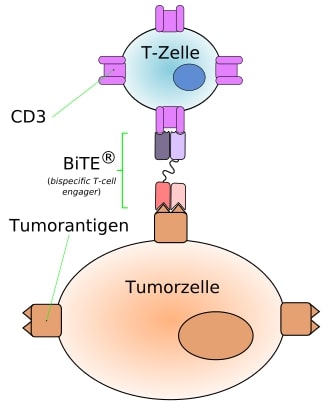
Abbildung 3: Wirkungsmechanismus eines bispezifischen Antikörpers am Beispiel eines BiTE-Antikörpers.
Genetische Manipulation der Andockstelle
Um mit einer genetischen Manipulation das gleiche Ziel erreichen zu können, müsste man einer Andockstelle das Gen für die Neuraminidase herausschneiden und eine tumorspezifische einfügen. Jedoch ist dies nicht so einfach umzusetzen wie zum Beispiel bei den Bakteriophagen. Phagen können nämlich auf diese Art und Weise manipuliert werden, damit sie sich an ein bestimmtes Bakterium binden können. 3
Einbau von Promotoren
Unter den Begriff Promotoren versteht man Genschalter, welche in das Genom des Virus eingebaut werden können. Diese Promotoren werden von bestimmten Signalen aktiviert, welche dadurch auch die Vermehrung des Virus kontrollieren.
Ein Beispiel ist die Aktivierung der Promotoren durch Melanin, dadurch liegt die Präferenz der Vermehrung des Virus in Melanomzellen. Das Gleiche gilt für Aktivierung der Promotoren durch PSA, so kann der Virus nur in Prostatzellen vermehrt werden. Diese Art der Genmanipulation ist bei Adenoviren üblich. 3
In der Praxis verwendete Anwendungsgebiete
Mit einer systemischen Anwendung/Injektion erreicht man eine zusätzliche Erfassung von Metastasen im Körper, jedoch entstehen eventuelle unkontrollierbare Reaktionen. Die Sicherheit, dass das verabreichte Virus an der richtigen bzw. gewollten Stelle ankommt ist nicht gegeben und es besteht das Risiko einer generierten Immunantwort bei häufiger Gabe des Virus. Systemisch injizierte Viren sind RNA Viren, z.B. das Vesikuläre Stomatitis Virus (VSV) oder das Reovirus. 4
Die invasivere Anwendung ist die lokale Injektion, bei ihr besteht die Sicherheit des Ankommens an die gewollte Stelle und es entstehen wenige bis keine systemischen Nebenwirkungen. Metastasen können mit dieser Verabreichung nicht reduziert oder bekämpft werden. Zu lokaler Anwendung werden die Adenoviren, Herpes simplex Viren und das Varizella Zoster Virus verwendet. 4
Fazit
Trotz jahrelanger intensiver Bemühungen und Forschungen reichen die herkömmlichen Therapien, wie zum Beispiel Chemotherapie oder Bestrahlung, zur Behandlung von Krebs unglücklicherweise oftmals nicht aus. Daher greift man immer häufiger auf alternative und eher unkonventionelle Therapieoptionen, wie die Therapie mittels onkolytischer Viren. Es wurden bereits klinische Studien durchgeführt bei denen Virotherapie zum Einsatz kam. Dabei werden Viren genetisch modifiziert, sodass sie gezielt Tumorzellen zerstören und gesunde Zellen verschont lassen.
Durch Verfahren, wie beispielsweise das Virogramm, kann die Kompatibilität von Tumor und zu verwenden geplanter Virus überprüft werden. Der Virus wird anschließend genetisch verändert und dem Patienten injiziert, wo er sich idealerweise in den Tumorzellen vermehrt, um diese letztendlich zu zerstören.
Quellenverzeichnis
1 Sturm, J.(2011): Effekte von Hyper-IL-6 in der Vaccinia-Virus-vermittelten Krebstherapie ; Dissertation 1
2 Lauer, UM. (2018):Virotherapie bei Bauchfellkrebs erfolgreich getestet; Tumor, Diagnostik und Therapie 39; 569-570 2
3 Thaller, A.(2008): Neue Strategien zur Verbesserung der Onkotropie onkolytischer Viren; EHK 57:(3) 166-174 3
4 Leske, H.(2019): In vitro Testung des Varizella-Zoster Virus als onkolytisches Virus in der Glioblastomtherapie ; Dissertation 4
5 Seubert, C.(2010): Onkolytische Virotherapie:Virus-vermittelte Expression von MCP-1 oder ß-Galaktosidase in Vaccinia-Virus-kolonisierten Tumoren führt zu einer erhöhten Tumorregression; Dissertation 5
6 Blitzer, M., Lauer, M.U.(2003): Onkolytische Viren als innovativer Ansatz in der Therapie gastrointestinaler Tumoren; Z Gastroenterol 41:(7) 667-674 6
7 Bergmann, M., Längle, J.(2015): Onkolytische Virustherapie bei Malignomen ; Jatros Infektiologie und Gastroenterologie-Hepatologie 4/15: 21-23 7
8 Raab, V.(2010): Histologische Charakterisierung Vaccinia Virus-infizierter humaner Tumore im Mausmodell); Dissertation 8
9 McFadden, G., Standford, M.M.(2007):Myxoma virus and oncolytic virotherapy: a new biologic weapon in the war against cancer; Expert Opinion on Biological Therapy 7:(9) 1415-1425 9
10 Schulte, E.A.(2014): Onkolytische Viren im Einsatz gegen Tumor(stamm)zellen ; Pädiatrix: 21-25 10
11 Müther, N.(2008): Konstruktion und Charakterisierung neuer onkolytischer Herpes Simples-Viren Typ 1 ; Dissertation 11
12 Kaufmann, K.J.(2013): HMWMAA-gerichtete Chemotherapie des Malignen Melanoms mit onkolytischen Masernviren ; Spitzenforschung in der Dermatologie: 40-50 12
13 Holm P.S.; Retz, M.; Gschwend J.E. und Nawroth R.(2016): YB-1-basierte Virotherapie; Der Urologe 55: 356-363 13
14 Lemperle, S.(2013) Das Vesikuläre Stomatitis Virus in der onkolytischen Virotherapie des pankreatischen duktalen Adenokarzinoms; Dissertation 14
15 Bian, H., Fournier, Ph., Moormann, R., Peeters, B., Schirrmacher, V.(2005): Selective Gene Transfer to Tumor Cells by Recombinant Newcastle Disease Virus via a Bispecific Fusion Protein; Int J Oncol.26:(2) 431-439 15
16 Borchers, M.(2019): BiTE:Neuer Biss gegen (solide) Tumoren; InFo Hämatologie + Onkologie 23:(3) 61 16
Abbildungen
Abbildung 1: Von Christoph Leberecht, CC BY-SA 3.0 https://commons.wikimedia.org/w/index.php?curid=25662133
Abbildung 2: Prinzip onkolytischer Viren, gezeichnet von Helen Lilith Wackes
Abbildung 3: Von Armin Kübelbeck, Wirkungsmechanismus eines bispezifischen Antikörpers am Beispiel eines BiTE-Antikörpers https://de.wikipedia.org/wiki/Bispezifischer_Antik%C3%B6rper#/media/Datei:BiTE_antibody_01.svg
