Tumorterápia onkolítikus vírusokkal |
Contents
Bevezetés
A rák az egyik fő halálozási ok világszerte. Az orvostudomány területén óriási fejlődések történtek, de ennek ellenére még mindig jelentős a rákos megbetegedések száma. A hagyományos kemo-,és sugárterápia számos mellékhatással rendelkezik. Ennek köszönhetően megkezdődött olyan terápiák keresése is amelyek, kifejezetten a tumorsejteket károsítják, a szervezet sejtjeit érintetlenül hagyva. A vírus onkoterápia is ígéretes módszernek bizonyult, számos olyan vírust azonosítottak, melyek rákellenes hatással bírnak. A tumorsejtek jobb megismerésével és a biotechnológia, virológia fejlődésével megvalósíthatóvá vált a vírusok tervezése, alakítása, mellyel növelhető lett az onkolítikus aktivitásuk és a tumorsejt szelektivitásuk. Folyamatos kutatások folynak az onkolítikus vírusok megfelelő használatára, megismerésére.
Története
A tumorok onkolítikus vírusokkal való kezelésének gondolata 1950-ben jelent meg. Ekkor fejlesztették ki a daganatos szövet-, illetve rágcsáló modelleket, és rákos emberek sokaságán tesztelték a szennyezett onkolítikus készítmények hatásást. Ennek eredménye az esetek többségében az volt, hogy az immunrendszer eliminálta a vírusokat, ám elenyésző számban, és főleg a gyenge immunrendszerű emberekben mégis megállt a daganat fejlődése. Itt a problémát a vírus továbbterjedése okozta az egészséges szövetekre. Az 1970-es években a tumoros megbetegedések ezen módszerekkel való visszaszorításának kutatása alábbhagyott (Russell és mtsai, 2012).
Az onkolítikus viroterápia modern korszaka az 1990-es évek elején kezdődött, mikor egy kutatás során kiderült,hogy egy mutáns, legyengített herpes simplex vírus hatással van egy rágcsáló agydaganatos sejtjeire. Ez volt az első módosított, mesterséges vírus, melynek sikere új kapukat nyitott meg a tudomány számára. Azóta számos vírustörzset használnak fel hasonló célokra, és rengeteg cikk, valamint kutatás született a témával kapcsolatban (Martuza és mtsai, 1991).
A 2000-es évek elején számos daganatos megbetegedés kutatása során jártak már sikerrel szövettenyészeteken és állatmodelleken onkolítikus vírusok használatával. Példa erre a bél tumor állatmodellben adenovírus által bejuttatott TRAIL-gén mely a tumor regressziójához vezetett (Mohr és mtsai, 2004). Ugyanígy onkolítikus adenovírussal a hasnyálmirigyrák növekedésének gátlása, és áttétképzés gátlása is sikerrel járt már több állatmodellen(Sunamura és mtsai, 2004) (Noro és mtsai, 2004).
Ezen kívül a metasztázisos melanóma kezelésére is alkalmaznak onkolítikus vírusokat. Cutan,subcutan és nyirokcsomó áttéteknél módosított Herpes simplex vírust juttatnak be a szervezetbe intratumorálisan. A kezelésnek jelentős intralokális és immun serkentő hatása van, mely klinikai kutatások során monoterápiásan és immunterápiával kombinálva is remek eredményeket mutat (Baltás és mtsai, 2019).
Vírustörzsek
Adenovírusok
Az Adenoviridae családba tartozó, nagyon ellenálló vírusokat sok esetben használják a tumorok elleni küzdelemben onkolítikus hatásuk miatt. A család tagjai lineáris duplaszálú DNS-sel rendelkeznek tehát a Baltimore I-es csoportba sorolhatóak. Tüneteik különfélék lehetnek: például az Aviadenovirus betegségei, amelyek madarakat fertőznek, máj- és, vesegyulladást, valamint zuzógyomor eróziót okoznak. A tumorsejtek elleni használatukra vonatkozóan számos kutatás folyik.
Li és munkatársainak tanulmánya szerint az Adenovírusok képesek kifejezetten a májrákot támadni.Müködését tekintve az egyik lehetőség, hogy az Adenovírus a replikációs génje módosításával támadja a tumort, ehhez azonban törölnünk kell az E1A vagy E1B gént a vírusból. Az ONYX-015 egy olyan manipulált adenovírus, amelyből az E1B már törölve lett. Az I és II-es típusú klinikai vizsgálatokban az ONYX-015 intravénás vagy intratumorális injekciónál nem mutattak ki toxikus határértéket és biztonságosnak bizonyult használata. Másik lehetőség a tumorrá fajuló májsejtek membrán receptorainak megcélzása egy módosított adenovirus kapsziddal (Li és mtsai, 2020).
Herpesz simplex
A Herpesviridae család tagja a herpes simplex vírus. Lineáris, duplaszálú DNS-sel rendelkeznek, rövid reprodukciós ciklusra képesek. Jellemző rájuk, hogy integrálódnak a DNS-be, így aki egyszer megfertőződik vele örökre fertőzött marad. Onkogenitásuk miatt gyakran használják őket is a tumorterépia egyes területein. A HSV-1 mutációval való megváltoztatása a vírus replikációs képességét is befolyásolja, ezek hatással vannak az immunsejtekre is, fokozzák azok működését, így hatva a tumorra. Hatásosak lehetnek a glioma, melanóma, vastagbél-, prosztata-, petefészek- és hasnyálmirigyrák ellen (Varghese és Rabkin, 2002). Lehetséges használatokra folyamatosan folynak a klinikai tesztek. Jelentős előrelépések történtek ezen a kutatási területen, de még mindig számos nehézséggel és kérdéssel állunk szemben. Kutatások (Dósa, 2010) megállapították, hogy a 3D-s tumorsejtek, sokkal ellenállóbbak a virális onkoterápiával szemben, mint a 2D-s daganatsejtek.
Reovírusok
A Reoviridae családba tartozó betegségek általában emésztő és légzőrendszeri tüneteket okoznak. Baltimore III-as csoportba sorolhatóak, virális transzkriptáz enzimüket hordozzák magukkal. Tanulmányok szerint a reovírusokat hatékonyan lehet beinjektálni a véráramba, így a vírus a rákos sejtek elpusztítása mellett, immunválaszt is kivált, amely elősegítheti a további rákos sejtek eltávolítását. A jövőt tekintve a kutatási irány jelentős előrelépést jelenthet a rákkezelés kifejlesztése terén. Szintén kutatások irányulnak arra is, hogy például az agydaganat esetében is hatékonyak lehetnek ezek a vírusok.
Tumor lokalizálás
A rákos betegségek terápiás kezelése során az egyik legfontosabb és legnehezebb feladat a tumorsejtek megkülönböztetése a normál sejtektől. Az onkolítikus vírusok genetikai állományuk módosítását követően, legyengítve kerülnek a szervezetbe, így ha normál sejtekbe jutnak, azokban aktiválják az immunválaszt, és a sejt eliminálja. Ez a vírusra adott sejtválasz a mutálódott tumor sejtekben nem található meg, ezért ellenállás sincs a vírusfertőzéssel szemben (Megjegyzendő, hogy az ilyen terápiák során az immunszupresszív állapotban lévő betegek jobban reagálnak a kezelésre, mint az ép immunrendszerűek) (Russell és mtsai, 2012). A daganatos sejtek minél inkább szelektív megcélzása elősegíti a vírus normál sejtekre kifejtett citopatogenikus hatásait, és felesleges immunválaszok csökkentését is (Jhawar és mtsai, 2017).
|
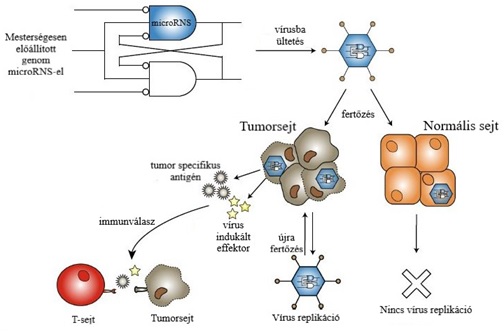
1.kép: A genomba ültetett microRNS hatásmechanizmusa (Kaufman és mtársai, 2015) |
Onkolítikus vírusok természetes tumor lokalizációja
Különböző vírusok különböző sejtekben, szövetekben szaporodnak, így léteznek olyanok is melyek kifejezetten a daganatos sejteket preferálják. Vannak olyan vírusok, melyek természetes tropizmussal rendelkeznek az daganatos sejtek, normál sejtekkel szemben túlzottan expresszált/rendellenes sejtfelszíni fehérjéi iránt. Ezen kívül a rákos sejtek által okozott egyéb tényezők, immunszupresszív mikrokörnyezet, a megváltozott transzkripciós és jelátviteli utak hibás működése vagy a már említett természetes védekezőképesség hiánya segíti a vírusok helyszínre jutását. Ugyanígy segítséget nyújtanak a rákos sejtek specifikus megcélzásában a sejtek apoptózisát meggátoló fehérjék. Mindezen tényezők nemcsak a tumor helyének meghatározásában, hanem a tumorba jutást is segítik, megkönnyítik(Jhawar és mtsai, 2017).
Onkolítikus vírusok mesterségesen előidézett tumor lokalizációja
Ezen eljárások lényege különböző onkolítikus vírusok megtervezése, módosítása genetikailag és szerkezetileg, hogy a tumoros sejtek által kifejezett, egyedi sejtfeületi fehérjéket, specifikusan célozzák meg. Ez kétféleképpen csoportosítható: Külső, szerkezeti tényezők, melyek a lokalizációt és a sejtbe jutást segítik. A vírus felszínén expresszált receptorokat és fehérjéket megváltoztatása nagymértékben segíti az adaptációt a meghatározott sejtek felületén. A külső markerek kémiai módosítása biokompatibilis polimerekre (pl. polietilénglikol (PGE)) az immunrendszerrel szemben biztosít védelmet a vírusnak. Ezt a módszert az áttétes daganatok kezelésénél alkalmazzák, amikor a vírusok a keringés révén jutnak el az egyes tumorcentrumokba. Ezzel a vírus keringésben töltött idejének megsokszorozódása érhető el, minimalizálódik a máj és lép általi szekréció. Ugyanezen hatás elérhető a vírus hordozósejtbe ültetésével. Erre a célra használható normál sejtek primer sejtvonala, vagy mezenchimális sejtek. A legfontosabb, hogy olyan hordozósejtet kell alkalmazni, melyet nem öl meg az onkolítikus vírus mielőtt infiltrálódik a daganatba (Russell és mtsai, 2012). Belső, a vírus nukleinsavát, genomját módosítva, a vírus replikációja, és annak körülményei befolyásolhatók. A genomba mesterségesen programozhatók promóter régiók, melyek a gének expresszióját, a fehérjék termelését és a sejten belüli szaporodás szabályozzák. Egészséges sejtbe kerülve a promóter régió gátolva van, tumorsejtbe jutva viszont ez a régió aktiválódik, beindítja egy, a tumorsejtekre jellemző faktor, ezáltal vírus replikációt eredményez. Egy másik, hasonló eljárás, hogy a génállományba úgy nevezett microRNS-t ültetnek. Ez egy kicsi, információt nem kódoló RNS szakasz, ami szövetspecifikusan képes expresszálódni. A microRNS a mRNS 3’ végéhez kapcsolódik és meggátolja a transzlációt. Az onkolítikus vírusokat úgy tervezik, hogy egy bizonyos szövetre jellemző microRNS-t hordozzanak, így amikor az a bizonyos szövetbe kerülve kifejeződik, a hasonlóság miatt lebomlik és a vírus képes lesz a reprodukcióra. Ha a nem megfelelő szövetbe kerül a vírus a microRNS gátlása miatt elmarad a fehérjetermelés (1.kép) (Huang és mtsai, 2019).
Sejtbejutás
|
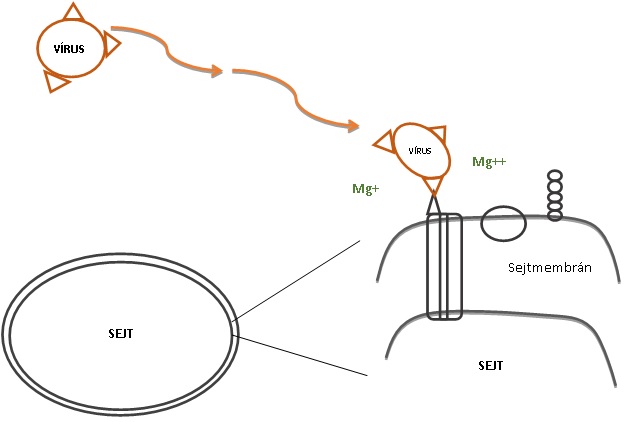
2.kép: Antireceptor-receptor kötés,adszorpció.(Saját készítésű) |
A különböző sejteket más stratégiával fertőznek a vírusok. Az állati eukarióta sejtek illetve az egyszerűbb belső felépítésű prokarióták, sejtmembránnal vannak körülvéve, míg a növényi sejtek sejtfallal is rendelkeznek. Ez a különbség alapvető lesz a vírusfertőzés kialakulásának módja szempontjából. A növényi sejtfalon csak sérülések útján tudnak bejutni a vírusok. A sejtmembránban az életfenntartásához elengedhetetlen csatornák, receptorok és markermolekulák helyezkednek el, amik biztosítják az anyagáramlást és kommunikációt az adott sejtnek (L.Yeagle, 1989). Ezeket a receptorokat és csatornákat fogja a vírus kihasználni annak érdekében, hogy bejusson a sejtekbe ahol aztán a önmaga sokszorozódását elindíthatja. A vírusoknak a sokszorozódási mechanizmusa számos egymás utáni lépésből tevődik össze. Talán a legfontosabb, az első lépés, a sejteken való megtapadásuk, az adszorpció. Evolúciós lépésekkel a vírusoknak az antireceptorai, amivel be tudnak kötni a sejtek felszínére, folyamatosan adaptálódtak. Ezek a felszíni fehérjék fogják meghatározni, hogy milyen fajt és azon belül milyen szövetet, sejtet képesek megfertőzni. Egy tanulmány szerint például: a HIV felszíni antireceptora a gp120, csak a CD4 receptorra képes bekötni, a CD4 receptor a humán fehérvérsejtek egy csoportján található meg, így csak azokat képes támadni (Wyatt és mtsai, 1998). Az adszorpciót azonban számos tényező képes hátráltatni:
-Mozgásukat a környezeti hatásoknak a sodrása fogja befolyásolni, maguktól nem képesek helyváltoztatásra. A sodrás véletlenszerű ütközéseket eredményez, amik által, a vírus találkozik a sejtekkel, azonban nem biztos, hogy az adekvált receptorral ütközik.
-Egyes vírusfertőzések során, általában a duplaszálú RNS genomúak pl: Reoviridae-k családba tartozó vírusok esetében, kiválthatnak sejtszinten való interferon termelést, ha az adott vírus nem rejti el a genomját kellő kép a sejtben való sokszorozódása során (Beck, 2013). Az interferon (IFN) egy jelzővegyület a többi sejt számára, ami a felszíni receptoraik számának csökkenését fogja eredményezni, így kevésbé kitettek a fertőzésnek, rezisztensebbek a vírusra nézve. Ez a folyamat „up and down” regulációval zajlik (Isaak, A. 1963).
-Mind a receptor mind az antireceptor negatív töltetű, lévén fehérjéből épülnek fel, és ez, taszítást fog eredményezni. Ezt a taszítást a környezetükben lévő kationok tudják semlegesíteni (Medveczky és mtársai, 2011). Ha mind az ütközés mind a töltés megfelelő, a vírusok irreverzibilis antireceptor-receptor kapcsolatot tudnak kialakítani ennek folyamatát (2.kép).
Miután a vírusok sikeresen rögzültek a sejtek felszínén, a genetikai anyagukat, genomjukat be kell juttatniuk a sejt belsejébe a sokszorozódás érdekében, ez a folyamat a penetráció. Onkogén vírusok, mint a többi eukarióta sejtet támadó vírusok a sejtmembránon keresztül, két különböző képen juttatják be a genomjukat:
1. endocitózis révén az egész vírus bejut a citoplazmába és egy vakuólumba kerül. Ezt a folyamatot nevezik viropexisnek.
2. fúzió során pedig a burkos vírusok peplonja (külső lipidburka) fuzionál a sejtmembránnal és a benne található kapszid, bekerül a citoplazmába.
Fertőzés
A sejteken belül a DNS állomány folyamatosan ellenőrzés alatt áll, a hibák elkerlése végett. Sejtosztódás ideje alatt főleg a G1/S, és a G2/M átmenetben . A tumorsejtek kialakulásához, a DNS-ben kialakult és ki nem javított olyan hibák vezetnek, amelyek az onkogénekben, vagy közel hozzájuk történnek. Ezek a génszakaszok felelnek a normális osztódási folyamatokért, ha itt hiba történik, a sejt önszabályozás és hibajavítás nélkül kezd el nagy ütemben osztódni. Sok esetben, megváltoznak a külső felszínen lévő sejtmarkerek, amik által az immunrendszer felismeri a hibás osztódást és fellép ellenük, azonban sajnos sok esetben ez nem történik meg. Ha a receptorok nem változnak meg, akkor az onkogén vírusok antireceptoraival a tumorsejtek fertőzése fennállhat. Számos tumorképző vírus, az osztódásukhoz, beépítik genomjukat a gazdasejtek genomjába, és azoknak a természetes másolásával érik el a saját genomjuk másolását, ez által a sokszorozódásukat. Ezeknek a vírusoknak, osztódó sejtekre van szükségük, így a burjánzó tumorsejtekben gyorsan tudnának hatni. Ezt a folyamatot még meggyorsítja az is, hogy sokszor az onkogénekhez közel építik be genomjukat és gátolják meg a DNS másolásnak normális leállását, így folyamatosan másolódna a módosított genomjuk. Ezek a vírusok rendszerint a Baltimore 1-s típusba sorolt duplaszálú DNS-el rendelkezők. Ilyenek a Papilloma-, Polyoma-, Adeno-, Herpes-, Pox-, és Asfarviridae családba tartozó vírusok, utóbbi kettő nem épül be a sejtmagba, rendelkezik saját enzimrendszerrel. Ezek a vírusok ha normál sejteket fertőznek, általában jóindulatú daganatokat eredményeznek, azonban, átcsaphatnak, rosszindulatúvá ezért kell különös figyelmet fordítani rájuk (Chiocca, 2002).
Hatásmechanizmus
Két fő mechanizmusa a tumorsejtekre gyakorolt közvetlen sejtlízis, és indirekt módón a tumorsejt közelében az immunfaktorok számának növekedése, a környezet megváltoztatása.
Közvetlen
A tumorsejtek lízise több módon is bekövetkezhet:
Természetes
-Az onkolítikus vírus tumor sejtben való replikációja során meggátolja a sejt saját metabolizmusához szükséges anyagok termelését, vírus alkotók termelése kezdődik meg. Ezáltal a vírus felhasználja a sejt anyag és energiaforrásait, majd a virionok kiszabadulásakor a sejtek pusztulását, lízisét okozzák (Choi és mtsai, 2016).
Mesterséges
-A sejthalál másik módja, a sejt DNS replikációjának meggátolása. Erre példa egy mesterségesen megtervezett adenovírus, mely a genomjában hordoz egy gént, és a sejbe jutva expresszál egy HSV-1 timidin kináz enzimet. Ez az enzim képes a DNSbe beépülő timidint analógokat monofoszfátokká alakítani. A monofoszfátok beépülnek az osztódó sejt DNS-ébe és a lánc zárásához, valamint ezáltal sejthalálhoz vezetnek (Kubo és mtsai, 2003).
-Mesterségesen kialakíthatók olyan vírusok is, melyek „öngyilkos” géneket hordoznak. Ezek a gének, olyan proapoptotikus fehérjéket kódolnak, mint a TNF- α (tumor nekrózis faktor-α), vagy TRAIL (TNF-el kapcsolatos apoptózis faktor). A TNF- α és TRAIL fehérjék apoptózist indukálnak a tumorsejtekben. Ezen módszer használatának korlátja, hogy a szisztémás keringésbe jutva toxikus hatásokat idéz elő (Jhawar és mtsai, 2017). Ennek ellenére több kutatás is sikeresen alkalmazta és foglalkozik ezen módszer kihasználási lehetőségeivel. Hirvinen, M. és mtársai 2015-ös kutatása során egy TNF- α-át expresszáló adenovírus hatásait vizsgálták. Kutatásuk eredménye, hogy a gént hordozó és kifejező adenovírus jelentős mértékben okozta a daganat pusztulását. Ezen kívül különböző immunválaszokat váltott ki a szervezetből, ami tovább fokozta a hatást (Hirvinen és mtsai, 2016).
-Tervezhetők olyan gének is, melyek által olyan fehérjéket fejez ki a vírus, melyek hatására a sejt hajlamosabb lesz felvenni a szisztémás keringésből a gyógyszereket, esetleg képesek bizonyos elővegyületet gyógyszerré alakítani, így javítva a terápia hatékonyságát (Choi és mtsai, 2016).
Indirekt
|
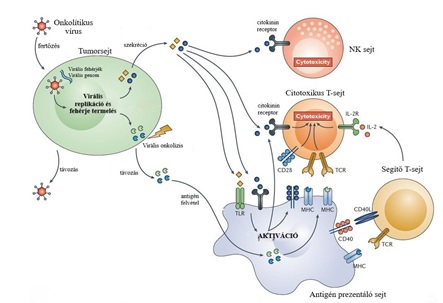
3.kép: Az onkolítikus vírusok és az immunrendszer kölcsönhatása (Huang és mtsai, 2019) |
Az immunhatásban fontos szerepet játszik a természetes és az adaptív immunitás is.
Természetes
A daganatos sejtekben az onkolítikus vírusok által előidézett sejthalál során tumor asszociált antigének, mutálódott fehérjék, tumor specifikus fehérjék és szöveti elemek szabadulnak fel. Ezek a molekulák aktiválják az immunrendszert. Fontos a szerepük a citotoxikus T-sejteknek, melyek képesek a vírussal nem fertőzött tumorsejteket is észlelni és eliminálni. Ezen reakciók során még több szöveti faktor: kórokozóval vagy károsodással kapcsolatos molekulák, kalretikulin, hősokk fehérjék és citokininek szabadulnak fel. A felszabadult szöveti faktorok elősegítik az immunrendszeren belüli információ átadást, serkentik az antigénprezentáló sejtek működését, helper- és további citotoxikus T-sejteket aktiválnak (3.kép). Ezen kívül a természetes immunitásba részt vevő természetes ölősejtek (NK- sejtek) és neutrofil granulocyták száma is megnő a daganat helyszínén (Choi és mtsai, 2016).
Mesterséges
-Génmutációval előállított onkolítikus vírusok expresszálhatnak citokinineket a tumorsejtekben. Ez az adaptív immunrendszer aktivitásának megnövekedéséhez vezet. A citotoxikus T-sejtek aktivitása nemcsak lokálisan, hanem a szisztémás keringésben is megfigyelhető (Choi és mtsai, 2016).
-Hősokk fehérjék génjének beültetése az onkolítikus genomba, majd annak kifejeződése a dendritikus sejtek megnövekedett aktivitásáhot és kemokintermeléshez vezet. A kemokin expressziója lehetővé teszi, hogy a limfociták által termelt ellenanyagok, az MHC-komplex ellenére, eliminálják a tumort. Ezen kívül a tumor mikrokörnyezetét is megváltoztatják, elősegítve a gyulladásos folyamatokat (Choi és mtsai, 2016).
-Megtervezett genomú vírusokkal a daganatos sejtek felületén expresszálhatók olyan molekulák (ko-stimuláló molekulák), melyeket az antigénprezentáló sejtek termelnek a T-sejtek serkentésére (Choi és mtsai, 2016).
-Onkolítikus vírusokba ültethetők olyan gének, melyek anti-angiogén molekulákat kódolnak,amik a tumor környéki érrendszerre hatnak. A folyamat során a vírusok által expresszált anti-vaszkuláris endoteliális növekedési faktor és vaszkuláris endoteliális növekedési receptor semlegesíti az angiogenezis faktorait és megakadályozza azt. Ezáltal, a tumor elveszti a vérellátását, ami sejthalálhoz vezet (Choi és mtsai, 2016).
Felhasználás
Egyes kutatók elkezdték a tumort képző vírusokat tanulmányozni, annak reményében,hogy a daganatos elváltozások kezelésére is alkalmasak lehetnek. A vírusokat, mint vektorokat, fel lehet használni célzottan, különböző sejtek fertőzésére, majd a célsejtek osztódásának megállítására. Ehhez azonban a genomjukat a megfelelő módon meg kell változtatni, hogy a sejteket belülről legyen képes befolyásolni.
-Kifejlesztettek egy HSV-1 (herpes simplex)-ből genetikailag módosított KTR27-fehérjét amit, ha lokális tetraciklin mellett adnak be, csökkenti a tumor sejtek növekedését. Egérben növesztett nagysejtes humán tüdőrák ellen alkalmazták ezt az eljárást és sikeresnek is bizonyult, azonban további kutatások szükségesek (Yao és mtsai, 2010).
-Kutatások folynak, a glioblastoma multiforme , vírusok alkalmazásával történő kezelésére vonatkozóan is, ami egy igen agresszív és az egyik leggyakoribb idegrendszeri daganat. Hatástalanított MTH-68/H vírust alkalmaznak amely apoptózist vált ki. Sajnos a sejtvonalak érzékenysége változó, a probléma áthidalását még kutatják. Szintén erre a célra kutatnak egy HSV-1 típusú (dlsptk) módosított vírust is (Martuza és mtsai, 1991).
-A SCID (súlyos kombinált immundeffektus) kezelésésre 1990-ben alkalmaztak retrovírussal génterápiát sikeresen, a további esetekben leukémia jelentkezett, ezért még finomítják a beavatkozást.
-Sikeresen kezeltek egy thalassaemiában szenvedő beteget (a szervezet nem képes normális hemoglobint előállítani) lentivírussal, így nem kellett transzfúzióra járnia a továbbiakban.
-Duchenne-féle izomdisztrófiánál adeno-asszociált vírusokat vetnek be, amelyek segítségével működő fehérjék termelését érték el. Ez a 19.-kromoszómákon hat. Ezeket a vírusokat tanulmányozzák a Parkinson-kór kezelésére is, továbbá öröklődő vakság esetleges megoldása érdekében. Ezekből az esetekből is láthatjuk, hogy a jövő kutatási vonalának egy nagyon jelentős hányadát a víruskutatás teszi ki, mivel ígéretesnek bizonyul a kártékony tulajdonságaik jóra való fordításának megoldása.
Jövő
Egyre gyakrabban alkalmazzák a szokásos terápiák (kemo- / sugár- /immunterápia) és az onkolítikus vírus terápia kombinációját. Klinikai adatok, és kutatások is mutatják, hogy ez a módszer javíthatja a terápia során kiváltott választ, hatékonyabb lesz általa a kezelés. Az egyik legígéretesebb, és legnagyobb jövő előtt álló ilyen kombináció az onkolítikus vírusok és az immunrendszer szinergizmusa, mely során a vírus tumorellenes immunválaszt indukál a szervezetben. Természetesen felmerül ezen módszerek kockázatának a kérdése is. A kezelt betegről átterjedhet-e más élőlényre a vírus? Mutációk során vissza nyerheti-e a patogén hatását a legyengített kórokozó, okozhat-e így gondot a szervezetben? Milyen hatása van ezen terápiának hosszú távon? Az onkolítikus vírusok alkalmazása a tumoros megbetegedések ellen, egy viszonylag új, de annál érdekesebb, reményt adó, sok kérdést felvető terület, mely nagy jövő előtt áll az emberi orvoslásban (Choi és mtsai, 2016).
Források
Irodalomjegyzék:
1. Baltás, E.; Kis, E.; Korom, I.; Németh, I.; Varga, A.; Varga, E.; Ócsai, H.; Oláh, J. (2019): Új diagnosztikai és kezelési eljárások a dermatoonkológiában. Bőrgyógyászati és Verneológiai szemle 95(2)53-58
http://publicatio.bibl.u-szeged.hu/16239/
2. Chiocca, E.A. (2002): Oncolytic viruses. Nature 2:(12)938-50
https://www.nature.com/articles/nrc948
3. Choi, A. H.; O’Leary, M. P.; Fong, Y.; Chen, N. G. (2016): From Benchtop to Bedside: A Review of Oncolytic Virotherapy. Biomedicines 4:(3)18
https://www.mdpi.com/2227-9059/4/3/18
4. Dósa, S.; Valyi-Nagy, K. ; Kovacs, S. K.; Bacsa, S.; Voros, A.; Shukla, D.; Folberg, R. (2010): Identification of virus resistant tumor cell subpopulations in threedimensional uveal melanoma cultures. Cancer Gene Therapy 17:(4)223-234 doi: 10.1038/cgt.2009.73
5. Hirvinen, M.; Rajecki, M.; Kapanen, M.; Parviainen, S.; Rouvinen-Lagerström, N.; Diaconu, I.; Nokisalmi, P.; Tenhunen, M.; Hemminki, A.; Cerullo, V. (2015): Immunological effects of a tumor necrosis factor alpha-armed oncolytic adenovirus. Human Gene Therapy 26:(3)134-44
https://www.ncbi.nlm.nih.gov/pubmed/25557131
6. Huang, H.; Liu, Y.; Liao, W.; Cao, Y.; Liu, Q.; Guo Y.; Lu, Y.; Xie, Z. (2019): Oncolytic adenovirus programmed by synthetic gen circuit for cancer immunotherapy. Nature Communications 10:(1)4801
https://www.nature.com/articles/s41467-019-12794-2
7. Jhawar, S. R.; Thandoni, A.; Bommareddy, P. K.; Hassan, S.; Kohlhapp, F. J.; Goyal, S.; Schenkel, J. M.; Silk, A. W.; Zloza. A. (2017): Oncolytic Viruses—Natural and Genetically Engineered Cancer Immunotherapies. Frontiers in Oncology 7:202. doi: 10.3389/fonc.2017.00202.
https://www.frontiersin.org/articles/10.3389/fonc.2017.00202/full
8. Kubo, H.; Gardner, T. A.; Wada, Y.; Koeneman, K. S.; Gotoh, A.; Yang, L.; Kao, C.; Lim, S. D.; Amin, M.B.; Yang, H.; Black, M. E; Matsubara, S.; Nakagawa, M.; Gillenwater, J.Y.; Zhau, H. E.; Chung, L. W. (2003): Phase I dose escalation clinical trial of adenovirus vector carrying osteocalcin promoter-driven herpes simplex virus thymidine kinase in localized and metastatic hormone-refractory prostate cancer. Human Gene Therapy 14:(3)227-41 doi: 10.1089/10430340360535788.
https://www.ncbi.nlm.nih.gov/pubmed/12639303
9. Li, Y.; Shen, Y.; Zhao, R.; Samudio, I.; Jia, W.; Bai, X.; Liang, T. (2020): Oncolytic virotherapy in hepato‐bilio‐pancreatic cancer: The key to breaking the log jam?. Cancer Medicine 00:1–17. doi: 10.1002/cam4.2949.
10. Isaak, A.(1963): Interferon. Advances in Virus Research 10:1-38
https://www.sciencedirect.com/science/article/pii/S0065352708606958
11. Martuza, R.L.; Malick, A.; Markert, J. M.; Ruffner, K. L.; Coen D. M. (1991): Experimental therapy of human glioma by means of genetically engineered virus mutant. Science 252:(5007)854-856 doi: 10.1126/science.1851332.
https://science.sciencemag.org/content/252/5007/854
12. Mohr, A.; Henderson, G.; Dudus, L.; Herr, I.; Kuerschner, T.; Debatin, K. M.; Weiher, H.; Fisher, K. J.; Zwacka, R. M. (2004): AAV-encoded expression of TRAIL in experimental human c olorectal cancer leads to tumor regression. Gene Therapy 11:(6)534-43
https://www.nature.com/articles/3302154
13. Noro, T.; Miyake, K.; Suzuki-Miyake, N.; Igarashi, T.; Uchida, E.; Misawa, T.; Yamazaki, Y.; Shimida, T. (2004): Adeno-associated viral vector-mediated expression of endostatin inhibits tumor growth and metastasis in an orthotropic pancreatic cancer model in hamsters. Cancer Research 64:(20)7486-90. doi: 10.1158/0008-5472.CAN-03-1296.
https://cancerres.aacrjournals.org/content/64/20/7486
14. Russell, S. J.;Peng, KW.; Bell, J. C. (2012): Oncolytic virotherapy. Nature Biotechnology 30:(7)658-70. doi: 10.1038/nbt.2287.
https://www.nature.com/articles/nbt.2287
15. Sasso, E.; Froechlich, G.; Cotugno, G.; D’Alisen, A. M.; Gentile, C.; Bignone, V.; De Lucia, M.; Petrovic, B.; Campadelli-Fiume, G.; Scarselli, E.; Nicosia, A.; Zambrano, N. (2020): Replicative conditioning of Herpes Simplex type 1 virus by Survivin promoter, combined to ERBB2 retargeting improves tumor cell-restricted oncolysis. Scientific Reports 10:(1)4307. doi: 10.1038/s41598-020-61275-w. https://www.nature.com/articles/s41598-020-61275-w
16. Sunamura, M.; Hamada, H.; Motoi, F.; Oonuma, M.; Abe, H.; Saitoh, Y.; Hoside, T.; Ottomo, S.; Omura, N.; Matsuno, S. (2004): Oncolytic virotherapy as a novel strategy for pancreatic cancer. Pancreas journal of neuroendocrine tumors and pancreatic diseases and sciences 28:(3)326-329
17. Varghese, S.; Rabkin, S. (2002): Oncolytic herpes simplex virus vectors for cancer virotherapy. Cancer Gene Ther 9:(12)967-78. doi: 10.1038/sj.cgt.7700537
https://www.nature.com/articles/7700537
18. Wyatt, R.; Kwong, P.D.; Desjardins, E.; Sweet, R.W.; Robinson, J.; Hendrickson, W.A.; Sodroski, J.G. (1998): The antigenic structure of the HIV gp120 envelope glycoprotein. Nature 393:(6686)705-11.
https://www.nature.com/articles/31514
19. Yao, F.; Murakami, N.; Bleiziffer, O.; Zhang, P.; Akhrameyeva, N.V.; Xu, X.; Brans, R.(2010): Development of a Regulatable Oncolytic Herpes Simplex Virus Type 1 Recombinant Virus for Tumor Therapy. Journal of virology 84:(16)8163-71. doi: 10.1128/JVI.00059-10
https://jvi.asm.org/content/84/16/8163.short
20. Yeagle P.L. (1989): Lipid regulation of cell membrane structure and functio. The FASEB Journal 3(7):1833-42.
https://www.fasebj.org/doi/pdf/10.1096/fasebj.3.7.2469614
Felhasznált tankönyvek:
1. Beck, Z. (2012): Általános virológia. Az orvosi mikrobiológia tankönyve. Medicina Könyvkiadó Zrt. ISBN: 978 963 226 463 9 https://regi.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_Mikrobiologia/ch02.html#id512115
2. Medvecky, I.; Rusvai, M.; Varga, J.; Tuboly, S. (2011): Virológia. Állatorvosi járványtan I. Mezőgazda kiadó. ISBN: 963 9121 71 1 https://regi.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_521_Allatorvosi_jarvanytan1/ch03.html#id576229
Egyéb felhasznált irodalom:
1. ICTV: Adenoviridae https://talk.ictvonline.org/ictv-reports/ictv_9th_report/dsdna-viruses-2011/w/dsdna_viruses/93/adenoviridae
2. ICTV: Herpesviridae https://talk.ictvonline.org/ictv-reports/ictv_9th_report/dsdna-viruses-2011/w/dsdna_viruses/91/herpesviridae
3. Wikikönyvek: Mikrobiológia/Általános virológia/A vírusok szaporodása https://tinyurl.hu/S6Lv/
4. Daganatok.hu: Hibák a sejtciklusban - a tumorsejtek kialakulása http://daganatok.hu/mi-a-rak/hibak-a-sejtciklusban-a-tumorsejtek-kialakulasa
5. Fazekas, H.: A vírusok szaporodása (vírusreplikáció) https://docplayer.hu/68610762-A-virusok-szaporodasa-virusreplikacio.html
6. Pap M.: Onkolítikus virus indukált génexpressziós változások https://szkk.pte.hu/hu/kutatocsoportok/tarsult_tagok/jelatviteli_kutatocsoport
7. Tóth, Zs.: Mitózis, meiózis http://semmelweis.hu/anatomia/files/2018/09/Mit%C3%B3zis-meiozis-TZs.pdf
Képjegyzék:
1. Átrajzolt ábra: Kaufman, H.L.; Kohlhapp, F.J.; Zloza, A. (2015): Oncolytic viruses: a new class of immunotherapy drugs. Nat Rev Drug Discov. 14(9):642-62
2. Saját készítésű
3. Átrajzolt ábra: Huang, H.; Liu, Y.; Liao, W.; Cao, Y.; Liu, Q.; Guo Y.; Lu, Y.; Xie, Z. (2019): Oncolytic adenovirus programmed by synthetic gen circuit for cancer immunotherapy. Nat Commun. 10(1):4801 https://www.nature.com/articles/s41467-019-12794-2