Tumorterápia onkolítikus vírusokkal |
Contents
Bevezetés
A rák az egyik fő halálozási ok világszerte. Az orvostudomány területén óriási fejlődések történtek, de ennek ellenére még mindig jelentős a rákos megbetegedések száma. A hagyományos kemo-, és sugárterápia számos mellékhatással rendelkezik. Ennek köszönhetően megkezdődött olyan terápiák keresése is amelyek, kifejezetten a tumorsejteket károsítják, a szervezet sejtjeit érintetlenül hagyva. A vírus onkoterápia is ígéretes módszernek bizonyult, számos olyan vírust azonosítottak, melyek rákellenes hatással bírnak. A tumorsejtek jobb megismerésével és a biotechnológia, virológia fejlődésével megvalósíthatóvá vált a vírusok tervezése, alakítása (OV), mellyel növelhető lett az onkolítikus aktivitásuk és a tumorsejt szelektivitásuk. Folyamatos kutatások folynak az onkolítikus vírusok megfelelő használatára, megismerésére.
Története
A tumorok onkolítikus vírusokkal való kezelésének gondolata 1950-ben jelent meg. Ekkor fejlesztették ki a daganatos szövet-, illetve rágcsáló modelleket, és rákos emberek sokaságán tesztelték a szennyezett onkolítikus készítmények hatásást. Ennek eredménye az esetek többségében az volt, hogy az immunrendszer eliminálta a vírusokat, ám elenyésző számban, és főleg a gyenge immunrendszerű emberekben mégis megállt a daganat fejlődése. Itt a problémát a vírus továbbterjedése okozta az egészséges szövetekre. Az 1970-es években a tumoros megbetegedések ezen módszerekkel való visszaszorításának kutatása alábbhagyott. (Russell és mtársai, 2012) Az onkolítikus viroterápia modern korszaka az 1990-es évek elején kezdődött, mikor egy kutatás során kiderült,hogy egy mutáns, legyengített Herpes Simplex vírus hatással van egy rágcsáló agydaganatos sejtjeire. Ez volt az első módosított, mesterséges vírus, melynek sikere új kapukat nyitott meg a tudomány számára. Azóta számos vírustörzset használnak fel hasonló célokra, és rengeteg cikk, valamint kutatás született a témával kapcsolatban. (Martuza és mtársai, 1991) A 2000-es évek elején számos daganatos megbetegedés kutatása során jártak már sikerrel szövettenyészeteken és állatmodelleken onkolítikus vírusok használatával. Példa erre a bél tumor állatmodellben adenovírus által bejuttatott TRAIL-gén mely a tumor regressziójához vezetett. (Mohr és mtársai, 2004) Ugyanígy onkolítikus adenovírussal a hasnyálmirigy rák növekedésének gátlása, és áttétképzés gátlása is sikerrel járt már több állatmodellen. (Sunamura és mtársai, 2004) (Noro és mtársai, 2004) Ezen kívül a metsasztázisos melanóma kezelésére is alkalmaznak onkolítikus vírusokat. Cutan,subcutan és nyirokcsomó áttéteknél módosított Herpes Simlex vírust juttatnak be a szervezetbe intratumorálisan. A kezelésnek jelentős intralokális és immun serkentő hatása van, mely klinikai kutatások során monoterápiásan és immunterápiával kombinálva is remek eredményeket mutat. (Baltás E. és mtársai, 2019)
Vírustörzsek
Adenovírusok
Az Adenoviridae családba tartozó, nagyon ellenálló vírusokat sok esetben használják a tumorok elleni küzdelemben onkolítikus hatásuk miatt. A család tagjai lineáris duplaszálú DNS-sel rendelkeznek tehát a Baltimore I-es csoportba sorolhatóak. Tüneteik különfélék lehetnek: például az Aviadenovirus betegségei, amelyek madarakat fertőznek, máj- és, vesegyulladást, valamint zuzógyomor eróziót okoznak. A tumorsejtek elleni használatukra vonatkozóan számos kutatás folyik.
Yuwei Li ás munkatársainak tanulmánya szerint (Li és mtsai, 2020) az Adenovírusok képesek kifejezetten a májrákot támadni.Müködését tekintve az egyik lehetőség, hogy az Adenovírus a replikációs génje módosításával támadja a tumort, ehhez azonban törölnünk kell az E1A vagy E1B gént a vírusból. Az ONYX-015 egy olyan manipulált adenovírus, amelyből az E1B már törölve lett. Az I és II-es típusú klinikai vizsgálatokban az ONYX-015 intravénás vagy intratumorális injekciónál nem mutattak ki toxikus határértéket és biztonságosnak bizonyult használata. Másik lehetőség a májrák sejt receptorainak megcélzása egy módosított adenovirus kapsziddal.
Herpesz simplex:
A Herpesviridae család tagja a Herpes simplex vírus. Lineáris, duplaszálú DNS-sel rendelkeznek, rövid reprodukciós ciklusra képesek. Jellemző rájuk, hogy integrálódnak a DNS-be, így aki egyszer megfertőződik vele örökre fertőzött marad. Onkogenitásuk miatt gyakran használják őket is a tumorterépia egyes területein. A HSV-1 mutációval való megváltoztatása a vírus replikációs képességét is befolyásolja, ezek hatással vannak az immunsejtekre is, fokozzák azok működését, így hatva a tumorra. Hatásosak lehetnek a glioma, melanóma, vastagbél-, prosztata-, petefészek- és hasnyálmirigyrák ellen. (VARGHESE, S., RABKIN, S, 2002) Lehetséges használatokra folyamatosan folynak a klinikai tesztek. Jelentős előrelépések történtek ezen a kutatási területen, de még mindig számos nehézséggel és kérdéssel állunk szemben. Kutatások (DÓSA, 2016. 15) megállapították, hogy „a 3D környezetben növesztett tumorsejtek sokkal ellenállóbbak a virális onkoterápiával szemben, beleértve a HSV-1 és adenovírusok által közvetített onkolítikus terápiákat, mint azok a daganatsejtek, melyek 2D környezetben tenyésznek”
Reovírusok:
A Reoviridae családba tartozó betegségek általában emésztő és légzőrendszeri tüneteket okoznak. Baltimore III-as csoportba sorolhatóak, virális transzkriptáz enzimüket hordozzák magukkal. Tanulmányok szerint a reovírusokat hatékonyan lehet beinjektálni a véráramba, így a vírus a rákos sejtek elpusztítása mellett, immunválaszt is kivált, amely elősegítheti a további rákos sejtek eltávolítását. A jövőt tekintve a kutatási irány jelentős előrelépést jelenthet a rákkezelés kifejlesztése terén. Szintén kutatások irányulnak arra is, hogy például az orthoreovirusok (reovírus család) agydaganat esetében is hatékonyak lehetnek, felvetve, hogy képesek átjutni a vér-agy gáton. (STARR, 2018)
Tumor lokalizálás
A rákos betegségek terápiás kezelése során az egyik legfontosabb és legnehezebb feladat a tumorsejtek megkülönböztetése a normál sejtektől. Az onkolítikus vírusok genetikai állományuk módosítását követően, legyengítve kerülnek a szervezetbe, így ha normál sejtekbe jutnak, azokban aktiválják az immunválaszt, és a sejt eliminálja. Ez a vírusra adott sejtválasz a mutálódott tumor sejtekben nem található meg, ezért ellenállás sincs a vírusfertőzéssel szemben. (Megjegyzendő, hogy az ilyen terápiák során az immunszupresszív állapotban lévő betegek jobban reagálnak a kezelésre, mint az ép immunrendszerűek.)(Russell és mtársai, 2012) A daganatos sejtek minél inkább szelektív megcélzása elősegíti a vírus normál sejtekre kifejtett citopatogenikus hatásait, és felesleges immunválaszok csökkentését is. (Jhawar és mtársai, 2017)
|
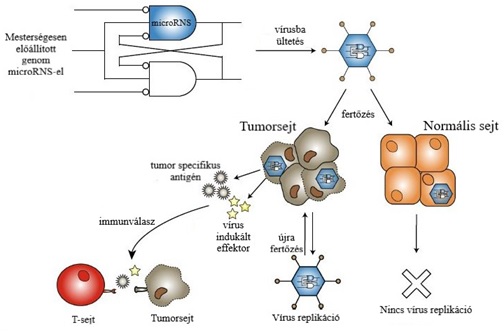
1.kép: RÉKA TÖLTSD KI!!! |
Onkolítikus vírusok természetes tumor lokalizációja:
Különböző vírusok különböző sejtekben, szövetekben szaporodnak, így léteznek olyanok is melyek kifejezetten a daganatos sejteket preferálják. Vannak olyan vírusok, melyek természetes tropizmussal rendelkeznek az daganatos sejtek, normál sejtekkel szemben túlzottan expresszált/rendellenes sejtfelszíni fehérjéi iránt. Ezen kívül a rákos sejtek által okozott egyéb tényezők, immunszupresszív mikrokörnyezet, a megváltozott transzkripciós és jelátviteli utak hibás működése vagy a már említett természetes védekezőképesség hiánya segíti a vírusok helyszínre jutását. Ugyanígy segítséget nyújtanak a rákos sejtek specifikus megcélzásában a sejtek apoptózisát meggátoló fehérjék. Mindezen tényezők nemcsak a tumor helyének meghatározásában, hanem a tumorba jutást is segítik, megkönnyítik.(Jhawar és mtársai, 2017)
Onkolítikus vírusok mesterségesen előidézett tumor lokalizációja:
Ezen eljárások lényege különböző onkolítikus vírusok megtervezése, módosítása genetikailag és szerkezetileg, hogy a tumoros sejtek által kifejezett, egyedi sejtfeületi fehérjéket, specifikusan célozzák meg. Ez kétféleképpen csoportosítható: Külső, szerkezeti tényezők, melyek a lokalizációt és a sejtbe jutást segítik. A vírus felszínén expresszált receptorokat és fehérjéket megváltoztatása nagymértékben segíti az adaptációt a meghatározott sejtek felületén. A külső markerek kémiai módosítása biokompatibilis polimerekre (pl. polietilénglikol (PGE)) az immunrendszerrel szemben biztosít védelmet a vírusnak. Ezt a módszert az áttétes daganatok kezelésénél alkalmazzák, amikor a vírusok a keringés révén jutnak el az egyes tumorcentrumokba. Ezzel a vírus keringésben töltött idejének megsokszorozódása érhető el, minimalizálódik a máj és lép általi szekréció. Ugyanezen hatás elérhető a vírus hordozósejtbe ültetésével. Erre a célra használható normál sejtek primer sejtvonala, vagy mezenchimális sejtek. A legfontosabb, hogy olyan hordozósejtet kell alkalmazni, melyet nem öl meg az onkolítikus vírus mielőtt infiltrálódik a daganatba. (Russell és mtársai, 2012) Belső, a vírus nukleinsavát, genomját módosítva, a vírus replikációja, és annak körülményei befolyásolhatók. A genomba mesterségesen programozhatók promóter régiók, melyek a gének expresszióját, a fehérjék termelését és a sejten belüli szaporodás szabályozzák. Egészséges sejtbe kerülve a promóter régió gátolva van, tumorsejtbe jutva viszont ez a régió aktiválódik, beindítja egy, a tumorsejtekre jellemző faktor, ezáltal vírus replikációt eredményez. Egy másik, hasonló eljárás, hogy a génállományba úgy nevezett microRNS-t ültetnek. Ez egy kicsi, információt nem kódoló RNS szakasz, ami szövetspecifikusan képes expresszálódni. A microRNS a mRNS 3’ végéhez kapcsolódik és meggátolja a transzlációt. Az onkolítikus vírusokat úgy tervezik, hogy egy bizonyos szövetre jellemző microRNS-t hordozzanak, így amikor az a bizonyos szövetbe kerülve kifejeződik, a hasonlóság miatt lebomlik és a vírus képes lesz a reprodukcióra. Ha a nem megfelelő szövetbe kerül a vírus a microRNS gátlása miatt elmarad a fehérjetermelés. (Huang és mtársai, 2019)
Sejtbejutás
|
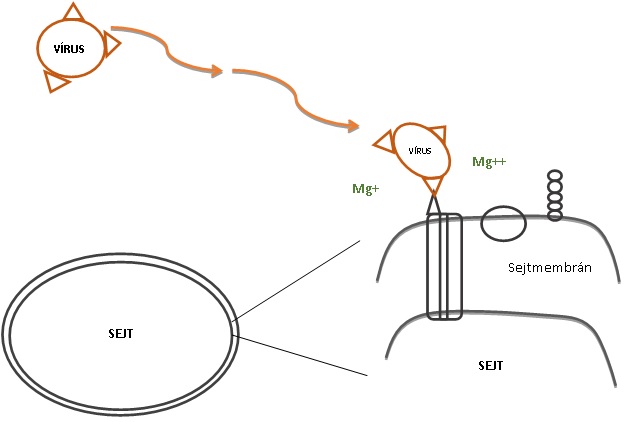
2.kép: Saját kép |
A különböző sejteket más stratégiával fertőznek a vírusok. Az állati eukarióta sejtek illetve az egyszerűbb belső felépítésű prokarióták, sejtmembránnal vannak körülvéve, míg a növényi sejtek sejtfallal is rendelkeznek. Ez a különbség alapvető lesz a vírusfertőzés kialakulásának módja szempontjából. A növényi sejtfalon csak sérülések útján tudnak bejutni a vírusok. A sejtmembránban az életfenntartásához elengedhetetlen csatornák, receptorok és markermolekulák helyezkednek el, amik biztosítják az anyagáramlást és kommunikációt az adott sejtnek. (L.YEAGLE ) Ezeket a receptorokat és csatornákat fogja a vírus kihasználni annak érdekében, hogy bejusson a sejtekbe ahol aztán a önmaga sokszorozódását elindíthatja. A vírusoknak a sokszorozódási mechanizmusa számos egymás utáni lépésből tevődik össze. Talán a legfontosabb, az első lépés, a sejteken való megtapadásuk, az adszorpció. Evolúciós lépésekkel a vírusoknak az antireceptorai, amivel be tudnak kötni a sejtek felszínére, folyamatosan adaptálódtak. Ezek a felszíni fehérjék fogják meghatározni, hogy milyen fajt és azon belül milyen szövetet, sejtet képesek megfertőzni. Egy tanulmány szerint például: a HIV felszíni antireceptora a gp120, csak a CD4 receptorra képes bekötni, a CD4 receptor a humán fehérvérsejtek egy csoportján található meg, így csak azokat képes támadni. (WYATT ÉS TÁRSAI 1998) Az adszorpciót azonban számos tényező képes hátráltatni: -Mozgásukat a környezeti hatásoknak a sodrása fogja befolyásolni, maguktól nem képesek helyváltoztatásra. A sodrás véletlenszerű ütközéseket eredményez, amik által, a vírus találkozik a sejtekkel, azonban nem biztos, hogy az adekvált receptorral ütközik. - Egyes vírusfertőzések során, általában a duplaszálú RNS genomúak pl: Reoviridae-k családba tartozó vírusok esetében, kiválthatnak sejtszinten való interferon termelést, ha az adott vírus nem rejti el a genomját kellő kép a sejtben való sokszorozódása során. (BECK, 2013) Az interferon (IFN) egy jelzővegyület a többi sejt számára, ami a felszíni receptoraik számának csökkenését fogja eredményezni, így kevésbé kitettek a fertőzésnek, rezisztensebbek a vírusra nézve. Ez a folyamat „up and down” regulációval zajlik (MARAMOROSCH, J. SHATKIN 1964) . -Mind a receptor mind az antireceptor negatív töltetű, lévén fehérjéből épülnek fel, és ez, taszítást fog eredményezni. Ezt a taszítást a környezetükben lévő kationok tudják semlegesíteni. (MEDVECZKY ÉS TÁRSAI) Ha mind az ütközés mind a töltés megfelelő, a vírusok irreverzibilis antireceptor-receptor kapcsolatot tudnak kialakítani. Miután a vírusok sikeresen rögzültek a sejtek felszínén, a genetikai anyagukat, genomjukat be kell juttatniuk a sejt belsejébe a sokszorozódás érdekében, ez a folyamat a penetráció. Onkogén vírusok, mint a többi eukarióta sejtet támadó vírusok a sejtmembránon keresztül, két különböző képen juttatják be a genomjukat:
1. endocitózis révén az egész vírus bejut a citoplazmába és egy vakuólumba kerül. Ezt a folyamatot nevezik viropexisnek.
2. fúzió során pedig a burkos vírusok peplonja fuzionál a sejtmembránnal és a benne található kapszid, bekerül a citoplazmába.
Fertőzés
A sejteken belül a DNS állomány folyamatosan ellenőrzés alatt áll, a hibák elkerlése végett. Sejtosztódás ideje alatt főleg a G1/S, és a G2/M átmenetben . A tumorsejtek kialakulásához, a DNS-ben kialakult és ki nem javított olyan hibák vezetnek, amelyek az onkogénekben, vagy közel hozzájuk történnek. Ezek a génszakaszok felelnek a normális osztódási folyamatokért, ha itt hiba történik, a sejt önszabályozás és hibajavítás nélkül kezd el nagy ütemben osztódni. Sok esetben, megváltoznak a külső felszínen lévő sejtmarkerek, amik által az immunrendszer felismeri a hibás osztódást és fellép ellenük, azonban sajnos sok esetben ez nem történik meg. Számos tumorképző vírus, az osztódásukhoz, beépítik a genomjukat a gazdasejtek genomjába, és azoknak a természetes másolásával érik el a saját genomjuk másolását, ez által a sokszorozódásukat. Ezeknek a vírusoknak, a mellett, hogy osztódó sejtekre van szükségük, sokszor az onkogénekhez közel építik be genomjukat és gátolják meg a DNS másolásnak normális leállását, így sejtburjánzást eredményeznek. Ezek a vírusok rendszerint a Baltimore 1-s típusba sorolt duplaszálú DNS-el rendelkezők. Ilyenek a Papilloma, Polyoma, Adeno, Herpes, Pox, és Asfarviridae családba tartozó vírusok, utóbbi kettő nem épül be a sejtmagba, rendelkezik saját enzimrendszerrel. (E. CHIOCCA 2002) Ezek a vírusok általában jóindulatú daganatokat eredményeznek, azonban, átcsaphatnak, rosszindulatúvá ezért kell különös figyelmet fordítani rájuk.
Hatásmechanizmus
|
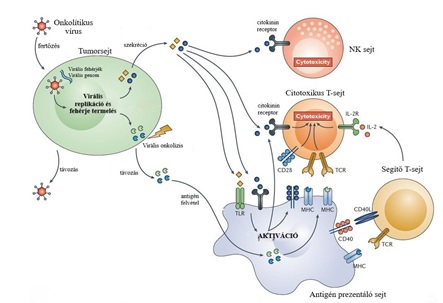
3.kép: RÉKA TÖLTSD KI!!! |
Két fő mechanizmusa a tumorsejtekre gyakorolt közvetlen sejtlízis, és indirekt módón a tumorsejt közelében az immunfaktorok számának növekedése, a környezet megváltoztatása. A közvetlen sejtlízis több módon is bekövetkezhet: Egyes vírusok a sejtben való szaporodás és kiszabadulás után, a sejt erőforrásait kihasználva okozzák a sejtek pusztulását. Mások speciális, a genomjukba épített primerek segítségével olyan enzimet termeltetnek a sejttel, mely a DNS-be beépülendő timint más monofoszfátokká alakítják, így a DNS lánc zárásához, és sejthalálhoz vezetnek. De léteznek „öngyilkos” géneket hordozó vírusok is, melyek a sejt apoptózisának megindulásához szükséges fehérjéket termelnek (TNF (tumor nekrózis faktor) és TRAIL (TNF-el kapcsolatos apoptózis faktor) proapoptótikus molekulák). Ezek az „öngyilkos” gének képesek olyan fehérjéket is kifejezni, melyek hatására a sejt hajlamosabb lesz felvenni a szisztémás keringésből a gyógyszereket, esetleg képesek bizonyos elővegyületet gyógyszerré alakítani, így javítva a terápia hatékonyságát.(Jhawar és mtársai, 2017) Az indirekt immunhatásban fontos szerepet játszik a természetes és az adaptív immunitás is. A daganatos sejtekben az onkolítikus vírusok által előidézett sejthalál során tumor asszociált antigének, a tumorra jellemző molekulák, fehérjék, szöveti elemek szabadulnak fel. Ennek hatására aktiválódnak az NK sejtek, a citotoxikus T-sejtek és antigén prezentáló sejtek, melyek aktiválják az immunrendszer további részeit is. Ugyanezen reakció kiváltható akkor is, ha géntechnológiával módosított genomú vírus jut a tumorsejtbe, és azok a szervezet védelmét aktiváló citokinineket, kemokineket, és más immunrendszert stimuláló molekulákat termelnek, megváltoztatják a sejtek mikrokörnyezetét. Mindezek hatására gyulladás keletkezik, a szervezet hatékonyan képes fellépni nemcsak a megjelölt, de azok környezetében található daganatos sejtek ellen is. Vannak olyan onkolítikus vírusok melyek a tumorsejtek környéki érrendszert célozzák meg, a tumor elveszti a vérellátását, ami sejthalálhoz vezet. Az így kialakított vírusok által expresszált anti-vaszkuláris endoteliális növekedési faktor és vaszkuláris endoteliális növekedési receptor semlegesíti az angiogenezis faktorait és megakadályozza azt. (Choi és mtársai, 2016)
Felhasználás
Egyes kutatók elkezdték a tumort képző vjrusokat tanulmányozni, annak reményében,hogy a daganatos elváltozások kezelésére is alkalmasak lehetnek. A vírusokat, mint vektorokat, fel lehet használni célzottan, különböző sejtek fertőzésére, majd a célsejtek osztódásának megállítására. Ehhez azonban a genomjukat a megfelelő módon meg kell változtatni, hogy a sejteket belülről legyen képes befolyásolni. - Kifejlesztettek egy HSV-1 (herpes simplex)-ből genetikailag módosított KTR27-fehérjét amit, ha lokális tetraciklin mellett adnak be, csökkenti a tumor sejtek növekedését. Egérben növesztett nagysejtes humán tüdőrák ellen alkalmazták ezt az eljárást és sikeresnek is bizonyult, azonban további kutatások szükségesek. (FENG YAO ÉS TÁRSAI 2010) - Kutatások folynak, a glioblastoma multiforme, vírusok alkalmazásával történő kezelésére vonatkozóan is, ami egy igen agresszív és az egyik leggyakoribb idegrendszeri daganat. Hatástalanított MTH-68/H vírust alkalmaznak amely apoptózist vált ki. Sajnos a sejtvonalak érzékenysége változó, a probléma áthidalását még kutatják. (PAP) Szintén erre a célra kutatnak egy HSV-1 típusú (dlsptk) módosított vírust is . (RL MARTUZA ÉS TÁRSAI 1991) - A SCID kezelésésre 1990-ben alkalmaztak retrovírussal génterápiát sikeresen, a további esetekben leukémia jelentkezett, ezért még finomítják a beavatkozást. - Sikeresen kezeltek egy thalassaemiában szenvedő beteget (a szervezet nem képes normális hemoglobint előállítani) lentivírussal, így nem kellett transzfúzióra járnia a továbbiakban. -Duchenne-féle disztrófiánál adeno-asszociált vírusokat vetnek be, amelyek segítségével működő fehérjék termelését érték el. Ez a 19.-kromoszómákon hat. Ezeket a vírusokat tanulmányozzák a Parkinson-kór kezelésére is, továbbá öröklődő vakság esetleges megoldása érdekében. Ezekből az esetekből is láthatjuk, hogy a jövő kutatási vonalának egy nagyon jelentős hányadát a víruskutatás teszi ki, mivel ígéretesnek bizonyul a kártékony tulajdonságaik jóra való fordításának megoldása.
Jövő
Egyre gyakrabban alkalmazzák a szokásos terápiák (kemo- /sugár-/immunterápia) és az onkolítikus vírus terápia kombinációját. Klinikai adatok, és kutatások is mutatják, hogy ez a módszer javíthatja a terápia során kiváltott választ, hatékonyabb lesz általa a kezelés. Az egyik legígéretesebb, és legnagyobb jövő előtt álló ilyen kombináció az onkolítikus vírusok és az immunrendszer szinergizmusa, mely során a vírus tumorellenes immunválaszt indukál a szervezetben. (Choi és mtársai, 2016) Természetesen felmerül ezen módszerek kockázatának a kérdése is. A kezelt betegről átterjedhet-e más élőlényre a vírus? Mutációk során vissza nyerheti-e a patogén hatását a legyengített kórokozó, okozhat-e így gondot a zservezetben? Milyen hatása van ezen terápiának hosszú távon? Az onkolítikus vírusok alkalmazása a tumoros megbetegedések ellen, egy viszonylag új, de annál érdekesebb, reményt adó, sok kérdést felvető terület, mely nagy jövő előtt áll az emberi orvoslásban.
Források
Irodalomjegyzék:
1. Dr. DÓSA Sándor (2016): HERPES SIMPLEX-1 LÁTENCIA VIZSGÁLATA IN VIVO ÉS IN VITRO MÓDSZEREK SEGÍTSÉGÉVEL, SZTE Orvosi Mikrobiológiai és Immunbiológiai Intézet, Interdiszciplináris Orvostudományok Doktori Iskola, Szeged, Ph.D. értekezés tézisei http://doktori.bibl.u-szeged.hu/3175/13/PhD_Thesis_fuzet_HUN_Dosa_Sandor.pdf
2. STARR, Michelle (2018): This Incredible Virus Attacks Brain Cancer And Actually Boosts Our Immune System, Science Alert, 4 JANUARY 2018, https://www.sciencealert.com/mammalian-orthoreovirus-brain-cancer-immune-system-trial
3. Yuwei LI, Yinan SHEN, Ronghua ZHAO, Ismael SAMUDIO, William JIA, Xueli BAI, Tingbo LIANG (2020): Oncolytic virotherapy in hepato‐bilio‐pancreatic cancer: The key to breaking the log jam?, Cancer Medicine, 04 March 2020 https://doi.org/10.1002/cam4.2949
4. VARGHESE, S., RABKIN, S. (2002): Oncolytic herpes simplex virus vectors for cancer virotherapy. Cancer Gene Ther 9, 967–978. https://doi.org/10.1038/sj.cgt.7700537, https://www.nature.com/articles/7700537
5. Ny.F. Agrártudomány letöltés 04.06 http://www.nyf.hu/agrtud/sites/www.nyf.hu.agrtud/files/segedletek/Segedlet%20a%20Novenytan%20c.%20tantargyhoz%20I..pdf
6. PHILIPL.YEAGLE Department of Biochemistry, State University of New York at Buffalo, Buffalo, New York 14214, USA https://www.fasebj.org/doi/pdf/10.1096/fasebj.3.7.2469614
7. RICHARD WYATT, PETER D. KWONG, ELIZABETH DESJARDINS, RAYMOND W. SWEET, JAMES ROBINSON, WAYNE A. HENDRICKSON & JOSEPH G. SODROSKI Nature Published: 18 June 1998 The antigenic structure of the HIV gp120 envelope glycoprotein https://www.nature.com/articles/31514
8. BECK ZOLTÁN Az orvosi mikrobiológia tankönyve 2. fejezet - 2.ÁLTALÁNOS ORVOSI MIKROBIOLÓGIA A vírusok – Általános virológia Medicina Könyvkiadó Zrt. Kiadás éve 2012., 2013 https://regi.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_Mikrobiologia/ch02.html#id512115
9. KARL MARAMOROSCH, AARON J. SHATKIN Advances in Virus Research Sience direct Volume 10, 1964, Pages 1-38 https://www.sciencedirect.com/science/article/pii/S0065352708606958
10. DR. MEDVECZKY ISTVÁN, DR. RUSVAI MIKLÓS, DR. VARGA JÁNOS, DR. TUBOLY SÁNDOR Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia 3. fejezet - Virológia Mezőgazda Kiadó Kiadás Éve: 2011 https://regi.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_521_Allatorvosi_jarvanytan1/ch03.html#id576229
11. HENRIK FAZEKAS PPT sz.n letöltés: 04.09 https://docplayer.hu/68610762-A-virusok-szaporodasa-virusreplikacio.html
12. DR. TÓTH ZSUZSANNA Semmelweis Egyetem, Anatómiai, Szövet -és Fejlődéstani Intézet pdf letöltés 04.06 http://semmelweis.hu/anatomia/files/2018/09/Mit%C3%B3zis-meiozis-TZs.pdf
13. E. ANTONIO CHIOCCA Nature Published: 01 December 2002 https://www.nature.com/articles/nrc948
14. FENG YAO, NAO MURAKAMI, OLIVER BLEIZIFFER, PENGWEI ZHANG, NATALI V. AKHRAMEYEVA, XIMING XU, RICHARD BRANS Journal of virology Aug. 2010 Department of Surgery, BRI Cancer Center, Brigham and Women’s Hospital, andHarvard Medical School, Boston, Massachusetts 02115Received 12 January 2010/Accepted 18 May 2010 https://jvi.asm.org/content/84/16/8163.short
15. DR. M.D., PH.D. PAP MARIANNA PTE Jelátviteli kutatócsoport Kutatócsoport Vezető https://szkk.pte.hu/hu/kutatocsoportok/tarsult_tagok/jelatviteli_kutatocsoport
16. RL MARTUZA, A MALICK, JM MARKERT, KL RUFFNER, DM COEN Molecular Neurogenetics Laboratory, Harvard Medical School, Massachusetts General Hospital-East, Charlestown 02129.
17. Science 10 May 1991: Vol. 252, Issue 5007, pp. 854-856 DOI: 10.1126/science.1851332 https://science.sciencemag.org/content/252/5007/854
18. Jhawar, S. R.; Thandoni, A.; Bommareddy, P. K.; Hassan, S.; Kohlhapp, F. J.; Goyal, S.; Schenkel, J. M.; Silk, A. W. and Zloza. A. (2017) Oncolytic Viruses—Natural and Genetically Engineered Cancer Immunotherapies, Frontiers in Oncology (PubMed: 28955655) https://www.frontiersin.org/articles/10.3389/fonc.2017.00202/full
19. Russell, S. J.;Peng, KW.; Bell, J. C. (2012) Oncolytic virotherapy, Nature Biotechnology
(PubMed: 22781695)
https://www.nature.com/articles/nbt.2287
20. Huang, H.; Liu, Y.; Liao, W.; Cao, Y.; Liu, Q.; Guo Y.; Lu, Y. and Xie, Z. (2019) Oncolytic adenovirus programmed by synthetic gen circuit for cancer immunotherapy, Nature Communications (PubMEd: 31641136) https://www.nature.com/articles/s41467-019-12794-2
21. Sasso, E.; Froechlich, G.; Cotugno, G.; D’Alise, A. M.; Gentile, C.; Bignone, V.; De Lucia, M.; Petrovic, B.; Campadelli-Fiume, G.; Scarselli, E.; Nicosia, A. and Zambrano, N. (2020) Replicative conditioning of Herpes Simplex type 1 virus by Survivin promoter, combined to ERBB2 retargeting improves tumor cell-restricted oncolysis, Scientific Reports (PubMed: 32152425) https://www.nature.com/articles/s41598-020-61275-w
22. Martuza, R. L.; Malick, A.; Markert, J. M.; Ruffner, K. L.; and Coen D. M. (1991) Experimental therapy of human glioma by means of genetically engineered virus mutant, Science Vol.252, pp. 854-856 (PubMed: 1851332) https://science.sciencemag.org/content/252/5007/854
23. Choi, A. H.; O’Leary, M. P.; Fong, Y.; Chen, N. G. (2016) From Benchtop to Bedside: A Review of Oncolytic Virotherapy, Biomedicines (PubMed: 2853638) https://www.mdpi.com/2227-9059/4/3/18
24. Mohr, A.; Henderson, G.; Dudus, L.; Herrr, I.; Kuerschner, T.; Debatin K. M.; Weiher, H.; Fisher, K. J.; and Zwacka, R. M. (2004) AAV-encoded expression of TRAIL in experimental human c olorectal cancer leads to tumor regression, Gene Therapy (PubMed: 14999225) https://www.nature.com/articles/3302154
25. Sunamura, M.; Hamada, H.; Motoi, F.; Oonuma, M.; Abe, H.; Saitoh, Y.; Hoside, T.; Ottomo, S.; Omura, N. and Matsuno, S. (2004) Oncolytic virotherapy as a novel strategy for pancreatic cancer, Pancreas (PubMed: 15084981) https://journals.lww.com/pancreasjournal/Abstract/2004/04000/Oncolytic_Virotherapy_as_a_Novel_Strategy_for.22.aspx
26. Noro, T.; Miyake, K.; Suzuki-Miyake, N.; Igarashi, T.; Uchida, E.; Misawa, T.; Yamazaki, Y. and Shimida, T. (2004) Adeno-associated viral vector-mediated expression of endostatin inhibits tumor growth and metastasis in an orthotropic pancreatic cancer model in hamsters, Cancer Research (PubMed: 15492274) https://cancerres.aacrjournals.org/content/64/20/7486
27. Baltás E.; Kis E.; Korom I.; Németh I.; Varga A.; Varga E.; Ócsai H. és Oláh J. (2019) Új diagnosztikai és kezelési eljárások a dermatoonkológiában, Bőrgyógyászati és Verneológiai szemle 95.évf. 53.-58.o. DOI: 10.7188/bvsz.2019.95.2.4
Internetes források:
3. https://hu.wikipedia.org/wiki/V%C3%ADrus
4. https://hu.wikipedia.org/wiki/Reoviridae
6. Daganatok.hu http://daganatok.hu/mi-a-rak/hibak-a-sejtciklusban-a-tumorsejtek-kialakulasa