Endokrin diszruptorok szerepe: a ZEA ismert hatásai
Contents
Bevezetés:
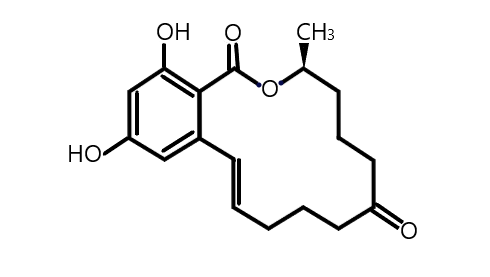
A Zearalenon (1. ábra) egy olyan mikotoxin, melyet a Fusarium nemzetségbe tartozó gombák termelnek, amelyek valószínűsíthetően a legelterjedtebb gombatoxin-termelő fajok Amerika, Európa és Ázsia mérsékelt övi éghajlatain (Gajecki, 2002). Egyes esetekben együtt termelődik más mikotoxinokkal, melyre a leggyakoribb példák a T-2 toxin, HT-2 toxin és deoxynivalenol. Leginkább a F. graminearum, F. equiseti és F. cerealis fajokat lehet kiemelni (Zhang és mtsai, 2018). Leggyakrabban a kukoricát és a búzát szennyezi be, de a legtöbb gabonaféléből kimutatták már. Legjobban a hideg és nedves időjárás kedvez neki, de a világ eltérő éghajlatú tájain is széleskörűen elterjedt. Endokrin diszruptor, hiszen képes a szervezet hormonális működésébe beleszólni és ezáltal a szervezetre nemkívánt, káros hatásokat kifejteni. Az egészségre gyakorolt toxikus hatásainak oka, hogy a molekula és metabolitjainak (melyek közül a legjelentősebbek az α- és β-zearalenol) térszerkezete hasonlít az ösztrogén térszerkezetéhez, emiatt könnyen illeszkednek a szervezet ösztrogén-receptoraiba, így a xenoösztrogének közé sorolhatók (Fitzpatrick és mtsai, 1989). A vegyületnek relatíve alacsony az akut toxicitása, egerekben végzett kísérleteket követőenLD50-es értékét 500 mg/kg-ra becsülték (Ouanes és mtsai, 2003). Ennek ellenére nagy veszélyt jelenthet az emberekre és a gabonaféléket fogyasztó haszonállatokra egyaránt, de vannak olyan fajok, melyek az átlagosnál jóval fogékonyabbak, például a sertés. A kitettség mértékében a kor és a nem is szerepet játszhat, a legnagyobb kárt a fiatal nőstény egyedekben tehet. A legfőbb hatásai közé tartoznak az immunszuppreszió, hímekben a tesztoszteronszint csökkenése, így a csökkent spermatogenezis, illetve nőstényekben az embriók súlyának és túlélési arányuknak csökkenése, vulvovaginitis és a tejmennyiség csökkenése, vagy a tej retenciója (Minervini és mtsa, 2008). Ezeken kívül még számos egészségkárosító hatása ismert, melyek miatt az újabb és hatékonyabb detoxifikációs módszerek kikísérletezése egyre sürgősebb lett. Endokrin diszruptorokból (ED) sokat ismerünk, de valószínűleg ez csak egy töredéke az összesnek, ugyanis rendkívül sok helyről szármozhatnak. Létrejöhetnek természeti folyamatok során, gombák, növények, állatok által. A modern ipar is jelentős forrása, mivel minden új anyag, melléktermék és ezek kisebb-nagyobb átalakulásával keletkezett molekula is lehetséges ED. A természetben előforduló anyagok közül talán az arzén a legismertebb, amit szennyezett ivóvízzel lehet felvenni. Mérgezése súlyos tünetekkel jár, akár halálos is lehet. Számos növény termel ösztrogén hatású molekulákat, amiket fitoösztrogéneknek hívunk. Például a lencse, a bab, kalászosok, a len- és szezámmag, valamint a komló is tartalmaz ilyen anyagokat. A mesterséges ED-k közé a permetező-, rovarirtó szerek (DDT), a műanyag gyártáshoz köthető anyagok (BPA,ftalátok) és oldószerek tartoznak (Gergely J., 2017). Ezek a gyors fejlődés következtében, legtöbbször csak a természet károsítása után kerülnek felfedezésre.
|
1. ábra: A ZEA szerkezete |
Előfordulás:
A vegyület főként a gabonafélékben található. Zinedine és mtsai (2007) szerint elsősorban ezekben és a közvetlenül ezekből készült termékekben mutatható ki, hiszen gyors biotranszformációjának és exkréciójának köszönhetően a hús és tejtermékekben elhanyagolható mértékben jelenik meg, így a takarmányban lévő toxin csak az állat egészségére van hatással, az állati eredetű termékek fogyasztóira nem. Laktáló teheneken végzett kísérlet során kimutatták, hogy a tejben csupán 6,1μg/L mennyiség található, ha 6000mg (12mg/kg-nak megfelelő) mennyiségű ZEA-t juttatnak az állatba orális úton. Ez a mennyiség jóval az országok által küldött mintákban található átlagos mennyiségek fölött van, Európa országaiban például a gabonafélék ZEA tartalma nem haladta meg a 8mg/kg-ot. Szervezeten belüli gyors metabolizációja ellenére a vegyület nagyon stabil, így az élelmiszerek feldolgozása során, őrlés vagy főzés során még magas hőmérsékletek hatására sem bomlik el teljesen. A legfontosabb gabonatermények, amelyekben elterjedhet a kukorica, búza, zab, árpa, rozs és szója. Elterjedtsége függ a környezeti viszonyoktól, általánosan elmondható, hogy gyorsabban terjed hideg és nedves körülmények között. A terményekben főleg aratás előtt szaporodik fel, de mivel megjelenhet aratás után is, így jelenléte nem csupán az időjárástól és az éghajlattól, hanem a megfelelő raktározástól is függ (Zhang és mtsai, 2018). Az éves mennyiségét a termesztési év is befolyásolja, hiszen a különböző növényekben eltérő mértékben szaporodhat. Egyik országból gond nélkül átkerülhet egy másikba a termények szállítása során, így a globális világkereskedelem növekedése nagy részben járul hozzá a mikotoxin világszintű elterjedéséhez. Habár nincs közvetlen bizonyíték arra, hogy globálisan mindenhol jelen van, a legtöbb országban kimutatták már (Zinedine és mtsai, 2007).
A ZEA anyagcseréje:
A zearalenon (ZEA) anyagcseréje a különböző élőlényekben eltérő lehet. A biotranszformációja elsősorban a májban történik (Rogowska és mtsai, 2019). Olsen és mtsai (1981) szerint két ismert anyagcsereúton keresztül következik ez be. Az első során hidroxilációs reakció történik, amely α-, és β-zearalenol (α-, és β-ZOL) kialakulását eredményezi. Ezeket a folymatokat katalizáló enzimek az 3α-, és a 3β-hidroxiszteroid-dehidrogenázok. A második reakcióútnál a ZEA és annak redukált metabolitjai glükuronsavval konjugálódnak. Itt az uridin-difoszfát-glükuronil transzferáz enzim játszik szerepet az átalakulás során.
Prokarióták:
Az elősejtmagvasoknál is megfigyelték a ZEA biotranszformációját. Sertés bélcsatornájában élő bélflóránál , valamint szarvasmarha bendőjében élő bizonyos baktérium fajoknál tapasztalták a ZEA többnyire α-ZOL-lá történő átalakítását (Rogowska és mtsai, 2019).
Eukarióták:
Eukariótáknál az anyagcsere során a gomba által fertőzött növények számos metabolitot képesek előállítani, mint például: zearalenon-14-glükozid, zearalenon-14-szulfát, és zearalenon-16-glükozid (Rogowska és mtsai, 2019).
Háziállatok:
Minervini és mtsai (2008) szerint a bélhámsejtek által felvett ZEA általában vagy helyben az enterocytákban, vagy a hepatocytákban, a májban alakul át. Sertésben legnagyobb részben α-ZOL képződik a hepatikus biotranszformáció során, vagy extrahepatikusan a granulóza sejtekben. Ezzel ellentétben amennyiben a ZEA átalakulása már a bélhámsejtekben megkezdődik, akkor ott sokkal nagyob eséllyel konjugálódik először glükuronsavval. Ezt követően a konjugálódott forma képes kiürülni az epével a vékonybélbe (a duodenumba), ahol az enterocyták által redukálódhatnak szintén elsősorban α-ZOL-lá. A redukált forma innen visszajuthat a keringésbe, majd újra a májban köthet ki. Ezt a ciklust nevezzük entero-hepatikus körforgásnak, ami így megnöveli a toxin szervezetben töltött idejét, ami a különböző szervezetre gyakorolt kedvezőtlen hatások kialakulásának esélyét növeli.
Szarvasmarhában ezzel szemben elsősorban β-ZOL termelődik a májsejtekben és granulóza sejtekben egyaránt (Minervini és mtsai, 2008).
A juh májában lezajló anyagcsere során szintén elsősorban α-ZOL képződik (9), de ezen kívül a vizeletben bizonyos mennyiségben α- és β-ZOL-t is kimutattak (Minervini és mtsai, 2008).
Ember:
Szintén a májban lezajló biotranszfromáció során alakul át a ZEA (Rogowska és mtsai, 2019). A placenta is képes metabolizálni (Huuskonen és mtsai, 2015), valamint emberi Caco-2-sejtekkel végzett kísérletek során kimutatták, hogy ezen sejtek is átalakítják a ZEA-t mindkét ismert anyagcsereúton keresztül. In vivo ezek a metabolitok elsősorban a glükuronidos formában szekretálódnak a vizeletbe (Rogowska és mtsai, 2019).
A ZEA hatásai:
A ZEA és metabolitjai a véráram segítségével eljutnak a szervezet minden pontjára. A toxin egy része a sejtfelszínen található receptorokra köt, másik fele a sejtmembránon keresztül belép a citoplazmába, ösztrogénhez hasonló szerkezetüknek köszönhetően (Nóra M., 2014). Itt, ugyanezen okból, képes ösztrogén receptorokhoz kapcsolódni, ezzel többek között transzkripciós és transzlációs folyamatokat befolyásolni.
Érintett jelpályák:
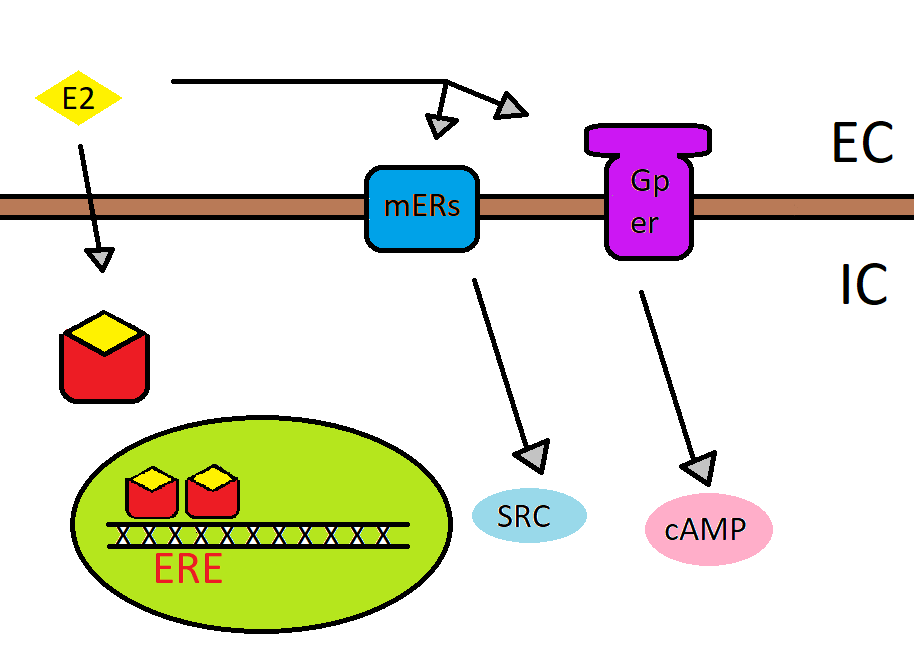
A sejtek felszínén találhatók a G-protein kapcsolt receptorok, amik 7-szer átfúrják a membránt (7-TM). Miután kapcsolódott a ZEA a receptorhoz a G-protein aktiválja a Foszfolipáz-C (PLC) vagy Adenilát-cikláz (AC) enzimet. Hatását további hírvivő moleklák,- inozitol-triszfoszfát (IP3), diacilglicerin (DAG), ciklikus adenozin-monofoszfát (cAMP) -, mennyiségének változtatásával fejti ki (Gergely J., 2017). Mivel ez nem feltétlen az átíródási folyamatokat érinti (2. ábra), ezért ezt ajelátviteli utat, nem genomiális útnak (non-genomic pathway) nevezik. A másodlagos hírvivő molekulák segítségével ez sokkal gyorsabban okoz változásokat a sejtben.
|
2. ábra: A 17ß-ösztradiol receptorokon keresztül kifejtett hatásai. Az ER (piros) aktivált dimerként a transzkripciót szabályozza. Sejtmembránban található receptor (kék) segítségével a tirozin kináz rendszerre hat, aminek helytelen működését rákos sejtek kialakulásával hozták összefüggésbe. G-protein kapcsolt receptoron keresztül pedig a cAMP, egy másodlagos hírvivő molekula szintjét befolyásolja. |
Az ösztrogén receptor:
Az ösztrogén 3 hasonló szerkezetű hormonból áll, az ösztriolból, az ösztradiolból és az ösztronból. Ebből a 17ß-ösztradiol (E2) rendelkezik a legerősebb hatással és receptor affinitással, ezért ezt szokták viszonyítási alapul használni. Ösztrogén receptorokból jelenleg kétfélét különböztetünk meg α és ß típusút (ERα és ERß). ERα többlet a méhben, a placentában, a tejmirigyekben, a központi idegrendszerben, a szív- és érrendszerben, a májban és a csontszövetben található. ERß túlsúly ezzel szemben, a petefészkekre, a herékre, a tobozmirigyre, a pancreasra és a bőrre jellemző. Ez azért fontos, mert a ZEA az ERα-hoz kötődve agonistaként viselkedik, míg ERß-n keverten, hol agonista, hol antagonistaként. Ez változhat a különböző metabolitjainál, ahogy azok erőssége is, például az α-zearalenol ösztrogén-szerű hatás több százszorosa a ZEA-hoz viszonyítva (Bálint B., 2017). Ezzel magyarázható, hogy a különböző szövetek miért reagálnak eltérő módon a toxinra.
Hatása az endokrin rendszerre:
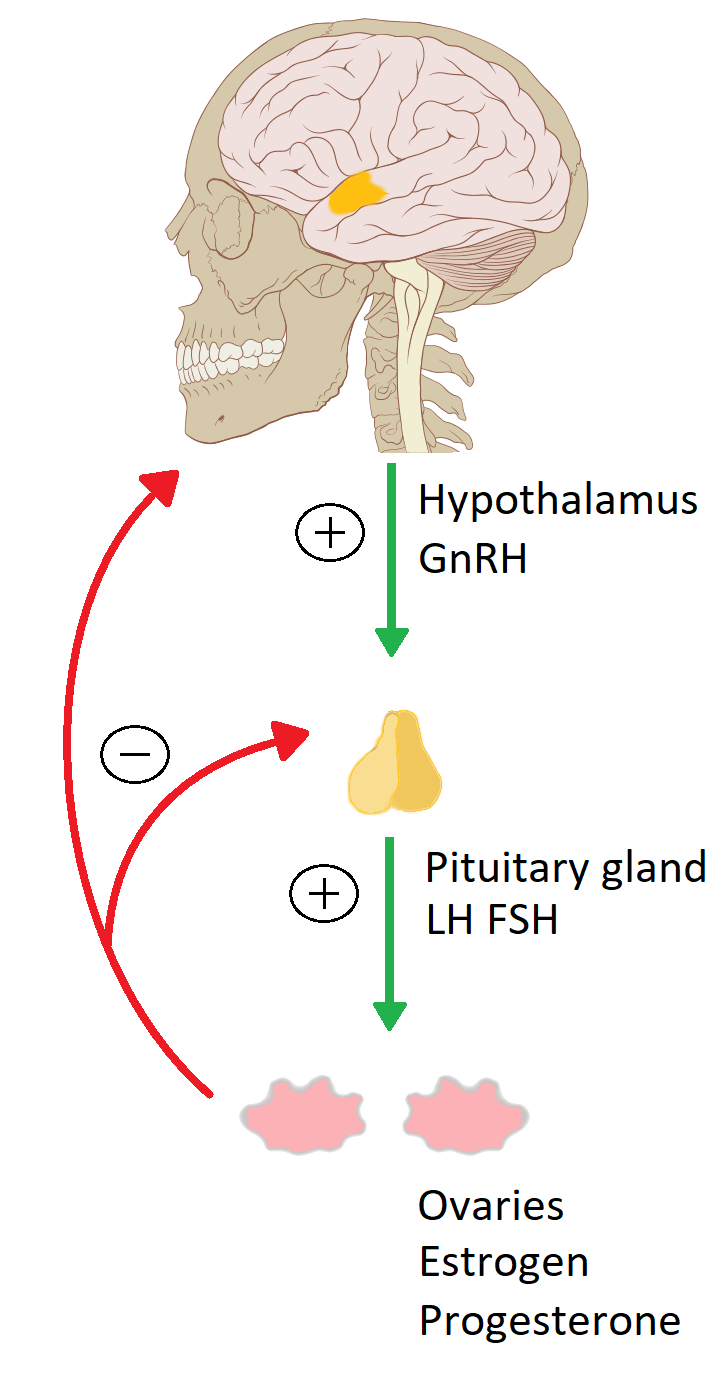
Mivel megnöveli a szervezetben található ösztrogén hormonok mennyiségét ezért az érzékeny szabályozó rendszeren keresztül sok egyéb hormont és receptort fog befolyásolni. Upregulációt okoz az ER-nál és indirekt módon a pajzsmirigy- (TR) és progeszteron receptoroknál (PR) is. A negatív feedback rendszer útján (3. ábra) megzavarja a hypothalamus és a hypophysis hormon termelését is, ami csökkenti a LH, így a progeszteron, de még a TSH mennyiségét is (Gergely J., 2017).
|
3. ábra: A HPG axis a női ivarban. A hipotalamusz-agyalapi mirigy-gonádok alkotta tengely a nemi hormonok szabályozásáért felelős képleteket és egymással való kapcsolatukat foglalja össze. A hipotalamusz és az agyalapi mirigy hormonjai serkentő hatásúak (zöld), míg az ösztrogén és progeszteron negatív visszacsatolással gátolja azok túlzott termelődését (piros). Megkülönböztetnek még HPT és HPA tengelyt is, ami a pajzsmirigy, valamint a mellékvese hormon szekrécióját befolyásolja. |
Genotoxikus hatása:
Az ösztrogén-receptorok (ER) a szteroid magreceptorok közé tartoznak és 3 részből állnak. Egy ligand-kötő helyből (Ligand Binding Domain), egy DNS-kötő helyből (DNA-BD) és egy változó részből (VD). Megfelelő molekula kapcsolódásakor aktiválódik és hozzákötődik a DNS ERE (Estrogen Responsive Element) szakaszához, ahol kifejti enhancer vagy silencer hatását. A ZEA hatása azonban nem merül ki a transzkripció és transzláció befolyásolásában.
Az osztódásban lévő sejteket megállítja G2/M fázisban, aminek következményeként a sejt képtelen befejezni a mitózist és fehérje-szintézise is gátolva van. Ezt azzal magyarázzák, hogy a DNS-hez kötődött toxint a szervezet nem tudja megfelelően eltávolítani és a hibás javítás eredményeként jönnek létre DNS-fragmentációk és mikronukleuszok (Nóra M., 2014).Emellett növeli a sejtben található szabadgyökök mennyiségét, ami a DNS, a mitokondrium és különböző fehérjék károsodását is okozhatja. A ZEA tehát cito- és genotoxikus hatással is rendelkezik.
Xenoösztrogén hatások:
Mivel az ösztrogén esszenciális a normális nemi működéshez ezért a ZEA hatásának kitett állatok és emberek reprodukciós zavarokat szenvednek el. Elhúzódó ösztruszt vagy anösztruszt, álvemhességet és az emlőmirigyek hypertrófiáját is okozhatja, ami mind a hiperösztrogenizmusnak tudható be. Emberben szerepet játszhat emlődaganat kialakulásában. Emellett a hüvelyben hyperkeratinizációt és az endometriumban kóros burjánzást, adenocarcinomát is indukálhat. In vitro kimutatták, hogy a ZEA serkenti a tumorsejtek proliferációját és csökkenti azok apoptózisát. Szarvasmarhában a terméketlenség mellett direkt módon is visszaveti tejtermelést, ami jelentős gazdasági károkhoz vezethet (Zinedine és mtsai, 2007) . Hím állatokban is okozhat terméketlenséget a tesztoszteron termelés és spermatogenezis mérséklésével, valamint a herék atrófiájával. Bár a baromfik általánosságban érzékenyek a mikotoxinokra, a ZEA-val szemben, főleg a csirkék, közel rezisztensnek mondhatók (Nóra M., 2014). Minervini és mtsai (2008) szerint a legveszélyeztetettebbek a sertések, mivel kis dózisban is jelentősen ront a kanok termékenységén és libidóján. Nőstény süldőkben pedig a péra tájék ödémás duzzanatát, hüvely- esetleg végbél előesést is okozhat. Bizonyos dózisú toxinnak kitett juhokban csökkenhet a termékenység, valamint az ovulációs ráta. Lovakkal végzett tanulmányok során kimutatták, hogy a ZEA hatására a fejlődő tüszők száma megnőtt és ebből lehet következtetni arra, hogy valószínűleg ez a mikotoxin hatással lehet a petefészekre és azon belül is a folliculusok fejlődésére.
Hatásai egyéb szervekben:
A reproduktív szerveken kívül a májban, vesékben, csontokban és a tobozmirigyben is károkat tesz. Patkányokban osteopetrosist okoz, amikor is a csont keménnyé és rideggé válik, így könnyebben eltörik (Bálint B., 2017).A máj méregtelenítő szervként nagy mértékben ki van téve a toxinnak, így ott léziók és carcinomák jelennek meg (Nóra M., 2014). A májkárosodás pedig sebezhetővé teszi a szervezet egyéb anyagok és kórokozók számára.
Mivel az immunrendszer szorosan összefonódik a neuroendokrin rendszerrel, ezért a ZEA erre is hatással van. A thymus atrófiáját okozza, lymphocytákat is képes gátolni a mitózisban, valamint ösztrogén jellege miatt gyulladáscsökkentő, immunszupresszív hatású (Gergely J., 2017).
Hatásai embriókra:
Az agy megfelelő fejlődéséhez elengedhetetlen az ösztrogén és pajzsmirigy hormonok egyensúlya. Fontos szerepük van mielinizáció, idegpályák kialakítása, migráció, differenciálódás, szinapszisok létrejöttének szabályozásában (Bálint B., 2017). Az embrionális agysejtek expresszálnak ERα és Thyroid receptorokat (TR), azonban a hormonok nem csak genomiális úton befolyásolják a fejlődést, például a tiroxin (T4) az astrocytákban aktin polimerizációt idéz elő. A ZEA képes átjutni a placentán és súlyos agykárosodást okozni, ami halvaszületéshez vezet. Az élve született állatok is kisebb súllyal, nem olyan életerősen jönnek a világra. Amikor a ZEA áthatol a vér-agy gáton károsítja azt, így átjárhatóvá válik a kórokozók számára is (Gergely J., 2017). Fiatal állatban a hypothalamus és a hypophisis hypertrófiájával mirigydaganathoz, valamint koránéréshez, korai pubertáshoz vezethet (Bálint B., 2017). Kivételt képeznek egyes rágcsálók (nyúl, tengerimalac, egér és patkány) amikre nincs teratogén hatással, tehát az embriókban nem okoz fejlődési rendellenességet (Nóra M., 2014).
A ZEA neutralizációs módszerei:
Számos módszer létezik a zearalenon, valamint egyéb gombatoxinok semlegesítésére. Ezek között szerepelnek fizikai, kémiai és mikrobiológiai módszerek egyaránt. Emellett fontosnak bizonyulnak a megelőzéses módszerek is. Ide tartoznak a különböző gombaölő szerek használatai, valamint a növények megfelelő gondozása és betakarítása. Sajnos azonban ezek az eljárások nem bizonyultak teljesen hatékonynak a gombatoxinok jelenlétének megszüntetésében (Rogowska és mtsai, 2019).
Fizikai módszerek:
A legtöbb az adszorpció (felületi megkötés) elvén működő eljárásokhoz tartozik, melyek során olyan anyagokat alkalmaznak, amik képesek tartósan megkötni a ZEA-t, vagy más gombatoxinokat. Ide tartoznak például azok a szerves-rektoritok, melyeket különböző kvaterner ammónium-sókkal módosítottak (Sun és mtsai, 2018), vagy azok a természetes zeolitok, amelyek felszínét benzalkónium-kloriddal transzformálták (Rogowska és mtsai, 2019). Ezek mellett gyakran használnak még hőkezelést, mosást és sugárkezelést is (Rogowska és mtsai, 2019).
Kémiai módszerek:
Rogowska és mtsai (2019) írása alapján különböző kémiai vegyületek alkalmazásán alapszik a módszer, mint például nátrium-hipoklorit, vagy hidrogén-peroxid használata. Kimutatták, hogy amennyiben a takarmányt kiegészítjük 2%-ban nátrium-karbonáttal, a ZEA mennyisége jelentősen leredukálódik. Ezeken kívül még használják az ózonnal való kezelést is, ami akár a ZEA teljes mennyiségének lebomlásához vezet.
Mikrobiológia módszerek:
Ezen módszerek előnye az eddigi eljárásokkal szemben, hogy itt nem veszít a kezelt takarmány, élelmiszer a tápértékéből (Rogowska és mtsai, 2019). Erre a célra olyan mikroorganizmusokat használnak fel, amelyek nem termelnek mérgező anyagokat és megkötik vagy lebontják a gombatoxinokat. Rogowska és mtsai (2019) szerint ezek bizonyos baktériumok, vagy meghatározott élesztőgomba fajok. Baktériumok közül leggyakrabban a tejsavbaktériumot használják, ami képes megkötni a ZEA-t a sejtfalával. Az élesztőgombáknál többek között az S. cerevisiae (sörélesztő) fajt alkalmazzák, amely a sejtfalán található β-D-glükánokkal tudja fizikailag megkötni a gombatoxinokat, ezzel hatástalanítva azokat.
Konklúzió:
A ZEA egyre nagyobb mértékű elterjedésének következtében egyre több állat, valamint ember van kitéve a kedvezőtlen hatásainak. Ezen okból kifolyólag fontos, hogy megtegyük a megfelelő óvintézkedéseket, így elsősorban megelőzzük, hogy a különböző gombafajok befertőzzék ültetvényeinket és ennek következtében a ZEA és egyéb gombatoxinok kialakuljanak rajtuk/bennük. Emiatt fontosak a különböző detoxifikáló módszerek is, melyeket folyamatosan fejlesztenek és egyre hatékonyabbnak bizonyulnak a kezelést illetően.
Irodalomjegyzék:
Cikkek:
Bálint B. (2017). Egy ismert mikotoxin, a zearalenon hatása fejlődő kisagyi sejtek ösztrogén és pajzsmirigyhormon receptorfehérjéinek expressziójára. Szakdolgozat, Állatorvostudományi Egyetem, Budapest, 40.
Fitzpatrick, D. W., Picken, C. A., Murphy, L. C., & Buhr, M. M. (1989). Measurement of the relative binding affinity of zearalenone, α-zearalenol and β-zearalenol for uterine and oviduct estrogen receptors in swine, rats and chickens: An indicator of estrogenic potencies. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 94(2), 691–694.
Gajecki M., (2002) Zearalenone-undesirable substances in feed. Polish Journal of Veterinary Sciences, 5(2),117-122.
Huuskonen, P., Auriola, S., & Pasanen, M. (2015). Zearalenone metabolism in human placental subcellular organelles, JEG-3 cells, and recombinant CYP19A1. Placenta, 36(9), 1052–1055.
Jócsák, G. (2017). The effects of bisphenol-A, zearalenone, arsenic and 4- methylbenzylidene camphor alone and in combination on the estrogen- and thyroid hormone receptor expression in developing rat cerebellum. PhD értekezés, Állatorvostudományi Egyetem, Budapest, 139.
Minervini, F., & Dell’Aquila, M. E. (2008). Zearalenone and Reproductive Function in Farm Animals. International Journal of Molecular Sciences, 9(12), 2570–2584.
Nóra M. (2014). A patulin és a zearalenon mikotoxinok által indukált oxidatív stressz folyamatok szabályzása hasadó élesztő sejtekben. PhD értekezés, Pécsi Tudományi Egyetem, 98.
Olsen, M., Pettersson, H., & Kiessling, K.-H. (1981). Reduction of Zearalenone to Zearalenol in Female Rat Liver by 3α-Hydroxysteroid Dehydrogenase. Acta Pharmacologica et Toxicologica, 48(2), 157–161.
Ouanes, Z., Abid, S., Ayed, I., Anane, R., Mobio, T., Creppy, E. E., & Bacha, H. (2003). Induction of micronuclei by Zearalenone in Vero monkey kidney cells and in bone marrow cells of mice: Protective effect of Vitamin E. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 538(1), 63–70.
Rogowska, A., Pomastowski, P., Sagandykova, G., & Buszewski, B. (2019). Zearalenone and its metabolites: Effect on human health, metabolism and neutralisation methods. Toxicon, 162, 46–56.
Sun, Z., Song, A., Wang, B., Wang, G., & Zheng, S. (2018). Adsorption behaviors of aflatoxin B1 and zearalenone by organo-rectorite modified with quaternary ammonium salts. Journal of Molecular Liquids, 264, 645–651.
Zhang, G.-L., Feng, Y.-L., Song, J.-L., & Zhou, X.-S. (2018). Zearalenone: A Mycotoxin With Different Toxic Effect in Domestic and Laboratory Animals’ Granulosa Cells. Frontiers in Genetics, 9, 667.
Zinedine, A., Soriano, J. M., Moltó, J. C., & Mañes, J. (2007). Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone: An oestrogenic mycotoxin. Food and Chemical Toxicology, 45(1), 1–18.
Ábrák:
Saját, Yikrazuul (2009) alapján, 1. ábra: https://en.wikipedia.org/wiki/File:Zearalenone.svg
Saját, Rat Genome Database- Medical College of Wisconsin munkái alapján újrarajzolva, 2.ábra: https://rgd.mcw.edu/rgdweb/pathway/pathwayRecord.html?processType=view&species=Rat&acc_id=PW:0000507
Saját, Dr. Mark Hill és Patrick J. Lynch munkái alapján újrarajzolva, 3.ábra: https://embryology.med.unsw.edu.au/embryology/index.php?title=File:HPG_female_axis.jpg https://hu.wikipedia.org/wiki/Emberi_agy#/media/F%C3%A1jl:Skull_and_brain_normal_human.svg