Contents
Bevezetés:
A Zearalenon, mely szerkezeti képlete az 1. ábrán látható, egy olyan mikotoxin, melyet a Fusarium nemzetségbe tartozó gombák termelnek, amelyek valószínűsíthetően a legelterjedtebb gombatoxin-termelő fajok Amerika, Európa és Ázsia mérsékelt övi éghajlatain. Egyes esetekben együtt termelődik más mikotoxinokkal, melyre a leggyakoribb példák a T-2 toxin, HT-2 toxin és deoxynivalenol. Leginkább a F. graminearum, F. culmorum és F. cerealis fajokat lehet kiemelni. Leggyakrabban a kukoricát és a búzát szennyezi be, de a legtöbb gabonaféléből kimutatták már. Legjobban a hideg és nedves időjárás kedvez neki, de a világ eltérő éghajlatú tájain is széleskörűen elterjedt. Endokrin diszruptor, hiszen képes a szervezet hormonális működésébe beleszólni és ezáltal a szervezetre nemkívánt, káros hatásokat kifejteni. Az egészségre gyakorolt toxikus hatásainak oka, hogy a molekula és metabolitjainak (melyek közül a legjelentősebbek az α- és β-zearalenol) térszerkezete hasonlít az ösztrogén térszerkezetéhez, emiatt könnyen illeszkednek a szervezet ösztrogén-receptoraiba, így a xenoösztrogének közé sorolhatók. A vegyületnek relatíve alacsony az akut toxicitása, egerekben, patkányokban és tengerimalacokban orális, illetve interperitonealis adagolást követően LD50-es értéke 4000-20000 mg/kg körül volt. Ennek ellenérenagy veszélyt jelenthet az emberekre és a gabonaféléket fogyasztó haszonállatokra egyaránt, de vannak olyan fajok, melyek az átlagosnál jóval fogékonyabbak, például a sertés. A kitettség mértékében a kor és a nem is szerepet játszhat, a legnagyobb kárt a fiatal nőstény egyedekben tehet. A legfőbb hatásai közé tartoznak az immunszuppreszió, hímekben a tesztoszteronszint csökkenése, így a csökkent spermatogenezis, illetve nőstényekben az embriók súlyának és túlélési arányuknak csökkenése, vulvovaginitis és a tejmennyiség csökkenése, vagy a tej retenciója. Ezeken kívül még számos egészségkárosító hatása ismert, melyek miatt az újabb és hatékonyabb detoxifikációs módszerek kikísérletezése egyre sürgősebb lett. Endokrin diszruptorokból (ED) sokat ismerünk, de valószínűleg ez csak egy töredéke az összesnek, ugyanis rendkívül sok helyről szármozhatnak. Létrejöhetnek természeti folyamatok során, gombák, növények, állatok által. A modern ipar is jelentős forrása, mivel minden új anyag, melléktermék és ezek kisebb-nagyobb átalakulásával keletkezett molekula is lehetséges ED. A természetben előforduló anyagok közül talán az arzén a legismertebb, amit szennyezett ivóvízzel lehet felvenni. Mérgezése súlyos tünetekkel jár, akár halálos is lehet. Számos növény termel ösztrogén hatású molekulákat, amiket fitoösztrogéneknek hívunk. Például a lencse, a bab, kalászosok, a len- és szezámmag, valamint a komló is tartalmaz ilyen anyagokat. A mesterséges ED-k közé a permetező-, rovarirtó szerek (DDT), a műanyag gyártáshoz köthető anyagok (BPA,ftalátok) és oldószerek tartoznak. Ezek a gyors fejlődés következtében, legtöbbször csak a természet károsítása után kerülnek felfedezésre.
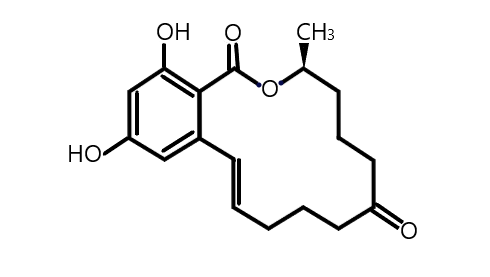 1. ábra: A ZEA szerkezete
1. ábra: A ZEA szerkezete
Előfordulás:
A vegyület főként a gabonafélékben található. Elsősorban ezekben és a közvetlenül ezekből készült termékekben mutatható ki, hiszen gyors biotranszformációjának és exkréciójának köszönhetően a hús és tejtermékekben elhanyagolható mértékben jelenik meg, így a takarmányban lévő toxin csak az állat egészségére van hatással, az állati eredetű termékek fogyasztóira nem. Laktáló teheneken végzett kísérlet során kimutatták, hogy a tejben csupán 6,1μg/L mennyiség található, ha 6000mg (12mg/kg-nak megfelelő) mennyiségű ZEA-t juttatnak az állatba orális úton. Ez a mennyiség jóval az országok által küldött mintákban található átlagos mennyiségek fölött van, Európa országaiban például a gabonafélék ZEA tartalma nem haladta meg a 8mg/kg-ot. Szervezeten belüli gyors metabolizációja ellenére a vegyület nagyon stabil, így az élelmiszerek feldolgozása során, őrlés vagy főzés során még magas hőmérsékletek hatására sem bomlik el teljesen. A legfontosabb gabonatermények, amelyekben elterjedhet a kukorica, búza, zab, árpa, rozs és szója. Elterjedtsége függ a környezeti viszonyoktól, általánosan elmondható, hogy gyorsabban terjed hideg és nedves körülmények között. A terményekben főleg aratás előtt szaporodik fel, de mivel megjelenhet aratás után is, így jelenléte nem csupán az időjárástól és az éghajlattól, hanem a megfelelő raktározástól is függ. Az éves mennyiségét a termesztési év is befolyásolja, hiszen a különböző növényekben eltérő mértékben szaporodhat. Egyik országból gond nélkül átkerülhet egy másikba a termények szállítása során, így a globális világkereskedelem növekedése nagy részben járul hozzá a mikotoxin világszintű elterjedéséhez. Habár nincs közvetlen bizonyíték arra, hogy globálisan mindenhol jelen van, a legtöbb országban kimutatták már.
A ZEA anyagcseréje:
A zearalenon (ZEA) anyagcseréje a különböző élőlényekben eltérő lehet. Elsősorban a májban történik a biotranszformációja (A. Rogowska és mtsai, 2019) két ismert anyagcsereúton keresztül (Olsen és mtsai, 1981). Az első során hidroxilációs reakció történik, amely α-, és β-zearalenol (α-, és β-ZOL) kialakulását eredményezi. Ezeket a folymatokat katalizáló enzimek az 3α-, és a 3β-hidroxiszteroid-dehidrogenázok. A második reakcióútnál a ZEA és annak redukált metabolitjai glükuronsavval konjugálódnak. Itt az uridin-difoszfát-glükuronil transzferáz enzim játszik szerepet az átalakulás során.
Prokarióták:
Az elősejtmagvasoknál is megfigyelték a ZEA biotranszformációját. Sertés bélcsatornájában élő bélflóránál (Kollarczik és mtsai, 1994), valamint szarvasmarha bendőjében élő bizonyos baktérium fajoknál tapasztalták a ZEA többnyire α-ZOL-lá történő átalakítását (Kennedy és mtsai, 1998).
Eukarióták:
Eukariótáknál az anyagcsere során a gomba által fertőzött növények számos metabolitot képesek előállítani, mint például: zearalenon-14-glükozid, zearalenon-14-szulfát, és zearalenon-16-glükozid (A. Rogowska és mtsai, 2019).
Háziállatok:
Ijms és mtsai (évszám) szerint a bélhámsejtek által felvett ZEA általában vagy helyben az enterocytákban, vagy a hepatocytákban, a májban alakul át. Sertésben legnagyobb részben α-ZOL képződik a hepatikus biotranszformáció során (9), vagy extrahepatikusan a granulóza sejtekben (10). Ezzel ellentétben amennyiben a ZEA átalakulása már a bélhámsejtekben megkezdődik, akkor ott sokkal nagyob eséllyel konjugálódik először glükuronsavval. Ezt követően a konjugálódott forma képes kiürülni az epével a vékonybélbe (a duodenumba), ahol az enterocyták által redukálódhatnak szintén elsősorban α-ZOL-lá. A redukált forma innen visszajuthat a keringésbe, majd újra a májban köthet ki. Ezt a ciklust nevezzük entero-hepatikus körforgásnak, ami így megnöveli a toxin szervezetben töltött idejét, ami a különböző szervezetre gyakorolt kedvezőtlen hatások kialakulásának esélyét növeli (8).
Szarvasmarhában ezzel szemben elsősorban β-ZOL termelődik a májsejtekben és granulóza sejtekben egyaránt (6,9,10).
A juh májában lezajló anyagcsere során szintén elsősorban α-ZOL képződik (9), de ezen kívül a vizeletben bizonyos mennyiségben α- és β-ZOL-t is kimutattak (8).
Ember:
Szintén a májban lezajló biotranszfromáció során alakul át a ZEA (A. Rog). A placenta is képes metabolizálni (Huuskonen), valamint emberi Caco-2-sejtekkel végzett kísérletek során kimutatták, hogy ezen sejtek is átalakítják a ZEA-t mindkét ismert anyagcsereúton keresztül (Pfeiffer et al.). In vivo ezek a metabolitok elsősorban a glükuronidos formában szekretálódnak a vizeletbe (A. Rog)
A ZEA hatásai:
A ZEA és metabolitjai a véráram segítségével eljutnak a szervezet minden pontjára. A toxin egy része a sejtfelszínen található receptorokra köt, másik fele a sejtmembránon keresztül belép a citoplazmába, ösztrogénhez hasonló szerkezetüknek köszönhetően. 3. Itt, ugyanezen okból, képes ösztrogén receptorokhoz kapcsolódni, ezzel többek között transzkripciós és transzlációs folyamatokat befolyásolni.
Érintett jelpályák:
A sejtek felszínén találhatók a G-protein kapcsolt receptorok, amik 7-szer átfúrják a membránt (7-TM). Miután kapcsolódott a ZEA a receptorhoz a G-protein aktiválja a Foszfolipáz-C (PLC) enzimet, ami az inozitol-triszfoszfát (IP3) és a diacilglicerin (DAG) mennyiségét változtatva fejti ki hatását. Ezzel a ZEA képes befolyásolni ezt a jelátviteli utat. Mivel ez nem feltétlen az átíródási folyamatokat érinti, ezért nem genomiális útnak (non-genomic pathway) nevezik. A másodlagos hírvivő molekulák segítségével ez sokkal gyorsabban okoz változásokat a sejtben.
Az ösztrogén-receptor:
Az ösztrogén 3 hasonló szerkezetű hormonból áll, az ösztriolból, az ösztradiolból és az ösztronból. Ebből a 17ß-ösztradiol (E2) rendelkezik a legerősebb hatással és receptor affinitással, ezért ezt szokták viszonyítási alapul használni. Ösztrogén receptorokból jelenleg kétfélét különböztetünk meg α és ß típusút (ERα és ERß). ERα többlet a méhben, a placentában, a tejmirigyekben, a központi idegrendszerben, a szív- és érrendszerben, a májban és a csontszövetben található. ERß túlsúly ezzel szemben, a petefészkekre, a herékre, a tobozmirigyre, a pancreasra és a bőrre jellemző. 2. Ez azért fontos, mert a ZEA az ERα-hoz kötődve agonistaként viselkedik, míg ERß-n keverten, hol agonista, hol antagonistaként. Ez változhat a különböző metabolitjainál, ahogy azok erőssége is, például az α-zearalenol ösztrogén-szerű hatás több százszorosa a ZEA-hoz viszonyítva. 2. Ezzel magyarázható, hogy a különböző szövetek miért reagálnak eltérő módon a toxinra.
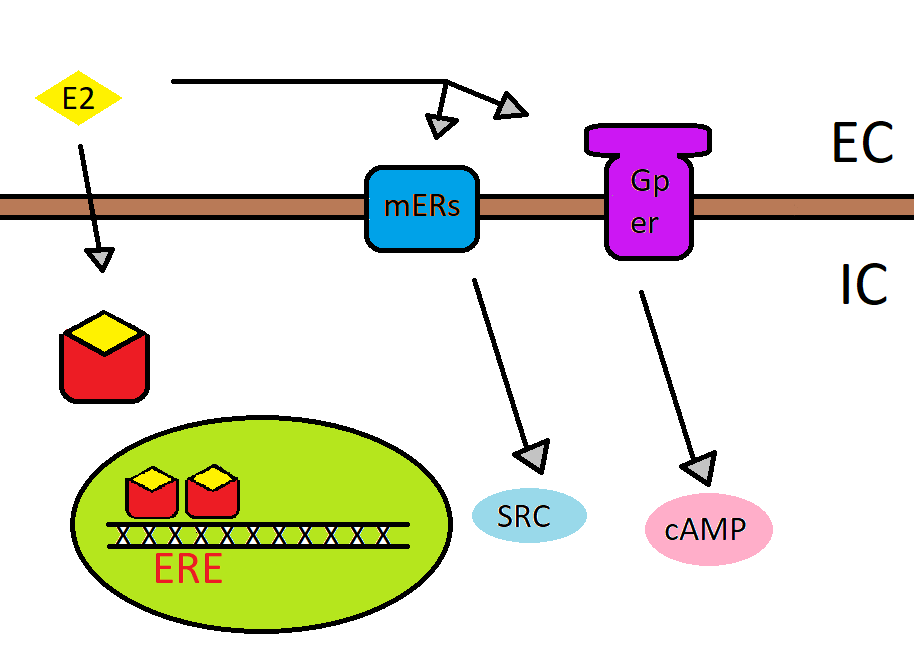
2. ábra: Az 17ß-ösztradiol receptorokon keresztül kifejtett hatásai. Az ER (piros) aktivált dimerként a transzkripciót szabályozza. Sejtmembránban található receptor (kék) segítségével a tirozin kináz rendszerre hat, aminek helytelen működését rákos sejtek kialakulásával hozták összefüggésbe. G-protein kapcsolt receptoron keresztül pedig a cAMP, egy másodlagos hírvivő molekula szintjét befolyásolja.
Hatása az endokrin rendszerre:
Mivel megnöveli a szervezetben található ösztrogén hormonok mennyiségét ezért az érzékeny szabályozó rendszeren keresztül sok egyéb hormont és receptort fog befolyásolni. Upregulációt okoz az ER-nál és indirekt módon a pajzsmirigy- (TR) és progeszteron receptoroknál (PR) is. A negatív feedback rendszer útján megzavarja a hypothalamus és a hypophysis hormon termelését is, ami csökkenti a LH, így a progeszteron, de még a TSH mennyiségét is.
Genotoxikus hatása:
Az ösztrogén-receptorok (ER) a szteroid magreceptorok közé tartoznak és 3 részből állnak. Egy ligand-kötő helyből (Ligand Binding Domain), egy DNS-kötő helyből (DNA-BD) és egy változó részből (VD). Megfelelő molekula kapcsolódásakor aktiválódik és hozzákötődik a DNS ERE (Estrogen Responsive Element) szakaszához, ahol kifejti enhancer vagy silencer hatását. A ZEA hatása azonban nem merül ki a transzkripció és transzláció befolyásolásában.
Az osztódásban lévő sejteket megállítja G2/M fázisban, aminek következményeként a sejt képtelen befejezni a mitózist és fehérje-szintézise is gátolva van. Ezt azzal magyarázzák, hogy a DNS-hez kötődött toxint a szervezet nem tudja megfelelően eltávolítani és a hibás javítás eredményeként jönnek létre DNS-fragmentációk és mikronukleuszok. 3.Emellett növeli a sejtben található szabadgyökök mennyiségét, ami a DNS, a mitokondrium és különböző fehérjék károsodását is okozhatja. A ZEA tehát cito- és genotoxikus hatással is rendelkezik.
Xenoösztrogén hatások:
Mivel az ösztrogén esszenciális a normális nemi működéshez ezért a ZEA hatásának kitett állatok és emberek reprodukciós zavarokat szenvednek el. Elhúzódó ösztruszt vagy anösztruszt, álvemhességet és az emlőmirigyek hypertrófiáját is okozhatja, ami mind a hiperösztrogenizmusnak tudható be. Emberben szerepet játszhat emlődaganat kialakulásában. Abdellah Zinedine. Emellett a hüvelyben hyperkeratinizációt és az endometriumban kóros burjánzást, adenocarcinomát is indukálhat. In vitro kimutatták, hogy a ZEA serkenti a tumorsejtek proliferációját és csökkenti azok apoptózisát. Szarvasmarhában a terméketlenség mellett direkt módon is visszaveti tejtermelést, ami jelentős gazdasági károkhoz vezethet. Abdellah Zinedine . Hím állatokban is okozhat terméketlenséget a tesztoszteron termelés és spermatogenezis mérséklésével, valamint a herék atrófiájával. Bár a baromfik általánosságban érzékenyek a mikotoxinokra, a ZEA-val szemben, főleg a csirkék, közel rezisztensnek mondhatók. 3. IJMS és mtsai (évszám) szerint a legveszélyeztetettebbek a sertések, mivel kis dózisban is jelentősen ront a kanok termékenységén és libidóján. Nőstény süldőkben pedig a péra tájék ödémás duzzanatát, hüvely- esetleg végbél előesést is okozhat. Bizonyos dózisú ZEA-nak kitett juhokban csökkenhet a termékenység, valamint az ovulációs ráta. Lovakkal végzett tanulmányok során kimutatták, hogy a ZEA hatására a fejlődő tüszők száma megnőtt és ebből lehet következtetni arra, hogy valószínűleg ez a mikotoxin hatással lehet a petefészekre és azon belül is a folliculusok fejlődésére.
Hatásai egyéb szervekben:
A reproduktív szerveken kívül a májban, vesékben, csontokban és a tobozmirigyben is károkat okoz. Patkányokban osteopetrosist okoz, amikor is a csont keménnyé és rideggé válik, így könnyebben eltörik. 2.A máj méregtelenítő szervként nagy mértékben ki van téve a toxinnak, így ott léziók és carcinomák jelennek meg. 3.A májkárosodás pedig sebezhetővé teszi a szervezet egyéb anyagok és kórokozók számára.
Mivel az immunrendszer szorosan összefonódik a neuroendokrin rendszerrel, ezért a ZEA erre is hatással van. A thymus atrófiáját okozza, lymphocytákat is képes gátolni a mitózisban, valamint ösztrogén jellege miatt gyulladáscsökkentő, immunszupresszív hatású. (Gergely J., 2017)
Hatásai embriókra:
Az agy megfelelő fejlődéséhez elengedhetetlen az ösztrogén és pajzsmirigy hormonok egyensúlya. Fontos szerepük van mielinizáció, idegpályák kialakítása, migráció, differenciálódás, szinapszisok létrejöttének szabályozásában. 2. Az embrionális agysejtek expresszálnak ERα és Thyroid receptorokat (TR), azonban a hormonok nem csak genomiális úton befolyásolják a fejlődést, például a tiroxin (T4) az astrocytákban aktin polimerizációt idéz elő. A ZEA képes átjutni a placentán és súlyos agykárosodást okozni, ami halvaszületéshez vezet. Az élve született állatok is kisebb súllyal, nem olyan életerősen jönnek a világra. Amikor a ZEA áthatol a vér-agy gáton károsítja azt, így átjárhatóvá válik a kórokozók számára is. (Gergely J., 2017). Fiatal állatban a hypothalamus és a hypophisis hypertrófiájával mirigydaganathoz, valamint koránéréshez, korai pubertáshoz vezethet. 2. Kivételt képeznek egyes rágcsálók (nyúl, tengerimalac, egér és patkány) amikre nincs teratogén hatással, tehát az embriókban nem okoz fejlődési rendellenességet. 3.
A ZEA neutralizációs módszerei:
Számos módszer létezik a zearalenon, valamint egyéb gombatoxinok semlegesítésére. Ezek között szerepelnek fizikai, kémiai és mikrobiológiai módszerek egyaránt. Emellett fontosnak bizonyulnak a megelőzéses módszerek is. Ide tartoznak a különböző gombaölő szerek használatai, valamint a növények megfelelő gondozása és betakarítása. Sajnos azonban ezek az eljárások nem bizonyultak teljesen hatékonynak a gombatoxinok jelenlétének megszüntetésében (A. Rogowska és mtsai, 2019).
Fizikai módszerek:
A legtöbb az adszorpció (felületi megkötés) elvén működő eljárásokhoz tartozik, melyek során olyan anyagokat alkalmaznak, amik képesek tartósan megkötni a ZEA-t, vagy más gombatoxinokat. Ide tartoznak például azok a szerves-rektoritok, melyeket különböző kvaterner ammónium-sókkal módosítottak (Sun és mtsai, 2018), vagy azok a természetes zeolitok, amelyek felszínét benzalkónium-kloriddal transzformálták (Markovića és mtsai, 2017b). Ezek mellett gyakran használnak még hőkezelést, mosást és sugárkezelést is (Zhang és mtsai, 2016).
Kémiai módszerek:
Különböző kémiai vegyületek alkalmazásán alapszik a módszer, mint például nátrium-hipoklorit, vagy hidrogén-peroxid használata. Kimutatták, hogy amennyiben a takarmányt kiegészítjük 2%-ban nátrium-karbonáttal, a ZEA mennyisége jelentősen leredukálódik (Polak és mtsai, 2009). Ezeken kívül még használják az ózonnal való kezelést is, ami akár a ZEA teljes mennyiségének lebomlásához vezet (McKenzie és mtsai, 1997).
Mikrobiológia módszerek:
Ezen módszerek előnye az eddigi eljárásokkal szemben, hogy itt nem veszít a kezelt takarmány, élelmiszer a tápértékéből. Erre a célra olyan mikroorganizmusokat használnak fel, amelyek nem termelnek mérgező anyagokat és megkötik vagy lebontják a gombatoxinokat. A. Rogowska és mtsai
Konklúzió:
A ZEA egyre nagyobb mértékű elterjedésének következtében egyre több állat, valamint ember van kitéve a kedvezőtlen hatásainak. Ezen okból kifolyólag fontos, hogy megtegyük a megfelelő óvintézkedéseket, így elsősorban megelőzzük, hogy a különböző gombafajok befertőzzék ültetvényeinket és ennek következtében a ZEA és egyéb gombatoxinok kialakuljanak rajtuk/bennük. Emiatt fontosak a különböző detoxifikáló módszerek is, melyeket folyamatosan fejlesztenek és egy hatékonyabbnak bizonyulnak a kezelést illetően.
Irodalomjegyzék:
Bálint B. (é. n.). EGY ISMERT MIKOTOXIN, A ZEARALENON HATÁSA FEJLŐDŐ KISAGYI SEJTEK ÖSZTROGÉN ÉS PAJZSMIRIGYHORMON RECEPTORFEHÉRJÉINEK EXPRESSZIÓJÁRA. 40.
Cs_contaminants_catalogue_fusarium_out65_en.pdf. (é. n.). Elérés 2020. április 24., forrás https://ec.europa.eu/food/sites/food/files/safety/docs/cs_contaminants_catalogue_fusarium_out65_en.pdf
Jócsák, G. (é. n.). The effects of bisphenol-A, zearalenone, arsenic and 4- methylbenzylidene camphor alone and in combination on the estrogen- and thyroid hormone receptor expression in developing rat cerebellum. 139.
Minervini, F., & Dell’Aquila, M. E. (2008). Zearalenone and Reproductive Function in Farm Animals. International Journal of Molecular Sciences, 9(12), 2570–2584. https://doi.org/10.3390/ijms9122570
Nóra M. (é. n.). A patulin és a zearalenon mikotoxinok által indukált oxidatív stressz folyamatok szabályzása hasadó élesztő sejtekben. 98.
Rogowska, A., Pomastowski, P., Sagandykova, G., & Buszewski, B. (2019). Zearalenone and its metabolites: Effect on human health, metabolism and neutralisation methods. Toxicon, 162, 46–56. https://doi.org/10.1016/j.toxicon.2019.03.004
What is Zearalenone? (é. n.). Romer Labs. Elérés 2020. április 24., forrás https://www.romerlabs.com/en/knowledge-center/knowledge-library/articles/news/what-is-zearalenone/
Zearalenone. (2020, április 15). http://www.mycotoxins.info/mycotoxins/common-mycotoxins/zearalenone/
Zhang, G.-L., Feng, Y.-L., Song, J.-L., & Zhou, X.-S. (2018). Zearalenone: A Mycotoxin With Different Toxic Effect in Domestic and Laboratory Animals’ Granulosa Cells. Frontiers in Genetics, 9. https://doi.org/10.3389/fgene.2018.00667
Zinedine, A., Soriano, J. M., Moltó, J. C., & Mañes, J. (2007). Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone: An oestrogenic mycotoxin. Food and Chemical Toxicology, 45(1), 1–18. https://doi.org/10.1016/j.fct.2006.07.030
