Itt írjon a(z) ZahnwalePottwale-ról/ről
Atmungs- und Kreislaufsystem im Bezug auf den Tag-Nacht-Rhythmus des Pottwals
Einleitung
Abbildung 1 |
|
Der Pottwal in seiner natürlichen Umgebung |
Der Pottwal (lat: Physeter macrocephalicus) gehört zur Ordnung der Waltiere und lebt im Nord- Pazifik. Als Meerestier besitzt er andere anatomische und physiologische Adaptionen, speziell wegen der im Wasser herrschenden Druckverhältnisse und der Tiefe, in der er sich berfindet.
Allgemeiner Verhaltensrhythmus
Abbildung 2 |
|
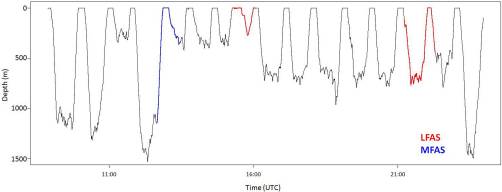
Tauchverhalten eines Pottwals |
Pottwale gehören zu den langsam atmende Meeressäugetieren. Sie tauchen in einer Tiefe von bis zu 1500m (siehe Abbildung 2). Aufgrund dessen sind Körper- und Lungenkreislauf auf die in dieser Tiefe herrschenden Druckverhältnisse anatomisch und physiologisch optimal abgestimmt.
Abhängig von seinem Tag und Nacht Rhythmus unterscheidet sich die Atmung in zwei Phasen. Zum einen die Tieftauchphase, die etwa 25 Minuten andauert und in der der Stoffwechsel auf ein Minimum reduziert wird, zum anderen eine darauf folgende fünf bis 15-minütige oberflächliche Tauchphase, die im Bereich von maximal 100 Metern stattfindet. Wenn der Wal sich in oberflächlicheren Gewässern aufhält, füllt der Wal die entstandene Sauerstoffschuld des Tiefgangs wieder auf. Dies ist nötig, da der Wal den Großteil des Tages damit verbringt, in der Tiefe nach Nahrung zu suchen 36,7%) (Patrick J.O. Miller et al., 2008).
Sie beginnt mit dem Anbruch der Dämmerung, hat ihre aktivste Phase um Mitternacht und sinkt ab, sobald der Tag wieder anbricht. (Au WW et al., May 2013)
Warum der Wal gerade in der Nacht jagt ist nicht bekannt. Dementsprechend hält sich der Wal nachts öfter und in tieferen Gewässerregionen auf, als tagsüber. Wie aus der Abbildung 3.1 ersichtlich, erreichen die Tauchgänge zwischen 21 und 12 Uhr eine Tiefe von bis zu 1.500m. Im Gegensatz dazu verbringt der Wal den Tag über in Tiefen bis zu ungefähr 700m.
Analyse des Tauchverhaltens nach Abbildung 3
Abbildung 3 |
|
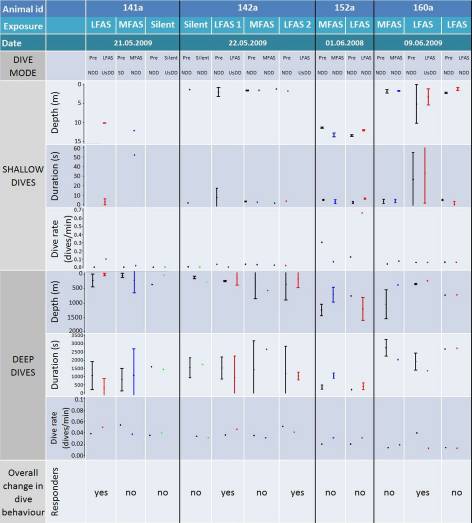
Vergleich von vier Pottwalen, 141a, 142a, 152a und 160a, und ihren einzelnen Tauchgängen |
Hauptsächlich wird in der Tabelle in 2 Zeilen jeweils zwischen oberflächlichen („shallow dives“) und tiefen („deep dives“) Tauchgängen differenziert, aufgeteilt in Tiefe („depth“) ,angegeben in Metern, und Dauer („duration“) in Sekunden. Zusammengefasst werden diese beiden Gesichtspunkte in der Tauchrate („dive rate“), Anzahl der Tauchgänge dividiert durch die Dauer pro Minute („dives per minute“). Zusätzlich werden die Exkursionen in den Spalten der Abbildung in oberflächliche („ShD“), normale tiefe („NDD“) und untypisch oberflächlich tiefen („UsDD“) Tauchgängen kategorisiert.
Bei dem Pottwal, der die Identitätsnummer 141a trägt wurde ausgewertet, dass aus 2 oberflächlichen Tauchgängen, einer normal mit einer Tiefe von ungefähr 12m und einer Dauer von 50s, der andere untypisch oberflächlich mit einer Tiefe von knapp 10m und nur ca. 10s. Die berechnete Tauchrate hält sich bei beiden unter dem Wert 0,1 dives/min auf.
Bei den tiefen Tauchgängen dieses Wals sind insgesamt sechs aufgelistet. Drei davon lassen sich zu den normal tiefen Tauchgängen („NDD“), zwei zu den untypisch oberflächlich tiefen („UsDD“) und einer zu den oberflächlichen („ShD“) zuordnen. Die zu den normalen Exkursionen gehörenden Gänge eins und drei sind sich mit einer Tiefe von ca. 500m und einer Dauer von ca. 2000s und 1600s relativ ähnlich, und entsprechen einer Tauchrate von ungefähr 0,04 dives/min. Der zweite Tauchgang dagegen ist an die 650m tief und dauert über 2500s. Dieser erhält laut Tabelle ebenfalls eine Tauchrate von 0,04 dives/min. Der rot markierte untypische Tauchgang besitzt nur eine Tiefe von ca. 200m und eine Dauer von 750s, dieser erhält somit eine Rate von 0,05 dives/min. Bei dem anderen, grün gekennzeichneten, untypischen Tauchgang schwimmt der Wal ebenfalls nur ungefähr 200m und benötigt dafür 1500s. Die angegebene Rate befindet sich knapp unter 0,04 dives/min. Der oberflächliche tiefe Tauchgang äußert sich darin, dass er nur an die 200m Tiefe zeigt und den Wal 1500s kostet. Die Tauchrate beträgt ca. 0,06 dives/min.
Ruheverhalten
Es ist nur wenig über das Schlafverhalten von wild lebenden Waltieren bekannt. Bezahnte Wale schlafen, indem sie eine Seite ihres Gehirns in einen Ruhezustand versetzen. Dies ist der so genannt einseitiger hemisphärischer Schlaf. Trotz des „Uni-Hemispheric sleep“ (Z.5, R21, Patrick J.O. Miller et al., 2008) ist der Wal befähigt selbständig zu schwimmen und zu atmen, also können sie einfache lebenswichtige Aktivitäten ausführen. Die Nahrungssuche und das soziale Verhalten wird in diesem Zeitraum unterbunden. Das Tier nimmt dafür eine typische vertikale Position direkt unter der Wasseroberfläche ein, dabei treibt der Wal im Wasser, so genannt „drift-dives“ (Z.13, R21, Patrick J.O. Miller et al., 2008). Während der Beobachtungsphase waren 7,1% „drift-dives“, währenddessen sie schlafen, 36,7% wurden nicht für die Nahrungssuche genutzt. Dies ist im Gegensatz zu anderen Tieren verhältnismäßig wenig. Wale treiben täglich, 3% von 6-12 Uhr und 30% von 18-24 Uhr, laut Aufzeichnungen. Überwiegend, also 80,6% der Zeit, betreiben sie Nahrungssuche, abweichend von den oberflächlichen Tauchgängen, bei denen sie nicht jagen, in der Tiefe oder bei der Echoorientierung (19,4% der Zeit). Es wurde dennoch aufgezeichnet, dass Wale auch in der Tiefe ruhen. Sie schwimmen stetig oder produzieren Echolaute während sie in der Tieftauchphase sind.
Verhalten in Gefangenschaft
Das Schlafverhalten wurde bei gefangenen Walen durch EEG und Augenuntersuchungen beobachtet. Hierbei konnte festgestellt, dass in sie in einer solche Lebenssituation nicht bilateral schlafen, auch wenn sie emotionslos sind. Bei großen wild lebenden Tieren ist diese Art von Untersuchung nicht möglich. Die inaktive und stereotypische Position ist charakteristisch für das Schlafverhalten (Patrick J.O. Miller et al., 2008).
Physiologische und anatomische Beschaffenheiten
Physiologisch
Abbildung 4 |
|
|
Die Lunge der Pottwale ist im Verhältnis zur Körpermasse kleiner, als die der oberflächlich schwimmenden Meeressäugetiere (z.B. Delphine, die bis zu 100m tief tauchen). Dadurch, dass die Lungengröße durch den höheren Druck in der Tiefe verringert wird, kann die Lunge nicht als Sauerstoffspeicher fungieren. So muss der Körperkreislauf diese fehlende Funktion ausgleichen. Das Blutvolumen ist relativ erhöht, es besteht ein höherer Hämatokrit und eine höhere Hämoglobin- und Myoglobinkonzentraion ist vorhanden (siehe Abschnitt Mb, Hb bei 2.3 und 2.4). (Marina A. Piscitelli at al., 2010)
Anatomisch
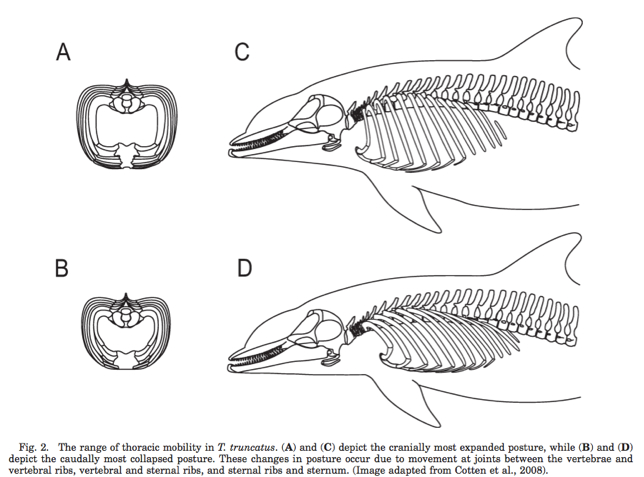
Abbildung 5 |
|
|
Nicht nur physiologisch, sondern auch anatomisch ist der Wal an seine Lebensweise angepasst (Abbildung 5). Dies bezüglich kann sich der Thorax in seiner Form verändern. Es bestehen Hypothesen zur anatomisches Besonderheit des Walbrustkorbes, z.B. dass zusätzliche flexible Verbindungen zwischen den Rippen der vertebralen und thorakalen Rippen bestehen. Auch die Beweglichkeit ist in diesem Zusammenhang beeinträchtigt, da von Forschern vermutet wird, dass es bei zunehmender Tiefe zu einer leichten Rotation der Rippen nach medial und caudodorsal kommt. Dies ist durch die bereits erwähnten flexiblen Verbindungen im vertebralen und sternalen Bereich des Thorax möglich. Das betroffene Gebiet reicht von den cervikalen, über die thorakalen bis zu den ersten drei lumbalen Wirbeln, den bereits genannten Rippen, einschließlich der Muskeln M. internus et externus intercostales, M.rectus abdominis. (Marina A. Piscitelli et al., 2010)
Je tiefer der Wal taucht, desto komprimierter ist das Gas in der Lunge und es kommt zu verringertem Auftrieb. Kleine Lungen hemmen leichter das Bedürfnis aufzutauchen, denn er wurde festgestellt, dass das Gasvolumen der Lunge in den ersten zehn Metern bis zu 50% sinkt. (Siehe Abbildung 4) (Marina A. Piscitelli et al., 2010)
Myoglobin
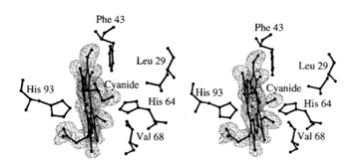
Abbildung 6 |
|
„Stereo view of the heme distills site of the cyanide derivative of L. pectinata HbI at room temperature (A) and at 100 K (B), as well as of sperm whale Mb at room temperature (C). In the three figures the heme plane is approximately edge on, and the E helix is on the right-hand side. Electron density for the ligand has been displayed together with the distal site residues, which are neighboring the bound cyanide. The figure was drawn with MOLSCRIPT" |
Abbildung 7 |
|
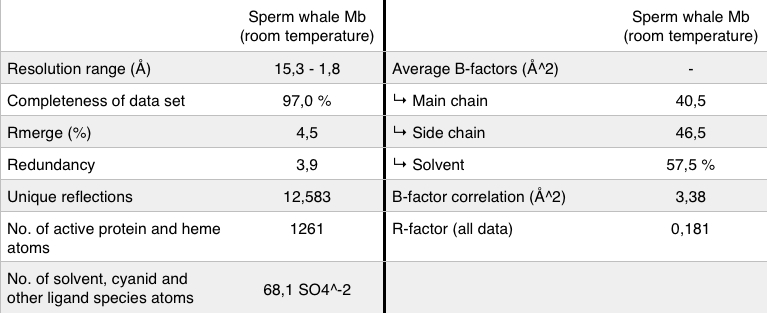
Die Tabelle zeigt ein paar wichtige Grunddaten des Myoglobins des Pottwals. |
Die allgemeine Funktion des Myoglobin ist der Transport und die Speicherung von Sauerstoff und Hydrogensulfid. Obendrein erleichtert es den Transport des zirkulierenden Blutes zu den Mitochondrien, wo es als Sauerstoffreservoir während der Tauchphase fungiert.Das Myoglobin ist ein monomerisches Hämprotein. Das des Pottwals, ist wie bei allen höheren Säugetieren aus 152 AS zusammengesetzt, wobei diese Anzahl nur als Prototyp angesehen wird (nach Kendrew’s, „Epoch-making crystallographic work“). Unter anderem besteht es aus 12 Einheiten Histidin (Abbildung 7).
Die reversible und ständige Sauerstoffbindung des Häm-Eisens bildet die Basis der Hämoglobin- und Moyglobin-Funktion. Die genaue Aminosäurensequenz wurde jedoch bis heute noch nicht entschlüsselt. Das Myoglobin des Pottwals ist auf eine stark basische Umgebung angewiesen (Keiji Shikama et al., 1995). Die allgemeine Funktion des Myoglobin ist der Transport und die Speicherung von Sauerstoff und Hydrogensulfid (Abdu I. Alayash et al., 1999).Obendrein fördert es den Transport es den Transport des zirkulierenden Blutes zu den Mitochondrien, wo es als Sauerstoffreservoir während der Tauchphase agiert. Als allosterischer Inhibitor dient das Laktat, welches die Umsetzung des Sauerstoffs, durch Konformationänderung des Myoglobin-Rezeptors hemmt (Abbildung 6). Das Myoglobin besitzt Cyanid-Liganden, die hauptsächlich über das N-Atom mit Phenylalanin (64), dendritischen Zellen (CD1) und Valin (68) anastomisieren. Die Orientierung des Liganden steht senkrecht zur Häm-Ebene.(Martino Bolognesi et al., 1999)
Hämoglobin
Das Hämaglobin macht den größten Teil des Gesamtproteins aus und bestimmt die Sauerstofftransportkapazität des Blutes. Die zytoplasmatische Hämaglobin-Sichelzelle verursacht im Zusammenleben zwischen Bakterien und den Wirbeltieren oder Pflanzen eine wahrscheinlich physiologische Wirkung auf die Symbiose. Die starke Sulfidbindung der Lucina Hb wurden untersucht und Hisitidin(44)E7, Leucin(19)B10 und Valin(64)E11 mit Glutamin, Phenylalanin und Phenylalanin bei Pottwalmyoglobin ersetzt und mit dem U0001d6abMR und Röntgen, die Kristallstruktur festgehalten. (Bao D. Nguyen et al., 1998)
Diese Strukturen zeigten, dass Unterschiede in der Ausrichtung von der Glutamin(64)EZ zwischen Aquomet und Cyanotmet-Komplex von Lucina HbI gibt, sodass sie als Wasserstoffbrückenbindungen oder als Akzeptor fungieren und sie beeinflussen die unterschiedliche Ausrichtung des Phenylalanin(68)E11-Ring , die die Ursachen für die unterschiedliche Sulfid-Affinität zwischen Lucina HBI und Pottwal dreifach Myoglobin bildet. Phenyalanin(68)E11 ist um 90° um X2 gedreht und sitzt ∼1-2Å näher an dem Eisenatom in der Myoglobin 3-fach Mutation als in dem Lucina HbI-Aufbau.
Dieser Wechsel in der Ausrichtung bewirkt die Aufhebung der Stabilisierung der Interaktion mit dem Sulfid. Zusammengesehen mit der Reduzierung der Größe, der Entfernung bewirkt es eine 7-fach geringere Sulfid-Affinität von der Myoglobin-Mutation Lucina HbI zu
Myoglobin der Walen.
„Bivalue molluse Lucina“ (Z. 1, Bao D. Nguyen et al., 1998) ist ein chemoautotrophes Bakterium und stellt ein Monomer Hämoglobin I (HbI) mit normaler Sauerstoffbindung, aber stärkerer Sulfidbindung her. Die Kristall-Struktur von Aquomet Lucia HBI zeigt eine aktive Seite mit drei Stoffen, welche nicht üblicherweise in Globulin der Wirbeltiere vorkommt. Phenylalanin(B10) Glutamin(E7) und Phenylalanin(E11).
Fügt man diese dem Myoglobin vom Pottwal hinzu, erhält man eine dreifache Mutation, welche um eine ca. 700 fach höhere Sulfidbindung besitzt, als die ursprüngliche Form. Sowohl der Myoglobin Gehalt als auch der Lucia HbI haben die weiteren Untersuchungen der Originalstruktur, aufgrund Ihrer unnatürlichen Sulfidaufnahme bewirkt. Der wichtigste Unterschied zwischen den beiden ist, dass , Aquomet als Wasserstoffbrücken-Verbindung-Akzeptor fungiert und die unterschiedliche Ausrichtung von Phenylalanin(68)
Quellenverzeichnis
- Abdu I. Alayash, Beth A. Brockner Ryan, Raymond F. Eich, John S. Olson, Robert E. Cashon (1999): Reactions of Sperm Whale Myoglobin with Hydrogen Peroxide. JBC- The Journal of Biological Chemistry. 274: 2029-2037
Au WW, Giorli G, Chen J, Copeland A, Lammers M, Richlen M, Jarvis S, Morrissey R, Moretti D, Klinck H. (2013): Nighttime foraging by deep diving echolocating odontocetes off the Hawaiian islands of Kauai and Ni'ihau as determined by passive acoustic monitors. The Journal of Acoustical Society of America. 133: (5) 3119-27
- Bolognesi M., Rosano C., Losso R., Borassi A., Rizzi M., Wittenberg JB., Boffi A., Ascenzi P. (1999): Cyanide binding to Lucina pectinata hemoglobin I and to sperm whale myoglobin: an x-ray crystallographic study. Biophysical Journal. 77: (2) 1093–1099
Bao D. Nguyen, Xuefeng Zhao, Krishnamurthi Vyas, Gerd N. La Mar, R. Ashley Lile, Eric Allen Brucker, George N. Phillips, Jr. and John S. Olson (1998): Solution and Crystal Structures of a Sperm Whale Myoglobin Triple Mutant That Mimics the Sulfide-binding Hemoglobin from Lucina pectinata. JBC- The Journal of Biological Chemistry. 273: 9517-9526
- Patrick J.O. Miller, Kagari Aoki, Luke E. Rendell and Masao Amano (2008): Stereotypical resting behavior of the sperm whale. Current Biology. 18: (1) R21-R23
- Piscitelli MA, MCLellan WA, Rommel SA, Blum JE, Barco SG, Pabst DA (2010): Lung size and thoracic morphology in shallow- and deep-diving cetaceans. Journal of Morphology. 271: (6) 654–673
Shikama K., Matsuoka A., Iwaasa H. (1995): The unique structures of protozoan myoglobin and yeast hemoglobin: an evolutionary diversity. The International Journal of Biochemistry & Cell Biology. 27: (11) 1107–1115
Weiterführende Links
Abbildungsverzeichnis
Abbildung 1: http://commons.wikimedia.org/wiki/File:Mother_and_baby_sperm_whale.jpg (Lizenzveröffentlichung siehe Wikipedia)
Abbildung 2: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3468818/figure/F4/ (Full dive record of sperm whale, Front Physiol. 2012; Published online 2012 October 11, freie Lizenz)
Abbildung 3: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3468818/figure/F7/ (Comparison of individual exposures to sperm whales, Front Physiol. 2012; Published online 2012 October 11, freie Lizenz)
Abbildung 4: http://www.ncbi.nlm.nih.gov/pubmed/?term=lung+size+and+thoracic+morphology+and+shallow+and+deep+diving+cetaceans (Lizenzgenehmigung des Autors)
Abbildung 5: http://commons.wikimedia.org/wiki/File:Skelett_eines_Pottwals,_Lübeck.jpg (Lizenzveröffentlichung siehe Wikipedia)
Abbildung 6: http://www.ncbi.nlm.nih.gov/pubmed/10423453 (freie Lizenz)
Abbildung 7: http://www.ncbi.nlm.nih.gov/pubmed/10423453 (Lizenzgenehmigung des Autors)