Ide kerül majd a szöveg. Kérem az első sort érintetlenül hagyni!
Az amfetamin és a limbikus rendszer
Az amfetamin az alkaloidok közé tartozó, mesterségesen előállított szerves vegyület. Elnevezése az alfa-metil-feniletilamin nevű vegyület rövidítéséből származik. A farmakológiában az összes hasonló kémiai szerkezetű vegyületet amfetaminszármazéknak nevezzük, melyek közül a legelterjedtebbek: amfetamin (Speed), metamfetamin, és a metiléndioxi-metamfetamin, azaz MDMA (Ecstasy). Pszichostimulánsok, azaz a szimpatikus idegrendszer izgalmát váltják ki. Ezen tulajdonságuk miatt népszerű tudatmódosító szerek: használójuk eufórikus állapotba kerül, sokszor enyhén hallucinácinál is. Ezen hatások megjelenesése azzal magyarázható, hogy ezen pszichostimulánsok hatással vannak az agy egy speciális területére, a limbikus rendszerre.
A limbikus, vagy határkérgi rendszer a hipotalamusszal szoros kapcsolatban álló, az agykéreg és a hipotalamusz által határolt agyterület. Ez a rendszer felelős az érzelmekért, a motiváció kialakulásáért, viselkedés és ösztönök kontrolljáért, valamint a memória is hozzá köthető. Legfontosabb alkotói az amygdala, a hippokampusz, funkcionálisan a gyrus cinguli (neocortex), a septalis area, a septum pellucidum. A limbukis rendszer rendkívül erős kapcsolatban áll a nucleus accumbenssel. A nucleus accumbens a testhelyzetet és mozgást nagyban befolyásoló csíkolt test (corpus striatum) része. A csíkolt test egy olyan törzsdúc, melynek dorsalis része a farkalt magból (nucleus caudtus) és a putamenből áll, az agy jutalmazó redszerét alkotó ventrális régióját pedig a nucleus accumbens és a tuberculum olfactorium adja.
A nucleus accumbens működését a limbikus rendszer dopamin-kibocsátása erősen szabályozza, így az amfetamin is leginkább a csíkolt testre fejti ki hatásait.
Az amfetamin szerkezete
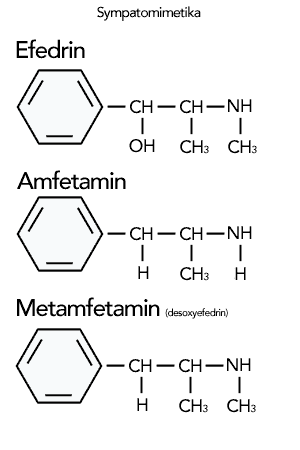
Szerkezetileg leginkább a természetben is fellelhető efedrinhez, a közöséges csikófark (Ephedra dystachia) által termelt fenil-etilamin származékhoz hasonlít. Az amfetamin szerkezetileg a fent említett, drogként használatos fenil-etilamin származékokon (metamfetamin, metiléndioxi-metamfetamin) kívül, egy természetben fellelhető kemikáliával is rokonvegyület. Ez közönséges csikófarkból (Ephedra dystachia) kivonható efedrin. Az efedrint, mivel szimpatikomimetikum, izgatószerként, étvágycsökkentőként, koncentrációt segítő anyagként, érszűkítőként használják.
|
Az amfetamin általános hatásai
- érszűkítő
- vérnyomásemelő
- hörgőtágító
- étvágycsökkentő
- entaktogén
- fájdalomcsillapító
- eufórikus érzés, hallucinációk kiváltása
Az amfetamin felezési ideje 12 óra. A fenti a jelenségek az aktív szakasz alatt jelentkeznek, intenzitásuk a fogyasztott drog mennyiségétől függ. Miután a szer kiürült a szervezetből, levertség, fáradtság, szomjúság és szénhidrátok utáni vágy jellemző.
Felhasználása
Amfetamin, mint gyógyszer
Az amfetamin fent említett hatásai miatt korábban gyógyszerészeti alapanyagként terjedt el. Narkolepszia, elhízás, figyelemhiányos hiperaktivitás, sőt még a részben elégtelen dopaminellátás okozta Parkinson-kór kezelésére is használták.
Amfetamin, mint drog - káros hatások
Manapság leginkább élénkítő hatású kábítószerként kerül forgalomba. Rendszeresen használva addiktív, mivel az amfetamin által nagyban befolyásolt dopamin receptorok mennyisége a növekvő számú inger hatására folyamatosan csökken, ezáltal a korábbi, megszokott mennyiségű pszichoaktív anyag már nem váltja ki a várt hatást, kialakul a függőség. Ez a folyamat a neuroadaptációs mechanizmus (Katona, 2007). Az amfetamin 2-3 hét rendszeres használat után az esetek nagy részében kialakítja a függőséget.
Függőség kialakulása esetén, nagy dózisban paranoid-skizofréniát okoz. Rendszeres fogyasztása esetén emellett az agy limbikus rendszere olyan mértékű irreverzibilis károsodást szenved el, hogy az korai Alzheimer-kórra jellemző tüneteket produkál. Kis dózisban növeli az egyszerű, általános motoros aktivitást, nagyobb dózisban pedig a fajspecifikus mozgásformák felerősödését eredményezi (Seiden és mtsai, 1993). Rusyniak kísérleteiben metamfetamin-függő személyeknél kognitív viselkedési zavarokat és neurológiai abnormalitásokat figyelt meg. (Rusyniak, 2013) A függőség jelentős közegészségügyi probléma, mely a mindennapokra is ható pszichiátriai és neuropatológiás zavarokat okoz (Henry és mtsai, 2010). Ezért kialakulásának, mechanizmusának pontosabb megismerése érdekében folyamatos kutatások folynak.
Hatásmechanizmus - biokémiai vonatkozások
A pszichostimuláns vegyületek hatásmechanizmusa azon alapul, hogy szerkezetük hasonlít a központi idegrendszer serkentő neurotranszmittereire, a katekolaminokra (dopamin, adrenalin, noradrenalin) vagy az indolvázas szerotoninra (Újváry, 2000). Ezek a kemikáliák a pre- és posztszinaptikus membránreceptorokon keresztül teremtenek kapcsolatot a szinapszisokban. Az amfetamin-vegyületcsalád tagjai ezen molekuláris kommunikáció normális működését befolyásolják, mivel adrenerg, szerotoninerg és dopaminerg hatással rendelkeznek. Az amfetamin stimulálta dopaminkibocsátás önmagában jelentéktelenebb mértékben okoz hangulatjavulást és nem is túl erősen stimuláló hatású. Ezekért a hatásokért az ilyen esetekben felszabaduló noradrenalinnak és szerotoninnak is nagyon fontos szerepe van. Magasabb amfetamin adag a a katekolaminok és a serotonin kibocsátását is fokozza, míg az alacsonyabb dózis főleg csak a katekolaminokét (Leyton és mtsai,2002).
Hatásmechanizmus - élettani vonatkozások
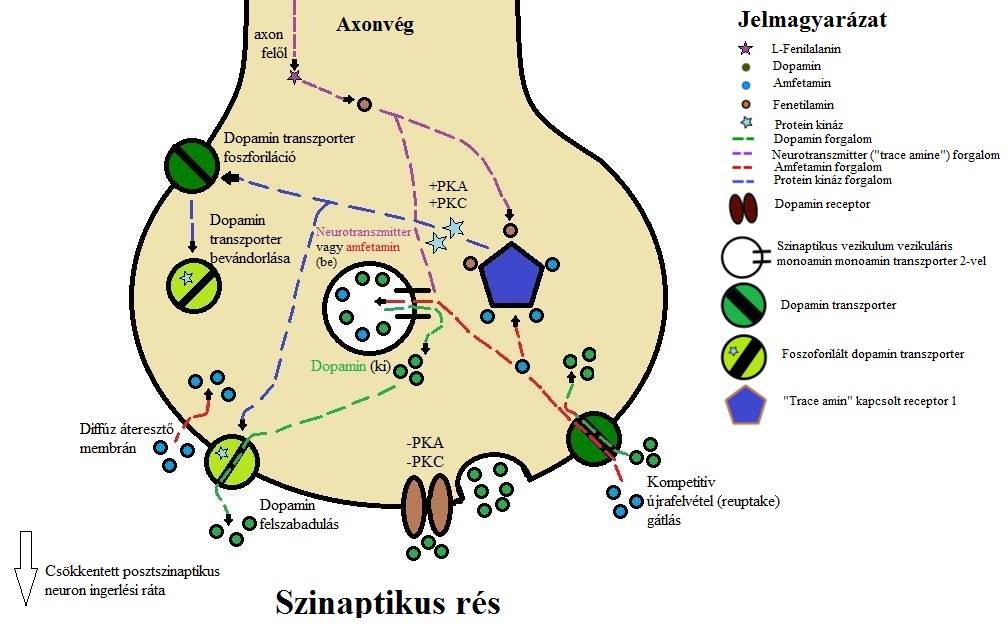
Használat esetén, akárcsak a kokain, leginkább a dopamin transzport és a normális jelátvitel megzavarása által idéznek elő viselkedésbeli változást.
A szájon át beadott amfetamin pszichoaktív vagy toxikus hatása jelentéktelenebb és jobban körülírható, mint az intravénásé (ugyanolyan mennyiségben) (Leyton és mtsai, 2002).
A dopaminkibocsátás serkentése
Egy 1988-ban végzett kísérletben agydialízissel vizsgálták, milyen változást okoz szabad mozgásban nem gátolt patkányok agyában, ha emberek által használt drogokat fogyasztanak.(Di Chiara és Imperato, 1988.) Az opiátok, az alkohol, a nikotin, az amfetamin és a kokain a nucleus accumbensben különösen emelték az extracelluláris dopamin koncentrációt és hipermotilitást okoztak. Ezzel szemben azok a drogok, melyeket az emberek nem használnak tudatmódosító szerként, nem váltottak ki szinaptikus dopaminkoncentráció-növekedést. (atropin, imipramin-antidepresszáns, difenilhidramin-antihsiztamin).
Ezen kutatásra is alapozták azt a feltételezést, hogy a függőséget okozó drogok közös tulajdonsága a dopaminkoncentráció-emelkedést kiváltó hatásuk.
Az amfetamin és a kokain elősegíti dopamin (illetve kisebb mértékben a noradrenalin és a szerotonin) fokozott kiáramlását, gátolja a neurotranszmitterek lebontását végző MAO (monoamino-oxidáz) enzimrendszert és a reuptake-et a preszinaptikus membránon keresztül a nucleus accumbensben (Kreek és mtsai, 2002.).
Az opiátok, a nikotin és az etanol serkentik a dopaminerg receptorok működését.
Az extracelluláris dopamin-többlet mesolimbikus rendszerre gyakorolt hatásai számos következménnyel bírnak. A konkrét viselkedési hatások még vitatottak, a szer használatakor jelentkező eufórikus érzésről még nem nem tudni pontosan, hogy a dopamin-többlet okozza-e, vagy maga a drog. Bizonyított azonban, hogy a dopamin-löket erős hatást gyakorol az agy jutalmazási rendszererére, vágyakozást kelt. A legfrissebb kutatások szerint talán inkább a motivációs állapot szabályozásában van szerepe, mint az eufórikus érzés megteremtésében. Szintén a mesolimbikus dopamin-többlet tehet a kábítószer használatkor jelentkező fokozott motorikus működésről és nyugtalanságról.
Az amfetamin hatásmechanizmusának egy másik kulcslépése az, hogy a ventrális corpus striatumban csökkenti a D2 dopamin receptorok szelektív antagonistáinak kötési potenciálját (Leyton és mtsai, 2002). (A kötési poptenciál a rendelkezásre álló neuroreceptorok számától és a ligand-receptor kötés affinitásától függő változó.)
|
A csíkolt test régióinak jellegzetességei
A dorsalis és ventralis corpus striatum neuroanatómiai összeköttetései tisztázottak. Főemlősökben a corpus striatum ventralis része dopaminlöketeit leginkább a középagy tegmentumának dorsális részéből, bementi információit (input) pedig a limbikus struktúráktól, az amygdalától, a középső és orbitofrontális kéregtől és az elülső cortex stingularis-tól kapja. Ezek a rendszerek fontos szerepet játszanak a jutalmazásban, az effektíven fontos hatások megfigyelésében és a jutalomra és büntetésre való reagálásban. (Ezzel szemben a dorsalis corpus striatumra ható dopaminlöketek a középagy alsó részéből származnak.)
Állatkísérletek már bebizonyították a ventrális csíkolt test dopaminra való reakciója alapoz meg néhány bizonyos erősen motivált viselkedésformát, azonban ahhoz, hogy ezen folyamatok érzelmekre gyakorolt hatását is megértsük, emberi példákat is vizsgálnunk kell. Ez pozitronemmissziós tomográfia segítségével történhet meg, ami egy olyan funkcionális, vagyis nem anatómiai, képalkotó eljárás, amely háromdimenziós képet ad a test egy adott területéről. Ezen módszerrel bizonyos szövetek élettani jellemzői is vizsgálhatóvá válnak egy adott pillanatban. Az amfetamin okozta, eufóriával járó endogén dopamin koncentráció változás mértéke eltérőnek bizonyult a különböző csíkolt test régiókban, a ventrálisban erősebb. Ezen rész dopamin kibocsátásának mértéke pozitív összefüggésben van az amfetaminra adott hedonista érzettel. (Drevets és mtsai, 2001)
A pszichostimuláns drogok okozta dopaminkibocsátás a csíkolt test ventrális részén belül is a nucleus accumbensben a legjelentősebb. (Carboni és mtsai, 1989)
Nucleus accumbens
A nucleus accumbens a csíkolt test ventralis részenek egyik alkotója, kérgi és magi régióval rendelkezik. Bár az amfetaminos kezelés mindkét régióra hatással van, az más-más eredményt okoz.
Ezen eltérő hatások a látens inhibíció folyamatán keresztül vizsgálhatóak leginkább. A látens inhibíció kifejezést arra az etológiai sajátságra alkamazzuk, hogy sokszor könnyebb valami teljesen újat megtanulni, mint egy berögződött viselkedésformát teljesen kizárni a repertoárból. Neurológiai szempontból ez azt jelenti, hogy néha egyszerűbb új kapcsolatokat kiépíteni a neuronok között, mint bizonyos régieket eltüntetni. (Ez a jelenség akut skizofréniás betegeknél nem jelentkezik.) Állatkísérletekkel bizonyították, hogy a mezolimbikus dopamin rendszer nagy szerepet kap ebben a folyamatban, sőt a nucleus accumbens magi és kérgi régiói kissé eltérő funkciókkal rendelkeznek a jelenség tekintetében. Patkányok nucleus accumbensének magi régióját károsítva a látens inhibíció akadálytalanul működik tovább, a kérgi régió sérülése viszont ezen folyamat kiesését okozza. A sérült kérgű, de ép maggal rendelkező állatok ezen kívül nagyobb motoros aktivitást mutattak amfetamin kezelés után, mint az érintetlen agyú kontrolcsoport tagjai (Weiner és mtsai, 1996).
A nucleus accumbens és a glutamát
Az amfetamin és a kokain hatásait az extracelluláris glutamát és aszpartát szintekre nézve is vizsgálták a nucleus accumbensben. Kiderült, hogy ezek a szerek az aszpartát-szintet nem befolyásolják, a glutamát-szintet viszont emelik. A glutamát-szint emelkedés kalcium dependens folyamatnak bizonyult. Emellett fény derült arra is, hogy a glutamát-szint növekedését moderálni lehet dopaminos kezeléssel (Reid és mtsai, 1997).
Mindezek mellett, összességében elmondható, hogy a pszichostimulánsoknak leginkább a nucleus accumbens dopamin neurotanszmissziójára hatva módosítják a viselkedést. Bizonyos kutatások azonban azt bizonyítják, hogy ezek neurológiai és a viselkedésbeli hatások megelőzhetők a serkentő aminosav receptorok antagonistáinak alkalmazásával, így a folyamatban szerepe lehet a leáltalánosabb serkentő neurotranszmitternek, a glutamátnak is. Eszerint a pszichostimulánsok alkalmazása megváltoztathatja a nucleus accumbens dopaminrendszerének glutamátra adott válaszkészségét. A kísérleti patkányok ventrális tegmentális régiójának glutamátra adott válasza jelentősen felerősödött amfetaminos kezelés után, míg ezzel ellentétben a nucleus accumbensük neuronjai amfetamin beadása után szignifikánsan kevésbé lettek érzékenyek a glutamát serkentő hatására. Így a viselkedés megváltoztatásában a glutamát receptorok megváltozott transzmissziójával is összefüggésben van a dopamin jelátviteli útjában (White és mtsai, 1995).
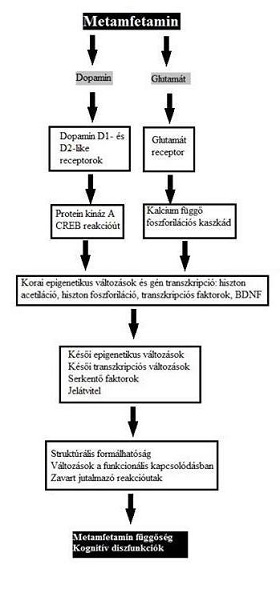
Epigenetikai és transzkripciós változások
Az amfetamin bizonyítottan kárt tesz az idegrendszerben. Hosszú távú használata a limbikus rendszer károsodásához vezet, ugyanis ott sejtszintű elváltozásokat okoz. A szer okozta agyi és viselkedésbeli változások sokkal jelentősebbek a kezdeti neurofarmakológiai hatásoknál. A pszichostimulánsok egyrészt, több kísérlet által bizonyítottan biokémiai adaptációt okoznak az agyi monoaminnal működő jelátviteli pályáknál, főleg a dopamin esetében. Másrészt, patkányokon végzett kíséretekből kiderült, hogy ezen drogok hosszú távú használat esetén azért is viselkedésmódosító hatásúak, mert képesek a szinaptikus kapcsolatokat átrendezni a nucleus accumbensben és a prefrontális kéregben. Ha a patkányokat mozgási lehetőség nélkül hosszan kezelték pszichostimulánsokkal a nucleus accumbens egy speciális sejtjének a közepes tüskés neuronnak a dendrit-ág és a dendrit-tüske-, illetve a prefrontális kéreg V-piramidális sejtjeinek apikális-dendrittüske száma megnőtt (Robinson és Kolb, 1999).
Az amfetamin ezen kívül befolyásolja a gének expresszióját és a fehérjék transzkripciójának intenzitását és a hisztonacetilizációs mintázatot is (Cadet és mtsai, 2013).
Korai elváltozások
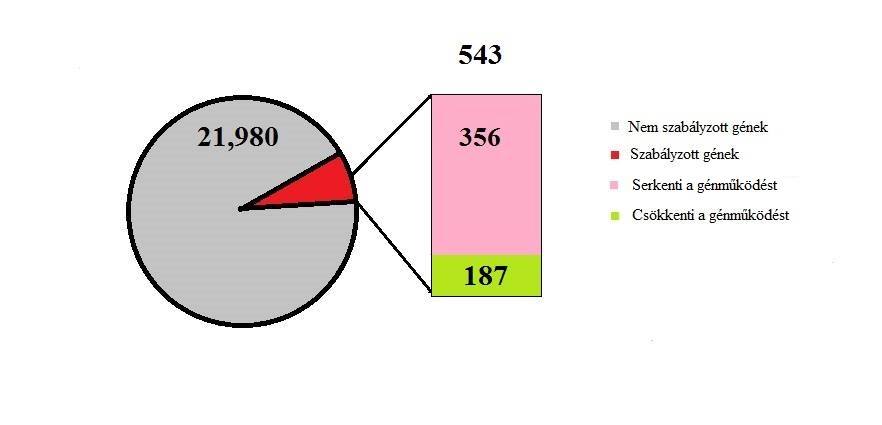
Cadet és munkatársai kísérletében patkányok szabadon adagolhattak maguknak amfetamint nyolc napon át, napi 15 órában, majd két órával az utolsó adagolás után elaltatták őket. Kvantitatív PCR-rel vizsgálták a génexpressziót a nucleus accumbensben és a corpus striatumban, ahol összesen 543 transzkripcióban történt változás (3. ábra). Azon gének expressziója, melyek részt vesznek a transzkripció szabályozásában, a sejt-sejt interakcióban, az idegrendszer működésében, és neurológiai betegségek génhálózatában, fokozódott (356 gén). Egyes gének működése csökkent: a drog anyagcserében, endokrin rendszerek működtetésében és a génexpresszió kontrollálásában fontos géneké. E megfigyelés, miszerint az amfetamin nagyban befolyásolja, milyen transzkripciós termékek keletkeznek, magyarázatául szolgálhat a függő személyeknél fellépő klinikai manifesztációkra: memóriazavar, depresszió és pszichózis (Rusyniak, 2013).
|
Foszforilációs kaszkádok
A CREB (ciklikus AMP response binding protein) foszforilációja intenzívebb lesz amfetamin hatására (Krasnova és mtsai, 2013). A CREB egy úgynevezett ATF (aktiváló transzkripciós faktor) családba tartozik, és foszforilálását a protein kináz A (PKA) végzi (Moens és mtsai, 2007). Ez az enzim szabályozza a c-fos, fosb és Bdnf gének transzkripcióját, (Krasnova és mtsai, 2013) melyeknek fontos szerepe van a tanulás és a memória, ezáltal az addikció kialakulásának folyamatában. A CREB fokozott foszforilációja tehát megemelkedett génexpresszióhoz vezet a hippokampuszban és csíkolt testben. Ugyanez a hatás érvényesül az ELK1 (ETS domain-containing protein) esetében is. A mitogén-aktivált protein kináz (MAPK) felelős az ELK1 foszforilálásáért. Ennek az enzimnek a fokozott aktivitása szerepet játszik a kokain- és amfetamin által okozott idegrendszeri elváltozásokért és függőség kialakulásáért (Cadet és Bisagno, 2013).
A nagy számú serkentett működésű génre magyarázatként szolgál még a megnövekedett KLF10 expresszió. Ez a Kruppel-féle cink-ujj transzkripciós faktorok közé sorolható. R1 doménje interakcióba lép a Sin3A nevű korepresszorral, és elnyomják a HDAC (hiszton-deaciláz) enzimek működését (Zhang és mtsai, 2001). A HDAC enzimek a génkifejeződés represszióját eredményeznék, ám ebben az esetben megfelelő működésük gátolt.
A c-Fos gén
Úgynevezett IEG (immediate early gene). Ezek a gének azonnal reagálnak, ha a sejtet valamilyen stimulus ér. A c-fos már 15 perc után aktiválódik, szabályozása foszforilációval történik, melyben részt vesznek a PKC, PKA és MAPK enzimek. A pszichoaktív drogok, mint az amfetamin és kokain, fokozzák a c-Fos működést a prefrontális agykéregben és a limbikus rendszer nucleus accumbensében, valamint a DeltaFosB akkumulációját a nucleus accumbens D1-típusú tüskés neuronjaiban (Graybiel és mtsai, 1990). Utóbbi biokémiai jelenség ugyanígy megfigyelhető más függőségek esetében is, legyen az a szer alkohol, kokain, kannabionidok, opiátok, nikotin vagy propofol. A DeltaFosB tehát számos függőséghez kapcsolt viselkedéssel kapcsolatban áll. Antagonistája a deltaJunD, mely egy transzkripciós faktor, és a G9a hiszton-metiltranszferáz enzim (Robison és mtsai, 2011).
Késői transzkripciós elváltozások
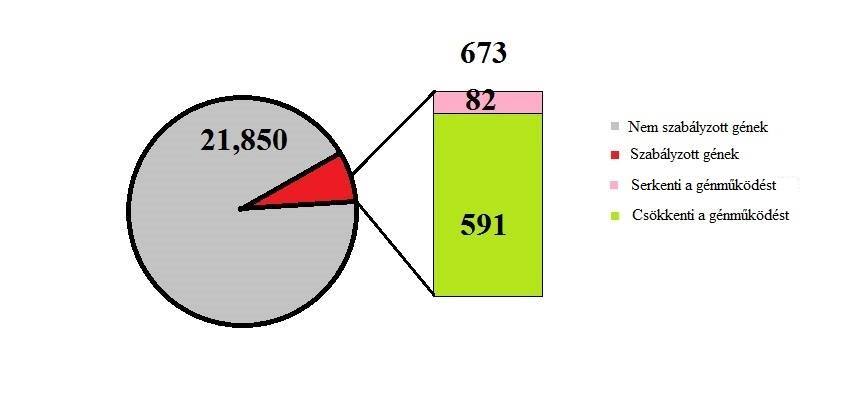
A kísérlet metódusa az előzőhöz hasonló: amfetamin-adagolás nyolc napon át, napi 15 órában, ám ezúttal 30 nappal az utolsó adag után altatták el az állatokat. A kvantitatív PCR eredménye a következő lett: 673 transzkripcióban volt különbség, 82 aktívabban működött, a többi csökkentetten (lsd 4. ábra) Ez jelentősen különbözik az előző kísérlet eredményétől, ahol a gének többségének intenzívebb lett az expressziója. Különösen azoknak a géneknek javult a működése, melyek szerepet játszanak a szervek fejlődésében, aminosav-anyagcserében, a sejtek osztódásában és növekedésében. Represszió jellemezte azokat, melyek részt vesznek fejlődési rendellenességek és idegrendszeri betegségek kialakításában. Ennek oka a HDAC-k (hiszton-deacilázok) működése a nucleus accumbensben (Martin és mtsai, 2012) és a dorsalis csíkolt testben (Jayanthi és mtsai, 2013). Az amfetamin-függőkről köztudott, hogy a szer rendszeres fogyasztása miatt memóriazavarokkal küzdenek. Érthető tehát, hogy egy hónappal a megvonás után különösen javult az eIF2alpha gén expressziója, melynek fontos feladata van a memória kialakításában (Costa-Mattioli és mtsai, 2009).
|
|
Függőség után
Brect és munkatársai korábban metamfetamin-függő, majd a szerről leszokott személyeket vizsgáltak. Arra az eredményre jutottak, hogy 50 százalékuk 2-3 éven belül visszatért a kábítószer-használathoz, ebből 36 százalék még az első hat hónapon belül (Brect és mtsai, 2010). Ennek okai főként az örömmámor keresése, impulzivitás, a megszokás. Mind embereknél, mind állatoknál megfigyelték, hogy a kábítószer utáni vágyakozás és az elvonási tünetek sokkal súlyosabbak, ha később vonják meg a drogot, és enyhébbek, ha fogyasztása nem volt annyira hosszan tartó (Shepard és mtsai, 2004).
Irodalomjegyzék
Alberini CM (2009) "Transcription factors in long-term memory and synaptic plasticity." Physiol Rev., 89(1):121–145.
Brecht ML, von Mayrhauser C, Anglin MD (2000) "Predictors of relapse after treatment for methamphetamine use." J Psychoactive Drugs, 32(2):211–220
Broussard JI (2012) "Co-transmission of dopamine and glutamate." J. Gen. Physiol. 139(1):93–96.
Cadet JL, Bisagno V (2013) "The primacy of cognition in the manifestations of substance ude disorders." Front Neurol, 4:189
Carboni E, Imperato A, Perezzani L, Di Chiara G (1989) "Amphetamine, cocaine, phencyclidine and nomifensine increase extracellular dopamine concentrations preferentially in the nucleus accumbens of freely moving rats." Neurosci., 28(3):653–661
Costa-Mattiolo M, Sossin WS, Klann E, Sonnenberg N (2009) "Tranlational control of long-lasting synaptic plasticity and memory." Neuron, 61(1): 10-26
Drevets WC, Gautier C, Price JC, Kupfer DJ, Kinahan PE, Grace AA, Price JL, Mathis CA (2001): "Amphetamine-induced dopamine release in human ventral striatum correlates with euphoria." Biol. Psychiatry, 49(2): 81–96
Graybiel AM, Moratalla R, Robertson HA (1990) "Amphetamine and cocaine induce drug-specific activation of the c-fos gene in striosome-matrix compartments and limbic subdivisions of the striatum." Proc. Natl. Acad. Sci. U.S.A, 87(17): 6912-6916
Irina N. Krasnova, Margarit Chiflikyan, Zuzana Justinova, Michael T. McCoy, Bruce Ladenheim, Subramaniam Jayanthi, Cynthia Quintero, Christie Brannock, Chanel Barnes, Jordan E. Adair (2013) "CREB phosphorylation regulates striatal transcriptional responses in the self-administration model of methamphetamine addiction in the rat." Neurobiol. of Dis., 58(0): 132-143
Leyton M, Boileau I, Benkelfat C, Diksic M, Baker G, Dagher A (2002) "Amphetamine-Induced Increases in Extracellular Dopamine, Drug Wanting, and Novelty Seeking: A PET/[11C]Raclopride Study in Healthy Men." Neuropsychopharm., 27: 1027-1035
Martin TA, Jayanthi S, McCoy MT, Brannock C, Ladenheim B, Garrett T, Lehrmann E, Becker KG, Cadet JL (2012) "Methamphetamine causes differential alterations in gene expression and patterns of histone acetylation/hypoacetylation in the rat nucleus accumbens." PLoS One, 7(3): 34236
Newton TF, De La Garza R 2nd, Kalechstein AD, Tziortzis D, Jacobsen CA (2009) "Theories of addiction: methamphetamine users' explanations for continuing drug use and relapse." Am J Addict, 18(4):294–300.
Rácz J (2014) "Pszichoaktív anyagok használatához társuló kórképek." In: Vikár András, Vikár György és Székács Eszter (szerk.): Dinamikus gyermekpszichiátria. 3. átdolgozott kiadás. Medicina Könyvkiadó Zrt., Budapest, 429-491
Reid MS, Kang Hsu Jr, Berger SP (1997) "Cocaine and amphetamine preferentially stimulate glutatmate release int he limbic system: Studies on the involveent of dopamine." Synapse, 27(2): 95-105
Renthal W, Nestler EJ (2009) "Chromatin regulation in drug addiction and depression". Dialogues Clin. Neurosci., 11(3): 257–268.
Robinson TE, Kolb B (1999) "Alterations in the morphology of dendrites and dendritic spines in the nucleus accumbens and prefrontal cortex following repeated treatment with amphetamine or cocaine." European J of Neurosci., 11(5): 1598–1604
Seiden LS, Sabol KE, Ricaurte GA (1993) "Amphetamine: Effects on Catecholamine Systems and Behavior." Annual Rev. of Pharm. and Toxic., 33: 639-676
Ujváry I (2000) "Az amfetamin-típusú drogok kultúrtörténete, kémiája, farmakológiája és toxikológiája." Psychiatria Hungarica, 15: 641-687
Vizi ESZ (2005) "Kábítószerek – a kreativitás mítosza és a rombolás valósága." Mindentudás egyeteme, VI. szemeszter
Weiner I, Gal G, Rawlins JNP, Feldon J (1996) "Differential involvement of the shell and core subterritories of the nucleus accumbens in latent inhibition and amphetamine-induced activity." Behav. Brain Res., 81(1-2): 123–133