Különböző diéták hosszútávú hatása a központi idegrendszerre
Contents
Maga a diéta szó étrendet jelent. Ha egy bizonyos diétát követünk, az azt jelenti, hogy egy meghatározott módon táplálkozunk. Sokféle okból kezdhetnek az emberek egy diétába. Lehet erkölcsi vagy vallási oka, lehet egészségügyi oka és lehet, hogy azért kezd valaki diétázni, hogy elérjen egy kívánt testsúlyt. Mivel a diéták következtében megváltozik a szervezetbe bevitt táplálék minősége és mennyisége is, ezért komoly változásokat okozhatnak a szervezet metabolizmusában, ami hosszú távon az idegrendszerre is kihathat.
Az alábbiakban 6 diétát vettünk számításba, és megvizsgáltuk, hogy hosszú távon milyen hatással lehetnek az idegrendszerre.
Vegetáriánus diéta
Története
Írásos dokumentumok már az ókorból is fennmaradtak, melyekben vegetáriánus diétát folytató filozófusok (Platón, Szókratész) szerepelnek. Ezek sokszor vallási, illetve filozófiai meggyőződéshez kötődtek. Európában a reneszánsz korban kezdett ismertté válni, ám nem terjedt el széles körben. Az 1950-es évektől kezdve a társadalmi szintű egészségromlás, népbetegségek (például a cukorbetegség, elhízás, magas vérnyomás) megjelenése és elterjedése, egyre nagyobb problémát jelentett. Azonban a vegetáriánus diétát követő emberekben kisebb arányban fordultak elő, ezért ez a táplálkozási forma egyre népszerűbbé vált. Napjainkban a „natúrtáplálkozás”, ökológiai kérdések, fenntarthatóság, környezetvédelmi aggályok következtében kerülnek előtérbe ezen diéták. (Rong et al., 2021)
Általános leírás
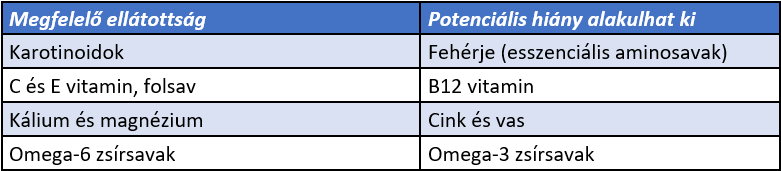
A vegetáriánus diéta alapvetően növényi alapú étkezési forma, amely húsok fogyasztását mellőzi. Ez alapján egyes tápanyagokból megfeleő mennyiséghez jut a szervezet, néhány szervezetet felépítő anyagokból viszont könnyedén hiány alakulhat ki (1. táblázat). Többféle csoportosítása ismert. Az alapján, hogy milyen mértékben engedélyezett egyéb állati eredetű termékek fogyasztása, négy alcsoportot különböztetünk meg:
Szigorú vegetarianizmus (továbbiakban veganizmus): Minden állati eredetű termék fogyasztásától tartózkodnak (hús, tejtermékek, tojás, méz)
Ovo-vegetarianizmus: Állati eredetű termékek közül csupán tojást fogyasztanak, tejtermékektől mentesen táplálkoznak.
Laktovegetarianizmus: Állati eredetű ételek közül csupán a tejtermékek fogyasztása engedélyezett, az egyéb állati eredetű termékeket (mint például a tojást) elhagyják
Ovolakto-vegetarianizmus: Mellőzik minden fajta hús (beleértve a hal) és a belőlük készült termékek fogyasztását, ám egyéb, állati eredetű termék bevitele engedélyezett.
(Schürmann et al., 2017)
|
1. táblázat: A vegetariánus diéták megfelelő, illetve hiányos tápanyag-ellátottsága (Craig, 2009; Chauveau et al., 2013) |
Egészségügyi vonatkozások és idegrendszeri hatások
Tanulmányokkal alátámasztott tény, hogy a vegetáriánus táplálkozást folytatóknál kisebb eséllyel alakul ki kettes típusú diabétesz, (Chiu et al., 2014) különböző daganatos elváltozások (Dinu et al., 2017) és metabolikus szindróma. (Sabaté és Wien, 2015; Burdge et al., 2017) Egyes tanulmányok az alacsonyabb agyi kreatin szinttel próbálták összekötni, ám az agy önálló szintetizáló tevékenysége miatt nem alakult ki szignifikáns eltérés az agy energia ellátottságában az omnivor diétát folytató személyekhez képest. (Solis et al., 2014) Más források lehetséges jótékony hatásokat feltételeznek több neurológiai elváltozás, például a sclerosis multiplex, illetve a fibromyalgiában szenvedőkkel kapcsolatban, ám ezen hatások még nincsenek tudományosan alátámasztva. (Medvar, 2019) A hosszútávon kialakuló idegrendszeri tünetek/elváltozások a nem megfelelően kivitelezett, megtervezett diéták következményei, illetve a vegetáriánus étrendet követő várandós és szoptató (egészséges) édesanyák gyermekeinél fordulnak elő.
B12 vitaminhiány
B12 vitamin, azaz kobalamin hiány elsősorban olyan csecsemőkben fordul elő, akiknek édesanyjuk vegetáriánus diétát követ a terhesség és a szoptatás időszakában, emiatt szervezetükben alacsonyabb a kobalamin szint, mely az anyatejben is alacsony koncentrációt mutat. Mivel az újszülött gyermekek táplálékforrása bizonyos korig kizárólag anyatej, emiatt könnyen megjelenhet a B12 vitaminhiány. Általában 4-12 hónapos korban jelentkeznek a tünetek, melyek közül a legjellemzőbb a megaloblastos aneamia (sejt megnagyobbodással járó vérszegénység), valamint az általános levertség és kimerültség. Azonban központi idegrendszerrel kapcsolatos rendellenességek, és ebből fakadóan pedig idegrendszeri tünetek is kialakulhatnak, mint például az corticalis atrophia, vagyis az agy térfogatának csökkenése, illetve a subarachnoidális tér megnagyobbodása. A pontos patofiziológiás háttere egyelőre tisztázatlan, ám több elmélet is született ezzel kapcsolatban. (Dror és Allen, 2008) Legelfogadhatóbbnak az idegsejtek demyelinizációját, azaz myelinhüvelyük károsodását tekintjük. Ez jelentős hatással van a központi idegrendszer működésére, mivel lassítja az idegsejtek ingerületvezető képességét. Ez számos problémát jelenthet az emberi szervezetben, például a vizuális és auditív információk késleltetett tudatosulását, ami tanulási nehézségeket vonhat maga után. Illetve azáltal, hogy az idegsejtek myelinizálódása elsősorban a korai fejlődés időszakára tehető, a kognitív fejlődés zavara, visszamaradása figyelhető meg a B12 vitaminhiányban szenvedő csecsemőknél. Ezen kívül az corticalis atrophiával érintett gyermekek felénél megfigyelhetők abnormális mozgásmintázatok, mint például remegés és izomrángás. És akár olyan súlyos idegi károsodásokat is okozhat, melyek látásvesztéshez vezetnek. (Bourre, 2006; Kocaoglu et al., 2014)
Omega-3 zsírsavak hiánya
Vegetáriánus diétát folytató személyeknél az omega-3 zsírsavak, különösen az eikozapentaténsav (EPA), illetve a dokozahexaénsav (DHA) bevitele a szervezetbe nehezebb feladat, mivel elsősorban olajban gazdag halakban fordulnak elő, így hiány alakulhat ki vegetáriánus emberekben. Mivel ezek a többszörösen telítetlen zsírsavak különösen fontosak a központi idegrendszer fejlődéséhez, a kialakuló idegrendszeri problémák ebben az esetben is a vegetáriánus (különösen a vegán) diétát követő anyák, anyatejjel táplált kisgyermekei számára jelenthetnek kockázatot. (Burdge et al., 2017) Ennek az az oka, hogy az agyszövet magzati korban és az élet korai szakaszában fejlődik ki, illetve a retina DHA és EPA hiányában ez a folyamat zavart szenved. Érdekes módon a gyermekeknél egy alvási defficiencia is megfigyelhető, méghozzá az SWS (slow-wave sleep) időtartamának csökkenése. (Stothers és Warner, 1977; Uauy et al., 1996)
Vashiány
A vas kiemelten fontos szerepet tölt be a központi idegrendszer fejlődésében. Hiánya két mechanizmuson keresztül okoz problémát. Egyrészt közvetetten -a vérképzésben betöltött szerepén keresztül- oxigénhiányos állapot jön létre. Másrészt csökkenti a cytokróm C enzim aktivitását, ezáltal pedig az általános energiaellátottságot, így csökkentve az agy metabolikus aktivitását. Ezek a folyamatok hosszútávon (különösen az embrionális fejlődés időszakában) maradandó kognitív visszamaradást okozhatnak. (de Ungria et al., 2000; Bourre, 2006)
Cinkhiány
A cink szintén kiemelkedő szerepet tölt be a kognitív funkciók fejlődésében, illetve a szaglás és ízérzékelés mechanizmusában. Abban az esetben, ha nem viszünk be elegendő mennyiséget a szervezetbe szaglásvesztés, és visszafordíthatatlan idegrendszeri károsodások léphetnek fel, mint például az átlag alatti intelligenciaszint kialakulása. (Bhatnagar és Taneja, 2001; Bourre, 2006)
Glikémiás diéta
Általános leírás
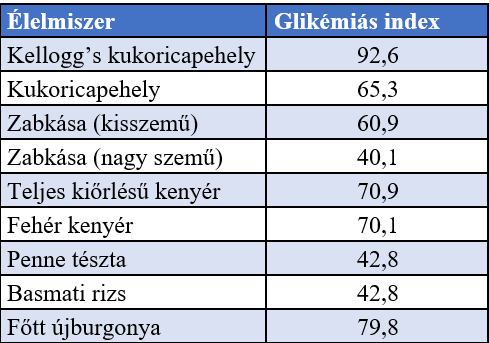
A glikémiás diéta az ételeket glikémiás indexük (GI) szerint rangsorolja, (ahogy arra a 2. táblázatban be is mutatunk néhány példát) és lehetőleg az alacsony GI-vel rendelkező ételek fogyasztását javasolja. A glikémiás index egy mértékegység nélküli arányszám, értéke 1-től 100-ig terjed. (Monro and Shaw, 2008). A GI az ételben található szénhidrátok vércukorra való hatásáról ad tájékoztatást. Azok az ételek, amelyek alacsony GI-besorolást kaptak, lassabban és kisebb mértékben emelik a vércukorszintet (a vér glükózkoncentrációját), míg a magasabb GI értékű élelmiszerek a vércukorszint hirtelen megemelkedését eredményezik. Az 55 alatti értékek alacsonynak, a 70 fölöttiek magasnak minősülnek. (Aston et al., 2008)
|
|
|
2. táblázat: Néhány élelmiszerféle glikémiás indexe (Aston et al., 2008) |
||
Egészségügyi vonatkozások és idegrendszeri hatások
A vér-agy gát (blood-brain barrier; BBB) sok tápanyagra nézve nem áteresztő, a glükóz számára azonban átjárható, így a szőlőcukor az agy legfontosabb energiaforrása. (Mergenthaler et al., 2013) A sejtek a glükózban tárolt energiát az oxidatív foszforiláció során ATP-szintézisre fordítják. Ennek során reaktív gyökök (reactive oxygen species; ROS) szabadulnak fel (normál vércukorszint mellett is).
Hyperglycaemia
Egyes és kettes típusú diabetes esetén a hyperglycaemia fokozott ROS-képződéshez, oxidatív stresszhez és gyulladásos folyamatokhoz vezethet. (Chen et al., 2019) A krónikus hyperglycaemia macrophag-aktivációt is kiválthat. A macrophagok a központi idegrendszerben található sejtek, egyik fő funkciójuk a sejtmaradványok phagocitálása, aktivációjuk szövetkárosodásra utalhat. (Watt et al., 2020)
GV (glycemic variability)
A pillanatnyi vércukorszinten kívül fontos tényező a szabadgyökök kialakulásában a glikémiás variabilitás (glycemic variability; GV). A glikémiás variabilitással a vércukorszint ingadozását, hullámzását jellemezhetjük. A konstans hyperglycaemia már önmagában is kiválthat ugyan eltúlzott mértékű ROS-felszabadulást, a folyamatra azonban a vércukor ingadozása (GV) fokozott hatással bír. In vivo cukorbeteg nőstény Goto-Kakizaki patkányokban modellezték a GV-t napi kétszeres intraperitonealis inzulin-injekcióval. Azt találták, hogy a vércukor-ingadozás szignifikánsan nagyobb mértékű neuron-apoptózishoz vezet, mint a hyperglycaemia egyedül. (Wang et al., 2021)
In vitro is megfigyelték a GV hatásait. Astroglia sejttenyészet tettek ki nagyon magas (12 mmol/l), illetve nagyon alacsony (0 mmol/l) glükózkoncentrációknak. Ezek a sejtek csökkent osztódást és glükózfelvételt, jelentős mértékű mitokondrium-károsodást, DNS-károsodást, valamint ROS-képzést mutattak. (Quincozes-Santos et al., 2017)
Egy obezitással összefüggő kísérlet keretében az alanyok hasonló makrotápanyag-összetételű, de eltérő glikémiás indexű diétát követtek. Az alacsonyabb glikémiás indexszel rendelkező ételek fogyasztását végző csoportban a GV alacsonyabb szinteket mutatott, mint a magas GI diétát követő csoportban. (Buscemi et al., 2013)
Mediterrán diéta
Általános leírás
A mediterrán diéta hagyományosan a mediterrán országok olívabogyó-termesztő területein élő emberek 1960-as évek közepéig jellemző étkezési szokásait veszi alapul. (Az 1960-as évek közepétől a globalizációnak már jelentős hatása volt a mediterrán étrendre.) Jellemző a sok zöldség, gyümölcs, valamint az olajos magvak, hüvelyesek, halfélék, és feldolgozatlan gabonafélék fogyasztása. Kerülendő élelmiszerfélék a tejtermékek (ez alól kivételt képeznek a különböző sajtfélék), valamint a vörös húsok. (Trichopoulou et al., 2003) Az alkoholfogyasztás görög szokásokon alapul: a kis-közepes mennyiségű alkoholt, jellemzően bort, lehetőleg étkezés közben kell meginni. (Trichopoulou et al., 2009) A diéta jellegzetessége a közepes-magas arányú zsírbevitel (az bevitt energia 30-40%-a származik zsírokból). (Trichopoulou et al., 2014)
Egészségügyi vonatkozások és idegredszeri hatások
Számos kutatás irányult a mediterrán diéta és különböző betegségek közötti összefüggések tanulmányozására. Ezek eredménye megerősítette a hipotézist, miszerint a mediterrán diéta csökkenti a szív- és érrendszeri betegségek, a rák, a diabétesz, az Alzheimer-kór és a dementia kialakulásának kockázatát. Black és munkatársai (2019) az FCD (focal cortical dysplasia ) - a sclerosis multiplex egyik fő prekurzora, és a mediterrán diéta közötti relációt tárták föl. Kísérletük alapján a mediterrán diéta, nyers vörös hússal kiegészítve, összefüggésbe hozható az FCD kockázatának csökkenésével. Azonban a hagyományos (vörös húst nem ajánló) étrend esetében nem találtak szignifikáns korrelációt a kockázatcsökkenéssel. A vörös húsok sok fontos mikro- és makrotápanyagot, például fehérjét, vasat, cinket, szelént, káliumot, D-vitamint (Taylor et al., 2014), sokféle B-vitamint és esszenciális zsírsavakat tartalmaznak, melyek elengedhetetlenek a normális idegműködés fenntartásához. (Howe et al., 2006; Ponnampalam et al., 2006) Ezek közül a D-vitamin és az esszenciális zsírsavak, valamint a vas hiánya könnyen vezethet sclerosis multiplex kialakulásához és a betegség súlyosbodásához. Így azon páciensek esetében, akiknél magas a sclerosis multiplex kialakulásának esélye, javallott lehet a vörös hússal kiegészített mediterrán étrend követése. (Black et al., 2019)
Szakaszos böjt (IF)
Általános leírás
A szakaszos böjt (intermittent fasting; IF) nem az elfogyasztott étel minőségét, vagy mennyiségét szabályozza, hanem azok bevitelének időpontját. Az IF alatt az esti órákban lehet étkezni, nap közben nem, ez körülbelül naponta 15-16 óra böjtölést jelent. Egy felmérés szerint a Ramadán (muszlim böjtölési időszak, a holdnaptár kilencedik hónapjában; 29-30 napon keresztül napkeltétől napnyugtáig tilos az étkezés) alatt a naponta bevitt átlagos kalóriatartalom nem különbözött szignifikánsan a nem böjti napok értékeitől. Az esti órákra visszaszorult étkezési lehetőség nem csak az étkezési szokásokra, hanem a teljes napi rutinra, alvási szokásokra is hatással van.(Lotfi et al., 2010)
Egészségügyi vonatkozások és idegrendszeri hatások
Az IF a központi idegrendszerre való hatását a bélbaktériumokon keresztül fejti ki. Az IF hatására kialakult bélflóra klinikai esetekben és rágcsálómodellben is javított a sclerosis multiplex lefolyásán. A sclerosis multiplex főleg nyugati országokban gyakori betegség, kialakulásában a táplálkozásnak számottevő szerepe van. Az IF hatására nőtt a bélbaktériumok mennyisége, különösen a Lactobacillaceae, Bacteroidaceae és Prevotellaceae családba tartozó baktériumok szaporodtak el, így sok antioxidáns mikrobiális metabolikus útvonal aktiválódott. (Cignarella et al., 2018)
A sclerosis multiplex mellett a Parkinson-kór is szorosan összefügg az étkezési szokásokkal. A szakaszos böjt lassítja a dopaminerg receptorok számának csökkenését a substantia nigra-ban, valamint rágcsálómodellben segíti a motoros funkciók hosszabb távú megőrzését az agy által termelt neorotroph faktorok expressziójának serkentése által. Ezen hatások a Furmicutes, Tenericutes törzsek bélben történő elszaporodásával, valamint a Proteobacteria törzs visszaszorulásával hozhatók összefüggésbe. (Rong et al., 2021)
Ketogén diéta
Történet
A ketogén diéta eredetileg az epilepsziás betegek, főként a gyermekek kezelésére lett kialakítva. Előfutárának a böjtöt (éhezést) tekinthetjük, mivel hosszú böjtölés során is ketózis alakul ki a szervezetben. Különböző böjtölési módszereket már Kr. E. 500 óta alkalmaztak az epilepszia kezelésére, majd az 1920-as években az orvosok megalkották a ketogén diétát, amely kifejezetten hatásosnak bizonyult. Később, az epilepszia modern gyógyszerekkel való terápiájának bevezetése után azonban egyre ritkábban alkalmazták. Csak az elmúlt 15 évben került újra vissza a köztudatba, az ilyen farmakológiai kezelések súlyos mellékhatásai miatt, valamint a fogyással kapcsolatban. (Wheless, 2008; Paoli et al., 2015)
Általános leírás
A ketogén diéta egy magas zsírtartalmú, de alacsony szénhidráttartalmú diéta. A klasszikus ketogén diéta 4:1 arányban határozza meg a zsírok, illetve a fehérjék és szénhidrátok arányát a táplálkozásban. Ez azt jelenti, hogy az energia 90% -a zsírokból származik, 10% -át pedig a fehérjék és a szénhidrátok együttesen teszik ki. (Kossoff et al., 2009) Napjainkban már többféle ketogén diétát különböztethetünk meg a kalóriabevitel szempontjából. Létezik az alacsony kalóriatartalmú ketogén étrend (LCKD), nagyon alacsony kalóriatartalmú ketogén étrend (VLCKD), valamint eukalorikus ketogén étrend (EKD).A ketogén diéták többsége terápiás célból jött létre, kivéve a zsírokban és fehérjékben gazdag, alacsony kalóriatartalmú étrendeket, melyeket rövid távú fogyás céljából alkalmaznak. (Sukkar és Muscaritoli, 2021)
Hatásmechanizmus
A ketogén diéta következtében ketózis játszódik le a szervezetben. A ketózis alapja az, hogy ha az étkezési szénhidráttartalom tartósan csökken, az ebből eredő csökkent inzulinszint a lipogenezis és a zsírraktárak csökkenéséhez vezet. Néhány nap ketogén diéta után a szervezet szénhidráttartalma annyira lecsökken, hogy a glükóztartalékok már nem elegendőek sem a normál béta-oxidációhoz, sem a központi idegrendszer energiaellátásához (amelynek fő energiaforrása a glükóz). (Owen et al., 1967; Paoli et al., 2013, 2015) Ebben az esetben a szervezetnek alternatív energiaforrásra van szüksége. Ezt az energiát a ketonanyagok (acetoacetát, a β-hidroxi-butirát és az aceton) szolgáltatják, amelyek a ketogenezis során acetil-CoA-ból keletkeznek, főként a máj mitokondriális mátrixban. (Fukao et al., 2004; Paoli et al., 2013) Bár a máj nem tudja hasznosítani a ketonanyagokat a szukcinil-CoA:3-ketoacid-CoA-transzferáz enzim hiánya miatt, az agy (és más szövetek, például az izmok) fel tudják használni őket energiaforrásként. Normál körülmények között a ketonanyagok koncentrációja a vérben nagyon alacsony (<0,3 mmol/l) a glükózkoncentrációhoz képest (∼4 mmol). Ha a ketogenezis következtében megemelkedett ketonanyagok koncentrációja eléri a ∼4 mmol-t, akkor (a monokarboxil transzporter enzim aktiválódása miatt) energiaforrásként szolgálhatnak a központi idegrendszer számára Azt is érdemes megemlíteni, hogy a ketonanyagok felhasználása több energiát termel, mint a glükóz felhasználása a nagyobb mitokondriális ATP-termelés miatt. (Fukao et al., 2004; Veech, 2004; Paoli et al., 2013) Fontos, hogy a ketogén diéta során fiziológiai ketózis zajlik le, ami nagy mértékben különbözik a kóros diabéteszes ketoacidózistól. (Krebs, 1966; Paoli et al., 2015)
Előnyök és hátrányokHa a ketogén étrendet megfelelő ideig és megfelelő módon alkalmazzák komolyabb kockázatok nem merülnek fel. Amennyiben a diétát helytelenül alkalmazzák, főleg a magas fehérjebevitelből adódhatnak problémák, bár az idegrendszerre eddig hosszútávon káros hatását nem mutattak ki. (Welle és Nair, 1990; Paoli et al., 2013; Sukkar és Muscaritoli, 2021)
Fontos azonban kiemelni, hogy az alacsony kalóriatartalmú ketogén étrendek csak rövid ideig alkalmazhatóak fogyás céljából és később fokozatosan vissza kell térni a helyes táplálkozáshoz, amely hagyományosan a különböző tápanyagok: szénhidrátok, fehérjék és zsírok közötti egyensúlyon alapul.(Sukkar és Muscaritoli, 2021) A ketogén diéták többi fajtáját, melyeket hosszú távon is alkalmazni lehet leginkább terápiás célból szokták ajánlani. (Paoli et al., 2013; Sukkar és Muscaritoli, 2021)
Egészségügyi vonatkozások és idegrendszeri hatások
A ketogén diétának számos jótékony hatását kimutatták az idegrendszerre. Ez a típusú diéta egy éhezés alatti állapotot utánoz, amely adaptív válaszokat vált ki a szervezetben. Többek között számos különböző faktor felszabadulását indukálja az agyban. Ilyen például a BDNF (brain -derived neurotrophic factor), amely az emlősökben az energiafelvételt és leadást, a szinaptikus plaszticitást, a neurogenezist és az idegsejtek stresszel szembeni ellenállását serkenti és szabályozza. Ennek köszönhető többek között hangulatjavító és memóriafejlesztő hatása. (Paoli, 2014; Paoli et al., 2015)Egyes tanulmányok kimutatták, hogy a ketogén diéta során fokozódik a PGC1-α termelődése, amely egy fontos mitokondriális metabolizmusra ható faktor. Többek között például serkenti a mitokondriális biogenezist, amely az Alzheimer-kór és a Parkinson-kór kezelése során fontos tényező lehet.(Srivastava et al., 2012; Paoli et al., 2013; Paoli, 2014)
A β-hidroxi-butirát jelenléte is fokozódik a szervezetben a ketogén diéta során. Ez a ketonanyag a hiszton-deacetiláz enzimek (HDAC) egyes csoportjának inhibítoraként léphet fel. A HDAC enzimek elnyomják a génexpressziót azáltal, hogy a hisztonok és hisztonfehérjék lizinmaradványainak acetil csoportját eltávolítják. Emiatt a HDAC inhibítorok megállíthatják a tumornövekedést, valamint különböző neurológiai betegségek kezelésében is haszosak lehetnek. Többek között ilyen betegség az amyotrophiás lateralsclerosis (ALS). (Yoo és Ko, 2011; Paoli et al., 2013; Paoli, 2014)
Egyes tanulmányok kimutatták, hogy az idős korban bekövetkező kognítív hanyatlás egyik oka, hogy a hippocampus és a praefrontalis cortex különböző neurobiológiai mechanizmusok következtében kevésbé képes felhasználni a glükózt, mint energiaforrást. (Hernandez et al., 2018) Emiatt a ketogén diéta a kognitív funkciók javításában fontos szerepet játszhat. Ezen kívül egyes neurokognitív rendellenességek, mint az enyhe kognitív károsodás (MCI) valamint a traumás agysérülés (TBI) is hatékonyan kezelhetők ketogén diétával.(Paoli et al., 2013; Horn et al., 2022)
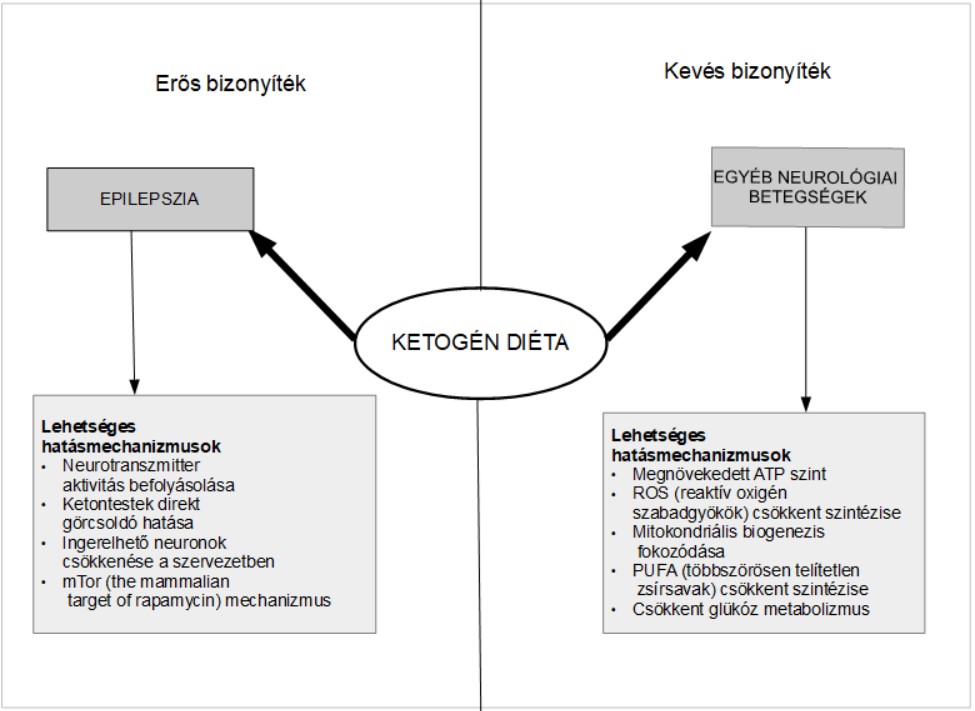
Talán a legfontosabb betegség, amely ilyen étrenddel kezelhető az antiepileptikum-kezelésre rezisztens epilepszia. A ketogén diéta epilepsziában fellépő hatásmechanizmusa nagyrészt tisztázatlan, de a legtöbb kutatás alapján a ketontestek által aktivált metabolikus mechanizmusok befolyásolják a neuronok neurotranszmitter aktivitását. Annak ellenére, hogy a hatásmechanizmus nem egyértelmű a ketogén étrend szerepe az epilepszia kezelésében jól megalapozott és kísérletekkel alátámasztott. Ezt foglaltuk össze az 1. ábrán. (Kessler et al., 2011; Kossoff, 2011; Paoli et al., 2013)
|
1. ábra: A ketogén diéta terápiás hatásainak hátterében álló lehetséges okok és az ezekhez kapcsolódó bizonyítékok erőssége. (Paoli et al., 2013) |
DASH diéta
Történet
A DASH (Dietary Approaches to Stop Hypertension) diétát eredetileg a magas vérnyomás és a szívbetegségek kockázatának csökkentése céljából fejlesztették ki egy tanulmány részeként. (Svetkey et al., 1999; Van Horn et al., 2016; Filippou et al., 2020)
Általános leírás
A DASH diéta nyolcféle élelmiszercsoportra koncentrál (3. táblázat), és meghatározza, hogy ezeket milyen arányban lehet fogyasztani a diéta során.
|
3. táblázat: A nyolc élelmiszercsoport a DASH diétában. (Karanja et al., 1999; Filippou et al., 2020) |
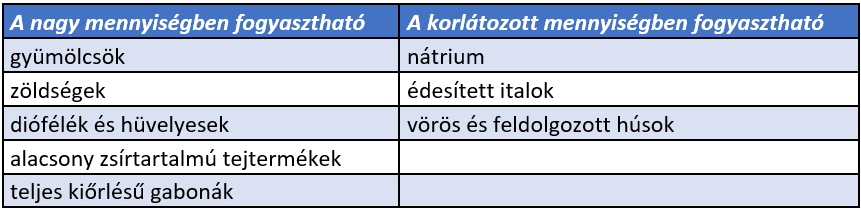
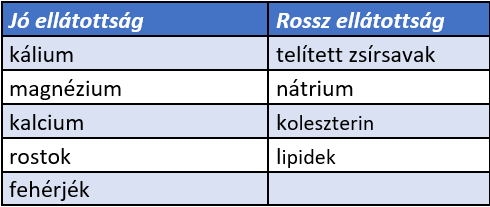
Ezek alapján a DASH diéta a következő tápanyagokban jó, illetve rossz ellátottságú (4. táblázat).
|
4. táblázat: A DASH diéta a következő tápanyagokban jó, illetve rossz ellátottságú (Appel et al., 1997; Karanja et al., 1999; Sacks et al., 2001) |
Egészségügyi vonatkozások és idegrendszeri hatások
Napjainkban a DASH diéta sokféle kutatás alapját képezi és bizonyítékok vannak arra, hogy a vérnyomás csökkentésén kívül a diéta követése sok más szervrendszerre is pozitív hatással van, többek között az idegrendszerre is. Emiatt a DASH diéta ma már széles körben alkalmazott és hosszú távú alkalmazása előnyös hatásokkal járhat a szervezetre.
Egy kísérlet kimutatta, hogy a DASH diétának már pár hónap elteltével is pozitív hatása lehet a végrehajtó funkciókra, a memóriára, a tanulási folyamatokra, valamint az észlelési sebességre. (Tangney et al., 2014) Ezen kívül kimutatták azt is, hogy a DASH diétát alkalmazók körében az időskorban kialakuló kognitív funkciók hanyatlása lassabb ütemben történik. (Tangney et al., 2014; Blumenthal et al., 2017)
A mediterrán diétával együtt alkalmazott DASH diéta különösen hatásos volt a különböző neurológiai betegségek kialakulásának megelőzésében. A pontos mechanizmusokról ezen a téren még nem áll rendelkezésre elég információ, de valószínűsíthető, hogy a kognitív hanyatlás megelőzésének hátterében különböző inflammatorikus (gyulladáscsökkentő) folyamatok állhatnak. A gyulladáscsökkentő folyamatokról pedig feltételezik, hogy a különböző kardiovaszkuláris rendellenességek, a stroke és szívbetegségek megelőzésében kulcsszerepet töltenek be. (Fung et al., 2008; Tangney et al., 2014) Egy másik tanulmány szerint a DASH és mediterrán diéták nyújtotta antioxidáns védelemhez köthető a kognitív funkciók javulása, mivel ezek az étrendek magas tokoferol, omega-3 zsírsav, tiamin, lutein és egyéb karotinoidok, K vitamin, folsav, valamint keratin polifenol tartalmúak. (Morris et al., 2005; Kastorini et al., 2011)
Az is feltételezhető, hogy a DASH diéta során nagy mennyiségben felvett élelmiszercsoportok jelenléte a bélben kedvezhet bizonyos baktériumoknak, amelyek megkönnyítik a neuroprotektív tényezők fenntartását. (Daulatzai és Daulatzai, 2013; Tangney et al., 2014)
Az is lehetséges, hogy az ilyen tápanyagok elősegítik a β-amyloid és a tau anyagcserét, így javítva a kognitív funkciókat. (Fernández-Fernández et al., 2012; Grossi et al., 2013; Tangney et al., 2014)
Meg kell azonban jegyezni, hogy az ilyen mechanizmusokat bizonyító információk még további kutatómunkát igényelnek.
Irodalomjegyzék
Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, Sacks FM, Bray GA, Vogt TM, Cutler JA, Windhauser MM, Lin P-H, Karanja N, Simons-Morton D, Mc Collough M, Swain J, Steele P, Evans MA, Miller ER, Harsha DW (1997): A Clinical Trial of the Effects of Dietary Patterns on Blood Pressure. New England Journal of Medicine 336:1117–1124
Aston LM, Gambell JM, Lee DM, Bryant SP, Jebb SA (2008): Determination of the glycaemic index of various staple carbohydrate-rich foods in the UK diet. Eur J Clin Nutr 62:279–285
Bhatnagar S, Taneja S (2001): Zinc and cognitive development. British journal of nutrition 85:139–145
Black LJ, Baker K, Ponsonby A-L, van der Mei I, Lucas RM, Pereira G, Ausimmune Investigator Group (2019): A Higher Mediterranean Diet Score, Including Unprocessed Red Meat, Is Associated with Reduced Risk of Central Nervous System Demyelination in a Case-Control Study of Australian Adults. The Journal of Nutrition 149:1385–1392
Blumenthal JA, Smith PJ, Mabe S, Hinderliter A, Welsh-Bohmer K, Browndyke JN, Lin P-H, Kraus W, Doraiswamy PM, Burke J, Sherwood A (2017): Lifestyle and Neurocognition in Older Adults with Cardiovascular Risk Factors and Cognitive Impairment. Psychosom Med 79:719–727
Bourre JM (2006): Effects of nutrients (in food) on the structure and function of the nervous system: update on dietary requirements for brain. The Journal of Nutrition 10:9
Burdge GC, Tan S-Y, Henry CJ (2017): Long-chain n -3 PUFA in vegetarian women: a metabolic perspective. J Nutr Sci 6:58
Buscemi S, Cosentino L, Rosafio G, Morgana M, Mattina A, Sprini D, Verga S, Rini GB (2013): Effects of hypocaloric diets with different glycemic indexes on endothelial function and glycemic variability in overweight and in obese adult patients at increased cardiovascular risk. Clin Nutr 32:346–352
Chauveau P, Combe C, Fouque D, Aparicio M (2013): Vegetarianism: advantages and drawbacks in patients with chronic kidney diseases. J Ren Nutr 23:399–405
Chen C, Wu S, Hong Z, Chen X, Shan X, Fischbach S, Xiao X (2019): Chronic hyperglycemia regulates microglia polarization through ERK5. Aging 11:697–706
Chiu TH, Huang H-Y, Chiu Y-F, Pan W-H, Kao H-Y, Chiu JP, Lin M-N, Lin C-L (2014): Taiwanese vegetarians and omnivores: dietary composition, prevalence of diabetes and IFG. PLoS One 9:e88547
Cignarella F, Cantoni C, Ghezzi L, Salter A, Dorsett Y, Chen L, Phillips D, Weinstock GM, Fontana L, Cross AH, Zhou Y, Piccio L (2018): Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metabolism 27:1222-1235
Craig WJ (2009): Health effects of vegan diets. The American journal of clinical nutrition 89:1627-1633
Daulatzai M (2013): Obesity and Gut’s Dysbiosis Promote Neuroinflammation, Cognitive Impairment, and Vulnerability to Alzheimer’s disease: New Directions and Therapeutic Implications. Journal of molecular and genetic medicine: an international journal of biomedical research S1:5
de Ungria M, Rao R, Wobken JD, Luciana M, Nelson CA, Georgieff MK (2000): Perinatal iron deficiency decreases cytochrome c oxidase (Cyt Ox) activity in selected regions of neonatal rat brain. Pediatric research 48:169–176
Dinu M, Abbate R, Gensini GF, Casini A, Sofi F (2017): Vegetarian, vegan diets and multiple health outcomes: a systematic review with meta-analysis of observational studies. Critical reviews in food science and nutrition 57:3640–3649
Dror DK, Allen LH (2008): Effect of vitamin B12 deficiency on neurodevelopment in infants: current knowledge and possible mechanisms. Nutrition Reviews 66:250–255
Fernández-Fernández L, Comes G, Bolea I, Valente T, Ruiz J, Murtra P, Ramirez B, Anglés N, Reguant J, Morelló JR, Boada M, Hidalgo J, Escorihuela RM, Unzeta M (2012): LMN diet, rich in polyphenols and polyunsaturated fatty acids, improves mouse cognitive decline associated with aging and Alzheimer’s disease. Behavioural Brain Research 228:261–271
Filippou CD, Tsioufis CP, Thomopoulos CG, Mihas CC, Dimitriadis KS, Sotiropoulou LI, Chrysochoou CA, Nihoyannopoulos PI, Tousoulis DM (2020): Dietary Approaches to Stop Hypertension (DASH) Diet and Blood Pressure Reduction in Adults with and without Hypertension: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Adv Nutr 11:1150–1160
Fukao T, Lopaschuk GD, Mitchell GA (2004): Pathways and control of ketone body metabolism: on the fringe of lipid biochemistry. Prostaglandins Leukot Essent Fatty Acids 70:243–251
Fung TT, Chiuve SE, Mc Cullough ML, Rexrode KM, Logroscino G, Hu FB (2008): Adherence to a DASH-Style Diet and Risk of Coronary Heart Disease and Stroke in Women. Archives of Internal Medicine 168:713–720
Grossi C, Rigacci S, Ambrosini S, Ed Dami T, Luccarini I, Traini C, Failli P, Berti A, Casamenti F, Stefani M (2013): The Polyphenol Oleuropein Aglycone Protects TgCRND8 Mice against Aß Plaque Pathology. PLoS One 8:e71702
Hernandez AR, Hernandez CM, Campos K, Truckenbrod L, Federico Q, Moon B, Mc Quail JA, Maurer AP, Bizon JL, Burke SN (2018): A Ketogenic Diet Improves Cognition and Has Biochemical Effects in Prefrontal Cortex That Are Dissociable From Hippocampus. Front Aging Neurosci 10:391
Horn J, Mayer DE, Chen S, Mayer EA (2022): Role of diet and its effects on the gut microbiome in the pathophysiology of mental disorders. Transl Psychiatry 12:164
Howe P, Meyer B, Record S, Baghurst K (2006): Dietary intake of long-chain omega-3 polyunsaturated fatty acids: contribution of meat sources. Nutrition 22:47–53
Karanja NM, Obarzanek E, Lin P-H, Mc Cullough ML, Phillips KM, Swain JF, Champagne CM, Hoben KP (1999): Descriptive Characteristics of the Dietary Patterns Used in the Dietary Approaches to Stop Hypertension Trial. Journal of the American Dietetic Association 99:19–27
Kastorini C-M, Milionis HJ, Esposito K, Giugliano D, Goudevenos JA, Panagiotakos DB (2011): The Effect of Mediterranean Diet on Metabolic Syndrome and its Components: A Meta-Analysis of 50 Studies and 534,906 Individuals. Journal of the American College of Cardiology 57:1299–1313
Kocaoglu C, Akin F, Çaksen H, Böke SB, Arslan Ş, Aygün S (2014): Cerebral Atrophy in a Vitamin B12-deficient Infant of a Vegetarian Mother. J Health Popul Nutr 32:367–371
Kossoff EH et al. (2009): Optimal clinical management of children receiving the ketogenic diet: Recommendations of the International Ketogenic Diet Study Group. Epilepsia 50:304–317
Krebs HA (1966): The regulation of the release of ketone bodies by the liver. Advances in Enzyme Regulation 4:339–353
Lotfi S, Madani M, Abassi A, Tazi A, Boumahmaza M, Talbi M (2010): CNS Activation, Reaction Time, Blood Pressure and Heart Rate Variation During Ramadan Intermittent Fasting and Exercise. World Journal of Sport Sciences 3 (1): 37-43
Medvar BL (2019): Modeling Approaches to Renal Systems Biology.
Mergenthaler P, Lindauer U, Dienel GA, Meisel A (2013): Sugar for the brain: the role of glucose in physiological and pathological brain function. Trends in Neurosciences 36:587–597
Monro JA, Shaw M (2008): Glycemic impact, glycemic glucose equivalents, glycemic index, and glycemic load: definitions, distinctions, and implications. The American Journal of Clinical Nutrition 87:237-243
Morris MC, Evans DA, Bienias JL, Tangney CC, Hebert LE, Scherr PA, Schneider JA (2005): Dietary Folate and Vitamin B12 Intake and Cognitive Decline Among Community-Dwelling Older Persons. Archives of Neurology 62:641–645
Nebeling LC, Lerner E (1995): Implementing A Ketogenic Diet Based on Medium-chain Triglyceride Oil in Pediatric Patients with Cancer. Journal of the American Dietetic Association 95:693–697
Owen OE, Morgan AP, Kemp HG, Sullivan JM, Herrera MG, Cahill GF (1967): Brain metabolism during fasting. J Clin Invest 46:1589–1595
Paoli A (2014): Ketogenic Diet for Obesity: Friend or Foe? Int J Environ Res Public Health 11:2092–2107
Paoli A, Bianco A, Grimaldi KA (2015): The Ketogenic Diet and Sport: A Possible Marriage? Exercise and Sport Sciences Reviews 43:153–162
Paoli A, Rubini A, Volek JS, Grimaldi KA (2013): Beyond weight loss: a review of the therapeutic uses of very-low-carbohydrate (ketogenic) diets. Eur J Clin Nutr 67:789–796
Ponnampalam EN, Mann NJ, Sinclair AJ (2006): Effect of feeding systems on omega-3 fatty acids, conjugated linoleic acid and trans fatty acids in Australian beef cuts: potential impact on human health. Asia Pac J Clin Nutr 15:21–29
Quincozes-Santos A, Bobermin LD, de Assis AM, Gonçalves C-A, Souza DO (2017): Fluctuations in glucose levels induce glial toxicity with glutamatergic, oxidative and inflammatory implications. Biochim Biophys Acta Mol Basis Dis 1863:1–14
Rong B, Wu Q, Saeed M, Sun C (2021): Gut microbiota—a positive contributor in the process of intermittent fasting-mediated obesity control. Animal Nutrition 7:1283–1295
Sabaté J, Wien M (2015): A perspective on vegetarian dietary patterns and risk of metabolic syndrome. British Journal of Nutrition 113:136–143
Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray GA, Harsha D, Obarzanek E, Conlin PR, Miller ER, Simons-Morton DG, Karanja N, Lin P-H, Aickin M, Most-Windhauser MM, Moore TJ, Proschan MA, Cutler JA (2001): Effects on Blood Pressure of Reduced Dietary Sodium and the Dietary Approaches to Stop Hypertension (DASH) Diet. New England Journal of Medicine 344:3–10
Schürmann S, Kersting M, Alexy U (2017): Vegetarian diets in children: a systematic review. Eur J Nutr 56:1797–1817
Solis MY, Painelli V de S, Artioli GG, Roschel H, Otaduy MC, Gualano B (2014): Brain creatine depletion in vegetarians? A cross-sectional 1H-magnetic resonance spectroscopy (1H-MRS) study. British Journal of Nutrition 111:1272–1274
Srivastava S, Kashiwaya Y, King MT, Baxa U, Tam J, Niu G, Chen X, Clarke K, Veech RL (2012): Mitochondrial biogenesis and increased uncoupling protein 1 in brown adipose tissue of mice fed a ketone ester diet. FASEB J 26:2351–2362
Stothers JK, Warner RM (1977): Oxygen consumption and sleep state in the new-born [proceedings]. The Journal of Physiology 269:57-58
Sukkar SG, Muscaritoli M (2021): A Clinical Perspective of Low Carbohydrate Ketogenic Diets: A Narrative Review. Front Nutr 8:642-628
Svetkey LP, Simons-Morton D, Vollmer WM, Appel LJ, Conlin PR, Ryan DH, Ard J, Kennedy BM, for the DASH Research Group (1999): Effects of Dietary Patterns on Blood Pressure: Subgroup Analysis of the Dietary Approaches to Stop Hypertension (DASH) Randomized Clinical Trial. Archives of Internal Medicine 159:285–293
Tangney CC, Li H, Wang Y, Barnes L, Schneider JA, Bennett DA, Morris MC (2014): Relation of DASH- and Mediterranean-like dietary patterns to cognitive decline in older persons. Neurology 83:1410–1416
Taylor CL, Patterson KY, Roseland JM, Wise SA, Merkel JM, Pehrsson PR, Yetley EA (2014): Including food 25-hydroxyvitamin D in intake estimates may reduce the discrepancy between dietary and serum measures of vitamin D status. J Nutr 144:654–659
Trichopoulou A, Bamia C, Trichopoulos D (2009): Anatomy of health effects of Mediterranean diet: Greek EPIC prospective cohort study. BMJ 338:23-37
Trichopoulou A, Costacou T, Bamia C, Trichopoulos D (2003): Adherence to a Mediterranean diet and survival in a Greek population. N Engl J Med 348:2599–2608
Trichopoulou A, Martínez-González MA, Tong TY, Forouhi NG, Khandelwal S, Prabhakaran D, Mozaffarian D, de Lorgeril M (2014): Definitions and potential health benefits of the Mediterranean diet: views from experts around the world. BMC Med 12:112
Uauy R, Peirano P, Hoffman D, Mena P, Birch D, Birch E (1996): Role of essential fatty acids in the function of the developing nervous system. Lipids 31:167–176
Van Horn L, Carson JAS, Appel LJ, Burke LE, Economos C, Karmally W, Lancaster K, Lichtenstein AH, Johnson RK, Thomas RJ, Vos M, Wylie-Rosett J, Kris-Etherton P (2016): Recommended Dietary Pattern to Achieve Adherence to the American Heart Association/American College of Cardiology (AHA/ACC) Guidelines: A Scientific Statement From the American Heart Association. Circulation 134:505–529
Veech RL (2004): The therapeutic implications of ketone bodies: the effects of ketone bodies in pathological conditions: ketosis, ketogenic diet, redox states, insulin resistance, and mitochondrial metabolism. Prostaglandins, Leukotrienes and Essential Fatty Acids 70:309–319
Wang H, Deng J, Chen L, Ding K, Wang Y (2021): Acute glucose fluctuation induces inflammation and neurons apoptosis in hippocampal tissues of diabetic rats. Journal of Cellular Biochemistry 122:1239–1247
Watt C, Sanchez-Rangel E, Hwang JJ (2020): Glycemic Variability and CNS Inflammation: Reviewing the Connection. Nutrients 12:3906
Welle S, Nair KS (1990): Relationship of resting metabolic rate to body composition and protein turnover. American Journal of Physiology-Endocrinology and Metabolism 258:990–998
Wheless JW (2008): History of the ketogenic diet. Epilepsia 49 Suppl 8:3–5
Yoo Y-E, Ko C-P (2011): Treatment with trichostatin A initiated after disease onset delays disease progression and increases survival in a mouse model of amyotrophic lateral sclerosis. Experimental Neurology 231:147–159
Ábrajegyzék
1. ábra: nature.come/articles/ejcn2013116/?crsi=6624969164
Készítette: Szűts Virág Dorottya
1. táblázat: sciencedirect.com/science/article/abs/pii/S1051227613001593
weboldalon leírtak alapján készült, Készítette: Szabó Kinga
2. táblázat: https://www.nature.com/articles/1602723
weboldalon leírtak alapján készült, Készítette: Mészáros Katalin
weboldalon leírtak alapján készült, Készítette: Szűts Virág Dorottya
4. táblázat: https://www.nejm.org/doi/full/10.1056/NEJM199704173361601
weboldalon leírtak alapján készült, Készítette: Szűts Virág Dorottya