A hypoxia és oxigenizáció hatása a daganatterápiára
Contents
Daganatokról általában
A szolid, rosszindulatú emberi daganatokban vannak eltérő oxigéntartalmú hypoxiás területek, amelyek befolyásolják a daganatok működését.
Kétféle sejttípusból épülnek fel: oxigenizált és oxigénhiányos sejtekből. A rosszindulatú daganatokban a csökkent oxigénellátottságú területeknél az oxigén nyomása 7 Hgmm-nél kisebb (Vaupel, 2006). A rövid- vagy hosszútávú hypoxiás állapot sok rosszindulatú súlyosbodásban szerepet játszó tényezőt aktivál. Vizsgálatokkal kiderítették, hogy a hypoxia fokozza a tumorok agresszivitását, szerepet játszik a malignizációban és a daganat kialakulásában (Höckel és mtsai, 1996). Az oxigenizáció ellenben in vitro gátolja az ép szövetek, daganatok sejtjeinek növekedését. Ebből a tulajdonságból adódóan következtethetünk a kezelés sikerére is, a hypoxiás tumorokban megfigyelhető a kemoterápiás rezisztencia, a sugárérzékenység csökken és eredménytelen a fotodinámiás kezelés. Ezért kiegészítésként, vagy csak kizárólagosan alkalmazzák az oxigéngáz belélegeztetését vagy oxigénnel telített víz ivását. Mára már bizonyítottan jótékony az oxigénbevitel terápiás radioszintetizáló és kemoszintetizáló hatása.
A daganat növekedéséhez megfelelő vérellátás szükséges. A tumoros progresszió, gyors növekedés, helyi terjedést és áttét képződést jelent, ez végbe mehet hypoxiás vagy anoxiás környezetben is. A proliferizáció miatt megnő a daganat oxigénigénye, így fokozott érképződés alakul ki. Ez biztosítja a rendkívüli vérellátást és növekedést. Az érhálózata vagy saját erekből, vagy az angiogenezis-faktor hatására kialakuló véredényekből alakul ki. Vaszkuláris csatornák is támogatják a tumor vérellátást, ezek fala daganat sejtekből áll (Tímár és mstai, 2000). Az újonnan keletkezett ér ellátás funkcionálisan eltér a normális erektől (értágulat, hiányzó/hiányos endothel bélés, vakonvégződés). Ezek miatt pedig lelassul a véráramlás és csökkent tápanyag- és oxigénellátottság alakul ki, hypoxiás vagy anoxiás területek. Gray és mtsai 1953-ban fedezték fel a tumoros hypoxiát. Ezért kimondható, hogy a kiterjedt hypoxiás területű tumorok gyorsan terjednek és képeznek áttéteket.
Oxigenizációs terápia
A kezelések (kemo- és sugárterápia) sikeressége nagyban függ a daganat oxigén tartalmától. A tumorok viselkedése több tényezőtől is függ. A legfontosabb az agresszivitás, ami azt jelenti, hogy milyen gyorsan nő és képez-e áttétet, ezt szintén befolyásolja a tumorszövet oxigénszintje. Emellett kiemelendő a gazda szervezet ellenállóképessége, mint tényező. Ha az oxigénszint alacsony, az gátolja az energiatermelő és enzimatikus folyamatokat, azonban magas oxigéntartalmú daganatsejtekben éppen ellenkezőleg, energia termelődik, mely a továbbiakban elősegíti a tumor növekedését, proliferizációját. [lásd. Laktátdehidrogenáz szerepe a prognózisban] Éppen ezért a daganatterápia egyik szerves részét képezi a hypoxia/oxigenizáció. A továbbiakban kitérünk a fontosabb kezelési módok ismertetésére, melyek a következőek:
- Sugárterápia
- Hiperbarikus oxigénterápia
- Kemoterápiás gyógyszerek
- Antiangiogenikus szerek
Egyéb lehetséges megoldások
Prognózis felállítása a daganatterápiában
A célzott és sikeres daganatterápia megkezdéséhez nélkülözhetetlen a megfelelő prognózis felállítása. Amennyiben gyanú merül fel egy tumor esetén, elsődlegesen a radiológus feladata, hogy feltérképezze az elváltozást, illetve annak környékét. Ez különböző helyeken előfordulva eltérő anatómiai felépítésű, kiterjedésű lehet, így mindenképpen elengedhetetlen a megfelelő képi analízis. Ezáltal nem csak a daganat pontos térfogata állapítható meg, de azt elválasztva az ép, környező szövetektől lehetővé válik a célirányosabb kezelés, és az egészséges területek megkímélése az esetleges sugárterápia, gyógyszeres kezelés, esetleg műtéti eltávolítás során. Az alábbiakban kitérünk a tumor oxigén ellátottságával kapcsolatos diagnosztikai, illetve prognosztikai eljárásokra.
MR képalkotó eszközök
Jelen vizsgálatok alapján a fej-nyaki régiók daganat térképezéséhez legmegfelelőbb képalkotó módszer az MR. Egyik legnagyobb előnye, hogy kontrasztanyag hozzáadása nélkül is jobb képet ad a lágy szövetről, mint a CT, illetve a daganatok kiterjedését több, mint 90%-os hatékonysággal határozza meg (Hermans, 2012). A felbontóképesség növelhető további kontrasztanyag hozzáadásával. Különböző kutatások folynak arról, hogy a daganat vaszkularizációjának, illetve oxigén ellátottságának megfelelő felmérésével következtethetünk a sugár- és gyógyszeres terápia hatékonyságára is. A rossz oxigén ellátottságú szövetek gyengén, vagy alig reagálnak a sugárkezelésre, bizonyos fokú ellenállást mutatnak azzal szemben, ezáltal kijelenthető, hogy a sugárkezelés sikeressége összefügg a hypoxiával.
A dinamikus kontraszt felhalmozódáson alapuló MR vizsgálat alapja a perfúzió, mivel a tumorban lévő kapillárisok áteresztőképessége eltérő a normális erekétől. A bejuttatott kontrasztanyag felhalmozódik, majd kimosódik, ezt követjük térben és időben is, s ez megfelelő képet ad a daganat vaszkularizációjáról (a nekrotikus daganat például hypoxiás, nem halmozódik fel az anyag, nem ad képet sem így).
Egy másik megfelelő prognosztikai képalkotó eljárás az MRSI, mely a szövetek metabolizmusáról nyújt információt, azok összetételét nem invazív módon értékeli. Két lényeges fajtája a protonspektroszkópia (a szövet magas tejsav tartalmát kimutatva hypoxiára következtethetünk, hiszen a daganatos szövetekben lévő felszaporodó laktátdehidrogenáz oxigén hiányában tejsavat erjeszt), illetve foszforspektroszkópia (in vivo méri a szövet oxigénellátottságát).
Laktátdehidrogenáz szerepe a prognózisban
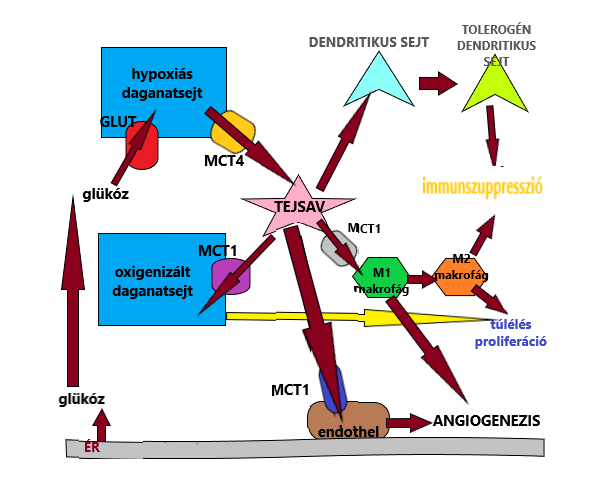
A prognosztikai eljárás alapja, hogy a rosszindulatú daganatok a proliferációhoz szükséges energiát a glikolízisből nyerik, illetve osztódásukhoz és terjedésükhöz szükséges előanyagokat is a folyamat során képződött metabolitokból szerzik (Feron, 2009). A glikolízis során glükózból különböző folyamatok hatására piruvát képződik, mely két irányban is átalakulhat a szövet vaszkularizációjának függvényében. Jó oxigén ellátottságú sejtekben acetil-koenzim A keletkezik, mely a citromsav ciklusba lép. Hypoxiás szövetekben ellenben oxigén hiányában laktátdehidrogenáz enzim által katalizált reakcióban tejsav képződik. A daganatsejtek expresszálnak egy bizonyos LDHA izoenzimet, melynek hatására fokozódik a tejsav termelés is, ezáltal a szervezet magas laktát tartalma összefüggéssel bír a betegséggel kapcsolatban, alacsonyabb a túlélési arány is.
A tumor kétféle sejttípust is tartalmaz: oxigenizált (peremén) és hypoxiás (centrálisan) sejtet, melyek szoros együttműködésben kifejtve hatásukat, egyfajta szimbiózisban tartják fent magát az elváltozást. A hypoxiás daganatsejtek rosszul vaszkularizáltak, kevés oxigént tartalmaznak, ezáltal tejsavtermelés lesz a feladatuk, melyet átadnak az oxigenizált sejteknek, ezzel segítve azok proliferációját és angiogenezisét. Az elkészült laktát leadását, illetve felvételét a monokarboxilát transzporterek (MCT) teszik tehetővé. Négy izoformája különböző szubsztrátaffinitást mutat, így a hypoxiás sejtek az MCT-4 segítségével átadják a tejsav molekulákat az oxigenizált sejteknek, amik MCT-1 közreműködéssel jutnak hozzá, s ezáltal táplálják anyagcseréjüket, a piruvátból légzési lánc révén energia keletkezik (Feron, 2009). Ez a kapcsolat dinamikus, ennek köszönhetően folyamatosan változik az oxigénnel ellátott területek aránya és helyeződése a tumoron belül is.
A termelődött tejsav nem csak az energianyerési folyamatokban vesz részt, de gátolja a szervezet veleszületett, illetve adaptív immunválaszát is, gátat szab a védekezésnek. A sejtek környezetében kialakult savas kémhatás egy bizonyos fajta citotoxikus T-sejt aktivációját is gátolja, proliferációját akadályozva. Ez az M1-es makrofágokkal van összefüggésben, amik természetes úton aktiválódnak a szervezetben, azonban feléve az elkészült laktátot fenotípusosan speciális M2-es makrofágok keletkeznek (Sica és mtsai, 2008).
Emellett a tejsav gátolja a monocyták dendritikus sejtekké történő változását és azok citokin termelését.
Összességében kijelenthetjük, hogy a beteg állatból vett szérum magas LDHA szintje negatív korrelációt mutat a túlélés esélyével, azaz a ráksejtek növekedését elősegíti az LDHA izoenzim. Prognosztikai szempontból ezért is nagyon fontos figyelembe vennünk a fent ismertetett tényezőket, ugyanis a daganatterápia eredményessebbé tehető bizonyos faktorok gátlásával. Oxigenizált daganatsejtek MCT-1 kivonása például növeli a hypoxiás daganatsejtek pusztulását, hiszen ezáltal az elkészült tejsavat nem tudják felvenni, nem készül belőle energia (Sonveaux, 2008). Emellett a szérum LDH, illetve LDHA szintje előrejelzést adhat a későbbi sugárterápia sikerességére vonatkozóan is. Tejsav csökkenést kiváltó terápiás szerek használata ígéretes eredményekhez vezethet.
A tejsav hatásmechanizmusát az 1. ábra ismerteti röviden:
|
1. ábra: Tejsav a daganatban |
Terápia
A hypoxia és anémia hatása a sugárterápiára
Bevezetés
Sugárterápiát daganatkezelés részeként először az 1800-as évek végére alkalmaztak, és még napjainkba is gyökeres része a lokális, előrehaladott tumorok kezelésében. A sugárterápia sikerességét jelzi a daganat visszatérő jellege, amelyet a kezelés és a paciens specifikus faktorokon kívül a daganat oxigénellátottsága és anémia esetleges jelenléte is nagy mértékben befolyásol (Teicher BA, 1995).
Az anémia korai felismerése és kezelése rendkívüli fontosságú lehet a terápia végkimenetelére nézve, mivel nemcsak a locoregionális kontrollt és a paciens életminőségét javítja, hanem az intratumorális hypoxia kialakulását és előrehaladását késlelteti. A hypoxia többek között a daganat rosszindulatú jellegét fokozza, valamint az újabb preklinikai kutatások szerint mutagén jellege is van. Reynolds és mtsai 2001-ben kimutatták, hogy a hypoxiás sejtek mutációs rátája szignifikánsan magasabb volt mind normál oxigenált körülmények között lévő sejtek. Ennek jelentősége a különböző rendkívül rezisztens sejtkolóniák megjelenésében mutatkozik (Kondo és mtsai, 2001).
Hatások a sugárterápia végkimenetelére
A sugárterápia sikerességének feltétele az intratumorális oxigén jelenléte, amely egyike a legfontosabb sugárszenzitivitást és ezáltal a DNS károsodást fokozó anyagoknak. Kísérletesen bizonyított, hogy a hypoxiás sejtek 2-szer,3-szor rezisztensebbek a sugárzással szemben, mint a normál oxigénellátottságú sejtek, és az így fennmaradó sejtek a daganat visszatérését vagy áttét képzését okozhatja. A frakcionált sugárterápia éppen ezért egyes kezelések között reoxigenizációt alkalmaz. Elméletben ez a reoxigenizáció a hypoxiás sejtek sugárszenzitivitását növeli és összeségében csökkenti ezen sejtek számát a daganaton belül. Összeségében elmondható, hogy a hypoxiás területek rendkívül alacsony oxigénellátottsága teszi a tumorsejteket életképessé és klonogénné, de egyben meghatározó szerepet játszik a kezeléssel szembeni rezisztenciában is (Teicher BA, 1995) (Okunieff és mtsai, 1996).
A tumor oxigénellátottságát a prognosztikában is gyakran alkalmazzák. Az oxigénkoncentráció jelentőségét először méhnyakrákkal kezelt betegek 19 hónapot követő utókezelésnél figyelték meg. Azok a paciensek akiknek az intratumorális oxigén koncentrációja pO2 > 10 Hgmm volt, szignifikánsan kevésbé volt a daganatjuk visszatérő jellegű, valamit ezen paciensek túlélési aránya is magasabb volt, mint az alacsonyabb intratumorális oxigénkoncentrációval rendelkező betegeké. Ezt az eredményt a 28. hónapot követő utókezelés is igazolta (Hockel és mtsai, 1993).
További kutatások azt is bizonyították, hogy ez az oxigénkoncentráció csak akkor rendelkezik prognosztikai jelentőséggel, amennyiben a hypoxia állapota a kezelés alatt legalább 2 hétig fenntartott (Strauss és mtsai, 1999).
Sugárszenzitivitás és oxigenizáció
A tumorok sugárszenzitivitásának növelésére számos módszert kifejlesztettek, de a legnagyobb problémát okozó hypoxiás területek terminálása még egyelőre még nem teljesen kiküszöbölt probléma.Az egyik már régebben bemutatott módszer a hiperbarikus oxigén lélegeztetése, amely bizonyítottan növeli a feji, nyaki és méhnyaktumorok szenzitivitását. Ez a módszer manapság már viszont nem használatos biztonsági és költségvetési okokból (Hellman és mtsai, 1997).
Ezen módszer alternatívájaként alkalmazható a carbogén lélegeztetés, ami a magas oxigénkoncentráció mellet széndioxidot is tartalmaz (Stuben és mtsai 1998).
Újabban alkalmazott módszer a sugárszenzitizáló szerek. Ezek az anyagok az oxigén tulajdonságait mutatják a tumoron belül, viszont lebomlásuk lényegesen lassabb. Az elmúlt két évtizedben leggyakrabban nitroimidazol vegyületek alkalmazása vált a legelterjedtebbé. Ezen vegyületek alkalmazása feji, nyaki, méhnyaki és tüdőrákban szenvedő betegek 1 éves túlélési arányát 8%-al növelte. Egy korábbi kutatás azt is kimutatta, hogy supraglottikus larynx és pharinx carcinómák lokoregionális kontrollját és a betegek túlélési arányát is szignifikánsan növeli a nitroimidazol származékok alkalmazása (Grigsby és mtsai, 1999).
Másik módszer a hypoxia csökkentésére a hypoxiás sejt szelektív szerek. Az ilyen szerek, például a mitomycin C, direkt módon károsítják a hypoxiás sejt DNS-ét és ezáltal fejtik ki citotoxikus hatásukat. Ezek az anyagok mind a lokoregionális kontrollt, mind a túlélési arányt szignifikánsan fokozták feji és nyaki rákos betegeknél (Haffty és mtsai, 1997).
Több kutatás is vizsgálta a dikumarol hozzáadását a mitomycin C-hez, hogy növeljék a hatékonyságát és biztonságosságát, de mindkét kutatás végül elvetette a dikumarol alkalmazását (Haffty és mtsai, 1997), (Keyes és mtsai, 1985). Az eredményeket az alábbi táblázat igazolja.
1. táblázat:
A sugárkezelés kimenetele nyaki és feji tumorokban mitomycin C-vel és anélkül |
||
|
Csak sugárterápia (%) |
Sugárterápia + mitomycin C +/- dikumarol (%) |
Általános túlélés aránya |
42 |
48 |
Eset specifikus túlélés aránya |
51 |
74 |
Visszatérés nélküli túlélés |
66 |
85 |
Lokoregionális visszatérés nélküli túlélés |
54 |
76 |
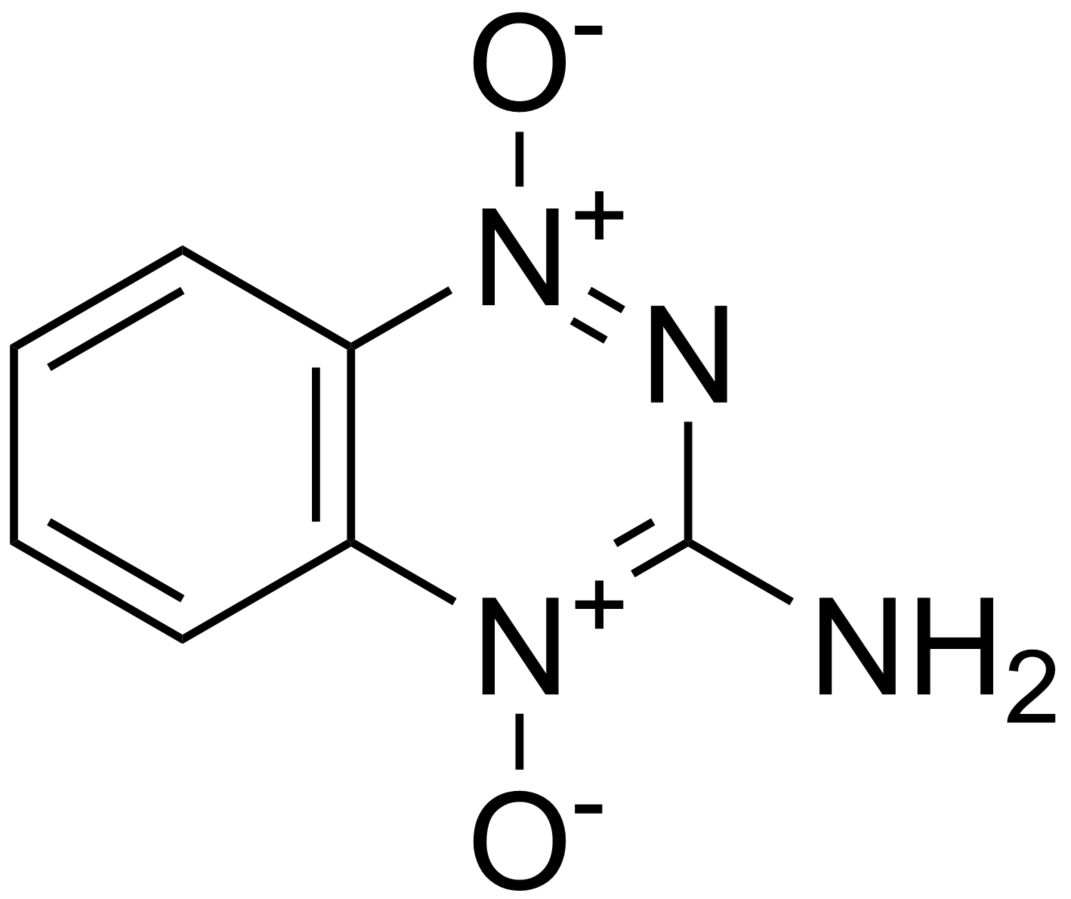
Mitomycin C alternatívaként különbözó bioreduktív anyagokat is vizsgáltak. A két legjobban vizsgált anyag, porfiromycin és tirapazamin, kedvezőbb cytotoxicitást mutattak a hypoxiás sejtekkel szemben, mint a mitomycin C. A porfiromycin jelenleg még kutatás alatt áll, hogy a laborban vizsgált eredmények a klinikumban is hasonló képpen mutatkoznak. A tirapazamin időbeosztás függö synergitást mutat különböző kemoterápiás anyagokkal (Brown és mtsai, 1998). Tirapazamin mellé leggyakrabban alkalmazott anyagok a cisplatin és az 5-flurouracil, amelyek együtt alkalmazva fokozzák a hypoxiás sejtek DNS-károsodását, valamint a vártnál magasabb lokoregionális kontrollt ad az előrehaladott daganatokban (Kim és mtsai, 1998).
|
2. ábra: Tirapazamin szerkezeti képlete |
Anémia kezelése
Az egyik gyakori oka a hypoxia kialakulásának a paciens anémiás állapota, emiatt a kezelés szempontjából létfontosságú annak korai felismerése és a megfelelő lépések megtétele annak kezelésére.
A hemoglobin szint és a prognózis közötti összefüggést először a 1940-es években méhnyakrák kezelése során vették észre. Ezt az észrevételt a későbbiekben más típusú daganatoknál is igazolták, emiatt megkezdődött a problémára való megfelelő megoldás keresése (Warde és mtsai, 1998). Az anémia nem csak a sugárkezelés szempontjából döntő jelentőségű, hanem a műtéti kezelésre is kihatással van. Azok a betegek, akik anémiában szenvedtek a műtét során szignifikánsan rosszabb 5 éves prognózist mutattak, valamint a kezelésük sikerességét is negatívan befolyásolta a csökkent hemoglobin szint (Guttenberger és mtsai, 1999).
A leggyakrabban alkalmazott terápiás módszer a transzfúzió. Ezen módszer alkalmazása esetén a lokális választ a sugárterápiára pozitívan befolyásolja, valamint összeségében is javítja a kezelés kimenetelét. Ez a módszer viszont ma már nem annyira alkalmazott, többek között a vele járó kockázatok miatt (fertőzés, immunszupresszió, krónikus/akut reakciók) (Henry DH, 1992). Ma gyakrabban alkalmazott módszer az r-HuEPO adása a kezelés során. Az ezen az anyaggal kezelt betegek 80%-a elérte a kívánt (14 g/dl) hemoglobin szintet. R-HuEPO-t jelenleg csak nem-myleoid daganatoknál alkalmaznak függetlenül attól, hogy a beteg részesül-e sugárterápiában (Lavey és mtsai, 1993). Az r-HuEPO-t tanulmányozták szájon át alkalmazott vasterápiával együtt, aminek eredményeképp szignifikánsan fokozódott a hemoglobin szint a nem ebbe a kezelésben résztvevő paciensekhez képest (Shasha és mtsai, 2000).
Konklúzió
Folyamatosan szükség van olyan módszerekre, amelyek növelik a lokoregionális kontrollt, valamint a túlélési rátát sugárkezelés után. Mivel ennek útjában nagyban ott áll a daganati hypoxia, emiatt mindig új és hatékonyabb módszerekre van szükségünk annak kezelésére. Emiatt fontosak azon kutatások, amelyeknek célja a különböző jelenleg is ismert módszerek fejlesztése, valamint új módszerek felfedezése.
HBO
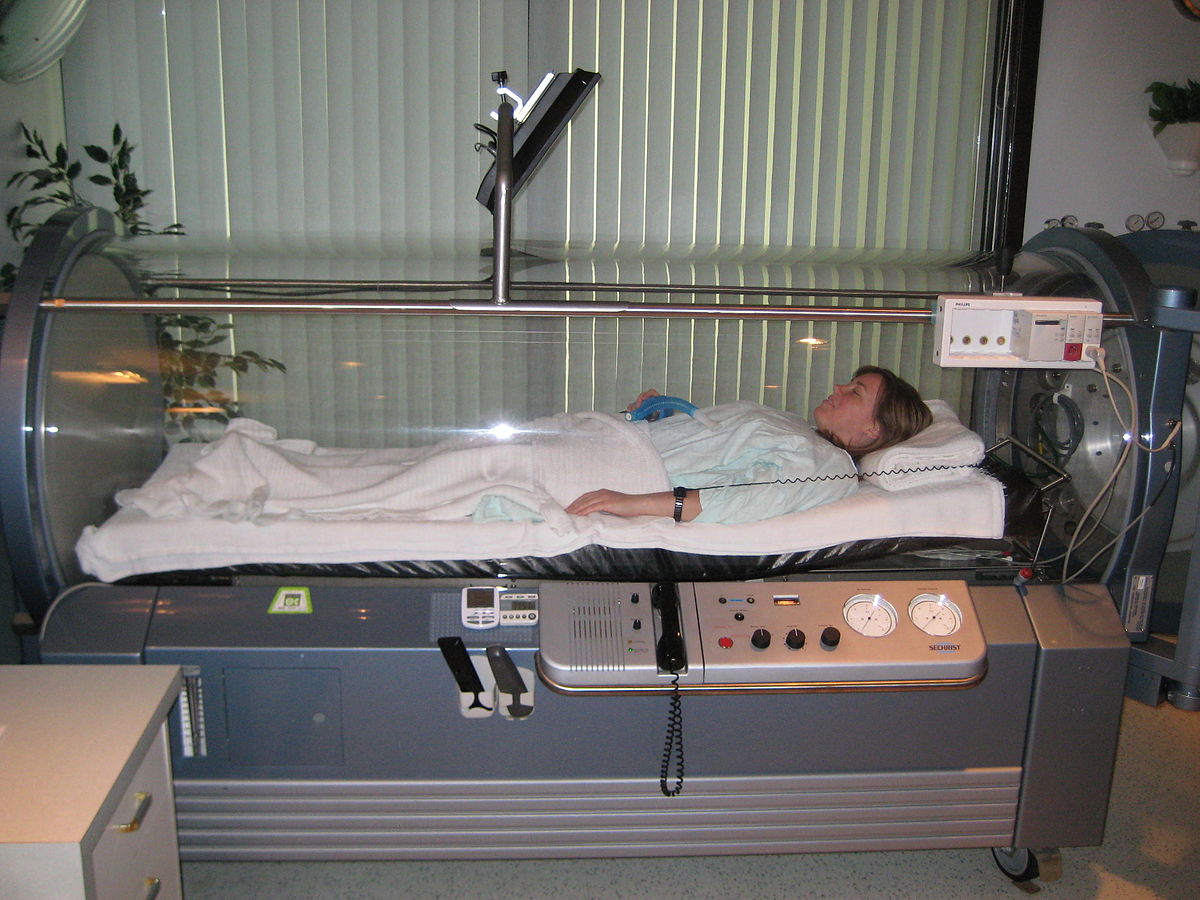
Granowitz és mtsai kimutatták, hogy a hiperbarikus oxigén kezelés (HBO) karcinómák sejttenyészetében programozott sejthalált okoz. Ezt többen is bizonyították (Mayer és mtsai, 2006). Ennek során 100 százalékos oxigéngázt lélegeztetnek be a beteggel, a besugárzás vagy a kemoterápiás kezelés előtt. A gáz belélegzése történhet közvetlenül oxigénpalackból orrmaszk segítségével.
|
3. ábra: Hiperbárikus oxigénterápia |
Ez a terápia azért működhet hatékonyan, mert az oxigenizáció a későbbiekben majd növeli a sejtek sugárérzékenységét, így sokkal kevesebb besugárzás is elég azonos hatás kiváltásához. Előnye az oxigén kezelésnek abban nyilvánul meg, hogy ezzel gyógyíthatóak a késői krónikus sugárkárosodások is. Ez a kezelés egyaránt jól alkalmazható jó- és rosszindulatú daganatokra. Ebből arra a lehet következtetni, hogy az anyagcsere folyamatokra hat. A tartós oxigéntelítettség szintén hasonló hatással bír.
Kemoterápiás gyógyszerek
Kiderült, hogy az oxigénhiányos tumorok sokszor ellenállóak a kemoterápiával szemben, in vitro és in vivo körülmények között is. Ezt hypoxia-indukált kemorezisztenciának nevezzük, komplex mechanizmuson alapul. A HBO kezelés a különböző gyógyszerek adagolásával együtt még kedvezőbb hatást tud elérni a tumorok visszaszorításában.
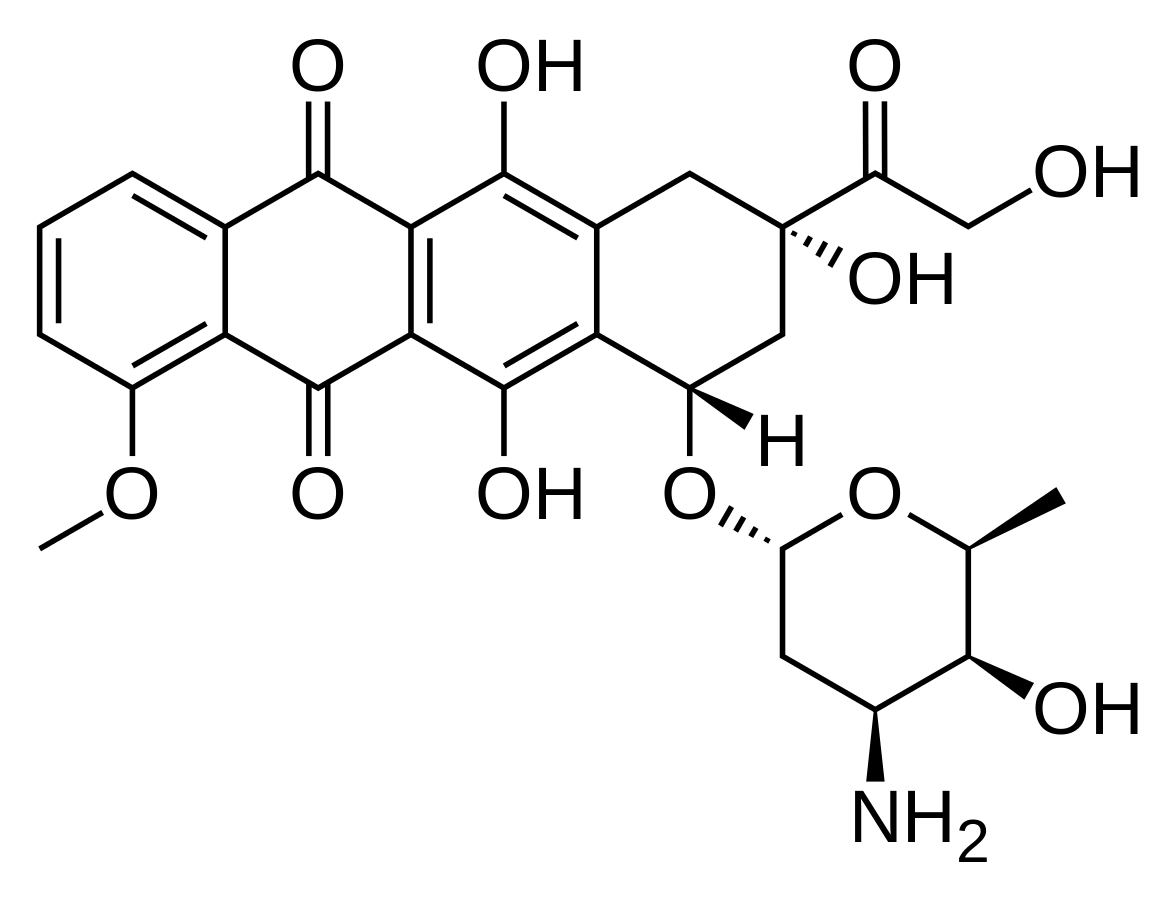
Ilyenek például a HBO és a doxorubicin vagy a HBO és az 5-fluorouracil.
|
4. ábra: Doxorubicin szerkezeti képlete |
Körülbelül 6 olyan molekulát fedeztek fel, ami kifejti a daganatellenes hatását a hypoxiás szövetben is. Ezek a tirapazamin (lásd. Sugárszenzitivitás és oxigenizácó), a tercier nitrogén oxid, EO9, RH1, NLCQ1, CB1954.
Antiangiogenikus szerek
A leggyakrabban használt antiangiogenikus szer a DC101, ami a VEGFR2 érképző faktor specifikus antitestje. Amikor agydaganatban szenvedő pacienseket kizárólag DC101-el kezeltek, nem láttak szignifikáns változást a tumor növekedésében, de amikor ezt sugárterápiával kombinálták, szignifikáns eltolódást találtak a daganat növekedési ütemében. Egy további vizsgálatban azt is figyelték, hogy ha a DC101 terápia megkezdése után 6-7 nappal kezdték el a sugárterápiát, akkor a vártál jelentősebb javulást tapasztaltak a növekedés visszatartásában. Amikor a DC101 hatását vizsgálták az hypoxiára, azt figyelték meg, hogy már a második napon szignifikánsan csökkent a mértéke, az ötödik napra szinte el is tűnt, viszont a nyolcadik napra enyhe visszatérést volt látható. Ezzel szemben az apoptózis szintje az ötödik napon tetőzött, viszont benne nem találtak csökkenést a nyolcadik napra. Ezzel magyarázható miért a leghatásosabb a sugárterápia megkezdése a 6.-7. napon.
Az eredményeket a 2. táblázat ismerteti:
|
nem kezelt kontroll |
IgG kezelt kontroll |
DC101 1.nap |
DC101 2.nap |
DC101 5.nap |
DC101 8.nap |
sejtmag denzitás (sejtmag/mm2) |
3166 ± 271 |
3214 ± 459 |
3181 ± 167 |
3315 ± 405 |
3503 ± 115 |
3142 ± 199 |
apoptózisos sejtmagok (összes sejtmag %) |
0.81 ± 0.09 |
0.86 ± 0.24 |
0.69 ± 0.05 |
0.67 ± 0.09 |
2.50 ± 0.31 |
2.27 ± 0.23 |
vérér asszociált apoptózisos sejtmagok (sejtmag/mm2) |
1.63 ± 0.59 |
0.91 ± 0.69 |
1.59 ± 0.30 |
0.94 ± 0.44 |
4.76 ± 0.90 |
4.99 ± 1.03 |
Egyéb lehetőségek
Számos egyéb daganatellenes kezelést is alkalmaznak még. Egy másik lehetséges módszer amikor egy oxigénben telített vízfürdőt készítenek a betegnek, a telítés oxigéngáz áramoltatással történik. Emellett ózonnal is próbálkoztak, de ez nem lett általánosan használt anyag. Az oxigén bejutása a tumorszövetbe közvetlen diffúzóval vagy vörösvérsejtek közvetítésével történik, ezért a vérszegény betegeknél sokszor nem sikeres ez a gyógymód. A daganatos betegek vérszegénységét eritropoetinnel kezelik, ami fokozza a tumorsejtek oxigenizációját.
A tanulmány összegzése
Az előzőekben leírtakat összesítve a daganatterápia egyik nélkülözhetetlen alapköve a kóros daganat sejteknek az oxigén ellátottsága, mely a kezelés kimenetelét lényegesen befolyásolhatja pozitív, illetve negatív irányban is. A terápia megkezdése előtt tisztában lévén a daganatok általános működési mechanizmusának, diagnosztizálni kell a tumort, majd felállítani az ismertek fényében a megfelelő prognózist. Ezek után kezdődhet maga a kezelés. Amennyiben a daganat hypoxiás, úgy oxigén hiányában rezisztensebb a sugár-, vagy kemoterápiával szemben, éppen ezért az anoxiás szöveti képződmény invazív is lehet. Erre építkeznek a különböző terápiás módszerek során, ezt kell kiküszöbölni azáltal, hogy a szervezetbe oxigént juttatunk be, vagy éppen azzal, hogy bizonyos készítmények felvételével a szövetekben reaktív oxigén gyökök képződnek, melyek elősegítik a sugárterápia soráni DNS károsítását a tumorsejtekben, ezzel mintegy kiírtva őket. A kutatások az oxigenizáció irányában hatalmas áttöréseket érnek el a daganatterápiában, mintegy 20 %-kal is növelhetik a túlélési esélyét a paciensnek, ami nem kis szó, tekintve, hogy még mindig mennyi feltérképezhetetlen területe maradt a témának.
Források
Felhasznált irodalomjegyzék:
Brown JM, Wang LH. (1998): Tirapazamine: laboratory data relevant to clinical activity. Anticancer Drug Des ;13:529-539
Deme Dániel dr.;Telekes András dr. (2017): A laktátdehidrogenáz (LDH) prognosztikai jelentősége az onkológiában. Orvosi hetilap, 158. évfolyam, 50. szám, 1977-1988 DOI: 10.1556/650.2017.30890
Feron O. (2009): Pyruvate into lactate and back: from the Warburg effect to symbiotic energy fuel exchange in cancer cells. Radiother Oncol.; 92: 329–333.
Frank W.; Sergey V. K. et al. (2004): Kinetics of vascular normalization by VEGFR2 blockade governs brain tumor response to radiation: Role of oxygenation, angiopoietin-1, and matrix metalloproteinases, Cancer Cell; 6,(6):553-563
Gődény Mária, Léránt Gergely (2014): Új lehetőségek, MRI-biomarkerek a fej-nyaki daganatok értékelésében. Magyar Onkológia 58, 269–280
Granowitz, E. V., Tonomura, N., Benson, R. M. és mtsai (2005): Hyperbaric oxygen inhibits benign and malignant human mammary epithelial cell proliferation. Anticancer Res., 25(6B), 3833–3842.
Grigsby PW, Winter K, Wasserman TH et al. (1999): Irradiation with or without misonidazole for patients with stages IIIB and IVA carcinoma of the cervix: final results of RTOG 80-05. Int J Radiat Oncol Biol Phys ;44:513-517
Guttenberger R, Lutterbach J; Beck C. (1999): Anemia is associated with decreased local control of surgically treated squamous cell carcinomas of the glottic larynx. Int J Radiat Oncol Biol Phys ;45(suppl 1):203
Haffty BG, Son YH, Papac R et al. (1997): Chemotherapy as an adjunct to radiation in the treatment of squamous cell carcinoma of the head and neck: results of the Yale mitomycin randomized trials. J Clin Oncol.;15:268-276
Hellman S. (1997): Principles of cancer management: radiation therapy. In: DeVita Jr VT, Hellman S, Rosenberg SA, eds. Cancer: Principles & Practice of Oncology, Fifth Edition. Philadelphia: Lippincott-Raven Publishers, :307-331.
Henry DH. (1992): Changing patterns of care in the management of anemia. Semin Oncol.;19(suppl 8):3-7
Hermans R. Head and Neck Cancer Imaging. Second Ed. Springer, Berlin 2012
Hockel M, Knoop C, Schlenger K et al. (1993): Intratumoral pO2 predicts survival in advanced cancer of the uterine cervix. Radiother Oncol.;26:45-50
Höckel, M.; Schlenger, K.; Aral, B. és mtsai (1996): Association between tumor hypoxia and malignant progression in advanced cancer of the uterine cervix. Cancer Res., 56, 4509–4515.
Keyes SR, Rockwell S, Sartorelli AC. (1985): Enhancement of mitomycin C cytotoxicity to hypoxic tumor cells by dicoumarol in vivo and in vitro. Cancer Res., 45:213-216
Kim C, Pinto HA, Tate D et al. (1998): Tirapazamine, cisplatin & fluorouracil as induction chemotherapy & simultaneous chemoradiotherapy for organ preservation in advanced head and neck cancer. Proc Am Soc Clin Oncol., 17:395a
Kondo A, Safaei R, Mishima M et al. (2001): Hypoxia-induced enrichment and mutagenesis of cells that have lost DNA mismatch repair. Cancer Res., 61:7603-7607
Lavey RS, Dempsey WH. (1993): Erythropoietin increases hemoglobin in cancer patients during radiation therapy. Int J Radiat Oncol Biol Phys., 27:1147-1152
Louis B. Harrison at al. (2002): Impact of Tumor Hypoxia an Anemia on Radiation Therapy Outcomes. The Oncologist 7, 492-508
Mayer, R.; Hamilton-Farrell, M. R., van der Kliej, A. J. és mtsai (2005): Hyperbaric oxygen and radiotherapy. Strahlenther. Onkol., 181, 113–123.
Okunieff P, de Bie J, Dunphy EP et al. (1996): Oxygen distributions partly explain the radiation response of human squamous cell carcinomas. Br J Cancer., 27(suppl):S185-S190.
Reynolds TY, Rockwell S, Glazer PM. (1996): Genetic instability induced by the tumor microenvironment. Cancer Res., 56:5754-5757
Shasha D, George MJ, Harrison LB.(2000): Once-weekly dosing of epoetin alfa increases hemoglobin and improves quality of life in anemic cancer patients receiving radiation therapy either concomitantly or sequentially with chemotherapy. Blood ;96(part IA):434a
Sica A; Larghi P; Mancino A, et al. (2008): Macrophage polarization in tumour progression. Semin Cancer Biol.; 18: 349–355.
Sonveaux P; Vegran F; Schroeder T, et al. (2008): Targeting lactatefueledrespiration selectively kills hypoxic tumor cells in mice. J Clin Invest.; 118: 3930–3942.
Steve Seung-Young Lee, Univ. of Chicago Comprehensive Cancer Center, National Cancer Institute, National Institutes of Health
Strauss HG, Haensgen G, Becker A et al. (1999): Prognostic impact of changes in the tumor tissue pO2 during early radiotherapy in cervical cancers: improved local control in primarily hypoxic tumors with reoxygenation and the impact of hemoglobin. Int J Radiat Oncol Biol Phys., 45(suppl 1):364
Stuben G, Stuschke M, Knuhmann K et al. (1998): The effect of combined nicotinamide and carbogen treatments in human tumour xenografts: oxygenation and tumour control studies. Radiother Oncol ;48:143-148.
Teicher BA. (1995): Physiologic mechanisms of therapeutic resistance:blood flow and hypoxia. Hematol Oncol Clin North Am., 9:475-506.
Tímár J.; Tóth J.; Döme B. és mtsai (2000): Tumor-sinusok avagy vaszkuláris csatornák malignus daganatokban. Magy. Onkol. 44, 105–107.
Tóth J. (2007): Az oxigenizáció hatása a daganatok biológiai viselkedésére. Orvosi Hetilap, 148. évfolyam, 30. szám, 1415–1420
Vaupel, P. (2006): The role of hypoxia-induced factors in tumor progression. The Oncologist 9, Suppl. 5, 1–15.
Képjegyzék:
1. ábra: Deme Dániel dr.;Telekes András dr. (2017): A laktátdehidrogenáz (LDH) prognosztikai jelentősége az onkológiában. Orvosi hetilap, 158. évfolyam, 50. szám, 1977-1988 DOI: 10.1556/650.2017.30890 után saját szerkesztett kép
Táblázatok:
1. táblázat: Haffty BG, Son YH, Papac R et al. (1997): Chemotherapy as an adjunct to radiation in the treatment of squamous cell carcinoma of the head and neck: results of the Yale mitomycin randomized trials. J Clin Oncol 15:268-276 alapján saját készítésű táblázat
Frank W.; Sergey V. K. et al. (2004): Kinetics of vascular normalization by VEGFR2 blockade governs brain tumor response to radiation: Role of oxygenation, angiopoietin-1, and matrix metalloproteinases, Cancer Cell; 6,(6):553-563 alapján saját készítésű táblázat