A gyulladásos és neuropátiás fájdalom (hiperalgézia); a proinflammatorikus citokinek szerepe
Munkánkban a fájdalom molekuláris és anatómia alapjain át igyekszünk bemutatni a neuropátiás- és röviden a gyulladásos fájdalom mechanizmusait, szabályozásának rendszerét. Ezen felül említésre kerül a neuropátiás fájdalom által leginkább érintett betegség, a diabéteszes neuropátia. Végül a legfontosabb citokinek szerepére térünk ki.
Contents
A fájdalom definíciója
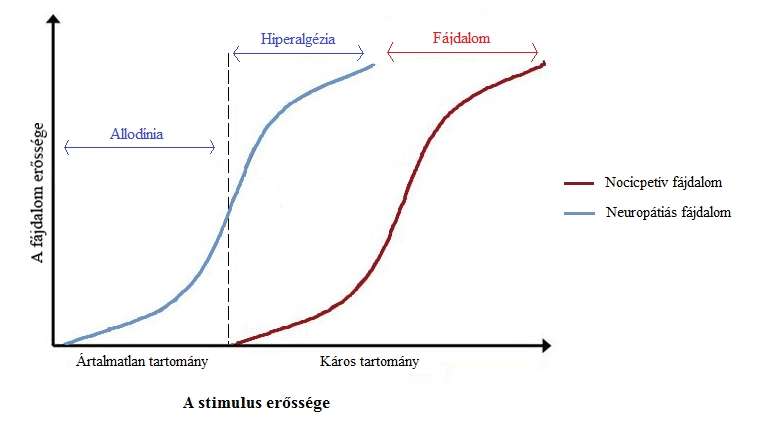
A fájdalom rendkívül fontos szerepet játszik a túlélésben: figyelmeztet minket a komolyabb sérülés veszélyére, vagy ha már megtörtént, a keletkezett kárt a minimumon igyekszik tartatni. Olyan reflexeket és viselkedésformákat generál, amik az egyed túlélését, épségének megőrzését igyekeznek elősegíteni. Ha a sérülés megtörtént, akkor az idegrendszer úgynevezett hiperszenzitivitást hoz létre a sérült szövetben és környékén, mégpedig azért, hogy a sebgyógyulást ne akadályozzák a hozzáérő tárgyak. Ezt nocicpetív fájdalomnak nevezzük. Megfigyeltek olyanokat, akik születésüktől fogva képtelenek voltak érzékelni a fájdalmat, és ez ahhoz vezetett, hogy a különféle stimulusokra adott válasz hiányában szöveti és egyéb károsodást szenvedtek. Azonban lehet jó is, ha nem, vagy kevésbé érzünk fájdalmat, például stresszhelyzetben, amikor a fájdalom hátráltatna a menekülésben. A krónikus fájdalom viszont gyakran nem védő szerepet lát el, hanem funkció nélkül keseríti meg az emberek vagy állatok életét: sokszor kínzó, meg nem szűnő fájdalomként jelentkezik azoknál, akik például arthritisben, vagy csonttumorban szenvednek. Hiperalgéziának nevezük, amikor káros stimulusra a szokásosnál erősebb érzet alakul ki. Allodíniának pedig hogyha a stimulus alapvetően nem káros, de mégis fájdalmat generál (lásd: 1. Ábra).
|
A fájdalom mechanizmusai
A fájdalmat a periférián primer neuronok szállítják a központi idegrendszerbe, ahol tudatosul, és valamilyen válaszreakciót alakít ki. Ezeket a fájdalmas ingereket érzékelő receptorokat, melyek szabad idegvégződések, nociceptoroknak nevezzük. Az arc különböző részeiről történő fájdalominger szállításért felelős idegsejtek sejttestjei a trigeminus ganglionjában, míg a test többi területéről érkező fájdalominger esetében, a dorzális ganglionban (DRG) helyeződnek. A rostokat két nagy csoportba tudjuk osztani, egyik az A rostok, amelyeket tovább osztva Aδ és Aß rostokat tudunk megkülönböztetni.
Az Aδ rostok közepes átmérőjűek és myelinizáltak, káros stimulusokat érzékelnek, ők a fájdalom első érzékelői, utána kapcsolódnak be a C rostok. Ezen kívül a primer, azaz a kis helyen lokalizált fájdalmat érzékelik. Több típusa van: amely hőt és mechanikai ingert is érzékel, illetve, ami csak hőt, és ami csak mechanikai ingert. Az az Aδ rosttípus, amely hő és mechanikai ingert is érzékel, két csoportra osztható. Az első, amely ingerküszöbe alacsony a mechanikai hatásokra, így ez a mechanikai fájdalom első érzékelője. Magas ingerküszöbe van a hőre (>50oC), de ha a fájdalom stimulusa hosszan fennáll, akkor ez csökken. A második típus alacsony ingerküszöbbel rendelkezik hőhatásokra, de mechanikaiakra magassal; azaz ez az, ami hőre gyorsan akut fájdalmat alakít ki.
Az Aß rostok nagyobb átmérőjűek és myelinizáltak, ezért gyorsabbak az Aδ rostoknál. Az ő feladatuk a nem káros stimulusokat érzékelni. A periférián lévő nem neuron érző egységektől (Merkel-féle tapintó test például) származó jelet a központba szállítják.
A C rostok nem myelinizáltak, kis átmérőjűek, így jóval lassabban szállítják az ingerületet, mint az A rostok. Általában polimodálisak, azaz több féle stimulusra is érzékeny egy rost: van, amely hőt és mechanikai ingert, van, amely mechanikai ingert és hideget, és van, amely mechanikai ingert, hideget és meleget is érzékel. Van olyan típus, amely csak egy féle stimulusra érzékeny, ilyen a hőérzékeny C rost, ami a C rostok 10%-át teszi ki. Egy különleges típusa a C rostoknak az ún. „silent” rost, ami mechanikai és hő hatásokra is érzéketlen, mindaddig, amíg különféle gyulladásos mediátorok nem érzékenyítik.
A rostok között óriási heterogenitás figyelhető meg, ez főleg a C rostokra jellemző, ahol egy peptiderg és nem peptiderg populációt lehet megfigyelni. A peptiderg populáció különféle neuropeptideket, Substance-P-t és CGRP-t (calcitonin-gene-related peptid) tud kibocsátani, a nem peptiderg populáció különféle receptorokat expresszál. Az érzőrostok a periférián felrostozódnak és myelinhüvelyüktől megválva kisebb (A rostok) és nagyobb (C rostok) részt idegzenek be. Az neuronok a centrális terminusukon és a perifériás terminusukon is ki tudják juttatni a sejttestükben szekretált anyagokat, így CGRP-t és Substance-P-t is, ami, ha a periférián jut ki a sejtből, akkor vazodilatációval és különféle fehérjék extravazációjával neurogén gyulladáshoz vezet.
Az ioncsatornák szerepe a fájdalomban
Az érzékelés szinte minden formájában kiemelkedő szerepe van az ioncsatornáknak, melyek bizonyos hatásokra nyílnak, vagy záródnak és így akciós potenciált váltanak ki. Éppen ezért tartottuk fontosnak a fájdalom jobb megértéséhez az egyes folyamatok során a legfontosabb ioncsatornák bemutatását.
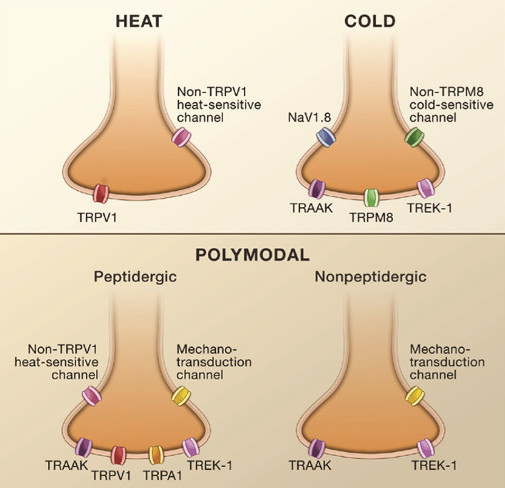
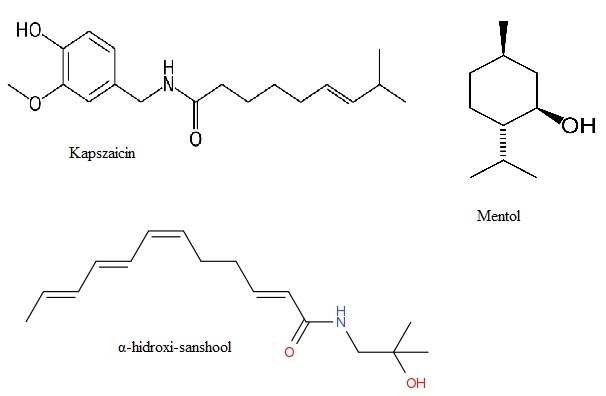
43oC-on határozták meg a káros hőt, mert ez vált ki fájdalmat a C nociceptorokon és Aδ hő és mechanikai érzékeny II-es típusú nocicpetor esetében. Ez a kapszaicin (képletét lásd: 3. Ábra) érzékeny TRPV-1 ioncsatorna (csatornákat lásd: 2. Ábra) ingerküszöbe is, mely az A rostokon és a csak hőérzékeny C rostokon található. Vannak egyéb csatornák is, mint a TRPV-2, melyről azt feltételezték, hogy a C rostokon felelős a hőérzékelésért, de ez az elmélet megdőlni látszik (Dubin és Patapoutian, 2010).
|
A hidegérzékelésében elsősorban a mentol (képletét lásd: 3. Ábra) érzékeny TRPM8 csatorna vesz részt, de vannak 4%-ban mentol inszenzitív, de hideg érzékelő rostok is. A TRPA1 is részt vesz a hidegérzékelésében, mely gyulladás esetén érzékeli a káros 15oC alatti hideget (bár ezen a téren az eredmények ellentmondásosak).
A mechanikai stimulusokat érzékelő csatornák, mechanizmusok nincsenek teljesen feltárva. Egy fonálféreg (Caenorhabditis elegans) receptorait vizsgálták (mec-4 és mec-10) és ezeknek az orthrológjait nézték meg emlősökben, melyek az ASIC-1, -2 és -3 csatornák, amik elsősorban savas pH-ra nyílnak, mert proton érzékenyek. Az ő hatásukat nem tudták bebizonyítani, de a fonálférgekben is komplexet képeznek egy somatin-like proteinnel (MEC-2). Ennek az orthrológja (SLP3), mikor egérben hiányzott, a nem káros fájdalom érzékelésében történtek változások (Bausbaum és mtsai, 2009), mert ilyenek az alacsony ingerküszöbű Aß és Aδ érzőrostokon vannak. Azt, hogy ez is komplexben működik-e, még nem sikerült kideríteni. Egyéb csatornák szerepét is kimutatták, mint a TRPV-2 és -4, melyek inkább az ozmotikus regulációban vesznek részt és a mechanikai érzékenység szempontjából elsősorban a hyperalgéziában van szerepük. Illetve a TRPA1, ami úgyszint nem elsődleges a mechanikai érzékelésben. Vizsgálták a KNCK-18 ioncsatornát, ami a szecsuáni bors (Zanthoxylum piperitum) hatóanyagára, az α-hidroxi-sanshool-ra (képletét lásd: 3. Ábra), adott választ, szúró, zsibbadó fájdalmat okozova (Bausbaum és mtsai, 2009), de valószínűleg ez sem elsődleges.
|
Kémiai irritációt nagyon sok anyag okoz, vannak közöttük olyanok, amelyek endogén keletkeznek, például egy gyulladásos folyamatban, míg mások kívülről kerülnek be. A legfontosabb ide tartozó ioncsatornák a már említett TRPV-1 (kapszaicin) TRPM-8 (mentol) és a legjelentősebb a TRPA1, amelyre nagyon sok anyag hat.
A keletkezett ingerület továbbításában a különböző feszültségfüggő Na+ és K+ csatornáknak kiemelkedő szerepe van, a Ca2+ csatornáknak főleg a neurotranszmitter kibocsátásban van szerepük. Különféle ma is használt analgetikumok (fájdalomcsillapítók) célpontjai ezek a csatornák.
A szervezet normális működése szempontjából fontos a fájdalom gátlása, ebben nagy szerepe van az endogén opioidoknak is. Ők gyulladásos folyamatok során kiszabadulnak a különféle immunsejtekből, melyek úgyszint a gyulladásos mediátorok hatására vándorolnak oda, és ilyenkor a receptoraik (MOR, DOR, KOR) is upregulálódnak. A perifériás opioid hatásnak óriási klinikai jelentősége lehet, hiszen, ha olyan agonistákat tudnak tervezni ezekhez a receptorokhoz, amelyek nem képesek átlépni a vér-agy gáton, ezek akkor is képesek lesznek kifejteni analgéziás hatásukat a periférián (Stein és mtsai, 2009)
A gyulladásos fájdalom
Különféle sérülések, fertőzések folyamán létrejövő gyulladás során rengeteg mediátor szabadul fel, immunsejtekből, endothél sejtekből, keratinocitákból és fibroblastokból. Természetesen az aktivált nociceptorokból is kiszabadulnak különféle mediátorok. Ezek az anyagok, mint neurotranszmitterek, citokinek, eikozanoidok extracelluláris proteázok, protonok (hidrogénionok) közvetlenül és közvetetten is hatnak a különféle receptorokra, melyeket az érző idegsejtek expresszálnak. Így mechanikai és hő hiperalgéziát és allodiniát okoznak, elsősorban a TRPV-1-es, TRPA-1-es és ASIC receptorokon keresztül.
Gyulladásos fájdalom kutyákban gyakran jelentkezik osteoarthritis képében, ezért ezzel a betegséggel a következőkben részletesebben foglalkozunk.
Osteoarthritis
A gyulladásos fájdalom egyik példája, a kutyák esetében is egyre gyakrabban megfigyelt kórkép (Canapp, 2013), az osteoarthritis, ami az ízületeket érinti.
Kiváltó oka lehet a túlsúlyosság, idős kor, túlzott megterhelés vagy autoimmun betegség, de a genetikai prediszpozició is szerepet játszhat a kialakulásában. Amikor az ízületi porc sejtjei károsodnak, olyan enzimatikus folyamatok indulnak be, amik az adott ízület gyulladását, merevségét, duzzanatát, valamint izomatrófiát, így végül sántaságot okoznak. A betegség során a felszabaduló enzimek, esetleg reaktív oxigén gyökök károsítják a chondrocytákat, és bontják a porc mátrixát.
Érintett a porc alatti csontszövet is, ami elmeszesedik, osszifikáció jön létre, vagy különféle kinövések, ún. csontsarkantyúk keletkeznek. A sérülés során felszabaduló gyulladásos mediátoroknak kiemelkedő szerepe van, mind a porcszövet degradációja, mind a hiperalgézia kialakítása szempontjából. A hiperalgézia lehet centrális vagy perifériás szenzitizáció oka, és betegenként eltérő, hogy melyik lesz a fokozott fájdalom kiváltója (Andrew és mtsai, 2013).
Az ízületi tokban, ligamentumokban és periosteumban elhelyezkedő nociceptorok a gyulladás során felszabaduló gyulladáskeltő citokinek hatására érzékenyítődnek. A TNF-α és IL-1 különösen jelentős, mert egyéb citokinek és faktorok termelését is serkentik. Kiemelkedő szerepe van még az FGF-2-nek, ami sokféle reakcióúton sok kinázt aktiválva hat, ezek a kinázok foszforilálnak bizonyos transzkripciós faktorokat és így a mátrixot bontó enzimek szintézisét serkentik. Jelentős az a reakcióút, amikor a PKCδ aktivációján keresztül hat, mert ez szabályozó funkióval bírhat, hiszen több anyag jelpálya útvonalának is közös pontja (FGF-2, Substance-P, TNF-α, IL-1, Fibronectin-fragment).
Kutya esetében a betegég jele lehet a sántítás, illetve ha az érintett ízület érintésre érzékeny, nehezebben, kevesebbet mozog az állat. Ilyenkor egyéb vizsgálatokkal, mint ízület-szúrcsapolás vagy különféle radiológiai vizsgálatok, igazolhatjuk diagnózisunkat (Canapp, 2013). Szerencsére többfajta gyógymód áll rendelkezésünkre, de mindezek előtt meg kell szüntetni a patológiás állapotot kiváltó okot (pl. meniscus-sérülésnél, kollaterális szalag sérülésénél, elülső kereszt szalag szakadásnál).
Elnyújtott hatású anyagok: injekcióval poliszulfatált glükózaminoglikánok, intraartikuláris hyaluronsav; valamint szájon át pl. chondroitin-szulfát és hosszú szénláncú zsírsavak alkalmazása sikeres lehet a kezelés során. A fájdalom enyhítésében használhatóak lehetnek az egyes gyulladásos mediátorok receptor antagonistái. Ezen kívül ígéretes eredményeket mutattak ki két anyag, a rezveratrol (trans-3,4’,5-tryhydroxistilbene, másnéven transz-rezervatrol) és bovine lactoferricin (LfcinB), esetében (Andrew és mtsai, 2013). Mindkettőnek a porc degradációját gátló hatása van, de a bovine lactoferricin esetében antibakteriális, antivirális, antikarcinogén hatást is kimutattak (Andrew és mtsai, 2013). Andrew és munkatársai kísérletében szarvasmarha nucleus pulposusában és humán chondrocytákban is vizsgálták a rezveratrol hatását, aminek során a mátrix bontó enzimek gátlását tapasztalták, mind transzkripcionális, mind transzlációs szinten. A LfcinB hasonló kísérleti körülmények között az FGF-2 és IL-1 termelését csökkentette, illetve gátolta az oxidatív stresszt és gyulladást okozó faktorok produkcióját. A helyileg bejuttatott szteroidok és nem szteroid gyulladáscsökkentők (NSAID) szintén javítanak az állat állapotán, azonban a fájdalom csökkenése mellett rehabilitációs kezelések (pl. vízi jártató, fizikoterápia) szükségesek. A páciens fogyása valamint az alternatív terápiák (pl. akupunktúra) szintén pozitívan hathatnak a gyógyulási folyamatokra.
A neuropátiás fájdalom
A nocicpetív, azaz védekező fájdalommal szemben a fennálló, perzisztens fájdalomnak semmiféle biológiai előnye nincsen számunkra, kizárólag kóros folyamatok eredménye (Woolf és Mannion, 1999.). Ezt nevezzük neuropátiás fájdalomnak. Ez az idegrendszer, az idegsejtek sérüléséből ered, és többféle tünetet okozhat: a szenzoros érzékelés hiányát, égető, vagy kis nyomásra, érintése, szúrásra jelentkező erős fájdalmat, külső hatással nem magyarázható fájdalomrohamokat.
A neuropátiás fájdalom kialakulásának nagyon sok oka, mechanizmusa lehet. Egyik ezek közül az afferens ideg sérülése. Idegi sérülés során ugyanis neuróma (idegdaganat) keletkezhet, ami vezethet spontán aktivitáshoz vagy rendellesen érzékenységhez különféle stimulusokra (Campbell és Mayer, 2006.) Azonban más vizsgálatok szerint nem feltétlenül szükségesek a neuropátiás fájdalomhoz a sérült idegből érkező jelek.
Azok a nociceptorok is szerepet játszhatnak benne, amik a sérült területet idegzik be, de ők maguk nem sérültek meg. Kísérletekkel bizonyították, hogy a sérült ideg beidegzési területén található ép afferensek adrenerg szenzitivitást, és TNFα-ra való megnövekedett érzékenységet mutattak (Campbell és Mayer, 2006.).
Fontos szerepük van még a növekedési (trófikus) faktoroknak is, mert jelentős hatásuk van a szenzoros és motoros rostokra egyaránt. Ha sérül az ideg, megváltozik a termelődésük. Az NGF (neuron growth factor) hő hiperalgéziát alakít ki. Idegi sérülés során termelődik, hiszen feladata az idegek regenerációja – azonban ha már képződött neuróma, akkor ez megakadályozza az NGF hozzáférését a sejtekhez. Ezáltal a felhalmozódott trófikus faktor hiperszenzitivizálhatja a többi, ép sejtet (Campbell és Mayer, 2006.).
Előfordulhat, hogy a sérült axon nem tudja közvetíteni a frissen termelt jelátviteli fehérjéket, és ezek a felhalmozódás miatt korán expresszálódnak, ez okozhat ektópikus aktivitást.
A nátrium csatornák közül néhány (az 1.3, 1.7, 1.8 és 1.9) részt vesz a neuropátiás fájdalom kialakításában. Ezek jelen vannak a DRG-ben (dorzális ganglion), részt vesznek a nociceptorok irányításában. Kóros esetben ezekben csökkenhet a küszöbérték, ezért kisebb stimulusra kelthetnek akciós potenciált, így aktiválva a fájdalomérző rostokat hiperszenzitivizáció esetén.
A perifériáról érkező ingerületet normális esetben különféle mechanizmusok szabályozzák. Például ezek közé tartozik a glutamát ürítésének gátlása mű-opioid receptorok által. Kísérletekkel bizonyították, hogy ezek a receptorok downregulálódnak idegi sérülés következtében (Campbell és Mayer, 2006.). Ez a centrális szenzitizáció egyik lehetséges útja.
Ide tartozik még például a kalcium csatornák upregulációja is a fájdalomérzők központi végződésén, és mivel a kalcium jel miatt ürülnek a neurotranszmitterek, ezért megnövekedett kalcium beáramlás fokozott ürítéshez vezet (Campbell és Mayer, 2006.)
A kalcium beáramlás azonban posztszinaptikusan depolarizációhoz vezet. Ez is része lehet a centrális szenzitizációnak, például ha a substance-P neuropeptid hatására a glutamát függő NMDA csatornák kinyílnak, és így a kalcium nem csupán az AMPA csatornákon át tud érkezni. Ez egy hosszú távú érzékenyítési folyamathoz vezet, ami hasonló az agyban létrejövő Long Term Potentiation-höz (LTP).
Szenzitizációhoz vezethet a különféle gátló folyamatok megszűnése is, például ha kevesebb gátló receptor expresszálódik az idegsejteken. Ez bizonyítottan megtörténhet idegi sérülés esetén (Campbell és Mayer, 2006.).
Sajnos visszafordíthatatlan folyamat, ha a gátló GABAerg interneuronok szelektív apoptózisa lép fel (Campbell és Mayer, 2006.). Ekkor a perifériás területeket célzó terápia már egészen biztosan sikertelen lesz.
Bár a neuropátiás fájdalom kezelése napjainkban egészen előrehaladott stádiumban van, a fentiekből is látszik, mennyire bonyolult és összetett az ellene irányuló küzdelem.
Neuropátiás fájdalmat többféle betegség is okozhat, azonban nehéz beazonosítani a fájdalom alapján az okot. Nem mindegyik betegnél lép fel a neuropátiás fájdalom, és akiknél fellép, azoknál sem ugyanúgy. Ugyanazokat a tüneteket okozhatja más mechanzimus, vagy ugyanaz a mechanizmus okozhat más-más tüneteket, de egy betegnél akár több folyamat is közrejátszhat.
A legismertebb betegség a diabéteszes neuropátia: az érintettekben égető fájdalmat okoz, ami általában a lábfejben keletkezik. Erről később bővebben lesz szó.
Talán kevésbé ismert a „Tic douloureux” nevű betegség, amit neveznek tigeminális neuralgiának is. Fájdalomrohamokat okoz az arc különböző területein. Oka az ideg agyba való belépésénél való kompressziója, ami demyelinizációhoz vezet. Ezeknél a betegeknél az arc egy adott területének érintése váltja ki a fájdalomrohamokat.
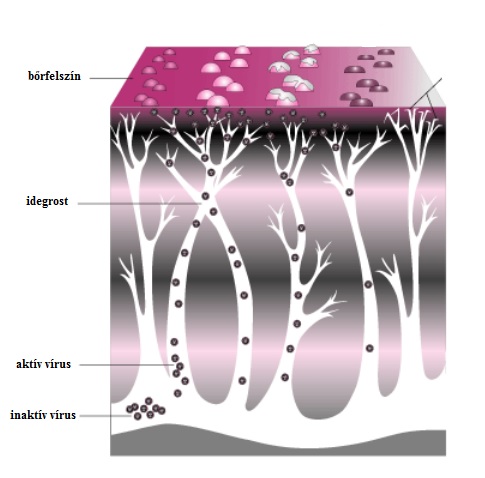
Fontos megemlíteni még a posztherpetikus neuralgiát is, ami az övsömör (herpes zoster) komplikációjaként léphet fel. A dorsalis gyökér ganglionja fertőződik, és a vírus az idegsejtekben terjedve a bőrhöz jut, ahol fájdalmas hólyagokat idéz elő. Ezek ugyan elmúlnak, de posztherpetikus neuralgia esetén megmarad a neuropátiás fájdalom az érintett területen (lásd: 4. Ábra). Ez azért alakulhat ki, mert a nociceptorok a vírus hatására elhalnak a fertőzött bőrfelületen, és emiatt a gerincvelőnek azon területe, ami normális esetben csak nociceptív jelet fogad, elkezd más, nem-nociceptív jeleket is fogadni. Ezt a központi idegrendszer félreértelmezi, így alakulhat ki allodínia (Woolf és Mannion, 1999.)
|
A diabéteszes neuropátia
A neuropátiás fájdalom megjelenésének aránya a diabéteszes betegek körében a legnagyobb. Ennek mechanizmusa igencsak szerteágazó, az összes út máig sem ismert. A kezelésében eddig csak a glükóz kontroll és a fájdalomcsillapítás bizonyult sikeresnek – azonban ezek is csak az egyes, és nem a kettes diabétesz típusban.
Leggyakoribb megjelenési formája a DSP, vagyis disztális szimmetrikus polineuropátia. Ennek a tünetei a zsibbadás, fájdalom, gyengeség, amelyek általában a lábban kezdődnek. Sok beteg úgy érzi, a zoknija begyűrődött, vagy nem jó rá a cipője. Habár ez a betegség fizikailag és mentálisan is ronthatja az életminőséget (például a zsibbadás sokszor eséshez vezethet), mégis sok diabéteszes beteg nem számol be orvosának a fenti tünetekről – pedig egyre nagyobb eséllyel kaphatnának sikeres kezelést.
A betegség kialakulásának oka a hiperglikémiában és a diszlipidémiában, valamint az inzulin rezisztenciában keresendő. A megnövekedett intracelluláris glükóz szint többféle mechanizmus által vezet súlyos károsodásokhoz a sejtekben.
A felgyorsult glükóz bontás (glikolízis) a légzési lánc túlterhelését, és ezáltal reaktív oxigén gyökök képződését okozza, amik károsíthatják a DNS-t, a zsírokat, a sejtmembránt.
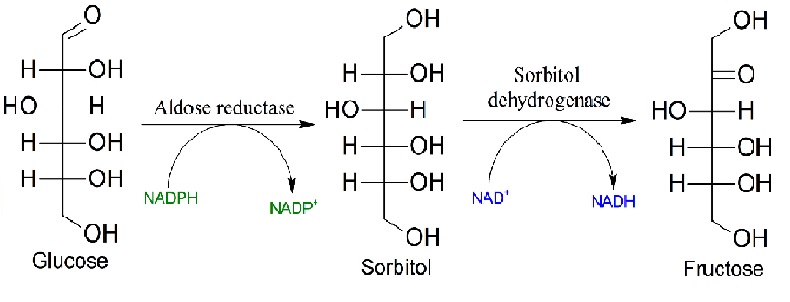
Ezen kívül fontos megemlíteni azt a mechanizmust, ami által a sejt a felhalmozódott glükózt szorbitollá alakítja („polyol pathway”, lásd: 5. Ábra). Emiatt ugyanis a sejtben súlyos ozmotikus stressz és NADPH hiány alakul ki, ami oxidatív stresszt is okozhat. Ez a reakció súlyos károsodást okoz nem csupán idegsejtekben, de a retinában és a vesében is.
|
Egy másik fontos probléma a diszlipidémia (azaz a szabad zsírsavak felszaporodása a vérben), ami károsíthatja a Schwann sejteket és proinflammatorikus citokinek felszabadulását serkentheti.
A fent említett folyamatok a sejtek súlyos károsodásához, ezáltal pusztulásához vezetnek, ami idegsejteknél egyenes utat jelent a neuropátia irányába.
A proinflammatorikus citokinek
A proinflammatorikus citokineknek fontos szerepe van a gyulladási folyamatok kialakításában, a sebgyógyulás folyamatában. Változatos molekuláris szerkezet jellemző rájuk. Nagyon kis koncentrációban vannak jelen, így a szérum szintjük nem árul el szinte semmit arról, hogy milyen lokális hatásaik vannak.
A fájdalom szempontjából jelentős szerepük van a gyulladásos fájdalomban, ahol a különféle egyéb gyulladásos mediátorokkal és hatásokkal, mint a hiperacidózis hatnak a fájdalom kialakulására és a hiperszenzitizációra. A gyulladt szövetben termelésüket a helyi macrophagok és oda migráló fehérvérsejtek végzik. Kiemelkedő szerepük van a neuropathiás fájdalomban is. Itt elsősorban gliasejtekből szabadulnak fel.
A következő pro-inflammatorikus citokineket ismerjük: IL-1β, TNF-α, IL-6, IL-15, IL-17, IL-18, és IFN-γ. Az IL-1β, TNF-α és IL-6 egymás termelődését pozitív feedbackkel segítik, így ha a gyulladásos folyamatok nem megfelelően szabályozottak, gátoltak, a fájdalom kialakulásakor fellépő citokin-kaszkád a krónikus gyulladás ördögi körévé válhat. A pro-inflammatorikus citokineket endogén módon a szervezet saját anti-inflammatorikus citokinjei (IL-4, IL-10 and TGF-β) transzlációs úton gátolják. Ezen anyagok algéziás hatása gyakran indirekt (pl. NO, PGE2 felszabadulás) vagy direkt, receptor-mediált.
TNF-α
A TNF-α szerepet játszik a fájdalom kialakításában, valamint a meglévő krónikus folyamatoknál a fájdalom fenntartásában.
A TNF-α a tumor nekrózis faktor/tumor nekrózis faktor receptor-fehérjék szupercsaládjába (TNF/TNFR SFP) tartozik. Kétféle receptoron hathat: TNFR1 és TNFR2. A TNFR1 az ép idegrendszerben mediálja a szenzoros neuronok ingerlését és a hiperszenzitizáció kialakulását, míg a TNFR2 a sérült idegben alakítja ki a neuropátiás reakciókat (Austin és Moalem-Taylor, 2010).
Az Aδ, Aß és C rostokra hatva csökkenti a mechanikai stimulusok ingerküszöbét.
Szubkután alkalmazva növeli a bőr ereinek átjárhatóságát, így a leukociták könnyebben beszűrődhetnek, fokozva a helyi immunválaszt. Ezenkívül egy perifériás ideg sérülése után a DRG neuronoknak (főként a Schwann sejteknek és makrofágoknak) megnő a TNF iránti érzékenysége, így akár hirtelen, gyors hiperszenzitizáció, hiperalgézia is kialakulhat (fokozza a TTX-R Na+ csatornákat, valamint növeli a membránok K+ áteresztő képességét így alakítva ki a neuropátiás fájdalmat).
A HIV terápiás kezelésénél, illetve a kemoterápiában nagymennyiségű TNF-α szabadul fel a szérumban, klinikai alkalmazásban rákellenes szer: a TNRF1-en valamint a „caspase” úton apoptózishoz vezet.
A TNF-α a központi idegrendszerben kulcsszerepet játszik a fájdalom közvetítésében (immune-to-brain), szekréciója főként a hippokampusban, a locus coeruleusban és a nucleus ruberben található. Gliális rendszereken keresztül mediálja a központi neuropátiás fájdalom mechanizmusait: idegi sérüléskor vagy gyulladáskor a mikroglia sejtek makrofág-szerű sejtekké alakulnak, amin MHC antigének fejeződnek ki és pro-inflammatorikus citokineket termelnek. Kimutatták, hogy az asztrociták felszínén a TNF-α G-protein kapcsolt receptor és TNF-α konvertáló enzim serkentésével a saját produkcióját stimulálja egy citokin-kaszkádot beindítva: IL-1, IL-6, NO, ATP képzés, így kialakul a patológiás fájdalom. (Leung és Cahill, 2010).
A speciális TNF-α-TNFR struktúrának köszönhetően génterápiás módszerekkel és fúziós proteinekkel csökkenthető a CCI által kiváltott allodynia és hiperalgézia. Ezentúl helyileg vagy a gerincvelőben alkalmazott TNF-α-antagonista anyagok szintén csökkentik a neuropátiás állatokban a fájdalmat (Austin és Moalem-Taylor, 2010).
IL-1β
Az IL-1β egy pleiotróp hatású pro-inflammatorikus citokin, kulcsszerepet játszik az akut és krónikus gyulladásokban, valamint az autoimmun rendellenességekben. A TNF-α-hoz hasonlóan ez is kétfajta receptoron keresztül fejtheti ki hatását: IL-1RI (ehhez kapcsolódva intracelluláris jelet alakít ki) és IL-1RII (egy csapdaként működik, nem vált ki sejtszintű választ).
Aktiválásában a gyulladásos folyamatok fő szabályzója az inflammasome (intracelluláris multi-protein komplex) játszik fontos szerepet, melynek végső lépéseként a Caspase-1 a pro-IL-1β-t bioaktív IL-1β-vá alakítja egy sejtsérülésre és mikrobiális összetevőkre érzékeny szenzor hatására beindult kaszkád részeként.
A köszvény egy ízületi nátrium-urát-felhalmozódás (MSU) okozta autoinflammatorikus rendellenesség, melynek főbb tünetei: intenzív pirosság, melegség, fájdalom az érintett ízület körül. A betegben láz, leukocitosis lép fel, gyulladásos markerek jelennek meg: inflammatorikus hatás kifejtése a NLRP3 inflammasome-on keresztül, IL-1β termelődés. Ez a folyamat IL-1 és IL-R1 antitestek, valamint IL-1ra rekombináns verziója (Anakinra) lokális alkalmazásával megszüntethető (Ren és Torres, 2009). Egyéb, IL-1β felszabadulással járó, fájdalmas autoimmun betegséget kiváltó ok lehetnek még az inflammasome összetevőit kódoló génszakaszok mutációi is („családi hideg csalánkiütés” (familial cold utricalia), Muckle-Wells szindróma).
Az IL-1β jelenléte bármely perifériás szövetben mechanikai és termális hiperalgéziát okoz. Komplex kaszkád jelrendszereken keresztül felszabadíthat vagy aktiválhat más nociceptív molekulákat, pl.: prostaglandin, Interleukin-6, Substance-P, MMP9. A NGF-re (nerve growth factor), mely kulcsszerepet játszik az akut és krónikus fájdalomban, up-regulációval hat transzkripciós és post-transzkripciós szinten. A nociceptorokra direkt módon is hathat, mivel felszínükön van IL-1RI, valamint a neuronok ingerlékenységét is befolyásolja receptorokon keresztül: TRPV1, Na-csatornák, GABA receptorok, NMDA receptorok.
Ahogy korábban említettük, az idegrendszer működési zavara neuropátiás fájdalomként jelentkezik. A sérült idegben nő az IL-1β kifejeződése, így a perifériás ideg sérülése után rögtön aktiválódnak a Schwann sejtek, a makrofágok odasereglenek, és mindkét sejttípus IL-1β-t szekretál. A gerincvelői gyulladásoknál tehát az IL-1β és az aktivált mikroglia sejtek fontos erősítő szerepet játszanak a nociceptív továbbításban (Ren és Torres, 2009).
IL-6
Az IL-6 egy főként gyulladást keltő jellegű citokin, de bizonyos estekben anti-inflammatorikus hatású is lehet. Hatását az IL-6R-en keresztül fejti ki, mely főként Schwann sejteken, makrofágokon, mikrogliákon és neuronokon található.
Idegi sérülésekkor jelentős szerepet játszik a szervezet reakcióiban: az ülőideg sérülésekor IL-6 up-reguláció figyelhető meg. A DRG-ben unilaterális idegi sérülést követően bilaterális up-regulációt mutattak ki, valamit a gerincvelőben egy perifériás ideg sérülésekor a dorsalis szarvban az IL-6 mennyisége megnő. Számos tanulmány kimutatta, hogy a pro-inflammatorikus citokin kaszkádban kiemelkedő szerepet játszik: először a TNF-α aktiválódik, majd ez indukálja az IL-1β működésbe lépését, ami végül az IL-6 felszabadulását váltja ki.
Perifériás ideg sérülésekor az IL-6 és az IL-6R többnyire a Janus kináz (JAK) szignálon, valamint a STAT (signal transducers and activators of transcription) transzkripciós faktor útján fejti ki hatását, más-más végeredménnyel a periférián és a gerincvelőben.
Az IL-6 akut nocicepcióra kifejtett hatásmechanizmusa még nem pontosan tisztázott, mivel különböző feltételek mellett eltérő, akár ellentétes hatásokat is kiválthat. Például, intraplantárisan alkalmazva mechanikai vagy termális hiperalgéziát is okozhat.
Habár egy humanizált monoklonális IL-6R elleni antitestet (Tocilizumab) nemrégiben kifejlesztettek a rheumatoid arthritis kezelésére, az IL-6 eltérő hatásai miatt nem igazán került a gyógyszerkutatások központjába (Austin és Moalem-Taylor, 2010).
Irodalomjegyzék
Andrew, S. L.; Ellman, M. B.; Yan, D.; Kroin, J. S.; Cole, B. J.; van Wijnen, A. J.; Im, H. (2013, Elsevier): A current review of molecular mechanisms regarding osteoarthritis and pain. Gene 527:(2) 440-447.
Austin, P. J.; Moalem-Taylor, G. (2010): The neuro-immune balance in neuropathic pain: Involvement of inflammatory immune cells, immune-like glial cells and cytokines. Journal of Neuroimmunology 229:(1-2) 26–50.
Basbaum, A. I.; Bautista, D. M.; Scherrer, G.; Julius, D. (2009, Elsevier): Cellular and Molecular Mechanisms of Pain. J.cell 139:(2) 267-284.
Callaghan, B. C.; Cheng, H. T.; Stables, C. L.; Smith, A. L.; Feldman, E. L. (2012): Diabetic neuropathy: clinical manifestations and current treatments. Lancet Neurol 11:(6) 521-34.
Campbell, J. N.; Mayer, R. A. (2006, Elsevier): Mechanisms of neuropathic pain. Neuron 52:(1) 77-92.
Canapp, D.A., (2013): Canine Osteoarthritis. Clinican’s Brief 2013 August, p. 21-23.
Dubin, A. E.; Patapoutian, A. (2010): Nociceptors: the sensors of the pain pathway. The Journal of Clinical Investigation 120:(11) 3760–3772.
Leung, L.; Cahill, C. M. (2010): TNF-α and neuropathic pain - a review. Journal of Neuroinflammation 2010, 7:27.
Ren, K.; Torres, R. (2009): Role of interleukin-1β during pain and inflammation. Brain Research Reviews 60:(1) 57-64.
Stein, C.; Clark, J. D.; Oh, U.; Vasko, M. R.; Wilcox, G. L.; Overland, A. C.; Vanderah, T. W.; Spencer, R. H. (2008, Elsevier): Peripheral mechanisms of pain and analgesia. Brain Research Reviews 60:(1) 90-113.
Woolf, C. J.; Mannion, R. J. (1999): Neuropathic pain: aetiology, smyptoms, mechanisms, and management. Lancet 353:(9168) 1959-64.
Ábrák
1. Ábra: készítette: Sebők Csilla: Cervero, F.; Laird, J. M. A. alapján (1996) (Mechanisms of touch-evoked pain (allodynia): a new model. Pain 68:(1) 13-23.)
2. Ábra: Basbaum, A. I.; Bautista, D. M.; Scherrer, G.; Julius, D. (2009, Elsevier): Cellular and Molecular Mechanisms of Pain. J.cell 139:(2) 267-284., Figure 3 (Nociceptor diversity)
3. Ábra: Wikipédia; Kapszaicin: https://commons.wikimedia.org/wiki/File:Kapsaicyna.svg , Mentol: https://commons.wikimedia.org/wiki/File:Menthol-skeletal.png , Hidroxi-a-sanshool: https://commons.wikimedia.org/wiki/File:HAS-2D.png
4. Ábra: https://commons.wikimedia.org/wiki/File:A_Course_of_Shingles_diagram.png
5. Ábra: https://commons.wikimedia.org/wiki/File:Polyol_metabolic_pathway.png