A jódhiány hatása a magzat fejlődésére terhesség során
Contents
-
A jódhiány hatása a magzat fejlődésére terhesség során
- A jód mint (nyom)elem
- A jód felvétele és a pajzsmirigy hormonok szintézise
- A pajzsmirigy hormonok hatásmechanizmusa
- A klinikai manifesztációja a jódhiánynak az egyes korcsoportokban
- A jód és pajzsmirigy hormonok magzatba jutása és magzati termelése
- A jód szerepe az egyedfejlődésben
- A kreténizmus 2 fajtája
- Állati modellek
- A halva születés és a jódhiányos magzati fejlődés kapcsoltsága
- Jódhiány problémája globálisan
- Irodalomjegyzék:
A jód mint (nyom)elem
A jód a természetben, mint halogén elem található meg. Kívülről egy barnás fekete csillogó szilárd anyag, amelynek legfőbb ismertető jele, hogy könnyen szublimál lila gőzzel és irritáló szaggal. Felhasználása igen széles körű, például: fertőtlenítés vagy hormon pótló gyógyszerek gyártása.
A jód egy esszenciális nyomelem, így a környezetünkből kell felvennünk. Nem csak az emberek, de az állatok szervezetében is elengedhetetlen. Nem csak a felnőtt élőlények számára nélkülözhetetlen, hanem fontos szerepe van a magzati növekedésben is. Számos sejttípus differenciálódáshoz és maga az idegrendszer egészséges fejlődéséhez is elengedhetetlen. Fontosságát adja, hogy a belőle keletkező jód tartalmú aminosav származékokból fognak a pajzsmirigy hormonok felépülni. Szervezetbe való bevitelét táplálék és ivóvíz segítségével végezzük. Pótlása jód tablettákkal, esetleg jódozott sóval ellátott termékek fogyasztásával lehetséges. A pajzsmirigy képes raktározni a jódot, sőt akár túl is tudjuk telíteni a mirigyet. Ez azért lehet fontos, mert ha a pajzsmirigyet nem sugárzó jóddal töltjük fel, akkor nem fogja felvenni a radioaktív 131-es radioaktív izotópját. Ennek hatásásra, ha valamilyen úton-módon radioaktív jód kerülne a szervezetünkbe, akkor ez megakadályozná, hogy a sugárveszélyes elem a hormonrendszer útján károsítsa a szöveteket (Zimmermann, 2012).
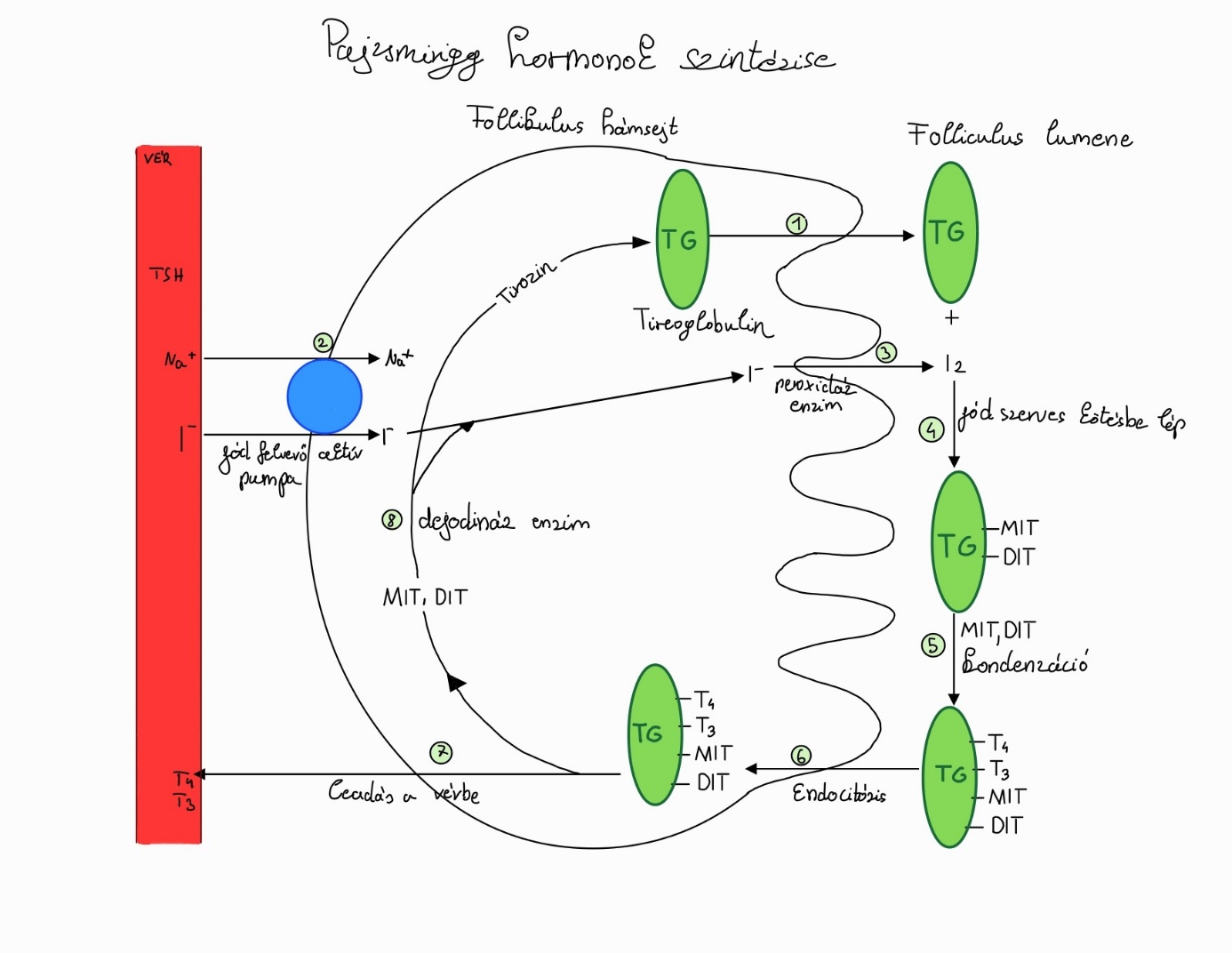
A jód felvétele és a pajzsmirigy hormonok szintézise
Felnőtt állatokban a pajzsmirigy a vérből aktív, energiaigényes pumpával egy ún. „jód csapda” segítségével képes felvenni a jód ionos formáját. Ez a rendszer 40x nagyobb jód koncentrációt tud létrehozni a pajzsmirigyben, mint ami a vérben uralkodik. A felvett jódid-iont intracellulárisan a thyreoid peroxidáz enzimek elemi jóddá alakítják egy lysosomális rendszer segítségével. Az elemi jód képes a hámsejtek által már előállított óriás fehérjével a thyreoglobulinnal összekapcsolódni (1. ábra), vagy a fehérjéhez már kötött tirozin maradékokhoz bekötni. Amennyiben egy jód kapcsolódik, akkor monojód-tirozin (MIT), ha kettő, akkor dijód-tirozin (DIT) keletkezik. Amikor egy monojód-tirozin és egy dijód-tirozin kapcsolódik össze víz kilépése mellett, akkor trijód-tironin (T3) vagy reverz-tironin lesz az eredmény. Két dijód-tirozin összekapcsolódásakor pedig tetrajód-tironin (T4) képződik. A thyreoglobulint a hámsejtek szintetizálják egy kolloid fehérje részeként, ami több mint 120 tirozin molekulát képes megkötni. Ezzel a molekulával a pajzsmirigy így nem csak szintetizálni, de raktározni is tudja a hormonokat.
Amikor a pajzsmirigy ki akarja juttatni ezeket a hormonokat, akkor a thyreoglobulin a hámba jut endocytozis-sal, ott pedig a follikulusok-ba fog belépni. Maga a thyreoglobulin a fehérje rész intracellulárisan lebomlik és igy a véráramba már csak a trijód- vagy reverz trijód-tironin és a tetrajód-tironin jut be. A megmaradt aminosav származékok, amik nem használódtak fel, szintén lebomlanak és a belőlük felszabaduló jód újra felhasználódásra kerülhet az epithel sejtekben. A sejtek a pajzsmirigy hormonokat passzívan diffúzióval a basalis oldalukon tudják leadni és így a vérbe jut. Ezt a teljes folyamatot a hypotalamusz által termelt TSH serkenti, kivételt képez ez alól a passzív diffúzióval történő transzport (Shahid és mtsai, 2022).
|
1. ábra: Az elemi jód tetrajód-tironinná alakítása |
A pajzsmirigy hormonok hatásmechanizmusa
A pajzsmirigy hormonok hatással vannak a test minden sejtjére. Ez a tulajdonság oda vezethető vissza, hogy képes befolyásolni a DNS azon HRE (hormon által aktiválható) szakaszát, mely a különböző metabolikus és sejtvázat alkotó fehérjék expressziójáért felelős. Ezen fehérjék nélkül számos sejt nem képes az egészséges életre (Zhang és Lazar, 2000).
A pajzsmirigy hormonok receptorai (csakúgy, mint a szteroid és retinoid receptorok) a magreceptorok családjába tartoznak, tehát a sejtmagban találhatók. Mivel a sejten belül találhatóak, ezért a hormonoknak elsőnek be kell jutniuk a citoplazmába. A tiroxin apoláris tulajdonsága miatt könnyen átjut a sejtmembrán foszfolipid rétegén és így a sejtplazmába jut. Ott csatlakozik magreceptorja karboxi-terminális végéhez. A komplex (hormon + receptor) bejut a sejtmagba, majd csatlakozik a DNS már említett HRE szakaszához, így szabályozva a különböző struktúrgének expresszióját. A tiroxin receptorok gyakran dimerizálódnak a retinoid X receptorokkal (RXR). A retinoidok az A-vitamin származékai, melyek jelátviteli molekulaként működnek. Ez a receptorok közötti kapcsolódás specifikusabbá teszi az adott génszakasz felismerését a DNS-en (Rowe, 1997).
A klinikai manifesztációja a jódhiánynak az egyes korcsoportokban
A pajzsmirigy hormonok nem megfelelő produkciójakor különböző elváltozások, rendellenességek jelentkezhetnek a szervezetben. Ilyen esetekben a klinikai tünetek az egyes korcsoportokban más és más módon jelentkezhetnek (1. táblázat). Megkülönböztetünk alul (hypothyreosis) és túlprodukciót (hyperthyreosis). Az utóbbi esetében fokozódnak a katabolikus (lebontó) folyamatok, melyek hatására nő az alapanyagcsere és az oxigénfogyasztás. Ezt a betegséget Basedow-kórnak nevezzük, melynek jellegzetes tünetei az előre fele domborodó, megnagyobbodott szemek és a lesoványodás.
Alacsony produkció leggyakrabban a csökkent jódbevitelre vezethető vissza. Ilyenkor csökken a pajzsmirigy hormontermelése. Mivel ezek a hormonok a szervezet egészére hatással vannak, hiányának hatásai a teljes testre kihatnak. Attól függően, hogy mikor alakul ki a hormon deficit, eltérő mértékben károsodhatnak a különböző szervrendszerek. Egy később tárgyalt pontban szó esik majd az embrionális korban kialakuló aránytalan törpeségről és a kreténizmusról. A hypothyreosis a szexuális fejlődésre is kihat, felléphet a spermiogenezis és ovuláció zavara (Zimmermann, 2009).
|
1. táblázat: Klinikai tünetek különböző korcsoportokon belül |
A jód és pajzsmirigy hormonok magzatba jutása és magzati termelése
Terhesség alatt az anya testében a placenta képzi a gátat, de egyben az összeköttetést is a magzat és az anya között. Képes megakadályozni, hogy káros anyagok átjussanak magzathoz, de lehetővé teszi egyes tápanyagok, köztük a jód és a pajzsmirigy hormonok szállítását anyától az utódig. Magának a jódnak, mint nyomelemnek a szállítása azért lehet fontos mert az embrió szervezetében is el tud raktározódni, és ez egy védelmi adaptációs mechanizmust jelenthet az anyai jódbeviteli vagy pajzsmirigy elégtelenségektől. Az első trimeszterben (emberben) az embrió nem tudja pajzsmirigy hormonokat önállóan megtermelni. Ezért az anyai szervezet megtermeli és plazmafehérjéhez kötve, a vérben szállítva a placentán át jutnak be a magzati szervezetbe ezek a hormonok (Neven és mtsai, 2020).
Később, amikor elég fejlett állapotban van a magzati pajzsmirigy, akkor már maga a fejlődő magzat is képes lesz megtermelni a pajzsmirgy hormonok egy részét. A magzati folyadékok foetalis tetrajód-tironin koncentrációja függ a T4 kötő fehérjék koncentrációjától, a placentán átjutott anyai T4-től, a magzat által termelt foetalis T4-től és a placentán át elszállított T4 -től.
A T4 kötő kapacitása a fehérjéknek genetikailag meghatározott, és teljesen független az anyai pajzsmirigy aktivitástól. Fontos, hogy a placenta nem enged át bármennyi T4-t, így egy gátat is jelent a számára. Az így képzett gát azért fontos, mert ha a magzati folyadékok ugyanazt a T4 és T3 szintet elérnék, mint az anyai szérumban van az túl magas koncentrációhoz vezetne és nagy valószínűséggel toxikus is lenne. Ez is mutatja, hogy nem csak a túl alacsony, hanem a túl magas pajzsmirigy hormonszint is súlyos károkat tud okozni a magzati fejlődés során.
Az anyai tetrajód-tironint a 2-es típusú dejodináz enzim átalakítja trijódtironiná, ami aktív hormonként kötődik a magreceptorokhoz. A második trimeszterben, amikor aktivvá válik a magzat pajzsmirigye, és csökken az anyai pajzsmirigy hormonok jelentősége, de születéskor is ezen hormonok 20-40% az anyától származik. Ebből következik, hogy az anyai jód ellátottság igen nagy mértékben befolyásolja az újszülött jód ellátottságát (Rey és mtsai, 2007).
A jód szerepe az egyedfejlődésben
A jód alapú thyreoid hormonoknak direkt vagy indirekt szerepe van a magzati fejlődés több fázisában. Ezek közül is az egyik legfontosabb a központi idegrendszer fejlődése. Emberekben az agykérgi fejlődés a terhesség 6. és 22. hete között megy végbe, és csak is ebben a behatározott időben. Tehát, amennyiben a hormonok nem képesek hatásukat kifejteni a terhesség első trimeszterében, akkor utána már nem lehetséges a károk visszafordítása. Ennek oka az, hogy az agykéreg fejlődése egy igen precíz és korlátozott sorozatot követ. A sejtek sem a periódus előtt és után sem fognak úgy reagálni a T3-ra, hogy az a megfelelő hatással bírjon.
Thyreoid hormon-receptorok igen nagy számban kimutathatóak a neuronok és a gliasejtek felszínén egyaránt. A T3 vagy T4 kapcsolódik a magreceptorhoz, amely megindítja a génexpressziót. Ezek az aktivált gének szerepet játszanak a axonok és a dendritek kifejlődésében, melyek elengedhetetlen elemei az idegrendszernek. Emellett hozzájárul a szinapszisok kialakításához és a sejtek vándorlásához, csoportulásához. A gliasejtek esetében az axon, myelin hüvelyekkel való bevonásához szükséges. Enélkül a beteg idegrendszerében az információ szállítás nagy mértékben lelassul (Velasco és mtsai, 2018).
A jód bevitele kifejezetten fontos, mivel a korábban említett módon az embrió szervezete csak a 24. hét után, azaz a második trimeszterben képes saját magát thyreoid hormonokkal ellátni. Addig a placentán átjutó anyai hormonok fedezik a szükséges mennyiséget. A nem megfelelő mennyiségű jódbevitel igen súlyos neurológiai problémákhoz vezethet, egyéb deformációk mellett. A leggyakoribb idegrendszer érintő betegség a kreténizmus (Velasco és mtsai, 2018).
A kreténizmus 2 fajtája
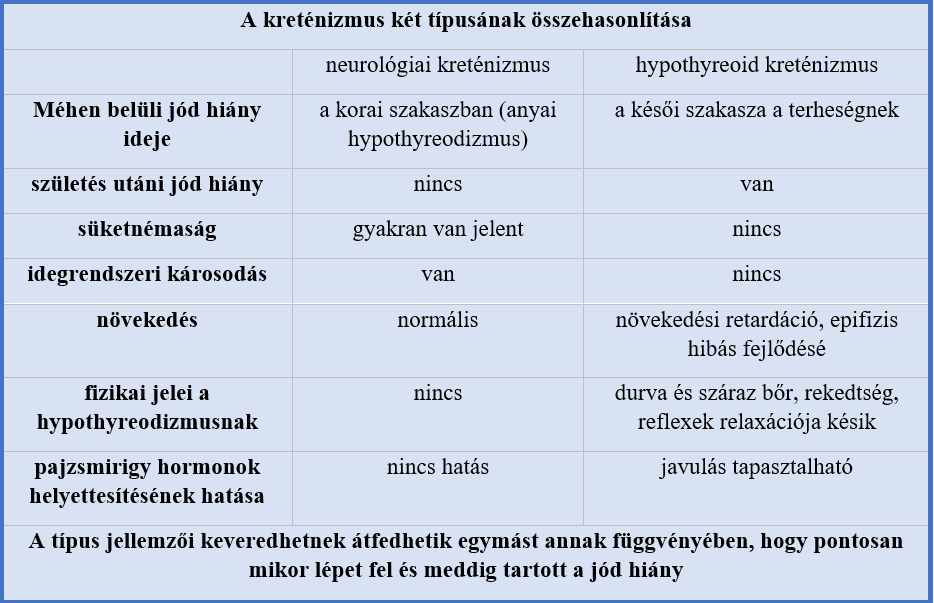
A kretén kifejezés a francia „crétien” szóból származik, melynek jelentése: „Valaki, aki ember a deformált mivolta ellenére”. Klinikai szempontból a kreténizmus a kezeletlen, veleszületett hypothyreoidezmus, ami járhat akár golyvával is. 2 fajta kreténizmust különböztetünk meg (2. táblázat), a neurológiai és a hypothyreoid kreténizmust (Salisbury, 2003).
1) Neurológiai kreténizmus:
Leggyakoribb oka a születés utáni nem megfelelő jódbevitel, de kialakulhat a terhesség alatt is. A legjellemzőbb tünete a nagy mértékű mentális retardáció. Az idegrendszer majdnem egészét érő fogyatékosságok közé tartozik:
- kancsalság, bandzsítás jellemző
- gyakran halló és kommunikációs problémák jelentkeznek, a legtöbb neurológiai kreténizmusban szenvedő egyén süket-vak
- Egy vagy kétoldali bénulás az alsóbb gerincvelői régiókban
- testtartási problémák, bizonyos esetekben ataxia is előfordulhat
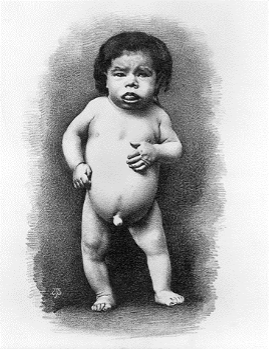
A vizelettel ürített jód mennyiség igen kicsi, kevesebb mint 2 μg/l szemben a normális 10-15 μg/l-es mennyiséggel. A neurológiai kreténizmus (2. ábra) nem mindig jár együtt golyvával vagy hypothyreoismussal, de egyes esetekben megtalálható (Chen és Hetzel, 2010).
|
2. ábra: Neurológia kreténizmusban szenvedő gyermek |
2) Hypothyreoid kreténizmus:
A hypothyreoid kreténizmus esetében a legfőbb tünet a törpenövés és a myxoedema (kifejezetten előre haladott pajzsmirigy megnagyobbodás). A betegségben szenvedők bőre száraz és vastag, szőrzetük és körmeik ritkák. A hangjuk mély és rekedtes. A törpenövés aránytalan, a csontváz retardálódott és gyakoriak a végtagi deformációk. Az ínak és izmaik gyengék, főleg a hasizmok. A reflexek lassabbak és az emésztőrendszeri működés is korlátozott. Az arcon is fellelhető több visszafejlődött képlet, mint például a hunyorgó szem, mandibuláris atrophia (hámszövet sérülés) és vastagabb ajkak. Mindkét változatra jellemző a mentális retardáció, de a neurológiai esetében nagyobb mértékben. Az egyszerű feladatok elvégzése is problémát jelentenek, még a szimpla táncolás is (Chen és Hetzel, 2010).
|
2. táblázat: A kreténizmus fajtáinak összehasonlítása |
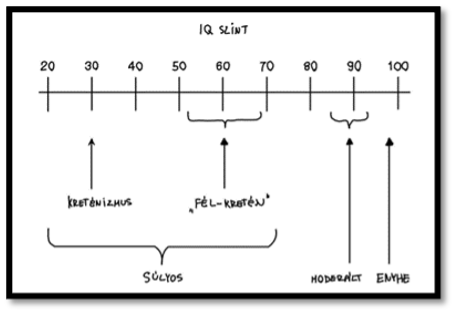
Az elégtelen jódbevitel okozta mentális hiányosság nem feltétlen jelenti, hogy az érintett kreténnek számít. A IQ szintjük alapján besorolhatjuk őket alkategóriákba is (3. ábra). Beszélhetünk például moderált, mikor az IQ szint csak kisebb mértékben csökken az átlagoshoz képest. Emellett az átlag IQ szint a kretének között területről-területre változhat. Például Thaiföldön 30-38 között mozog az átlagos IQ szint, míg világszinten inkább 50-69 a jellemző. A kreténizmus súlyosságát meghatározhatja, hogy a terhesség melyik stádiumban volt a legnagyobb mértékű jódhiány (Skeaff, 2011).
|
3. ábra: Kreténizmus súlyossága IQ-szint alapján |
Állati modellek
A jód egészséges fejlődéshez való szükségességét több állaton is tesztelték a múltban, például patkányon, selyemmajmon és az alább kifejtett esetben juhon. A tesztben használt állatot alacsony jódtartalmú diétán tartották (5–8 μg jód naponta egy 40–50 kg juhnak) a terhesség alatt. a 140 napos vemhesség után született bárány nagyban eltért a normális jód fogyasztás mellett fejlődő társaitól. Súlya kisebb, szőrzete gyérebb, koponyája pedig deformált volt. Lábai rövidebbek voltak a visszamaradt epiphysisalis növekedés miatt. Pajzsmirigye hyperplasias golyvát mutatott, valamint vérében az átlagnál alacsonyabb volt a T4 koncentráció. A későbbi vizsgálatok során látható volt a bárány mentális elmaradottsága is (Hetzel és mtsai, 1988).
A halva születés és a jódhiányos magzati fejlődés kapcsoltsága
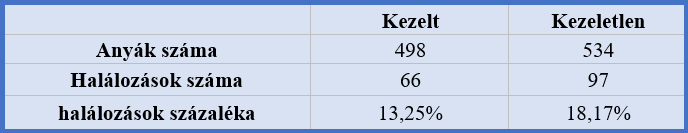
A terhesség alatti jódhiányt több publikációban is asszociálják a halva születéssel. Ennek alapja, hogy a jódhiányos területeken igen magas az aránya a csecsemő halandóságnak. Egy kutatás során Új-Guinea-ban vizsgálták a jódozott olaj hatását 1032 egy magzatos terhességet követtek nyomon (3. táblázat). A 1032 anyából 498 kapott jódos ellátást. Ebből a 498-ból 66 végződött születés előtti halállal. A kezelés mentes 534 esetből 97-nél volt halálozás.
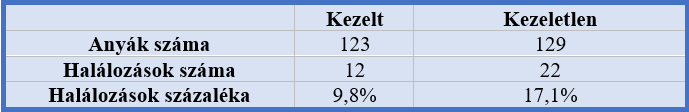
Egy másik esetnél Zaire-ben 252 anyánál végezték az előzőek alapján ugyanazt a vizsgálatot(4. táblázat)). Itt 123 kezelt szülésből 12, a kezeletlen 129-ből 22 végződött halva születéssel vagy bármilyen más születés előtti halálesettel (Potter és mtsai, 1979).
|
3. táblázat: Új-Guinea-ban végzett kísérletek eredménye |
|
4. táblázat: Zaire-ben végzett kísérletek eredménye |
A korábbi kettő kutatással szemben egy Finnországban készített vizsgálat során megnézték 199 halva született csecsemő anyjának a TSH szintjét, mely indikátora az egyed jód ellátottságának. A vizsgálat nem mutatott asszociációt a halva születés és a jódhiány között. A nem egyhangú eredmények miatt még nem kimondható a 2 tényező közötti kapcsolat. Valószínűleg a vizsgált területek különböző ellátottsági állapota is belejátszik a bizonytalan eredménybe (Purdue-Smithe és mtsai, 2021).
Jódhiány problémája globálisan
A jódhiány globális szinten is megemlítendő probléma, mivel sokszor az étrend nem biztosít elegendő jódot a szervezet számára. A fentiek alapján megállapíthatjuk, hogy terhesség és laktáció során különösen fontos erre odafigyelni, ekkor ugyanis több mint másfélszeresére nő a szükséglet. A napi bevitel 0-5 éves gyermek esetén 90 μg, 6-12 éves korban 120 μg. A felnőttek jódbevitele 150 μg körül mozog, míg terhesség alatt meghaladhatja a 250 μg-ot is. Az alacsony bevitel megoldására a só jódozása a leghatékonyabb módszer, melyet széleskörűen szabályoznak a világban.
A programot a WHO kezdte el kiterjeszteni 1960-ban, amikor ugyanis felismerték a golyva nagyon magas előfordulási arányát (20-60%-a világ népességének). Ezt követően a „Child Development Steeering Group” (Nemzetközi Gyermekfejlesztési Irányító Csoport) megállapította, hogy a csökkent jódbevitel egyike a négy kulcsfontosságú tényezőnek, melyek a gyermekek fejlődési rendellenességét okozzák. A program eredményesnek bizonyult, hiszen 2021-ben 124 ország rendelkezik kötelező a só jódozása vonatkozó jogszabályi szabályozással, emellett 21 országban engedélyezett az önkéntes jódbevitel. Ennek hatására manapság csaknem mindenhol stabilizálódott a jódbevitellel kapcsolatos probléma, leszámítva a legszegényebb országokat, mint Madagaszkár, Mozambik és Burundi.
Annak ellenére, hogy Nigériában és Indiában instabil az élelmiszerellátás, melynek hatására ezeken a területeken több millió alultáplált felnőtt és gyerek él, a jódprogramnak (só jódozása) köszönhetően csaknem teljes mértékben visszaszorultak a hiányával járó fejlődési rendellenességek (kreténizmus, halva születés, aránytalan törpeség). A só akkor nevezhető megfelelően jódozottnak, ha a hozzáadott mennyiség 15 és 40 ppm közé esik (Michael B. Zimmermann és Maria Andersson, 2021).
Terhesség alatti jódhiány, az anyai vagy a magzati pajzsmirigy alulműködését okozza, mely károsan befolyásolja a magzat neurológiai és növekedési fejlődését. Attól függően, hogy milyen súlyos és mikor alakul ki a hypothyreosis eltérő mértékben alakul ki a rendellenesség. Ennek megelőzésére terhesség alatt további jódbevitel ajánlott, mely háttérbe szorítja a kreténizmus kialakulásának esélyeit, csökkenti a magzat halálozási rátáját, emellett növeli a születési súlyt is (Zimmermann, 2012).
Irodalomjegyzék:
Chen, Z.P.; Hetzel, B.S. (2010): Cretinism revisited. Elsevier 24:(1) 39-50
Escobar, G.M.; Obregón, M.J.; Rey, F.E. (2007): Iodine deficiency and brain development in the first half of pregnancy. Public Health Nutrition 10:(1) 1554–1570,
Hetzel, B.S.; Chavadej, J.; Potter, B.J. (1988): The brain in iodine deficiency. Neuropathology and Applied Neurobiology 14:(2) 93-104
Neven, K.Y.; Cédric, B.D.M.; Janssen, B.G.; Roels, H.A.; Waegeneers, N.; Nawrot, T.S.; Ruttens, A. (2020): Variability of iodine concentrations in the human placenta. Sci Reports 10:(1)
Potter, J.D.; McMichael, A.J.; Hetzel, B.S. (1979): lodization and Thyroid Status in Relation to Stillbirths and Congenital Anomalies. International Journal of Epidemiology 8:(2) 137-144
Purdue-Smithe, A.C.; Männistö, T.; Reische, E.; Kannan, K.; Kim, U.J.; Suvanto, E.; Surcel, H.M.; Gissler, M.; Mills, J.L. (2021): Iodine and thyroid status during pregnancy and risk of stillbirth: A population-based nested case–control study. Maternal & Child Nutrition 18:(1)
Rowe, A. (1997): Retinoid X receptors. The International Journal of Biochemistry and Cell Biology 29:(2) 275–278,
Salisbury, S. (2003): Cretinism: The past, present and future of diagnosis and cure. Paediatr Child Health 8:(2) 105-106
Shahid, M.A.; Ashraf, M.A.; Sharma, S. (2022): Physiology, Thyroid Hormone. StatPearls, Treasure Island (FL): StatPearls Publishing 1:(1)
Skeaff, S.A. (2011): Iodine and cognitive development. Woodhead Publishing Series in Food Science, Technology and Nutrition 1:(1) 109-128
Velasco, I.; Bath, S.C.; Rayman, M.P. (2018): Iodine as Essential Nutrient during the First 1000 Days of Life. Nutrients 10:(3) 290
Zhang, J.; Lazar, M.A. (2000): The mechanism of action of thyroid hormones. Annual Review of Physiology 62:(1) 439–466,
Zimmermann, M.B. (2009): Iodine deficiency. Endocrin Reviews 30:(4) 376–408,
Zimmermann, M.B. (2012): The Effects of Iodine Deficiency in Pregnancy and Infancy. Paediatric and Perinatal Epidemiology 26:(1) 108–117,
Zimmermann, M.B. (2012): The effects of iodine deficiency in pregnancy and infancy. Paediatr Perinat Epidemiol 1:(1) 108-117
Zimmermann, M.B.; Andersson, M. (2021): Global Endocrinology: Global perspectives in endocrinology: Coverage of iodized salt programs and iodine status in 2020. European Journal of Endocrinology 185:(1) R13-R21