Az öregedés hatása a cardiovascularis rendszerre
Contents
- Az öregedés hatása a cardiovascularis rendszerre
A kor előrehaladtával nagy mértékben növekszik a szív- és érrendszeri megbetegedések aránya, amelynek oka a cardiovascularis rendszer funkcionális és morfológiai átalakulása. Ezeknél a betegségeknél meghatározó tényező lehet a genetikai és epigenetikai háttér, de legfontosabb faktor mégis maga az öregedés.
A szív szerkezetének változásai
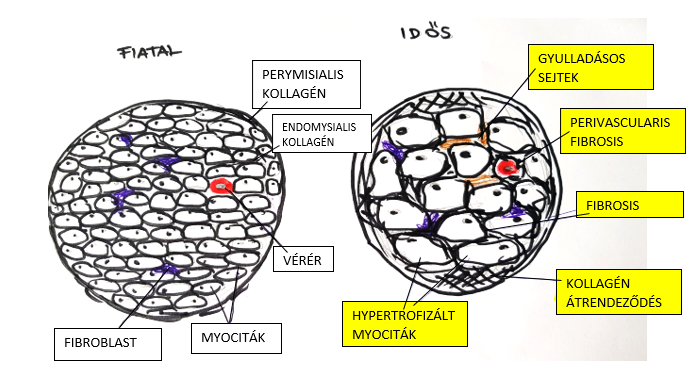
Az öregedés hatására a szív morfológiai változásai következnek be, amely az 1. ábrán jól látható. Ezek nem csak a szív, hanem az érrendszer funkcionális átalakulásához is vezetnek.A kor előrehaladtával a bal kamra koncentrikus hipertrófiája alakul ki. Az adott szövet növekedése a szerv megnagyobbodásához vezet. Az életkorral járó bal kamrai hypertrófia során a falvastagság mérsékelt növekedése és a szív hosszirányú tengelyének csökkenése következtében a szerv kissé lekerekítette, gömbölyűvé válik. A jelenséget mára echokardiográfiás vizsgálattal és mágneses rezonanciás képalkotással sikerült bizonyítani, ám okát még egyértelműen nem tisztázták. Egyik lehetséges magyarázata a szívizomsejtek alkalmazkodása az öregedés hatására kialakult érrendszeri változáshoz. A kor előrehaladtával ugyanis a nagyartériák fala merevebbé válik, aminek következtében a vérnyomás megnő, emellett kimutatták, hogy 30 és 70 éves kor között a myocyták száma csaknem 35 %-kal csökken (Anversa és mtsai, 1990). Az imént leírt vascularis változás miatt nő a balkamrai terhelés, amire a megmaradó szívizomsejtek fokozott működéssel válaszolnak. A myocytákra ható nagyobb feszülés hatására kialakul a hypertrófia.
|
1. ábra: Myocardium morfológiai változásai |
A szív működésének megváltozása
|
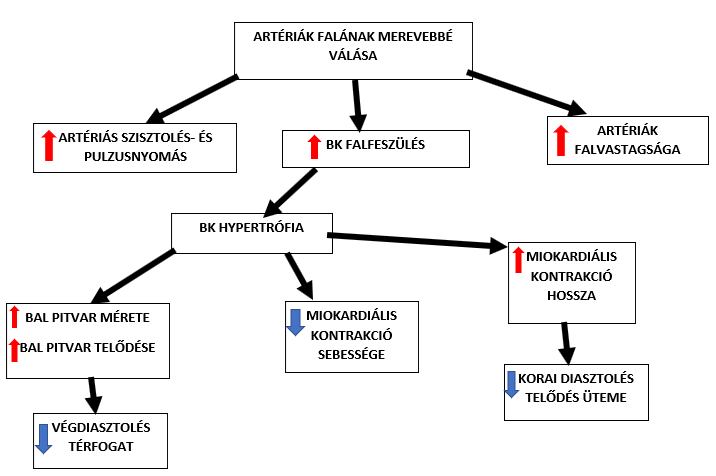
2. ábra: Főbb cardiovascularis változások |
Diasztolés funkció megváltozása
Az életkor előrehaladtával a bal kamrai systolés nyomás nem változik, ellentétben az érrendszerrel, ahol ez az érték nő az öregedéssel járó fokozott artériás merevség és az erek tágulékonyságának csökkenése következtében. A 2. ábrán ezen változások és későbbi folyományaik láthatók. A Doppler echokardiográfiás vizsgálat egy noninvazív módja a kamrai diasztolés funkció mérésének, amely során képesek vizsgálni az átfolyó vér mennyiségét a bal pitvarból a bal kamrába. A mérések kimutatták, hogy a korai diasztolés funkció, ami a kamrák aktív tágulását jelenti, a korral csökken, míg a késői diasztolés funkció, tehát a pitvari összehúzódás mértéke nő. Ennek oka, hogy a kamrai szövetben öregedés során felhalmozódik az extracelluláris mátrix, a szövet elpusztul és kötőszövet veszi át a helyét. Ezt a folyamatot myocardiális fibrosisnak nevezzük. Másik magyarázat egy patkányokon vizsgált molekuláris változás, mégpedig, hogy a sarcoplasmás reticulumban (SR) található Ca2+ ATP-áz pumpa mennyisége és aktivitása csökken az életkorral, ezen pumpa felelős az SR-be történő kalcium-ion visszavételére a relaxáció idején. A megváltozott ütemű Ca2+ visszavétel hatására az öregedés során meghosszabbodik a szív kontrakciója és megrövidül a myocardium relaxációja (Xu és Narayanan, 1998).Ezek hatására csökken a kamra funkciója, amit a pitvar ellensúlyozni próbál, emiatt alakul ki a késői diasztolés funkció megnövekedése.
A kamrai compliance változása
A diasztolés funkció változásához hozzájárul a compliance csökkenése, aminek oka a myociták elöregedése, ezáltal számuk fogyatkozása (Lakatta, 2003), a megmaradó szívizomsejtek hypertófiája, valamint az aránytalan kollagén-átrendeződés a bal kamra interstíciumában (de Souza, 2002). A kamrafal tágulékonysága (ΔV/ΔP, compliance) a diasztolés telődés alatti kamrai nyomás és a beáramló vér térfogatától függ.A megnövekedett mennyiségű kollagén rostok és az elöregedett szívizomsejtek hatására a vég diasztolés térfogat (EDV) csökken, amit ugyanakkora vég diasztolés nyomás (EDVP) nem képes azonos mértékűre tágítani, ezért az EDVP jelentősen megnövekszik.
A szívfrekvencia változása
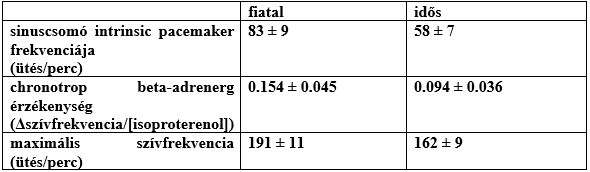
A nyugalmi szívfrekvencia fiatal és idős korban nem tér el lényegesen. Ezzel szemben a maximális szívfrekvencia az öregedéssel csökken, amit a szív életkorral gyengülő chronotrop β-adrenerg válaszának, és a sinuscsomó csökkenő frekvenciájának tulajdonítanak. A jelenség bizonyítása során 15 idős (65 ± 5 éves) és 15 fiatal (25 ± 4 éves) egészséges férfit vizsgáltak edzés közben, futópadon végzett Balke protokoll alapján. A sinuscsomóban található pacemaker sejtek idegi stimulustól függetlenül is funkcionálnak, ezért annak működését ganglion-blokkoló beadásának hatására monitorozták. A szívizomsejtek adrenerg válaszát pedig pozitív chronotrop hatással bíró isoproterenol adással vizsgálják. Intravénásan ganglionbénító (trimetaphan) adagolására, majd β1- és β2-receptor-izgató (isoproterenol) adás hatására mérhető maximális szívfrekvencia változás a 3. ábrán látható (Christou és mtsai, 2008).
|
3. ábra: Maximális szívfrekvencia változása |
Haqqani és mtsai (2007) kimutatták, hogy a sinuscsomó funkcionális változásának egyik lehetséges oka a pitvar relatív kollagén mennyiségének növekedése az idősödés során. A jelenség egy másik valószínűsíthető molekuláris magyarázata, hogy az öregedéssel csökken a pacemaker sejtekben egy kalcium csatorna Cav1.2 alegységének mennyisége, aminek hatására gyengül a depolarizáció mértéke, ezáltal a sinuscsomóban csökken az esély az akciós potenciál kialakulására és terjedésére (Jones és mtsai, 2007).
A β-adrenerg válasz időskori csökkenésére, tehát a receptordeszenzitációra több magyarázat született. White és mtsai (1994) számos biokémiai vizsgálattal kimutatták, hogy a jelensége okai a következők lehetnek: az öregedés során egyrészt kialakul a β-1 receptorok downregulációja, valamint jelentkezik a G-protein kapcsolt β-2 receptorok „szétkapcsolása” (agonistakötődés és effektorrendszer uncoupling-ja), aminek oka lehet a receptorok kevésbé hatékony kapcsolódása a serkentő G-protein-hez, vagy a gátló G-fehérje túlzott aktivitása, esetleg az adenil-cikláz csökkenő katalitikus aktivitása, összességében tehát a jelenségért G-protein függő transzdukció megváltozása is felelős.
Artériák tágulékonyságának csökkenése és merevebbé válása
|
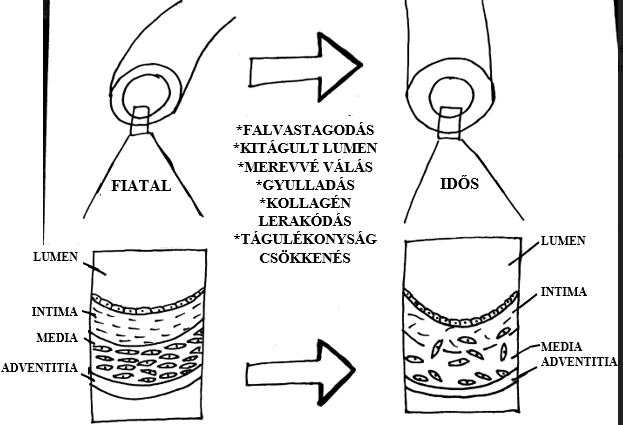
4. ábra: Struktúrális és funkcionális változások az artériákban |
Fiziológiás esetben, a fiatal szervezetben az artériák fala képlékeny, jó alkalmazkodóképességgel rendelkezik, térfogata a nyomás függvényében könnyen módosul. Az évek múlásával a tágulékonysági képesség, főként az elasztikus artériákban, jelentősen lecsökken. A 4. ábrán látható, hogy az érfal térfogata, annak merevsége miatt, nehezen tud a nyomásviszonyoknak megfelelően alakulni, az esetleges változásokhoz kevésbé idomul. Ennek molekuláris háttere, hogy az erek öregedése során csökken az elasztin és nő a kollagén (O’Rourke és Hashimoto, 2007), valamint a proteoglikánok szintje az artériák intimájában. A compliance folyamatosan romlik, melyhez kalcium, foszfor és más ásványi anyagok beépülése is hozzájárul (Watanabe és mtsai, 1996; Cattell és mtsai, 1996).
Az érhálózat centrálisan és perifériásan különböző típusú artériákból áll. Az öregedés más-más ütemben hat rájuk attól függően, hogy elasztikus, elasto-muscularis vagy muscularis típusúak. A folyamat legerősebben a centrálisan elhelyezkedő elasztikus artériákat befolyásolja, a perifériás elasto-muscularis és muscularis erek kevésbé érintettek. A centrális artériák fiatal korban tágulékonyabbak és rugalmasabbak, mint a perifériásak. Az idő múlásával ez éppen fordítva lesz igaz rájuk. Az idős kor egyik legfőbb jellemzője, hogy a centrális artériák elongálódnak, faluk merevvé válik, ezzel együtt jelentősen, akár háromszorosára is megvastagodik, a lumen dilatációja lép fel (O’Leary és mtsai, 1999). E jelenségeket legjobban az aortánál figyelhetjük meg. Ezen hatásokhoz még hozzájárul, hogy az évek előrehaladtával bizonyos anyagok, például az angiotenzin II vagy az endothelin-1 mennyisége megnő az érfalban, melyek vazokonstriktor tulajdonságukat így egyre erősebben tudják kifejteni. Az ezekkel ellentétes, vazodilatátor hatású ösztrogén vagy nitrogén-monoxid mértéke viszont számottevően lecsökken. Az erek merevsége nemenként is eltérően jelentkezik. Már fiatal korban is kevésbé tágulékonyak nőkben, mint férfiakban, ez a különbség pedig drámaian megnövekszik a menopauza után (Rossi és mtsai, 2011).
Fenti tényezők nagy klinikai jelentőséggel bírnak, mivel megjelenésük a szervezetben érrendszeri betegségekhez vezethet, így ezeknek különböző vizsgálatokkal való kimutatása nagy szerepet játszhat a megelőzésben.
Pulzusnyomás emelkedése
Fiatal korban a pulzusnyomást a perifériás ellenállóképesség határozza meg. A muscularis típusú artériákat és arteriolákat rezisztenciaereknek hívjuk, melyek a teljes perifériás ellenállás kialakításában vesznek részt, így nagy szerepük van a pulzusnyomás alakulásában.
A vascularis öregedés hatására a pulzusnyomás emelkedése következik be. Ennek magyarázata, hogy idősebb korban fő befolyásoló tényezője már nem a perifériás, hanem a centrális érfalak merevsége, mely, az előbbiekben foglaltak alapján, egyre növekszik az évek múlásával. A pulzusnyomás mérésével így következtetni tudunk a centrális artériák merevségének mértékére. Klinikai jelentősége is van az ilyen vizsgálatoknak, ugyanis segítséget nyújthatnak a koszorúér- betegségek prognosztizálásában.
Pulzushullám terjedési sebességének növekedése
|
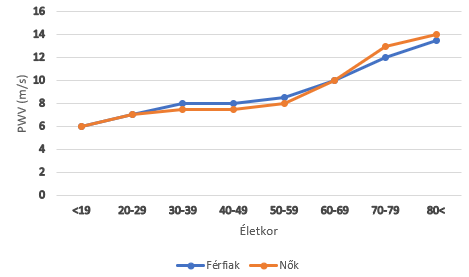
5. ábra: PWV alakulása az évek múlásával |
A pulzushullám terjedési sebessége (PWV, pulse wave velocity) legfőképp szintén az artériák falának merevségétől függ, de hat rá az érfal simaizomtónusa is. Magát a pulzushullámot az áramlási hullám és a bal kamra nyomáshulláma közösen képezi.
Az 5. ábra jól szemlélteti, hogy a PWV az idő múlásával folyamatosan nő, ahogy az érfalak is egyre merevebbé válnak. A későbbiekben tárgyalt endothel-diszfunkció és atherosclerosis szintén PWV növelő hatással bírnak, bizonyítandó, hogy a pulzushullám terjedési sebessége nem csupán az artériák szerkezeti változásától függ. Mivel a már korábban említetteknek megfelelően a perifériás, muscularis artériák fala az évek múlásával nem válik nagy mértékben merevebbé, így az érhálózat különböző területein más mértékben alakul az öregedés hatására bekövetkező PWV emelkedés. (5. ábra) A pulzusnyomással megegyezően a PWV is klinikai jelentőséggel bír, cardiovascularis megbetegedések előre jelző tényezője lehet (Laurent és mtsai, 2001; Mitchell és mtsai, 2010; Vlachopoulos és mtsai 2010).
Augmentációs index növekedés
Az augmentációs hullám szoros kapcsolatban áll az előbb tárgyalt pulzushullámmal. Az augmentációs index a pulzusnyomással összefüggésben azt mutatja meg, hogy mekkora a hullám amplitúdója a pulzusnyomás volumenéhez mérve.
Fiatal korban az augmentációs hullám a diasztolé alatt éri el az aortát, mivel az artériák fala még tágulékony, így a hullám sebessége kicsi, ezáltal diasztolés vérnyomásemelő hatással bír.
Csakúgy, mint az előbbieket, ezt a hullámot is nagyban befolyásolja az érfalak merevedése, ugyanúgy fokozódó tendenciát mutat (Laurent és Boutouyrie, 2007). A sebessége folyamatosan növekszik, ezért az aortához idősebb emberekben már a szisztolé alatt eljut. Ily módon a szisztolés vérnyomást fokozza, a diasztolésra már nincs hatással, ezáltal a két érték differenciáját fokozza. Az augmentációs indexnek idősebb korban már nincs olyan nagy klinikai jelentősége, mint az előző pontokban tárgyalt faktoroknak, hiszen a lehetséges betegségekkel nem áll egyértelmű korrelációban.
Kis- és nagyerek atherosclerosisa
|
6. ábra: Az érrendszer legfontosabb változásai az öregedés hatására |
Az atherosclerosis általában már korábbi, a 6. ábrán látható cardiovascularis megbetegedések velejárójaként jelenik meg. Ezen kívül kialakulásában részt vesznek más, külső faktorok is, mint például diabetes mellitus, vagy hypertonia. Az atherosclerotikus plakk csak mindkét tényező jelenlétében fejlődik ki. Ezek alapján magát az atherosclerosis-t nem is tekinthetjük önálló betegségnek (Lakatta és Levy, 2003), inkább egy tünetegyüttesnek, mely az öregedés miatt kialakuló érrendszeri problémákkal együtt közrejátszik az időskori mortalitás emelkedésében (Roth és mtsai, 2017). A progrediáló folyamat egyértelműen erősebben és gyorsabban alakul ki az idősekben, viszont létezik fiatalkorban megjelenő formája is. A korai atherosclerosis betudható annak, hogy bizonyos esetekben a cardiovascularis öregedés előbb és gyorsabban zajlik le, mint általában, mely a nem megfelelő életmódnak és étrendnek tudható be (Jakovljevic, 2018).
Klinikai jelentősége többek között abban rejlik, hogy áramlási zavart okoz az erekben, és mivel sokszor diabetes-szel jár együtt, ami pedig vascularis károsodásokat segít elő, így együtt még erősebb romboló hatással rendelkeznek. Főként a különböző szervekben lévő mikrocirkulációra lehet ártalmas hatással, különös tekintettel az agyra és a vesére.
Endothel diszfunkció
Az erek és a szív falát borító endothel funkciója sokrétű. Fontos szerepet játszik a vascularis homeosztázis és a vascularis tónus fenntartásában. Az endothel által termelt nitrogén-monoxid (NO) és prosztaciklin simaizom relaxációt okoznak, melynek eredményeként vasodilatatio jön létre, míg az angiotensin-II, tromboxán és az endotelinek érszűkítő hatással bírnak. A legfontosabb életkorral járó endothel funkció változást a NO szint csökkenése okozza. Ennek molekuláris mechanizmusa mára még nem tisztázott, de a kutatók több lehetséges tényezőt írtak le. Az egyik ilyen a NO-termelő endothel sejtek apoptózisa. Fiziológiás esetben a nitrogén-monoxid szintáz (eNOS) NO-t termel I-argininből BH4 kofaktor jelenlétében. Oxigén szabadgyökök nagyfokú képződése esetén eNOS uncoupling következik be, amely során az eNOS és a szubsztrátum szétkapcsolódik, ami az enzim működését gátolja, NO mennyiség csökkenés alakul ki (Collins és Tzima, 2011). A NO szint mérséklődésén kívül az életkorral járó csökkent vasodilatatiohoz hozzájárul a vasoconstrictor faktorok megnövekedett termelődése.
Korai vascularis öregedés (EVA)
A biológiai életkort az erek állapota határozza meg. A kronológiai és a biológiai életkor gyakran eltér. A korai vascularis öregedéshez minden olyan cardiovascularis rendszert érintő funkcionális és morfológiai változás hozzájárul, amit esszénkben korábban részleteztünk. A teljesség igénye nélkül: endothelfunkció csökkenés, artériás merevség, pulzushullám sebesség fokozódása és bal kamrai hypertrófia. Az előbbieknek számos rizikó faktora létezik, például a dohányzás, illetve a mozgásszegény életmód, jelentős mértékű alkoholfogyasztás, helytelen táplálkozás, elhízás, diabetes mellitus, stressz, kevés alvás. A legnagyobb kockázati faktor mégiscsak az öregedés, de az EVA kialakulását az említett tényezők gyorsíthatják. Az EVA paraméterei noninvazív módszerekkel vizsgálhatóak. Ennek során az artériafal merevségét, a centrális vérnyomást és a carotis intima vastagságát tanulmányozzák. Az EVA idejében történő felismerése a szív- és érrendszeri megbetegedések megelőzése érdekében szükséges. Az EVA felismerését követően érdemes elkezdeni a gyógyszeres kezelést, illetve az atherosclerosist elősegítő tényezők erélyes csökkentését. A magas szisztolés vérnyomás antihipertenzív kezeléssel, gyógyszeresen csökkenthető.
Cardiovascularis terhelhetőség
A cardiovascularis terhelhetőség szignifikáns változása figyelhető meg egészséges embereknél az öregedés folyamán (Malbut-Shennan és Young, 1999). A terhelhetőség, fittség mértéke leírható a maximális oxigénfelhasználás értékével (VO2max). A VO2max az artériás-vénás oxigénkülönbség és a szív perctérfogatának szorzatával határozható meg. A cardiovascularis terhelhetőséget terheléses vizsgálatokkal tanulmányozhatjuk, melyeket laboratóriumi vizsgálatokkal és pályatesztekkel végzünk el. A laboratóriumi vizsgálatok eszközei lehetnek evezőpad, kerékpár ergométer, úszó ergométer, futópad. A vizsgálat során EKG monitort, maszkot használunk. Növelhetik a teljesítményt, meredekséget, sebességet, ez alapján mérik a paraméterek változásait. A keringési rendszer alkalmazkodik a megnövekedett oxigén igényhez, így az aktív életmódot folytató egyének VO2max értéke magasabb. A VO2max értéke függ továbbá a nemtől, életkortól, illetve az örökölt tulajdonságoktól és a cardiovascularis állapottól (Fletcher és mtsai, 1995). Az öregedés során csökken a VO2, azonban a VO2max megnő, tehát azonos munka elvégzése idős korban korábban bekövetkező elfáradáshoz vezet. Az idősek aerob kapacitása csökken. A 7. ábra jól szemlélteti a fizikai terhelhetőség csökkenését az öregedés folyamán (Oxenham és Sharp, 2003).
|
7. ábra: Maximális fizikai terhelhetőség változása az öregedéssel |
A csökkent terhelhetőség hátterében csökkent szimpatikus idegrendszeri hatások állnak. A szimpatikus idegrendszer a terheléshez való alkalmazkodásban jelentős szerepet tölt be. A β-adrenerg receptorok jelátviteli mechanizmusa károsodik az életkor előrehaladtával, továbbá a β-adrenerg receptorok sűrűsége csökken a szívben (Hotta és Uchida, 2010). Terhelés hatására a vérben az adrenalin és a noradrenalin szintje nő, a neurotranszmitterek visszavétele csökken. Ez a jelenség azzal magyarázható, hogy a szervezet a csökkent szimpatikus hatást ellensúlyozni igyekszik, de ennek ellenére az öregedéssel, a receptorok előbb ismertetett változásai miatt, a szimpatikus működés csökken. A rendszeres fizikai aktivitás a nagyartériák merevebbé válását csökkenti, segít a bal kamra kontraktilitásának növelésében, a pulzushullám terjedési sebességének csökkentésében, ezáltal javítja az idős szervezet fokozott igénybevételhez történő alkalmazkodását.
Végszó
A 21. századra az ember átlagos élettartama jelentősen megnövekedett, ezáltal a társadalom nagy részét érintik cardiovascularis betegségek, ezért a szív- és érrendszerrel kapcsolatos kutatások napjainkban egyre inkább előtérbe kerülnek.
Irodalomjegyzék
Anversa P; Palackal T; Sonnenblick EH; Olivetti G; Meggs LG; Capasso JM (1990): Myocyte cell loss and myocyte cellular hyperplasia in the hypertrophied aging rat heart. Circulation Research 67: (4) 871–885
Cattell MA; Anderson JC; Hasleton PS (1996): Age-related changes in amounts and concentrations of collagen and elastin in normotensive human thoracic aorta. Clinica Chimica Acta 245: (1) 73-84
Christou DD; Seals DR (2008): Decreased maximal heart rate with aging is related to reduced β-adrenergic responsiveness but is largely explained by a reduction in intrinsic heart rate. Journal of Applied Physiology 105: (1) 24–29
Collins C; Tzima E (2011): Hemodynamic forces in endothelial dysfunction and vascular aging. Experimental gerontology 46: (2-3) 185-188
Fletcher C (1995): New Directions for Performance Appraisal: Some Findings and Observations. International Journal of Selection and Assessment 3: (3) 191–196
Haqqani HM; Kalman JM (2007): Aging and Sinoatrial Node Dysfunction. Circulation 115: (10) 1178–1179
Hotta H; Uchida S (2010): Aging of the autonomic nervous system and possible improvements in autonomic activity using somatic afferent stimulation. Geriatrics & Gerontology International 10 S127–S136
Jakovljevic DG (2018): Physical activity and cardiovascular aging: Physiological and molecular insights. Experimental gerontology 109 67-74
Jones SA; Boyett MR; Lancaster MK (2007): Declining Into Failure. Circulation 115: (10) 1183–1190
Lakatta EG; Levy D (2003): Arterial and Cardiac Aging: Major Shareholders in Cardiovascular Disease Enterprises. Circulation 107: (2) 346–354
Laurent S; Boutouyrie P; Asmar R; Gautier I; Laloux B; Guize L; Ducimetiere P; Benetos A (2001): Aortic Stiffness Is an Independent Predictor of All-Cause and Cardiovascular Mortality in Hypertensive Patients. Hypertension 37: (5) 1236–1241
Laurent S; Boutouyrie P (2007): Arterial stiffness: a new surrogate end point for cardiovascular disease?. Journal of Nephrology 20 S45-50
Malbut-Shennan K; Young A (1999): The physiology of physical performance and training in old age. Coronary artery disease 10: (1) 37-42
Mitchell GF; Hwang SJ; Vasan RS; Larson MG; Pencina MJ; Hamburg NM; Benjamin EJ (2010): Arterial stiffness and cardiovascular events: the Framingham Heart Study. Circulation 121: (4) 505
O'Leary DH; Polak JF; Kronmal RA; Manolio TA; Burke GL; Wolfson JrSK (1999): Carotid-artery intima and media thickness as a risk factor for myocardial infarction and stroke in older adults. New England Journal of Medicine 340: (1) 14-22
O’Rourke MF; Hashimoto J (2007): Mechanical Factors in Arterial Aging. Journal of the American College of Cardiology 50: (1) 1–13
Oxenham H; Sharpe N (2003): Cardiovascular aging and heart failure. European journal of heart failure 5: (4) 427-434
Rossi P; Francès Y; Kingwell BA; Ahimastos AA (2011): Gender differences in artery wall biomechanical properties throughout life. Journal of hypertension 29: (6) 1023-1033
Roth GA; Johnson C; Abajobir A; Abd-Allah F; Abera SF; Abyu G; Ahmed M; Aksut B; Alam T; Alam K; Alla F; Alvis-Guzman N; Amrock S; Ansari H; Ärnlöv J; Asayesh H; Atey TM; Avila-Burgos L; Awasthi A; Murray C (2017): Global, Regional, and National Burden of Cardiovascular Diseases for 10 Causes, 1990 to 2015. Journal of the American College of Cardiology 70: (1) 1–25
de Souza RR (2002): Aging of myocardial collagen. Biogerontology 3: (6) 325–335
Vlachopoulos C; Aznaouridis K; Stefanadis C (2010): Prediction of Cardiovascular Events and All-Cause Mortality With Arterial Stiffness. Journal of the American College of Cardiology 55: (13) 1318–1327
Watanabe M; Sawai T; Nagura H; Suyama K (1996): Age-related alteration of cross-linking amino acids of elastin in human aorta. The Tohoku journal of experimental medicine 180: (2) 115-130
White M; Roden R; Minobe W; Khan MF; Larrabee P; Wollmering M; Port JD; Anderson F; Campbell D; Feldman AM (1994): Age-related changes in beta-adrenergic neuroeffector systems in the human heart. Circulation 90: (3) 1225–1238
Felhasznált weboldalak
Ábrajegyzék
1. ábra: Készítette: Hambuch Flóra
2. ábra: Készítette: Hambuch Flóra
https://slideplayer.com/slide/754648/
3. ábra: Készítette: Hambuch Flóra
https://journals.physiology.org/doi/full/10.1152/japplphysiol.90401.2008
4. ábra: Készítette: Bujtor Zsófia Krisztina
5. ábra: Készítette: Bujtor Zsófia Krisztina
6. ábra: Készítette: Bujtor Zsófia Krisztina
7. ábra: Készítette: Simon Zsófia Zoé