A környezet hatása az autoimmun betegségek kialakulására
~ humán és állati vonatkozásban ~
Contents
Bevezetés
A humán és az állati immunrendszer 2 részből áll, melyek a veleszületett rész, (közvetlenül képes reagálni az idegen anyagokra) és az adaptív rész, melynek rövid időre van szüksége a megfelelő immunválasz kifejlesztéséhez. A nyálkahártya felszínek kulcsfontosságúak, a szervezet normál vagy diszfunkcionális immunválaszának a kialakításában. Ezeket a részeket különböző, idegen tényezők befolyásolhatják, melyek immunszuppresszióhoz, immunstimulációhoz és túlérzékenységhez, autoimmunitáshoz vezetnek (Cannas és mtsai, 2020).
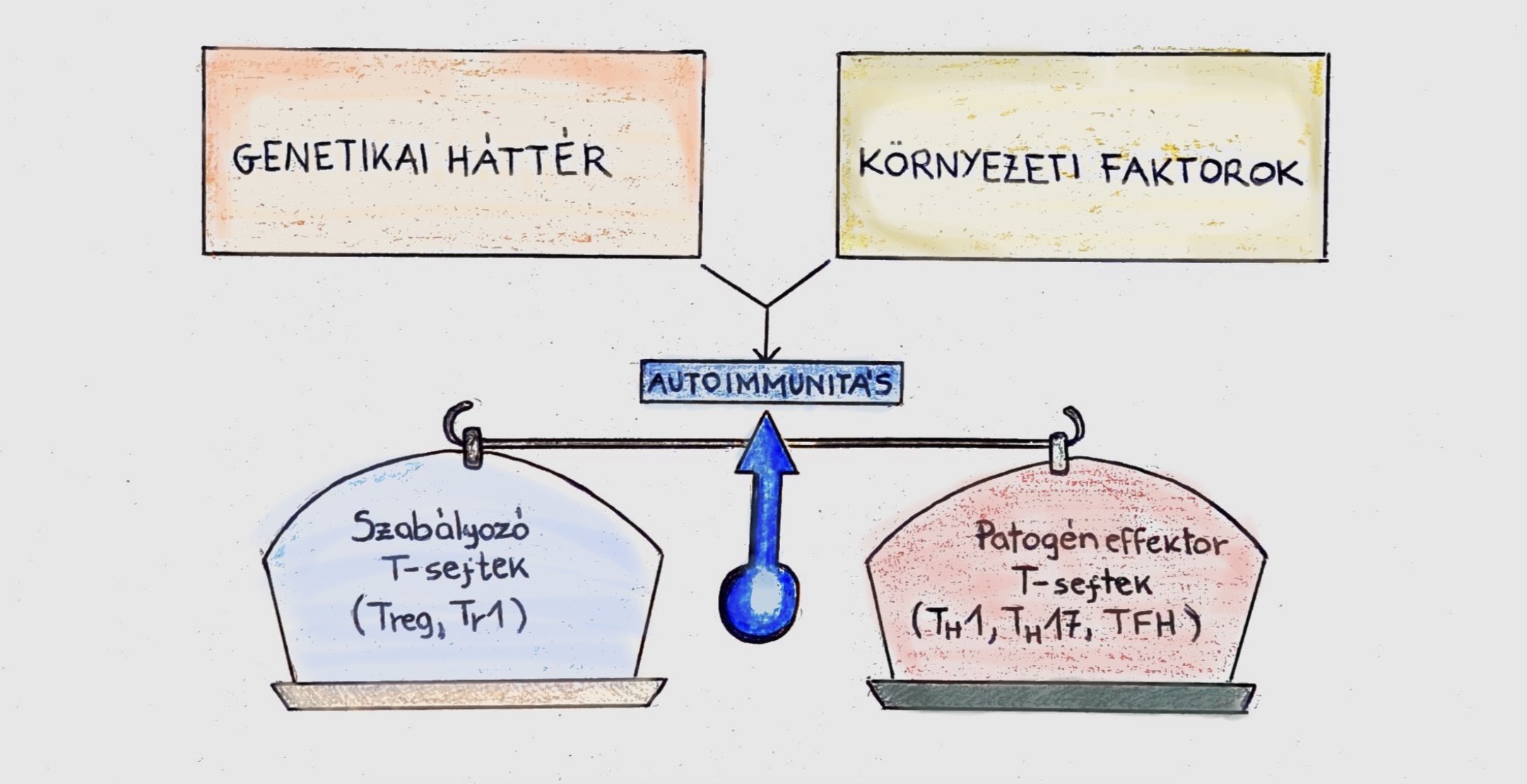
Az autoimmun betegség a szervezetnek az diszfunkcionális működési folyamata, mely során az egyén vagy egyed immunrendszere támadólag lép fel a saját sejtjeivel szemben, mivel nem tudja megkülönböztetni a „sajátot” az „idegentől”. Az autoimmun betegségek kialakulásában elsősorban a genetika játszik fontos szerepet, azonban egyéb tényezők is befolyásolhatják, mint a véletlenszerű faktorok, vagy a környezeti tényezők. A genetikai, epigenetikai és környezetei tényezők közötti multifaktorális kölcsönhatás miatt expresszálódik számos autoimmun betegség (1. ábra) (Cannas és mtsai, 2020).
Az autoimmun betegségek típusait tekintve megkülönböztetünk szövetet, szervet vagy egész szervezetet megtámadó betegségeket, melyeket ilyen formában a sejtspecifikus, szervspecifikus vagy szisztémás kategóriába sorolhatunk. Sejtspecifikus típusú betegségek például a szklerózis multiplex; a primer biliáris cirrhosis, mely egy autoimmun májbetegség; és a polychondroitis, mely a porcszövet, visszatérő, gyulladásos betegsége. Szervspecifikus betegségek például az I.-es típusú cukorbetegség, a Hashimoto-thyreoditis, a Basedow-Graves’s-kór, az autoimmun hepatitis és a pemphigus, mely egy hólyagos bőrbetegség. A szisztémás megbetegedések esetén pedig, említhetjük az SLE-t, (szisztémás lupus erythematosus) mely elsősorban a bőrt a veséket és a szívet támadja; a rheumathoid arthritist; a Sjögren-szindrómát, mely a külső elválasztású mirigyeket érintő gyulladásos megbetegedés és, az MCTD, (mixed connective tissue disease) ami a kötőszöveteket érintő gyulladásos autoimmun megbetegedés.
Az autoimmun betegségek egyik fő jellemzője, mely megerősíti súlyosságukat, hogy véglegesen nem gyógyíthatóak, csak tüneti kezelés mellett enyhíthetőek a páciens panaszai.
|
1. ábra: Az immunitás egyensúlya. A szervezet és a környezeti tényezők együttesen okozhatják egy autoimmun betegség kialakulását. |
A környezeti tényezők
Nyomelemek és ásványi anyagok
A legtöbb autoimmun betegséggel kapcsolatban rengeteg tanulmány dolgozza fel azokat az információkat, melyek a betegségek genetikai okait és az öröklődést támasztják alá, azonban kifejezetten kevés foglalkozik az ezen betegségekhez hozzájáruló környezeti tényezőkkel, mint például a különböző ásványi anyagok, nyomelemek, túlzott vagy csekély bevitelével a szervezetbe, azonban több autoimmun betegség esetében kimutatták a kapcsolatot a fentiek között (Burek és Talor, 2009).
Mind háziállataink körében, mind humán vonatkozásban az autoimmun betegségek által legjobban érintett szerv a pajzsmirigy. Ezen megbetegedések kapcsán (pl. Hashimoto-thyreoiditis (HT), Graves- kór (GD), és autoimmun pajzsmirigy betegség (AITD)) bizonyított, hogy egyes elemek, mint a jód, a vas és a szelén, fokozott vagy csekély felvétele megnöveli a kockázatát a fent említett betegségek kialakulásának (Rayman, 2019).
A jód szerepe
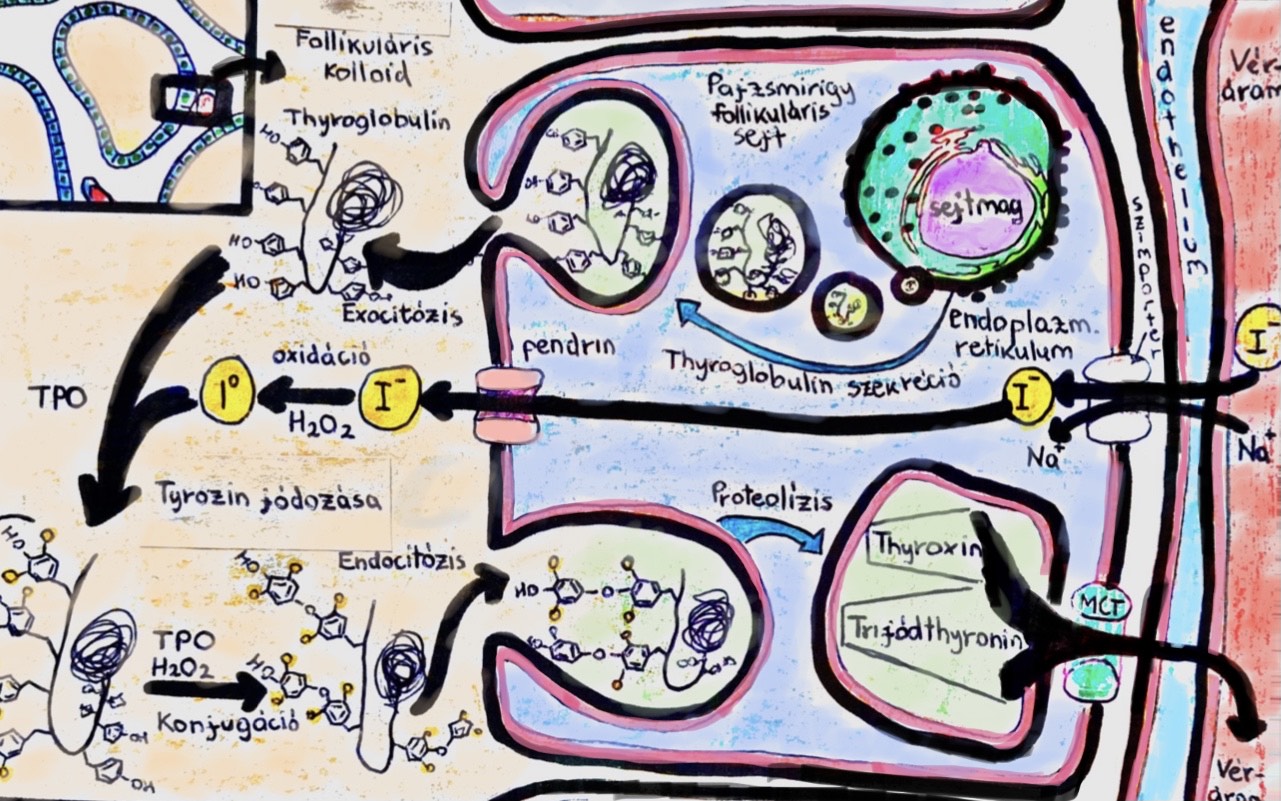
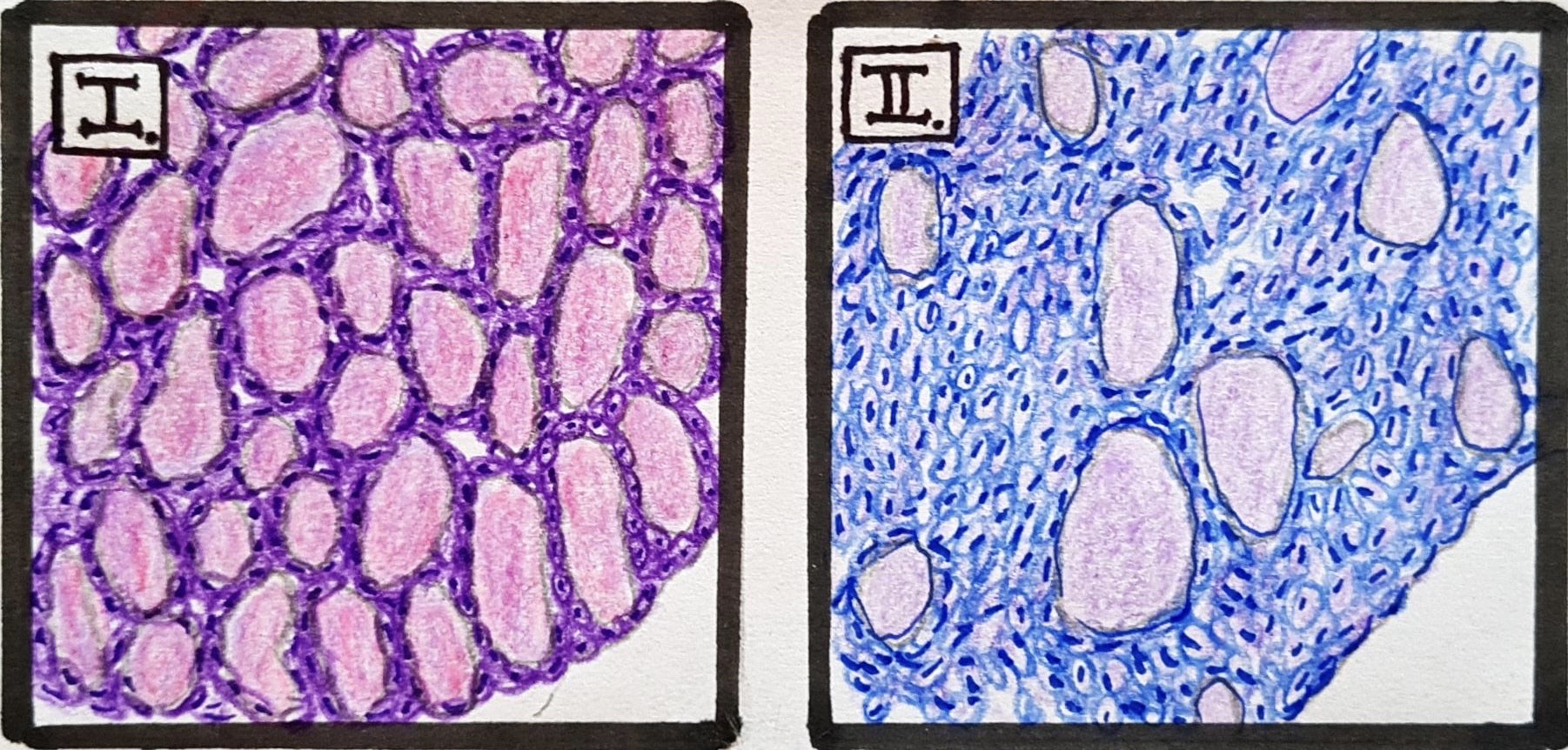
A legtöbb tanulmány a jód szerepét fejti ki, mivel ez az elem a pajzsmirigyhormonok egyik fő összetevője. Így a lentebbi ábrát (2. ábra) tanulmányozva érthetővé válik, hogy mind a jódhiányos állapot vezethet krónikus pajzsmirigy gyulladáshoz, mely annak kóros megnagyobbodásával, azaz golyva vagy strúmaképződéssel járhat, mind a fokozott jódbevitel is káros hatással van az autoimmun betegségeknek legjobban kitett szervünkre (Rayman, 2019). Az ezt alátámasztó kutatások közül a legkiforrottabb a Merck Laboratórium kutatóihoz köthető, akik keresztezéssel létrehoztak egy kísérleti-állatmodellt, melynek neve a NOD.H2H4 (Burek és Talor, 2009). Ez a modell két olyan egérvonal keresztezésével jött létre, melyeknél egyikben sem kimutatható a szülők között a pajzsmirigy elváltozása, azonban ezen a példányok több, mint 90%-ában mégis expresszálódótt a betegség, abban az esetben, ha az ivóvízükbe jódot adagoltak, ami bizonyítja a jód szerepét a betegség kialakulásában (Weatherall és mtsai, 1992). A betegség autoimmun voltát, pedig az támasztja alá, hogy a példányok öröklődés útján, nem rendelkeztek hajlammal az adott pajzsmirigy betegségre, mégis kialakult bennük az elváltozás (3. ábra) (Burek és mtsai, 1999).
|
2. ábra: Pajzsminrisg hormonok szintézise a pajzsmirigyben. A jód kulcsfontosságú szerepe. |
|
3. ábra: Eltérés a normál és jódozott ivóvízű egerek pajzsmirigyének szövettani metszetei között a follikulus állományában. |
Fémek és metalloidok
- Az számos autoimmun betegség közül melyeket ismerünk, a szklerózis multiplex (a központi idegrendszer gyulladásos neurodegeneratív betegsége) esetében találhatunk, olyan kutatási eredményeket, melyek bizonyítják, hogy az alacsony antioxidáns szint, mely a réz, cink, mangán és vas hiányára, kiegyensúlyozatlan szintjére utal, befolyásolja ezen autoimmun betegség kialakulását (Mezzaroba és mtsai, 2019) (Sheykhansari és mtsai, 2018). Ezek a fémek/metalloidok, kulcsfontosságú szerepet játszanak a szervezet egészséges működésében, azonban más fémek, mint az ólom és a kadmium, jelenlétükkel megemelik az oxidatív stresszt kialakulásának esélyét. Az oxidatív stressz befolyása a szervezetre egy bonyolult mechanizmus következménye, melynek lényege, hogy az oxidáló anyagok, azaz a szabad gyökök és az antioxidánsok aránya és egyensúlya felborul, melynek következtében a folyamat az oxidációs folyamatok javára tolódik el. Ez a mechanizmus megnöveli a multiplex sklerózis kialakulásának veszélyét (Etemadifar és mtsai, 2016) (Monti és mtsai, 2016). A réz, mint elengedhetetlen elem szerepelt korábban a szkelórizos multiplex esetében, azonban ugyanez az elem súlyosbíthatja is a betegséget, ha a szintje az egészséges kontrolléhoz képest magasabb, ugyanez vonatkozik az I. típusú cukorbetegségre is, mely esetében a legtöbb páciensnél a normálisnál magasabb réz szintet mutattak ki a szervezetükben, mely bizonyítja, hogy összefüggés van a betegség és a réz bevitele között (Squitti és mtsai, 2002). Ezenfelül bizonyították, hogy az I. típusú cukorbetegség összeköttetésben áll a króm hiányával a szervezetben, mivel az befolyásolja a lipid-, inzulin- és glükózanyagcserét. Az inzulin szintézisét, és szekrécióját ezenkívül a nem megfelelő mangán nem megfelelő jelenléte is megzavarhatja (Cannas és mtsai, 2020).
Megbetegedések, melyeken az egyén vagy egyed élete folyamán átesik
Bakteriális eredetű betegségek
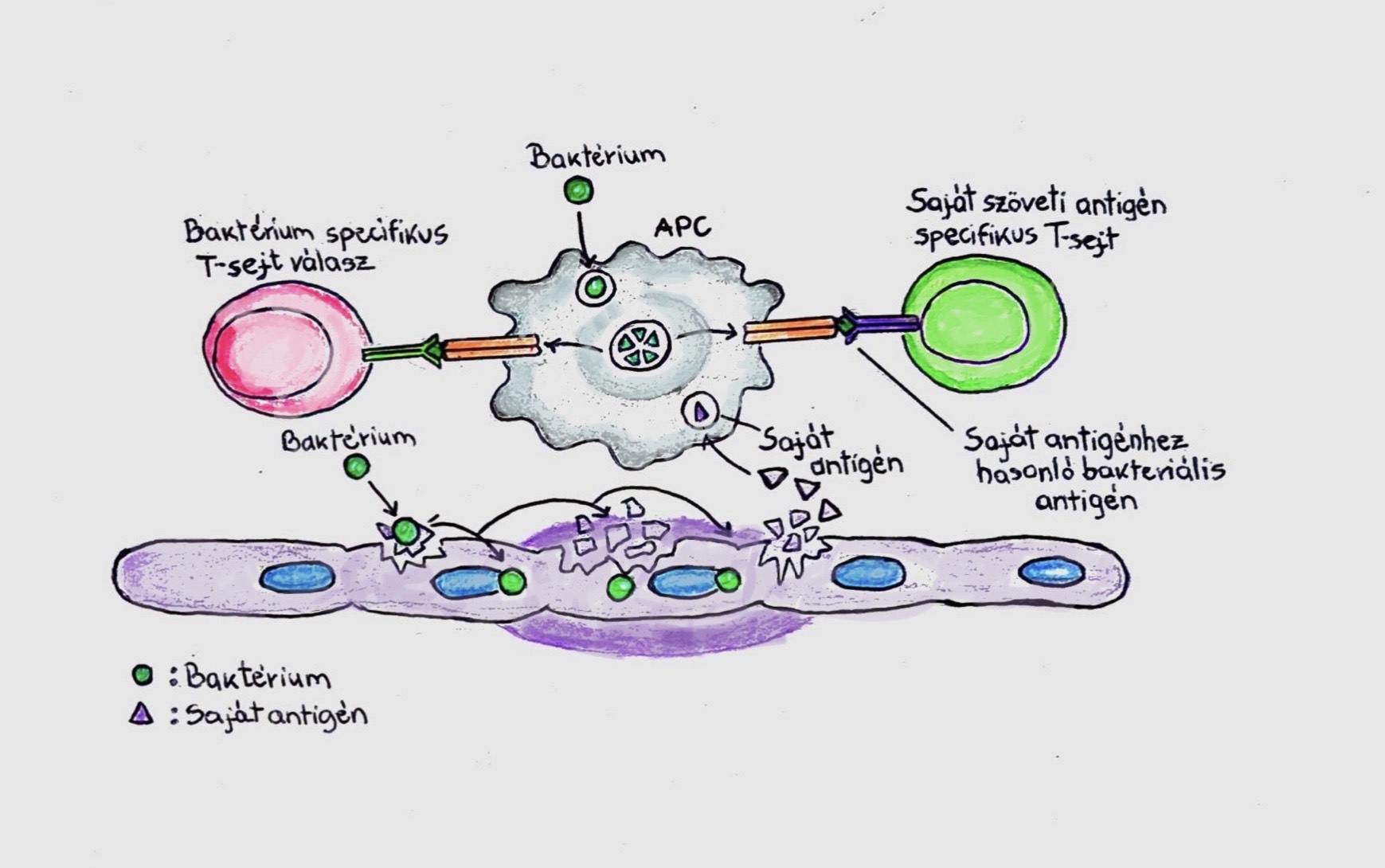
A bakteriális fertőzések igazoltan hozzájárulhatnak az autoimmun betegségek kialakulásához, bár a folyamat mechanizmusa még nem teljesen tisztázott. Számos humán patogén baktérium termel és hordoz olyan extracelluláris DNS-t vagy amiloidokat (fehérjéket), amelyek épp a számukra végzetes immunválasz elkerülése érdekében nagyon hasonlítanak a gazdaszervezet sajátjaira. Ha a szervezet ezeket mégis testidegennek ismeri fel, akkor az ezekre adott válasz autoimmun betegséghez vezet (4. ábra).
Az egyik legjobban ismert ilyen kapcsolat a Salmonella, Shigella, Yersinia, vagy Campylobacter kórokozók által okozott gasztrointesztinális fertőzés következtében kialakuló köszvény (ízületi gyulladás). A betegség általában az eredeti fertőzéstől számítva 1-4 héten belül kezdődik, és elsősorban az ízületeket támadja meg, de egyes esetekben szemgyulladást és húgyúti tüneteket is okoz. Az ilyen ízületi gyulladások antibiotikummal nem kezelhetők, a gasztrointesztinális betegséget okozó baktérium nem tenyészthető ki az ízületi folyadékból.
Összefüggés van a mandulagyulladást okozó Streptococcus baktérium és egy autoimmun betegség, a pikkelysömör között is. Az összefüggést bizonyítja, hogy bíztató enyhülést figyeltek meg pikkelysömörrel élő betegek esetében mandulaműtétet követően, valamint hosszútávú penicillin-kezelést követően is.
A Lyme-kórt okozó Borrelia burgdorferi baktériummal való fertőződés következtében egy krónikus autoimmun betegség, az SLE, vagy rövid nevén lupus alakulhat ki. A Lyme-kór tünetei a köszvény, idegrendszeri problémák és a fáradtság, míg a lupus gyakorlatilag minden szervet érintheti, mégis leggyakoribb célpontjai a bőr, a vesék, és a szív.
A közvetetten autoimmun betegséget okozó patogén baktériumoknak egy közös tulajdonsága biztosan van: a gazdaszervezetéhez hasonló amiloidokat termelnek a molekuláris mimikri (molekuláris utánzás) fenntartása és az immunrendszer támadásának enyhítése érdekében (Nicastro és Tükel, 2019).
|
4. ábra: A fertőzés által indukált autoimmunitás mechanizmusai a molekukáris mimikrin keresztül. A bakteriáli behatásra felszabaduló saját szöveti antigén és a bakteriális antigén egyidejű bemutatása a T-sejteknek; az aktivált T-sejtek a saját és a bakteriális antigén ellen is termelhetnek antitesteket. |
Vírusos megbetegedések
Számos esetben tapasztalták, hogy egyes vírusok okozta fertőzések közvetett velejárója lehet egy autoimmun betegség. Sajnos az, hogy egy vírus miként tudja fogékonyabbá tenni a gazdaszervezetet egy autoimmun betegségre még nem tisztázott, mert nagyon sok tényezőtől függ, hogy egy vírus miként és mennyire súlyosan betegíti meg a gazdaszervezetet, valamint ez utóbbi által adott válaszreakció is lényegesen befolyásolhatja, hogy kialakul-e a fertőzés miatt autoimmun betegség.
Tovább nehezíti a témáról való véleményalkotást az, hogy több esetben is pont fordított kapcsolatot fedezhetünk fel a két betegség között: a vírusos fertőzés olyakor ellenállóbbá teszi a gazdaszervezetet bizonyos autoimmun betegségekkel szemben.
Szervezetünk bizonyos "killer" sejtekkel van felszerelve arra az esetre, ha egy másik sejtet vírus fertőzne meg. Ezek a sejtek képesek elpusztítani a fertőzötteket, de közben vigyázni kell az egyensúly megtartására. Ha az egyensúly felborul, és a "killer" sejtek egészséges társaikat is megtámadják, abból autoimmun betegség alakulhat ki.
Egy vírus által fertőzött sejt I-es típusú interferonokat (IFN-α és IFN-β) termel a fertőzésre adott immunválasz elején, mely anyagoknak számos antivirális és immunerősítő hatása ismert. Ugyanakkor ezen anyagok hosszútávú jelenléte káros hatással van a szövetekre.
Diéták és tápanyagbevitel
Sófogyasztás
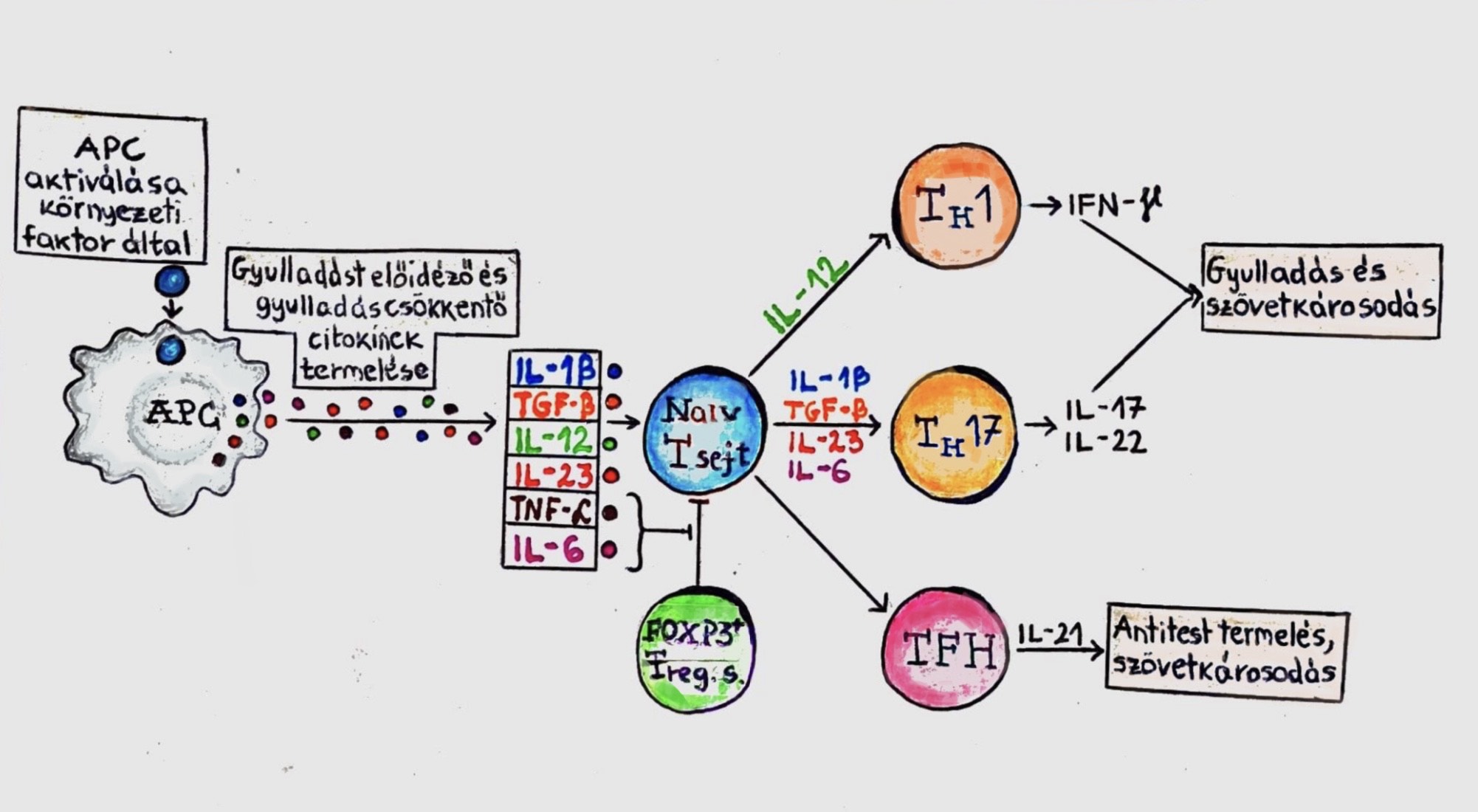
Utóbbi években több kutatás kimutatta, az országok sófogyasztása közötti különbséget, illetve a bizonyítékot a magas sófogyasztás és a magas vérnyomás, stroke, koronális artériák megbetegedése és más nem a keringési rendszerrel összefüggő megbetegedések között (Brown és mtsai, 2009) (Cook és mtsai, 2007). Ezek az összehasonlító kutatások azt is kimutatták, hogy a modern társadalmakban magasabb a sófogyasztás értéke. Például Ázsiában a szójaszószos ízesítés miatt, valamint a gyorséttermi ételek fogyasztásának köszönhetően. Azonban a közelmúltban fény derült a magas NaCl fogyasztás hatására a T-helper sejtekre. A CD4+ T sejtek tudnak differenciálódni különböző működés által elkülönült sejtcsoportokra, ehhez transzkripciós regulátorokra van szükség. Például T-bet a TH1 sejtet, vagy FOXP3+ a TH3 sejt kialakulásához (5.ábra).
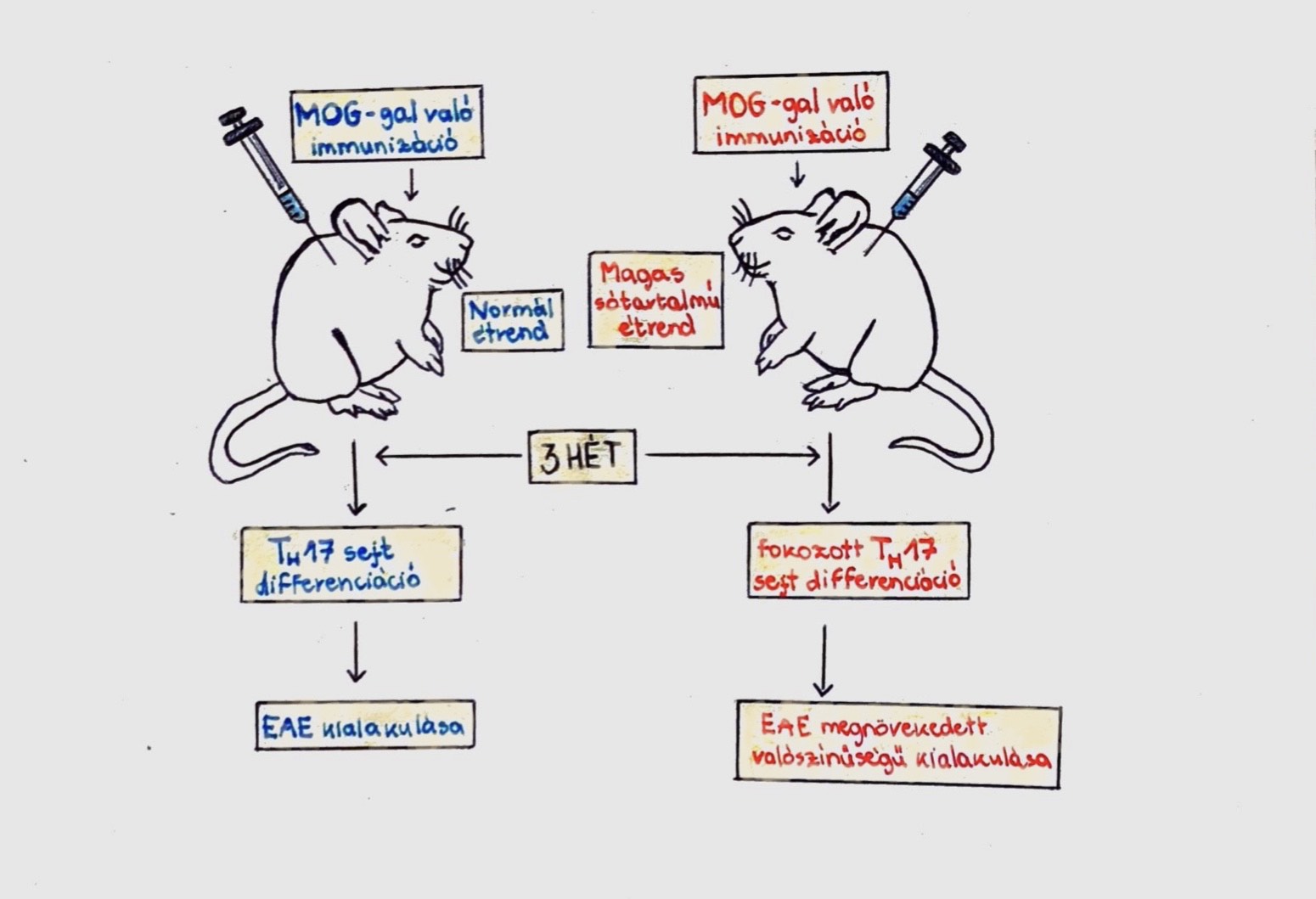
Ezek közül az IL-23-függő IL-17-gyártó (IL-23-dependent IL-17-producing) CD4+ T-helper sejtek játszanak kiemelkedő szerepet az autoimmun betegségek kialakulásában. NaCl képes autoimmun betegséget kialakítani, azzal, hogy gerjeszti a patogén TH17 sejteket (Kleinewietfeld és mtsai, 2013). Ezeket a kísérleteket 10-40mM koncentrációjú táptalajon végezték, ezzel utánozva a magas sótartalmú étrendet fogyasztó állatokat. A megnövekedett NaCl koncentráció markánsan indukálta a CD4+ T-sejtek átalakulását IL17A-t expresszáló CD4+ T-sejtekké. Ez a hatás dózisfüggő volt, és 40mM-re növelésnél volt a legmagasabb. Egereket érintő kísérlet során a kontrolokkal összehasonlítva a magasabb sótartalmú étrendben szereplő egereknél sokkal nagyobb számú IL-17A-t expresszáló, illetve patogén TH17 sejtet mutattak ki (6.ábra) (Vojdani, 2014).
|
5. ábra: A T-sejtek differenciációja, immunreakciók megjelenése. |
|
6. ábra: MOG: Myelin Oligodentrocyte Glycoprotein |
Tejfogyasztás és gluténbevitel
Az étkezési fehérjékkel kapcsolatban több kutatás is igazolta, hogy tejben és búzában lévő különböző fehérjék és peptidek kapcsolatban állnak az autoimmun betegségek kialakulásában. Az egyik tanulmány például, a tejfehérje-butirofilin és az extracelluláris IV-szerű doménje immunulógiai keresztaktivitásról, más néven molekuláris utánzásról (mimikri) számol be (Stefferl és mtsai, 2000). E folyamat során a butirofilin képes módosítani az encephalitogén T-sejt válaszát a mielin oligodendrocita-glikoproteinre, a kísérleti autoimmun enchephalitis esetén. További ilyen keresztreakció még a tej albumin komponensei és a pancreas szigeti sejt antigén-1 és a béta sejt felszíni fehérjével. Ez a reakció főleg korai csecsemőkori tej táplálásakor figyelhető meg és ez 1-es típusú diabetes kialakulásához vezethet.
A búzafehérjékkel kapcsolatban is bebizonyosodott, hogy a búza alapú étrend indukálja a Th1-es típusú citokin többletet a bélben, valamint fokozza a T-sejtek reaktivitását a gluténnal szemben (Vojdani, 2014).
D-vitamin szerepe
A D vitamin nagyon fontos szerepet tölt be az emberi szervezetben, növeli a Ca és P felszívást a belekből, valamint gátolja a parathormon szintézist, ezáltal a csontok normál épülését segíti. Nem csak a calcium háztartásra és az endokrin rendszerre, de az immunrendszerre is hatással van. A D vitamin indirekt és direkt módon irányítja a CD4+ T-limphociták differenciálódását és ezáltal az autoimmun betegségek megelőzésében is fontos szerepet játszik.
A D vitamin két úton gátolja dendritikus sejteket. A dendritikus sejtek olyan antigén bemutató sejtek, amelyek a T-sejt-függő immunválasz elindításában és fenntartásában vesznek részt. In vitro 1,25 (OH) 2D3-vitamin gátolja a monociták dendritikus sejtekké történő differenciálódását, ezáltal csökkentve a T-sejtek stimulusát.
In vivo 1,25 (OH) 2D3-vitamin direkt immunszupressziv hatással csökkenti. a dentritikus sejtek IL-12 termelését, ami a TH1-sejtek válaszát és termelődését irányítja.
Ezen kívül a T-regulátor sejtek, melyek feladata a perifériás autoreaktív T-sejtek aktivációjának szabályozása, illetve gátlása, 1,25 (OH) 2D3-vitamin hiányában funkciójuk károsodott, ezzel elősegítve az autoimmun betegségek kialakulását, például szisztémás lupus erythematosus, rheumatoid arthritis, vagy diabetes mellitus.
Mind kísérletek mind klinikai adatok alátámasztják, hogy a D-vitamninak alapvető szerepe van az autoimmun betegségek kialakulásában. Földrajzi elhelyezkedés alapján az északi országok, például Kanadában, Észak-Amerikában, vagy Európában a a gyulladásos bélbetegség és a sclerozis multiplex gyakoribb, mint a déli országokban. Az évszakos váltakozását tekintve a sclerosis multiplex, tavasszal súlyosabb, mint az év többi részében (Szodoray és mtsai, 2008) (Murdaca és mtsai, 2019).
Gyógyszerek
Antivirális terápia
Az autoimmun hepatitis (AIH) kialakulását a közvetlenül ható antivirális (DAA) terápia is előidézheti. Matsumoto és munkatársai, egy olyan esetet írtak le, ahol, egy 81 éves nőt kezeltek DAA-val krónikus hepatitis C vírus (HIV) ellen. Két hónapos kezelést követően a betegben előrehaladott máj problémát állapítottak meg, amiről máj biopsziát követően megállapították, hogy a gyógyszer által kialakult autoimmun hepatitis a betegség (DI-AIH). A DAA terápia elhagyásával és más terápiára való váltással, a májműködési zavar is enyhült (Matsumoto és mtsai, 2018).
Szteroidok
A nemi hormonok is részt vesznek az immunrendszer megfelelő működédében, épp ezért az autoimmun betegségek kialakulását is elősegíthetik, vagy gátolhatják. Ebben a témakörben azt is meg kell említenünk, hogy az autoimmun betegségek megjelenésének gyakoriságában nagy különbség van a két nem között. A szklerózis multiplex, és a Hasimoto pajzsmirigy betegség főleg a nőket érinti, ugyanakkor az ízületi gyulladás (Rheumatoid Arthritis) a menopauza után lesz gyakoribb. Az ösztrogénnek főleg immunstimuláló, “gyulladás kiváltó” hatása van, befolyásolja a CD4+ T-sejtek aktivációját és differenciálódását, ezáltal kiválthat autoimmun betegséget. A progeszteronnak főleg immunszupresszáló hatása van. A CD4+ T-sejtek differenciálódását úgy befolyásolja, hogy növeli a IL-4 gyártást, és a T-regulátorrá történő differenciálódást, valamint csökkenti az IFN-gamma előállítást, ezzel gátolva a gyulladásos folyamatok beindulását. Az. androgén hatása is immunszupresszáló, főleg a B-lymphocyták szabályozásában, és a T-lymphocyták reakciónak gátlásában van szerepe. Összefoglalava a szteroid hormonok nagy szerepet játszanak az autoimmun betegségek kialakulásában, de mondhatjuk azt, hogy egyes hormonok csat gátló, vagy serkentő hatásúak, az adott autoimmun betegséget illetően (Benagiano és mtsai, 2019).
GM-CSF
Granulocita. macrofág kolónia stimuláló faktor: So Jin Bing és társai kimutatták, hogy a GM-CSF IFN- γ és IL17- α hiányában autoimmun szivárványhártya gyulladásnál átveszi a gyulladást kiváltó faktor szerepét (Bing és mtsai, 2020).
Egyéb faktorok
A fentebb említett környezeti faktorok hatása az immunrendszerre, már kiforrottabb tanulmányok által igazolt, hiszen hosszú évek óta fentálló problémákkal vannak összeköttetésben, azonban az utóbbi időben, több egyéb tényező kapcsolatát is firtatják az autoimmun betegségek kialakulásával kapcsolatban, melyek elsősorban a jelenkor problémáival köthetőek össze. Ezek a faktorok elsősorban a környezetszennyezés és helytelen életmód miatt vannak jelen a mi, illetve háziállataink életében, ilyen például, a légszennyezés, a különféle sugárzások, a stresszes életmód és humán vonatkozásban a dohányzás is.
Légszennyezés és dohányzás
A gyárak és személygépkocsik által kibocsájtott gázok (szén-monoxid, nitrátok, kén-dioxid, ózon,) aeroszolok és a különböző mérettartományba eső, finom szemcsés anyagok a tüdőbe jutva, gyulladásos folyamatokat indítanak be, vagy a meglévő gyulladást súlyosbítják. Az autoimmun ízületi gyulladás (rheumatoid arthritis) esetében, a levegőben keringő szilícium, és finom szemcsés anyagok magas koncentrációja is előidézheti ezt a betegséget. Ezenfelül a dohányzás is egy újabb rizikófaktor, mely hasonló folyamatokat indít be a szervezetben, mint a légszennyezésben résztvevő anyagok (Gawda és mtsai, 2017).
Sugárzások
A légszennyezés közvetetten hatással van egy olyan egyéb környezeti tényezőre, amely szintén befolyással bír az immunrendszerünkre. A gázok melyek a légkörbe kerülnek, nem csak az egyén, illetve egyed tüdejét és ezáltal immunrendszerét veszik célba, hanem hatást gyakorolnak az ózonrétegre is, melynek következtében az antarktiszi ózonlyuk egyre nő. Ez úgy köthető az autoimmun betegségekhez, hogy a sugárzások, értve ezalatt a fentebb kifejtett probléma következtében megemelkedett UV-sugárzást és a radioaktív sugárzásokat is, kóros és a szervezet számára előnytelen immunválaszt indukálhatnak (Ponsonby és mtsai, 2002) (Sakaguchi és mtsai, 1994).
Stressz
Feltételezések szerint a stressz is fontos szerepet tölt be az autoimmun betegségek kialakulásában, olyan páciensekben, akikben a genetikai hajlam is jelen van. A stressz hatására a katekolaminok és a glükokortikoidok nagy mennyiségben szabadulnak fel a mellékveséből. Ezek a hormonok az immunrendszer egyes sejtjeit befolyásolják, olyan irányba, hogy a sejtek differenciálódását módosítják (Sharif és mtsai, 2018).
Konklúzió
Napjainkban számos autoimmun betegséget ismerünk, melyek egyre gyakrabban expresszálódnak az emberek és háziállataink körében egyaránt, azonban a tudomány számára, továbbra is feltérképezetlen, vagy csekély mértékig ismert tényezőnek számít, kialakulásuk pontos oka, és folyamata. Azonban kutatások által válik bizonyítottá, hogy a környezeti faktorok, erősen befolyásolják ezeket a betegségeket, és ezeknek a szerepe és hatása, a fejlődéssel egyre- és egyre nőni fog. (lásd egyre több megjelenő gyógyszer, új betegségek megjelenése, káros anyagok megemelkedett bevitele, káros nyomelemek felvétele a környezetből, folyton fokozódó stressz) A fentiekben felsorolt széleskörű hatások miatt fontos, hogy ezt a területet sokkal jobban kiismerjük, és ezáltal, eljuttassuk az emberekhez éltmódjuk fontosságát az autoimmun betegségek kialakulására nézve, illetve, hogy mind a humán-, mind az állatorvosi praxisokban megemeljük, ezeknek a betegségeknek a pontos felismerését, diagnosztizálását, hogy ezáltal a fentálló kezelési módszerek segítségével a lehető legkevesebb panasszal kelljen a betegeknek együtt élnie.
Irodalomjegyzék
Benagiano M; Bianchi P; D’Elios MM; Brosens I; Benagiano G (2019): Autoimmune diseases: Role of steroid hormones. Best Practice & Research Clinical Obstetrics & Gynaecology 60: 24-34
Bing SJ; Silver PB; Jittayasothorn Y; Mattapallil MJ; Chan CC; Horai R; Caspi RR (2020): Autoimmunity to neuroretina in the concurrent absence of IFN- γ and IL17- α is mediated by a GM-CSF-driven eosinophilic inflammation. Journal of Autoimmunity 114
Brown IJ; Tzoulaki I; Candeias V; Elliott P (2009): Salt intakes around the world: implications for public health. International Journal of Epidemiology 38: 791-813
Burek CL; Talor M; Hill SL; Stafford EA; Barin J, Rose NR (1999): Adoptive transfer of iodine-induced autoimmune thyroiditis in the NOD.H2h4 mouse. Faseb Journal 13: 1000
Burek CL; Talor MV (2009):Environmental triggers of autoimmune thyreoiditis. Journal of Autoimmunity 33: (3-4) 183-189
Cannas D; Loi E; Serra M; Firinu D; P Valera; P Zavattari (2020): Relevance of Essential Trace Elements in Nutrition and Drinking Water for Human Health and Autoimmune Disease Risk. Nutrients 12: (7) 2074
Cook NR; Cutler JA; Obarzanek E; Buring JE; Rexrode KM; Kumanyika SK; Appel LJ; Whelton PK (2007): Long term effects of dietary sodium reduction on cardiovascular disease outcomes: observational follow-up of the trials of hypertension prevention. British medical Journal 334: 885-888
Etemadifar M; Mehrabi B; Kiani-Peykani R; Abtahi SH; Nekouie-Isfahani K; Ramagopalan SV; Fereidan-Esfahani M (2016): Soil heavy metals are associated with the distribution of multiple sclerosis in Isfahan, Iran. Acta Neurologica Scandinavica 134: 292-299
Flodström-Tullberg M (2003): Viral infections: their elusive role in regulating susceptibility to autoimmune disease. Microbes and Infection 5: (10) 911-921
Gawda A; Majka G; Nowak B; Marcinkiewicz J (2017): Air pollution, oxidative stress, and exacerbation of autoimmune diseases. Central European Journal of Immunology 42: (3) 305-312
Kleinewietfeld M; Manzel A; Titze J; Kvakan H; Yosef N; Linker RA; Muller DN; Hafler DA (2013): Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells. Nature 496: 518–522
Matsumoto K; Kikuchi K; Kajiyama Y; Takano Y; Mabuchi M; Doi S; Sato K; Miyakawa H; Yasuda I (2018): Development of Autoimmune Hepatitis during Direct-acting Antiviral Therapy for Chronic Hepatitis C Virus Infection. Internal Medicine 57: 2669-2673
Mezzaroba L; Alfieri DF; Colado Simão AN; Vissoci Reiche EM (2019): The role of zinc, copper, manganese and iron in neurodegenerative diseases. Neurotoxicology 74: 230-241
Monti MC; Guido D; Montomoli C; Sardu C; Sanna A; Pretti S; Lorefice L; Marrosu MG; Valera P; Cocco E (2016): Is geo-environmental exposure a risk factor for multiple sclerosis? A population-based cross-sectional study in South-Western Sardinia. Plos One 11
Murdaca G; Tonacci A; Negrini S; Greco M; Borro M; Puppo F; Gangemi S (2019): Emerging role of vitamin D in autoimmune diseases: An update on evidence and therapeutic implications. Autoimmunity Reviews 18: (9)
Nicastro L; Tükel C (2019): Bacterial Amyloids: The Link between Bacterial Infections and Autoimmunity. Trends in Microbiology 27: (11) 954-963
Ponsonby AL; McMichael A; Mei I (2002): Ultraviolet radiation and autoimmune disease: insights from epidemiological research. Toxicology 181-182: 71-78
Rayman PM (2019): Multiple nutritional factors and thyroid disease, with particular reference to autoimmune thyroid disease. Proceedings of the Nutrition Society 78: (1) 34-44
Sakaguchi N; Miyai K; Sakaguchi S (1994): Ionizing radiation and autoimmunity. Induction of autoimmune disease in mice by high dose fractionated total lymphoid irradiation and its prevention by inoculating normal T cells. The Journal of Immunology 152: (5) 2586-2595
Sharif K; Watad A; Coplan L; Lichtbroun B; Krosser A; Lichtbroun M; Bragazzi NL; Amital H; Afek A; Shoenfeld Y (2018): The role of stress in the mosaic of autoimmunity: An overlooked association. Autoimmunity Reviews 17: (10) 967-983
Sheykhansari S; Kozielski K; Bill J; Sitti M; Gemmati D; Zamboni P; Singh AV (2018): . Redox metals homeostasis in multiple sclerosis and amyotrophic lateral sclerosis. Cell Death & Disease 9: 348
Squitti R; Negrouk V; Perera M; Llabre MM; Ricordi C; Rongioletti MCA; Mendez AJ (2019): Serum copper profile in patients with type 1 diabetes in comparison to other metals. Journal of Trace Elements in Medicine and Biology 56: 156-161
Stefferl A; Schubar A; Storch M; Amini A; Mather I; Lassmann H; Linington C (2000): Butyrophilin, a milk protein, modulates the encephalitogenic T cell response to myelin oligodendrocyte glycoprotein in experimental autoimmune Encephalomyelitis. Journal of Immunology 165: 2859–2865
Szodoray P; Nakken B; Gaal J; Jonsson R; Szegedi A; Zold E; Szegedi G; Brun JG; Gesztelyi R; Zeher M; Bodolay E (2008): The Complex Role of Vitamin D in Autoimmune Disease. Scandinavian Journal of Immunology 68: (3) 261-269
Vojdani A (2014): A Potential Link between Environmental Triggers and Autoimmunity. Autoimmune Diseases 2014: 18
Weatherall D; Sarvetnick N; Shizuru JA (1992): Genetic control of diabetes mellitus. Diabetologia 35: (2) 1-7
Ábrajegyzék
1. ábra: Saját (Vojadni ábrája alapján, 2014)
2. ábra: Saját (Rayman ábrája alapján, 2019)
3. ábra: Saját (Burek és Talor ábrája alapján, 2009)
4. ábra: Saját (Vojadni ábrája alapján, 2014)
5. ábra: Saját (Vojadni ábrája alapján, 2014)
6.ábra: Saját (Vojadni ábrája alapján, 2014)