Lisztérzékenység előfordulása és okai
A lisztérzékenység (cöliákia, gluténszenzitív enteropátia) autoimmun betegség, megnyilvánulási módja betegenként eltérő lehet. A tünetek első leírása már több mint kétezer éves, de az első elfogadható leírás a 2. században keletkezett. A cöliákia betegség fogalmát Samuel Gee használta először (1888), míg a gabona magvaknak és a gluténnek a kialakulásban játszott szerepét Willem Dicke ismerte fel 1950-ben (Némedi, 2009). Számos embert és állatot érintő probléma, főként kellemetlen tünetei és gyermekekre kifejtett súlyos hatása miatt vált ismertté. Jelenleg a gluténérzékenység megszüntetésére nincs ismert kezelési mód, gluténmentes diétával azonban megállíthatóak a kóros immunológiai folyamatok, és a beteg tünetmentes, teljes életet élhet.
Contents
Előfordulás
Az egyik leggyakoribb genetikai eredetű betegség (de kiváltó okai között környezeti faktorok is szerepelnek) (Gujral és mtsai, 2012). A cöliákia előfordulási aránya az európai és észak-amerikai népesség körében körülbelül 1% (Észak-Európában magasabb lehet). Azonban mind a fejlett, mind a fejlődő országokban világszerte egyre nagyobb számban fordul elő ez a betegség, és globális egészségügyi problémává vált, ahogy általánosan megnőtt a gabonaféléket tartalmazó élelmiszerek fogyasztásának mértéke (a hagyományosan rizs alapú étrenddel rendelkező ázsiai országokban viszonylag ritka betegségnek számít). Kutatások igazolják, hogy nők körében háromszor akkora a cöliákia előfordulásának aránya, mint férfiakban (Rallabhandi, 2012). A cukorbetegségben vagy autoimmun betegségekben szenvedőkben, illetve azokban az emberekben, akiknek közeli rokonaik között vannak lisztérzékenyek, nagyobb valószínűséggel jelenik meg cöliákia (Gujral és mtsai, 2012).
Habár a gluténszenzitív enteropátia tünetei bármely életkorban jelentkezhetnek, megjelenésének átlagos időpontja az elmúlt 30-40 évben megváltozott. Azelőtt gyermekbetegségnek tartották, melyet többnyire 2 évesnél fiatalabb gyermekeknél diagnosztizáltak, napjainkban viszont gyakori, hogy középkorú vagy idősebb felnőtteknél állapítanak meg cöliákiát (Polgár, 1996). Gujral igazolta (2012), hogy gyermekek esetében az első három hónapban történő búza, árpa és rozs fogyasztás szignifikánsan megnöveli a cöliákiával kapcsolatba hozható antitestek termelődésének kockázatát. Eltérően a fentebb említett, felnőtt betegeknél tapasztalható nemek szerinti aránytól, a gyermek- vagy időskorban diagnosztizáltak körében a férfi és női betegek aránya 1:1 (Gujral és mtsai, 2012).
Kialakulásának okai
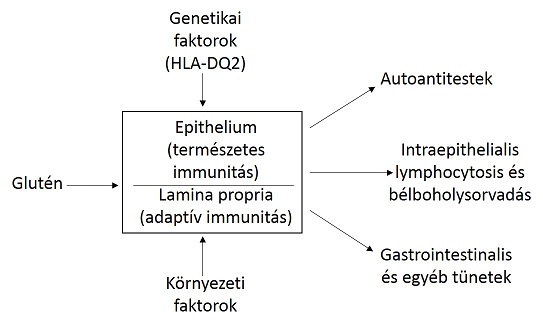
(1.ábra)
|
Bizonyos gabonafélék fogyasztása az arra érzékeny emberekben kóros immunológiai folyamatokat indukál, ennek hatására táplálékintolerancia alakul ki. Olyan, a szervezet saját kötőszövetes állományát károsító autoantitestek termelődnek, amik a vékonybélbolyhok sorvadását (krónikus vékonybél betegség) okozzák. A cöliákiát autoimmun patomechanizmusú szisztémás betegségnek tekintjük, a genetikailag komplex, poligénes, multifaktoriális betegségek csoportjába tartozik. Kialakulásában genetikai, környezeti és immunológiai faktorok is részt vesznek (Némedi, 2009).
A búza, rozs, árpa és tritikálé fehérje frakciói, a prolaminok – elsősorban a glutén - felelősek a bélbolyhok deformálódásáért és az emiatt bekövetkező felszívódási zavarokért. A glutén strukturális raktárfehérje komplex, gliadin és glutenin alkotja, búza sikérben ezek tömege megegyezik (Rallabhandi, 2012). A gliadin fehérjék monomerek (30-80 kDa), a glutenin fehérjék polimerek, melyek kis (25-45 kDa) és nagy (75-120 kDa) molekulasúlyú gluteninekből állnak. A fehérjék antigén jellegét immunogén karakterük és stabilitásuk befolyásolja. „Általában a 10-100 kDa közötti molekulatömegű fehérjék viselkednek immunogén antigénként. A 10 kDa-nál kisebb molekulatömegű fehérjék nem váltanak ki immunválaszt, míg a 100 kDa-nál nagyobbak nem tudnak felszívódni a bélcsatornán keresztül.” (Némedi, 2009).
A gluténérzékenység egyik formája a permanens Duhring-betegség (dermatitis herpetiformis), amely hólyagos bőrelváltozással és enyhébb emésztőrendszeri tünetekkel jár. A gabona- vagy gluténallergia tünetei a cöliákiához hasonlóak, az immunológiai folyamatok azonban különbözőek a két betegség esetében. Gabonaallergia hátterében IgE, cöliákiánál T-sejt mediált immunológiai reakció alakul ki. A gabonaallergiát a glutén mellett egyéb gabonafehérjék is okozhatják, valamint fontos különbség, hogy ez a betegség lehet időleges, és nem feltétlenül szükséges minden gluténtartalmú élelmiszert mellőznie a betegnek (Kovács, 2000). Az egyes típusú diabetes mellitus bizonyítottan gyakran társul a gluténérzékenységgel (Kocsis és mtsai, 2014). A cöliákiás betegek körében mérhetően magasabb a rákos megbetegedések kialakulásának kockázata, mint az egészséges populációban (Lebwohl és mtsai, 2015).
Állati ételallergia
Állatorvosi szempontból nagyon fontos felismerni az állati allergiát. Az ételallergia nem úgy mutatkozik a kutyákban, mint az emberekben. A kutyáknál leggyakrabban a bőr viszketése jelentkezik tünetként. Azok a kutyák, amelyek vakaróznak, nyalogatják, rágják vagy harapdálják, esetleg még dörzsölik is magukat főként az arc, a fül, a hónalj, a lágyék és a végbélnyílás területén, nagy valószínűséggel ételallergiások. Az állatorvosnak először arról kell meggyőződnie, hogy a viszketés hátterében nem áll-e állati parazita vagy gombás, esetleg bakteriális eredetű fertőzés.
Az ételallergia olyan kutyáknál is jelentkezhet, amelyek évek óta ugyanazt a táplálékot fogyasztják. Jelenleg még nincs olyan diagnosztikai módszer, amellyel biztosan ki lehet mutatni az állati élelmiszerallergiát. Ezért ilyenkor a beteg állatot kétféle diétára foghatjuk: vagy egy eliminációs diétára (amikor megpróbáljuk kiiktatni az étrendből a vélt patogén élelmiszereket), vagy pedig egy nyolc hétig tartó „exkluzív új protein” diétát követhetünk (amikor a szervezet számára ismeretlen élelmiszerekből állítjuk össze a beteg állat táplálékát). A cél az, hogy megállapítsuk, hogy az eledel okozza-e a viszketést. Ha a diéta nyolc hete alatt a tünetek csökkennek, és az eredeti étrendre történő visszaváltáskor a bőrgyógyászati panaszok megint jelentkeznek, akkor nagy biztossággal élelmiszerallergiáról beszélhetünk (Patterson, 2011).
A kutyák jellemzően azokra a fehérjékre lesznek allergiásak, amelyeket hosszú évek óta fogyasztanak. Amerikában ezek a fehérjék legtöbbször a marha- illetve csirkehús, tojás, tej, kukorica, búza és szója eredetűek (White, 2013).
Állatkísérletek
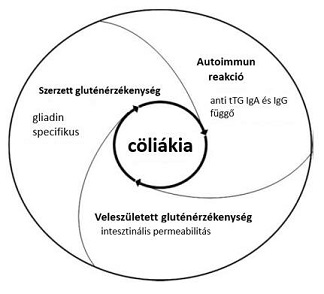
Számos állatkísérletet folytattak le a közelmúltban, melyek megpróbálták feltárni a cöliákia, mint betegség, komplex folyamatainak részeit. Eleinte ír szettereken végeztek kísérleteket, majd különböző rágcsálókon és napjainkban már majmokkal is modellezték a lisztérzékenységet. A kutatásokban mind a veleszületett, mind az adaptív glutén-immunválaszt vizsgálták. A legfontosabb következtetés, amit levontak, hogy a betegség három komponense (az öröklött gluténérzékenység, az adaptív gluténérzékenység és az autoimmun reakciók) független egymástól, ám bármelyikük felelhet a cöliákia kialakulásáért (Marietta és mtsai, 2011; 2. ábra)
|
Az 1980-as években ír szettereket használtak az állati lisztérzékenység kutatásához. A modellben kölyökkutyáknak búzát tartalmazó étrendet biztosítottak. Végeredményként a kutyáknál részleges bélboholy atrophiát és intraepitheliális lymphocyta infiltrációt figyeltek meg (Batt és mtsai, 1987).
A lisztérzékenység egy másik állati modellezésében rhesus makákókat használtak, amelyek szintén fogékonyak a cöliákia kialakulására. Ebben a kísérletben a gluténszenzitív makákók glutént tartalmazó diétát kaptak. A modell eredményeként a majmoknál bélboholy atrophiát, valamint anti-gliadin IgA-t és IgG-t találtak. A tTg, az IgG és az IgA elleni antitesteket későbbi kísérletekben is publikálták, egészen pontosan azt, hogy a szintjük megemelkedett más állatoknál is, de ez a szint sem a glutént tartalmazó diéta elvonásával, sem az újbóli alkalmazásával nem változott meg. Az azonban még tisztázatlan, hogy a jelenség társítható-e az MHC II molekulához. Viszont a modell jó volt az árpa endoproteáz (EP-B2), mint lehetséges új terápia tesztelésére is (Bethune és mtsai, 2008).
Az egészséges kontroll állatokon további kísérleteket folytattak. A modellezésben használtak egy transzepitheliális transzport peptidet, amely immunogén a cöliákiára nézve. Ez a peptid 33 aminosavból áll, ezért a „33-mer” névre keresztelték. A „33-mer” képes volt áthatolni az epitheliális barrieren azokban a majmokban, amelyek cöliákia-szerű enteropátiát mutattak, míg a teljesen egészséges állatokban nem tudott átjutni ezen a gáton (Mazumdar és mtsai, 2010).
A kutatásban azt a tényt is sikerült felfedezni, hogy bél permeabilitási zavarokat, melyek tight junction problémákon alapulnak, csak a glutén szenzitív majmoknál találtak, amelyek gliadint tartalmazó diétára voltak fogva. Ez utalhat arra, hogy a gliadin önmagában is képes volt kiváltani egy, a béláteresztő-képesség növekedésével járó rendellenes választ. Ezért a jövőben számíthatunk akár arra is, hogy a szerzett lisztérzékenység kiváltójaként szerepelhet a gliadin által indukált enteropátia (Marietta és mtsai, 2011).
Az egerek sokkal alkalmasabbak voltak a cöliákiás megbetegedések bemutatására, mint más fajok. A kísérletezést megkönnyítette a rövidebb élettartamuk és a genetikai manipuláció lehetősége. A tanulmányok végeztével kimutatták egy nem elhízott diabéteszes vonalban (non-obese diabetic, NOD) a spontán gluténérzékenységet, amely nem igényelt parenterális szenzitizációt. A NOD egerek egy csoportjával szabvány búza tartalmú tápot etettek, melynek következtében az egereknél a bélbolyhok magasságának diszkrét csökkenését figyelték meg, továbbá egy CD3 és egy IELs nevű molekula megjelenését tapasztalták, valamint az MHC II molekulák epitheliális expressziója is megnövekedett. A másik csoporttal gluténmentes tápot etettek. A két csoport között a különbség szignifikáns volt (Maurano és mtsai, 2005).
Genetikai háttér
A gluténszenzitív enteropátia genetikai és epigenetikai hátterével kapcsolatban még sok kérdés tisztázatlan. Összefüggést mutattak ki a betegség és a HLA-DQ2.5 molekula között, melynek heterodimerei két aminosavban különböznek, ez azonban funkcionális tulajdonságaikat nem befolyásolja. A molekulát hordozók relatív kockázata 40-50-szerese az átlagpopulációénak, viszont az átlagpopuláció 40%-a is hordozza a HLA-DQ2.5-öt lisztérzékenység kialakulása nélkül. Ebből következően a betegség megjelenésére nem-HLA-asszociált gének is hatással vannak, melyek valószínűleg recesszíven öröklődnek.
Autoimmun betegségek esetében a genetikai háttéren kívül a környezet hatása is jelentős. Cöliákiás betegekben a glutén befolyásolni képes a vékonybél mucosa epithelsejtjeinek differenciálódásáért felelős gének működését. Az epigenetika kapcsolatot teremt a genotípus és a környezeti tényezők hatásai között. Az autoimmun- és rákbetegségek kialakulásában az epigenom mutációinak döntő szerepet tulajdonítanak (Kocsis és mtsai, 2014).
Tünetek
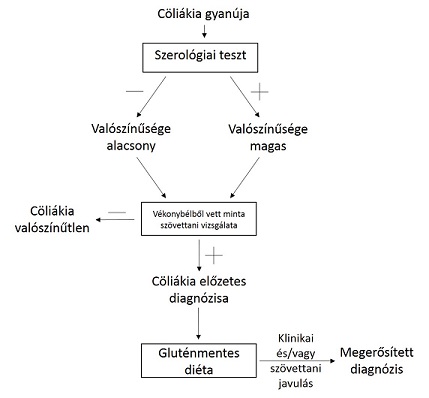
Hasonló tüneteket okozhatnak egymástól nagyon eltérő immunológiai folyamatok, de ugyanakkor egy betegségnek is megjelenhetnek igen változatos tünetei. A cöliákia diagnosztizálásához (3. ábra) nem elég a vékonybélbolyhok sorvadását igazolni, azt is bizonyítani kell, hogy az elváltozást glutén okozta, mivel a gluténérzékenységen kívül egyéb tényezőknek is lehet hasonló hatása. A következő általános tünetek adhatnak alapot cöliákia gyanújára: növekedésben való visszamaradás, fogyás, nemi érés késése, visszatérő vagy elhúzódó hasmenés (amennyiben nem bélfertőzés eredetű), hiányállapotok (nem kezelhetőek hagyományos módon – például fehérjehiány, vérszegénység, D-vitaminhiány, kalciumhiány) (Polgár, 2005). További tünetek lehetnek a fáradékonyság, mozgásszervi elváltozások, csontanyagcsere zavara, (nem virális eredetű) carditis, autoimmun hepatitis, nehezített teherbe esés, vetélés, férfi infertilitás, migrén, neuropathia (Kocsis és mtsai, 2014).
Kezeletlen betegeknél jelentkezhetnek pszichiátriai tünetek is, mint például szorongás, ingerlékenység, fásultság, egyes esetekben akár depresszió, pánikbetegség, amiknek valószínűleg egyes esszenciális aminosavak elégtelen mennyiségű felvétele az oka. Megfelelő, triptofánban (illetve fenilalaninban és tirozinban) gazdag gluténmentes diétával ezek is javulhatnak, azonban teljesen általában nem szüntethetőek meg. A triptofán a szerotonin prekurzora, csökkent felvétele esetén kevesebb szerotonin jut az agyba, ami hangulatrontó hatással van az egyénre, ezáltal hozzájárulhat a depresszió kialakulásához és fenntartásához (van Hees NJM és mtsai, 2015).
Gyakori, hogy felnőttkori lisztérzékenység esetében elsősorban extraintestinalis tünetek dominálnak, emésztőrendszeri panasz nincs, vagy csak enyhe. A tapasztalható tünetek általánossága miatt a cöliákia gyakran évekig diagnosztizálatlan marad, miközben a vékonybél folyamatos károsodásnak van kitéve. Igazolására specifikus antitestek kimutatása használható, a vékonybélbolyhok sorvadása szövettani vizsgálattal bizonyítható. Fontos megvizsgálni bizonyos hisztokompatibilitást kódoló gének kifejeződését is, a HLA (humán leukocita antigén) gének által kódolt fehérjéknek a glutén bélnyálkahártyát károsító hatásában betöltött mediátor szerepe miatt (Némedi, 2009).
|
Diéta
Jelenleg nem ismerünk olyan kezelési módot, amely a cöliákiát meg tudná szüntetni. A glutén étrendi kizárása viszont kiiktatja a kóros immunológiai folyamatokat, így a betegség minden tünete elmúlik, a vékonybél-nyálkahártya teljesen regenerálódik. Az étrendből tehát a búzát, az árpát, a rozst és a zabot (ez utóbbi gabonának a gluténmentes étrendbe való beillesztése még kérdéses) és származékaikat kell teljesen és véglegesen száműzni. Helyettesítésükre a kukorica, a szója vagy a rizs használható (Arendt és mtsai, 2004).
Az a hipotézis, hogy a zab káros hatásokkal bírna, a mai napig nem megalapozott, de mivel nincs bizonyítékunk ezen feltételezés ellenkezőjére, a Codex Alimentarius ajánlása szerint gluténmentes diéta során nem fogyasztható (Horacsek, 1995). A mai napig nincs egységes vélemény a szakemberek körében a zabot illetően. A diétára szoruló betegek 70%-a probléma nélkül használja, míg másoknál komoly tüneteket okoz (Némedi, 2009).
A cöliákiások esetében jelenleg még tisztázatlan a tünetek megjelenése nélkül elfogyasztható gluténmennyiség, a klinikai tünetek súlyossága és a szövettani eltérések közötti összefüggés. Az egyéni variációk és a klinikai heterogenitás is megnehezíti annak megállapítását, hogy a gluténmentes étrendben mennyi lehet a nyomokban előforduló glutén mennyisége.
Arról is vitatkoznak a szakemberek, hogy mekkora napi prolamin-bevitel okozhat problémát a gluténérzékeny betegeknek. Abban azonban egyetértenek, hogy az esetek nagy többségében nem okoz tüneteket a napi 10 mg alatti mennyiség. Ám korábbi kutatásokban előfordultak olyan esetek is, ahol a minimális prolamin mennyiség volt a tünetek okozója (Collin és mtsai, 2004).
Kitekintés
A búza és még néhány, ezzel a növénnyel rokon gabonaféle fogyasztása súlyos egészségügyi problémák kiváltójává válhat egy szűk embercsoport számára (EFSA-Q-2003-016, 2004).
A cöliákia autoimmun betegség, amely egy egész életen át tartó gluténmentes étrendet követel a betegektől. Megfelelő diétával nemcsak az akut esetek tünetei szüntethetők meg, hanem megelőzhetővé válnak a betegséghez társuló egyéb szövődmények, amelyek között a daganatos megbetegedések a legsúlyosabbak (Horacsek, 1995).
A végső cél az lenne, hogy teljesen gluténmentes termékeket készítsünk, de ez a valós esetekben csak nagyon nehezen kivitelezhető. A prolamin-szennyeződés minimálisra csökkentését azonban jó gyártási gyakorlattal (Good Manifacturing Practice, GMP) biztosítani lehetne (Némedi, 2009). A gluténmentes termékek jelölésére egy nemzetközileg is elismert logót használnak. (4. ábra)
|
Irodalom
Arendt, K. E., Schobert, T. J., Gormley, R., Gallagher, E. (2004): Új szemlélet a gluténmentes gabonatermékek előállításában. Élelmezési ipar. LVIII. évf. 1. szám, 5-13.
Batt RM, McLean L, Carter MW. (1987): Sequential morphologic and biochemical studies of naturally occurring wheat-sensitive enteropathy in Irish setter dogs. Dig Dis Sci. 32(2):184–194.
Bethune MT, Borda JT, Ribka E, Liu M-X, Phillippi-Falkenstein K, Jandacek RJ, Doxiadis GGM, Gray GM, Khosla C, Sestak K (2008): A non-human primate model for gluten sensitivity. PLoS One. 3(2):e1614.
Bethune MT, Ribka E, Khosla C, Sestak K. (2008): Transepithelial transport and enzymatic detoxification of gluten in gluten-sensitive rhesusmacaques. PLoS One. 3(3):e1857.
Collin, P., Thorell, L., Kaukinen, K., Maki, M. (2004): The safe threshold for gluten contamination in gluten-free products. Can trace amounts be accepted in the treatment of coeliac disease? - Aliment. Pharmacol. Ther. 19(12): 77-1283.
EFSA-Q-2003-016 (2004): Opinion of the scientific panel on dietetic products, nutrition and allergies on the request from the Commission relating to the evaluation of allergenic foods for labelling purposes. The EFSA Journal. 32 1-197.
Peter H. R. Green, Benjamin Lebwohl, Ruby Greywoode (2015): Celiac disease. J Allergy Clin Immunol. 135:1099-106. Naiyana Gujral, Hugh J Freeman, Alan BR Thomson (2012): Celiac disease: Prevalence, diagnosis, pathogenesis and treatment. World J Gastroenterol. 18(42): 6036-6059.
Horacsek, M. (1995): A gliadin kimutatása élelmiszerekben, Doktori összefoglalók. OÉTI.
Kocsis, D., Béres, N., Veres, G., Szabó, D., Müller, K. E., Arató, A., Juhász, M. (2014): Genetic and epigenetic aspects of celiac disease. Orv. Hetil. 155(3): 83–88.
Benjamin Lebwohl, Jonas F. Ludvigsson, Peter H. R. Green (2015): Celiac disease and non-celiac gluten sensitivity. BMJ. 351:h4347.
E. V. Marietta, C. S. David , J. A. Murray (2011): Important Lessons Derived from Animal Models of Celiac Disease. International Reviews of Immunology. 30(4):197–206.
Maurano F, Mazzarella G, Luongo D, et al. (2005): Small intestinal enteropathy in non-obese diabetic mice fed a diet containing wheat. Diabetologia. 48(5):931–937.
Mazumdar K, Alvarez X, Borda JT, et al. (2010): Visualization of transepithelial passage of the immunogenic 33-residue peptide from alpha-2 gliadin in gluten-sensitivemacaques. PLoS One. 5 (4):e10228.
Némedi, E. (2009): Molekuláris biológiai módszerek fejlesztése gluténmentesség ellenőrzésére. Központi Élelmiszer-tudományi Kutatóintézet Budapest.
Patterson, A. (2011): Itchy Dogs- Is Food the Problem? Pet Talk, College of Veterinary Medicine & Biomedical Sciences, Texas A&M University.
Prasad Rallabhandi (2012): Gluten and Celiac Disease—An Immunological Perspective. Journal of AOAC International Vol. 95, No. 2.
Van Hees NJM, Giltay EJ, Tielemans SMAJ, Geleijnse JM, Puvill T, Janssen N, et al. (2015): Essential Amino Acids in the Gluten-Free Diet and Serum in Relation to Depression in Patients with Celiac Disease. PLoS One. 10(4): e0122619.
White, S. D. (2013): Overview of food allergy. The Merck Veterinary Manual, Food Allergy Topic.