|
Size: 29676
Comment:
|
Size: 29677
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 86: | Line 86: |
| Az'' E. coli'' baktériumból a sejtfal károsodása esetén a szövetközbe kijutó nagyszámú endotoxinok a következő 12-24 órában a legsúlyosabb esetekben az állat elpusztulását okozhatják. Egyéb esetekben magas láz és a keringési rendszer állapotának romlása miatti alacsony vérnyomás léphet fel. A tünetek közé tartozik még a csökkent tejhozam, a tejben megjelenő szomatikus sejtek magasabb száma a normális szintnél, vörösség illetve a testhőmérséklet emelkedése. Egyes esetekben a csecsbimbó ''endothelium'' rétegének sérülése következményében fehár alvadék is jelentkezik. Az összes esetben az érintett tőgynegyed melegsége, duzzadtsága megfigyelhető. | Az'' E. coli'' baktériumból a sejtfal károsodása esetén a szövetközbe kijutó nagyszámú endotoxinok a következő 12-24 órában a legsúlyosabb esetekben az állat elpusztulását okozhatják. Egyéb esetekben magas láz és a keringési rendszer állapotának romlása miatti alacsony vérnyomás léphet fel. A tünetek közé tartozik még a csökkent tejhozam, a tejben megjelenő szomatikus sejtek magasabb száma a normális szintnél, vörösség illetve a testhőmérséklet emelkedése. Egyes esetekben a csecsbimbó ''endothelium'' rétegének sérülése következményében fehár alvadék is jelentkezik. Az összes esetben az érintett tőgynegyed melegsége, duzzadtsága figyelhető meg. |
A tőgy immunológiája
Contents
Bevezetés
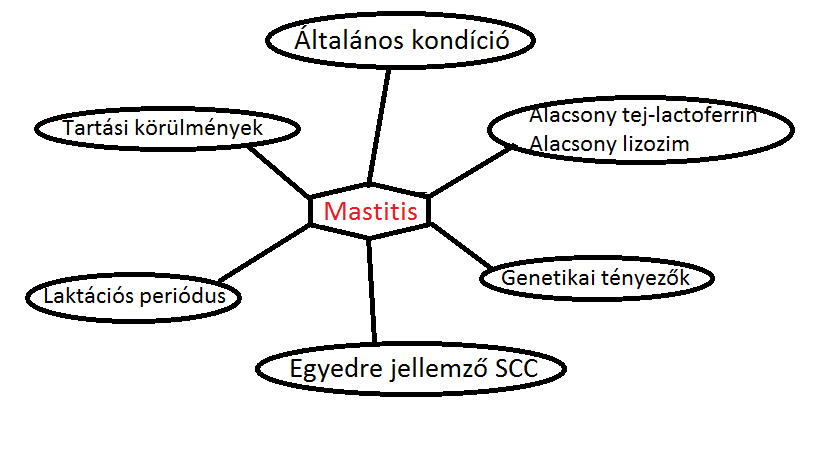
A tejelő szarvasmarha-állományok megbetegedései közül is kiemelkednek a tőgyet érő gyulladásos elváltozások. A mastitis (tőgygyulladás) a legnagyobb gazdasági kárral járó megbetegedés. A mastitis megjelenési formája nagyban függ a pathogén típusától, a fertőzésre adott válasz igen sokrétű a kiváltó kórokozótól függően. A következőkben ezen igen változatos védekezési mechanizmusokat szeretnénk bemutatni egy kicsit részletesebben.
|
A tőgy anatómiai és szövettani jellemzése
A tőgy a kültakaró egyik módosulta, amit kívülről cutis takar,de nincsen subcutis. A szervet felületes és mély pólya (fascia superficialis/profunda mammae) függeszti fel. A mély pólyának két lamina lateralis-a és két lamina medialis-a van. Ezekről a főlemezekről ún. melléklemezek erednek (lamallae suspensoriae), melyek a mirigylebenykék között haladnak. A mély pólyán belül találjuk a rendezetlen tömöttrostos kötöszövetből álló kötőszövetes tokot (capsula mammae),amey az interstitium része. Ebből lazarostos kötőszövetből felépülő sövények indulnak ki, melyek szintén az interstitium részei, és lebenyzetté teszik a szervet. Ennek a lazarostos kötőszövetnek a folytatása képez burkot a mirigyvégkamrák (periglanduláris ksz.) és a kivezető csövek (peritubuláris ksz.) körül. A szerv parenchyma-ját a mirigyvégkamrák és a hozzájuk tartozó kivezető csövek teszik ki. (Röhlich, 2006) A mirigyvégkamrák bogyószerűek és őket egyrétegben bélelik az epithelsejtek (MEC= Mammary Epithelial Cell). Második legnagyobb számban jelenlévő sejtéleség az MFC (Mammary Fibroblast Cell) és ezenkívül a permamensen jelenlévő boMdM-ek (bovine Monocyta-derived Macrophag). A hámsejteket lamina basalis veszi körül, majd ezt a periglandularis kötőszövet övezi. Myoepithel sejtek is találhatóak a kamrák falában, melyeknek feladata a tej ürítése. Laktációs időszakban a tőgy állományának 70%-a MEC (Günther és mtsai, 2016). A mirigy kivezető csatornák rendszere:az intralobularis kivezető csövekkel kezdődik, melyek közvetlenül a mirigyvégkamrákból indulnak ki. Ezek kilépve a kamrákból interlobuláris kivezető csövekké (ductus lactiferi, tejutak) szedődnek össze, melyek a tejmedencében (sinus lactiferi) végződnek. Ennek van egy pars glandularis és egy pars papillaris része. A kettő határán szűkület található, melyben a Fürstenberg-féle vénagyűrű (circulus venosus papillae) foglal helyet, ami vegetatív idegrendszeri hatásra a nyílást zárni képes. A pars papillaris tölcsérszerűen szűkül, és végül ductus papillaris-ban végződik. Itt záróizom és tejfaggyú (lactosebum) felelős a megfelelő záródásért. (Fehér, 2006) Természetesen a tejmirigy szövettani képe nagyon eltérő egy tejelő és egy nem tejelő állatban. A tejmirigy képe emellett az egyedfejlődés során is jelentősen változik. Artériás vérellátásáért az a. pudenda externa-ból eredő a. mammaria cranialis et caudalis felelős. A vénás vért a circulus venosus mammae-ból kiinduló v. epigastrica cranialis superficialis (cranialis irányba), v. pudenda externa és a v. labialis (caudalis irányba) szállítja el. Nyirokcsomók közül elsősorban a lnn. inguinales superficiales-eknek (lnn. mammari) van komolyabb jelentőségük. A tőgy beidegzéséért elsősorban n. genitofemoralis felelős, emellett a n. pudendus-nak és a n. ilioinguinalis-nak is szerepe van az innervációban. (König, 2004)
Védekezési mechanizmusok
A védekezési mechanizmusok két csoportra oszthatók, ezek a veleszületett immunitás (nem specifikus) és a specifikus immunitás. A nem specifikus immunelemek aktiválódnak először a fertőzés korai fázisában. A veleszületett immunitás elmei a macrophagok, NK-sejtek, neutrohil granulocyták és egyes lízist okozó faktorok. A tőgy szekretáló volta miatt vérellátása gazdag, laktációs periódusban pedig hatványozottabban több vért kap mint szárazon állás időszakában. A jó vérellátás következménye, hogy a tőgy szövetében a neutrophil granulocyták és a macrophagok nagy számban vannak jelen nagy arányban kitapadva fertőzésmentes időszakban is. A tőgy jellegzetes képlete a Fürstenberg-féle rozetta, az elsőszámú védelmi vonal, mely mint anatómiai barrier veszt rész a védekezésben. A sphincter izmok megakadályozzák a kórokozók bejutását a fejések közti időszakban. A ductus papillaris keratinizáltságának is szerepe van a védelemben, így a keratinréteg megsérülése jelentősen növeli a baktériumfertőzés kockázatát. Szárazon állás időszakában a keratin teljesen el is zárhatja a ductust. Ezen kívül a keratinréteg tartalmaz antimicrobiális anyagokat is. Ezek közé tartoznak például észterezett és nem észterezett zsírsavak, mint a mirisztinsav (C14H28O2), palmitoleinsav(C16H30O2), linolsav (C18H32O2), illetve pozitív töltésű proteinek, melyek képesek a pathogénhez kötődni, sejtfalukat károsítani és ozmotikus viszonyaikat megváltoztatni. Amennyiben a kórokozó "túljutott" a nem specifikus elemeken, abban az esetben a specifikus immunrendszer aktiválódik. A tőgyben az immunrendszer mindkét típusának tökéletes működése szükséges a kialakulandó mastitis leküzdése érdekében (Sordillo és Streicher, 2002).
A tőgygyulladás lefolyása és kialakulása
A következőkben egy gyulladás általános lefolyását és körülményeit ismertetjük.
Ha egy fertőző ágens bekerül a tőgybe, azok leggyakrabban a testi sejtek közül az epitheliális sejtekkel érintkeznek először (Griesbeck-Zilch., 2009). Az epitheliális sejtek felületén számos toll-like receptor ( TLR-2 és TLR-4) található.A TLR-eket PAMP-ok (pathogen-derived molecular patterns) aktiválják mint ligandok, tőgyfertőzés esetében általában ez a baktériumok által termelt endotoxinokat jelenti. A kötődés kaszkádreakciót indít be, melynek végén az NF-kb transzkripciós faktor aktiválódik. Ez a faktor több mint 200 immun-gén expresszióját regulálja (Hoesel és Schmid, 2013). Az endotoxinok általában a sejtfal felületén található különböző liposzacharidok. Amint ezeket az anyagokat egy sejt érzékeli, egyrészt mRNS transzkripciót fokozás történik, ami gyulladási faktorok szintézisét és ürülését idézi elő, másrészt antigén-prezentáció megy végbe. A tehén 18-as kromoszómáján található egy kvalitatív jellemet kódoló locus, mely a gyulladási faktoroknak a termelését szabályozza(Kühn 2009.). A gyulladás kialakításában a veleszületett immunitás (innate immunity) játszik szerepet. Ennek vannak celluláris és humorális tagjai. A humorális tagok közül a különböző komplement fehérjék, a lizozim és a lactoferrin (egy vasat tartalmazó, összetett globuláris fehérje) a legfontosabbak. A sejtes elemek közül a neutrophil granulocyták a legaktívabbak. Először a neutrophil granulocyták érkeznek a baktérium-fertőzött területre, pozitív kemotaxissal, kitűnő migrációs és diapedesises képességüket kihasználván. Különböző faktorok nem léte mellett is képesek bekebelezni a baktériumokat, de leginkább a felszabaduló gyulladási faktorok és a specifikus immunrendszer serkentése mellett lépnek ki a kapillárisok falán keresztül. A neutrophil granulociták két módon hatástalanítják a baktériumokat. Egyrészt bekebelezi őket, és emésztés után egy fehérjét termelnek és adnak le a környezetükbe, mely hálózatot alakít ki. Ebbe a hálózatba a baktériumok felakadnak, így mozgásuk korlátozottá válik, ezáltal csökken a terjedésük sebessége és könnyebbé válik a bekebelezésük. A fehérvérsejtek ezenkívül reaktív oxigén gyököket (ROS) is termelnek. Mivel a gyökök ugyanolyan veszélyesek a saját sejtekre mint a kórokozókra, termelésüket a szervezet különböző cytokinekkel erősen szabályozza. Dendrtitikus sejtek és macrophagok is tartózkodnak a tőgy szövetében. Ezek óriási mennyiségű cytokin termelésére képesek. Pathogén-specifikus immunválaszban való számszerű szerepük még nem tisztázódott.
A tőgy morfológiája és fertőzésekkel szembeni érzékenysége közötti összefüggés
Egy tanulmány szerint a tőgy fertőzésekkel szembeni érzékenységét mind a mirigytestnek (corpus mammae) és a csecsbimbónak (papilla mammae) az alakja, mind a csecsbimbónak hossza és vastagsága jelentősen befolyásolja (1. táblázat). A kutatás során fertőzött tőgyeket vizsgáltak, és az egyes tőgyek morfológiai különbségei és a fertőzöttségi fok közötti összefüggéseket keresték. Fontos megjegyezni a tanulmány későbbi megértéséhez, hogy a tőgy egészségi állapotát a tej szomatikus sejtszámával (SCC) könnyen megállapíthatjuk, így az SCC növekedésével egyenesen arányos a tőgy fertőzöttségi foka.
A tőgy alakja szerint két csoportot különíthetünk el: megereszkedett és szabályos. Megereszkedett tőgy esetében magasabb SCC-t mértek, mint a szabályos alakúnál. Valószínűleg ennek az erősebb fertőzési hajlamnak a megereszkedés lehet az egyik legfontosabb összetevője, – egy másik kutatás szerint – hiszen így a tőgy könnyebben sérül, érintkezik kórokozókkal, fertőződik. A csecsbimbó alakja szerint megkülönböztetünk laposat, hegyeset vagy befordultat. A vizsgálat során lapos csecsbimbó esetén mérték a legmagasabb SCC-szintet, ezt követte a befordult, majd a hegyes típus. Kissé hegyes és befordult csecsbimbók fogékonyabbak mastitis-re, mivel könnyebben felhalmozódik bennük tej, s így táptalajt nyújtanak egyes baktériumoknak. Ezen kevésbé előnyös csecsbimbó-formákat tenyésztéssel azonban könnyen szelektálhatjuk. A tejminták analízise azt is kimutatta, hogy a csecsbimbó vastagsága és hossza, illetve a tőgy fertőzésekkel szembeni érzékenysége között egyenes arányosság van, így mind a hosszú, mind a vastag csecsbimbók esetén magas SCC-t mértek. (Bharti és mtsai, 2015)
SCC átlagok az egyes tőgyformákban és csecsbimbó alakokban |
||
Jellemvonások |
Megfigyelések száma |
Átlagok (standard hibával) |
Megereszkedett |
74 |
6.393±0.037 |
Szabályos |
292 |
5.120±0.034 |
Lapos |
46 |
6.189±0.105 |
Befordult |
90 |
5.850±0.068 |
Hegyes |
230 |
5.030±0.035 |
1. táblázat (Bharti és mtsai, 2015) |
||
A tőgy jellemző fertőzései
Vírusos fertőzések
Papillomavírusok
A papillomavírusok kicsi, burok nélküli, duplaszálú DNS-vírusok, melyek legfőképp gerincesek bőr és nyálkahártyáinak epithelsejtjeinek magjában multiplikálódnak és okoznak szemölcsöket. A szarvasmarhát fertőző papillomavírus, BPV (Bovine Papillomavirus) felelős a bőr és tőgy papillomatosisáért, emellett egyéb rosszindulatú daganatokat okozhat a húgyhólyagban és a felsőbb emésztőtraktusban (Campo, 2002). Az eddig ismert BPV-ket (BPV1-13) genomuk feltérképezése után négy csoportba sorolják, ezek: Deltapapillomavirusok ( BPV1, 2, 13), Xipapillomavírusok (BPV3, 4, 6, 9, 10, 11, 12), Epsilonpapillomavírusok (BPV5, 8), és a BPV7. BPV-fertőzés világszerte előfordul, és habár nem okoz olyan mértékű gazdasági kárt, mint az E. coli eredetű mastitis, a szemölcsök, fekélyesedés, hámsérülések következtében romlik a tejtermelés, illetve a különböző hámsérülések miatt az állat jóval fogékonyabbá válik mastitisre. Az esetek többségében a tőgyet érő papilomatosisos elváltozások hátterében a BPV6 áll, ugyanakkor az összes többi BPV (különösen a BPV7, 9, 10) is okozhat tőgy-papillomatosist. A vírus típusától függetlenül a bőreredetű elváltozások jóindulatú daganatokra következtetnek szövettani vizsgálat után. Jellemző a híperkeratosis vagy parakeratosis eltérő stádiumú megléte, a stratum spinosum keratinocytáinak perinuclearis halo effektusa, kevés sejt fuzionálása, syctitiumképzése, illetve sejtmagok pkynosisa. (Tozato és mtsai, 2013)
Leukémia vírusok
A szarvasmarha leukémia vírusa, a BLV (Bovine Leukemia Virus) a Retroviridae családba tartozik. Szarvasmarha-állományok egyik legelterjedtebb vírusa, de Európa egyes területei már mentesek tőle. Megjelenhet tartós lymhocytosisként (PL), ekkor a keringő lymphocyták száma megemelkedik, illetve ritkábban B-sejt lymphomaként (Della Libera és mtsai, 2015). BLV a fertőzött szarvasmarháknál az esetek 20-30 százalékában tartós lymphocytosisként jelentkezik ( Gillet és mtsai, 2007)
A kéknyelv-betegség vírus 8-as szerotípusának (BTV-8) hatása a tejtermelésre
A BTV-8 fertőzés jelentős változásokat idéz elő a tejtermelésben - derült ki egy holland kísérletből, melyben a vizsgálat kezdetén még szeronegatív tehenek tejtermelésének a fertőzés hatására kialakult változásait figyelték meg.
A fertőzött állatok idővel szeropozitívak lesznek, hiszen vérükben már kimutatható a BTV-8 ellenanyag. A BTV-8-tel fertőzött állat tejtermelése az antitestek megjelenése és vérből való kimutathatósága közötti időszakban csökken. Fontos megjegyezni, hogy ezen időszak növekedésével fordítottan arányos a tejtermelés mennyisége (ebben az időszakban). Mind az antitestek megjelenése előtt, mind a szeropozitív vérkép kialakulása után a tejtermelés teljesen normális képet mutat. (Santman-Berends és mtsai, 2011).
Bakteriális fertőzések
Baktériumok esetén a Gram-pozitív és Gram-negatív csoportba való tartozás határozza meg a kiváltott gyulladás jellemzőit. A Gram-negatív csoportba tartozó fajok akut mastitist váltanak ki, míg a Gram-pozitív baktériumok enyhébb, általában tünetmentes, de hosszú ideig (akár 2 hónapig) fennálló gyulladást okoznak, mely normálistól eltérő tejtermeléssel jelentkezik. A mastitisek nagy hányadát a Gram-negatív Escherichia coli, e mellett a Gram-pozitív Staphylococcus aureus és Streptococcus uberis okozzák. E. coli fertőzés hatására nagymértékű cytokinszint emelkedés történik, míg a Gram-pozitív baktériumok, mint az S. aureus és S. uberis jóval kevésbé indukálják a gyulladási cytokinek termelését (Günther és mtsai, 2016). A fertőzést ért tőgynegyedekről a fertőzés átterjed a szomszédos, addig érintetlen negyedekre, tehát a tőgy mint egész ad választ az őt érő pathogén hatásokra. Az E. coli okozta fertőzés hordozza magában a legnagyobb gazdasági kár kockázatát. Az alom szennyezettsége, a nedves környezet, a felhalmozódó ürülék, a rossz tartási körülmények növelik a fertőzés kialakulásának valószínűségét. A mastitis súlyosságára, klinikai vagy szubklinikai voltára a tejben és vérben megjelenő egyes sejteknek a számából és arányából lehet következtetni. A következő tanulmányt (M. Alhussien és mtsai, 2015) Karan-fríz (Tharparkar és Holstein-fríz keresztezése) egyedekkel végezték. A kísérletben Karan-frízeket a korai laktációs periódusban vizsgáltak. A korai laktációs periódus abból a szempontból a legkritikusabb időszak, hogy ilyenkor a nem szekretáló tejtermelő epithelsejtek drasztikus celluláris, morfológiai, biokémiai változásokon mennek keresztül, így válva szekretáló sejtekké. E változások időszakában a tőgy fogékonyabb a fertőzésekre. A huszonnégy egyedet három-három nyolcas csoportba osztották a tejük SCC (Somatic Cell Count) szintje szerint. A tej SCC szintje a tejben lévő fehérvérsejtek, illetve epithelsejtek számának összegét adja meg. A legtöbb fajban a normál SCC szint 150.000 sejt/ ml tej. Vörös Holsteinben ez a szám 270.000 sejt/ml tej. Az SCC-szint nemcsak a tej minőségéről, de az egész állatról általános egészségügyi információt szolgáltat. A TLC a vér fehérvérsejtjeinek számát adja meg. Minden egyedtől vér- és tejmintát vettek további vizsgálatok céljából, melyek során a leukocyta-mennyiséget, neutrophil granulocyta-arányt, neutrophil granulocyta maturációs állapotot, élő neutrophul granulocvyták arányát és a phagocytáló aktivációt mérték. Az összes fehérvérsejtszám szignifikánsabban a legmamagasabb az akut mastitises egyedeknél a vérmintákban (2. táblázat). Neutrophil granulocyta arány és a neutrophil granulocyták közti éretlen sejtek száma is szignifikáns különbséget mutat a gyulladásos egyedek javára. Az élő neutrophil granulocyták aránya szignifikánsan nagyobb a nem fertőzött csoportban.
Vér |
Egészséges |
Szubklinikai mastitis |
Akut mastitis |
TLC (×103) |
7293±35.52 |
8417±55.96 |
9237±95.55 |
Neutrophil (%) |
24.66±0.2 |
38.78±0.34 |
60.01±0.70 |
Szegmentált n. (%) |
97.5±0.46 |
97.25±0.49 |
96.88±0.54 |
Stab n. (%) |
2.5±0.46 |
2.75±0.49 |
3.125±0.54 |
Élő n. (%) |
93.33±0.31 |
84.42±0.51 |
80.78±0.60 |
Lymphocyta (%) |
57.29±0.27 |
48.29±0.22 |
19.44±0.46 |
Monocyta (%) |
6.23±0.17 |
3.98±0.07 |
5.42±0.20 |
Phagocytáló aktivitás |
0.54±0.02 |
0.25±0.01 |
0.30±0.01 |
2. táblázat (Alhussien és mtsai alapján) |
|||
A tejminták eredménye szerint a fertőzött egyedekben szignifikánsan magasabb az SCC-szint mint nem mastitises állatokban, emellett nagyobb a neutrophil granulocyták aránya is (3. táblázat). A vér eredetű mintákkal összevetve a tejben nagyobb számban jelennek meg neutrophil granulocyták mint a vérben. A neutrophil granulocyták között csökkent a szegmentált, ezzel együtt, csakúgy mint a vérben, nőtt a Stab alakok száma. Akut mastitises egyed élő neutrophil granulocytáinak aránya jelentősen alacsonyabb mint a vérbeli neutrophil granulocytáknál.
Tej |
Egészséges |
Szubklinikai mastitis |
Akut mastitis |
SCC (×105) |
2.55±0.23 |
5.97±0.28 |
12.19±0.56 |
Neutrophil (%) |
18.5±0.45 |
43.29±0.58 |
77.4±0.59 |
Szegmentált n. (%) |
97.13±0.44 |
96.63±0.56 |
94.13±0.47 |
Stab n. (%) |
2.62±0.41 |
3.12±0.44 |
5.87±0.47 |
Élő n. (%) |
91.53±0.42 |
82.77±0.60 |
70.78±0.87 |
Límphocyta (%) |
14.58±0.48 |
11.58±0.36 |
5.60±0.25 |
Macrophag (%) |
66.92±0.68 |
45.13±0.62 |
17.00±0.63 |
Phagocytáló aktivitás |
0.45±0.01 |
0.37±0.01 |
0.34±0.01 |
3. táblázat (Alhussien és mtsai alapján) |
|||
Az eredmények a mastitis során a tejben és vérben jellemző sejtszám változásokra mutatnak rá. Az SCC-szint mérése mellett leginkább tehát a neutophil granulocyták arányának és egyéb tényezőinek a vizsgálatával meg tudjuk határozni az állat állapotát és a gyulladás típusát.
Escherichia coli
Az E. coli baktériumból a sejtfal károsodása esetén a szövetközbe kijutó nagyszámú endotoxinok a következő 12-24 órában a legsúlyosabb esetekben az állat elpusztulását okozhatják. Egyéb esetekben magas láz és a keringési rendszer állapotának romlása miatti alacsony vérnyomás léphet fel. A tünetek közé tartozik még a csökkent tejhozam, a tejben megjelenő szomatikus sejtek magasabb száma a normális szintnél, vörösség illetve a testhőmérséklet emelkedése. Egyes esetekben a csecsbimbó endothelium rétegének sérülése következményében fehár alvadék is jelentkezik. Az összes esetben az érintett tőgynegyed melegsége, duzzadtsága figyelhető meg.
T-lymphocyta-k mennyiségének változása Staphylococcus és Streptococcus Mastitis esetén
Staphylococcus, illetve Streptococcus Mastitis esetén különböző T-lymphocyta típusok szaporodnak el nagy mennyiségben - derült ki egy amerikai kutatás során, melyen egészséges és fertőzött tehenek tőgyéből származó vér- és tejmintákat hasonlítottak össze.
A Staphylococcus-szal vagy Streptococcus-szal fertőződött tehenek vérében a γ-δ T-lymphocyták mennyiségének jelentős növekedése figyelhető meg, míg a tejükben a kb. 75%-kal nő a α-β T-lymphocyta-k száma és 100%-kal a γ-δ T-lymphocyta-k száma. Jelentős különbség van azonban az α-β T-lymphocyta-k mennyiségének emelkedésében Staphylococcus, illetve Streptococcus Mastitis esetén. Staphylococcus Mastitis esetén a CD4+ T-sejteknek, míg Streptococcus Mastitis esetén a CD4+, illetve a CD8+ T-sejteknek köszönhető a gyarapodás. A γ-δ T-lymphocyta-knál nem beszélhetünk ilyesfajta eltérésről. A γ-δ T-lymphycyta-k számának a növekedése mind Staphylococcus, mind Streptococcus Mastitis esetén a GD3.1+ T-sejteknek köszönhető, míg a GD197+ T-sejtek száma nem változik. (Soltys és Quinn, 1999)
Források
König, H. E.; Liebich, H. G.: Veterinary Anatomy of Domestic Mammals: Textbook and Colour Atlas 4th Edition (2004, Schattauer Verlag)
Fehér, Gy.: A háziállatok funkcionális anatómiája 3. (2006, Mezőgazda Kiadó)
Röhlich, P.: Szövettan (2006, Semmelweis Kiadó és Multimédia Stúdió)
Sordillo, L. M; Streicher, K. L.: Mammary Gland Immunity and Mastitis Susceptibility. Journal of Mammary Gland Biology and Neoplasia, Vol. 7, No. 2, April 2002
Hoesel, B.; Schmid, J. (2013): The complexity of NF-kappaB signaling in inflammation and cancer. Mol Cancer. 2013;12:86. doi: 10.1186/1476-4598-12-86
Soltys, J.; Quinn, M. T. (1999): Selective Recruitment of T-cells Subsets to the Udder during Staphylococcal and Streptococcal Mastitis: Analysis of Lymphocyte Subsets and Adhesion Molecule Expression. Infection and Immunity 67: (12) 6293-6302 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC97032/
Bharti, P.; Bhakat, P.; Pankaj, P. K.; Bhat, S. A.; Prakash, M. A.; Thul, M. R.; Japheth, K. P. (2015): Relationship of udder and teat conformation with intra-mammary infection in crossbred cows under hot-humid climate. Veterinary World 8: (7) 898-901 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4774684/
Tozato, C. C. et al. Braz J Microbiol. (2013): Teat papillomatosis associated with bovine papillomavirus types 6, 7, 9, and 10 in dairy cattle from Brazil. Brazilian journal of microbiology, 2013 Dec 10;44(3):905-9.:https://www.ncbi.nlm.nih.gov/pubmed/24516429
Campo, M. S. (2002): Animal models of papillomavirus pathogenesis. Virus research, 2002 Nov;89(2):249-61.:http://www.ncbi.nlm.nih.gov/pubmed/12445664
Della Libera, A. M. M. P., et al (2015): Effects of bovine leukemia virus infection on milk neutrophil function and the milk lymphocyte profile. Vet Res. 2015; 46(1): 2.:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4297435/
Gillet, N. et al (2007): Mechanisms of leukomogenesis induced by bovine leukemia virus: prospects for novel anti-retroviral therapies in human. Retrovirology. 4:18. doi: 10.1186/1742-4690-4-18.
Günther, J.; Koy, M.; Berthold, A.; Schuberth, H. J.; Seyfert, H. M. (2016): Comparison of the pathogen species-specific immune response in udder derived cell types and their models.:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4736154/
Alhussien, M.; Kaur, M.; Manjari, P.; Kimothi, S. P.; Mohanty, A. K.; Dang, A. K. (2015): A comparative study on the blood and milk cell counts of healthy, subclinical, and clinical mastitis Karan Fries cows :https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4774734/
Santman-Berends, I. M.; Hage, J. J.; Lam, T. J.; Sampimon, O. C.; van Schaik, G. (2011): The effect of bluetongue virus serotype 8 on milk production and somatic cell count in Dutch dairy cows in 2008. Journal of Dairy Science 94: (3) 1347-1354 http://www.journalofdairyscience.org/article/S0022-0302(11)00089-0/fulltext
Griesbeck-Zilch, B.; Osman, M.; Kühn, Ch.; Schwerin, M.; Bruckmaier, R. H.; Pfaffl, M. W.; Hammerle-Fickinger, A.; Meyer, H. H. D.; Wellnitz, O. (2009): Analysis of key molecules of the innate immune system in mammary epithelial cells isolated from marker-assisted and conventionally selected cattle http://www.journalofdairyscience.org/article/S0022-0302(09)70789-1/fulltext
Burvenich, C.; Bannerman, D. D.; Lippolis, J. D.; Peelman, L.; Nonnecke, B. J.; Kehrli Jr., M. E.; Paape, M. J. (2007):Cumulative Physiological Events Influence the Inflammatory Response of the Bovine Udder to Escherichia coli Infections During the Transition Period : http://www.journalofdairyscience.org/article/S0022-0302(07)72059-3/fulltext