|
Size: 100997
Comment:
|
Size: 104027
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 47: | Line 47: |
| Az astrocyták jelentős szerepet játszanak a Mn-indukálta neuroinflammációban, mivel az agy'' [[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4516557/|Mn-homeosztázisának]] ''központját képezik'' (Wedler and Denman, 1984). ''Az astrocytákon található transferrin receptorok azonnal hozzákötődnek a Tf-Mn^3+^-hoz, emiatt található bennük több Mn, mint bármely más idegsejt-típusban. Valójában az astrocyták 10-50-szer nagyobb Mn koncentrációt is mutathatnak, mint a neuronok, ezért is érzékenyebbek a Mn toxicitásra más sejttípusoknál. Glutamát-indukálta excitotoxicitás során a többlet glutamát hirtelen annyira megnöveli az intracellularis Ca^2+^ szintet, hogy az blokkolni fogja a Mn^2+^ felvételét, elősegítve a mitochondrialis Mn^2+^ kijutását a cytosolba. A cytosol magas Mn^2+^ koncentrációja az astrocytákban aktiválja a glutamin-szintetázt, ami eltávolítja a fölösleges glutamátot'' (Wedler ''és mtsai.'', 1994). ''A többlet extracelluláris Mn^2+^ azonban kompetitíven kötődve a Ca^2+^-kötő helyekhez megszakíthatja az intracelluláris Ca^2+^ jeladást az astrocytákban, így megzavarva a mitochondriális Ca^2+^ homeostasist ''(Farina ''és mtsai.'', 2013)'', ami astrogliosist vált ki. Ezenkívül a Mn^3+^ oxidatív/nitrozatív utakon az astrocyták megduzzadását okozza ''(Rama Rao ''és mtsai.'', 2007). ''A megnövekedett Mn-szint az astrocytákban növeli a proinflammatorikus jelmolekulák (iNOS, IL-6) expresszióját'' (Moreno ''és mtsai.'', 2008)''.'' ''Míg ezeknek a jeleknek a jól időzített expressziója elengedhetetlen az idegi stresszre vagy sejtkárosodásra adott válasz kialakításában, addig túlprodukciójuk nemkívánatos, gyakran súlyosbítja a toxikus hatásokat. Mn-nak kitett primer emberi astrocyták microarray génexpresszió profilozása proinflammatorikus cytokineket kódoló gének upregulációját, ezzel párhuzamosan pedig a sejtciklussal, DNS replikációval és kijavítással kapcsolatos gének downregulációját mutatta ki ''(Sengupta ''és mtsai.'', 2007).'' '' '' | Az astrocyták jelentős szerepet játszanak a Mn-indukálta neuroinflammációban, mivel az agy'' [[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4516557/|Mn-homeosztázisának]] ''központját képezik'' (Wedler and Denman, 1984). ''Az astrocytákon található transferrin receptorok azonnal hozzákötődnek a Tf-Mn^3+^-hoz, emiatt található bennük több Mn, mint bármely más idegsejt-típusban. Valójában az astrocyták 10-50-szer nagyobb Mn koncentrációt is mutathatnak, mint a neuronok, ezért is érzékenyebbek a Mn toxicitásra más sejttípusoknál. Az astrocyták hármas szinapszisokon keresztül szabályozzák a neuronok közti extracelluláris glutamát mennyiségét (__K__[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#bib0225|arki és mtsai., 2013]], __P__[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#bib0370|opoli és mtsai., 2011]]). A magas Mn-koncentráció tumor nekrózis faktor-α (TNF- α) indukálásával megzavarja ezt a regulációt. Glutamát-indukálta excitotoxicitás során a többlet glutamát hirtelen annyira megnöveli az intracellularis Ca^2+^ szintet, hogy az blokkolni fogja a Mn^2+^ felvételét, elősegítve a mitochondrialis Mn^2+^ kijutását a cytosolba. A cytosol magas Mn^2+^ koncentrációja az astrocytákban aktiválja a glutamin-szintetázt, ami eltávolítja a fölösleges glutamátot'' (Wedler ''és mtsai.'', 1994). ''A többlet extracelluláris Mn^2+^ azonban kompetitíven kötődve a Ca^2+^-kötő helyekhez megszakíthatja az intracelluláris Ca^2+^ jeladást az astrocytákban, így megzavarva a mitochondriális Ca^2+^ homeostasist ''(Farina ''és mtsai.'', 2013)'', ami astrogliosist vált ki. Ezenkívül a Mn^3+^ oxidatív/nitrozatív utakon az astrocyták megduzzadását okozza ''(Rama Rao ''és mtsai.'', 2007). ''A megnövekedett Mn-szint az astrocytákban növeli a proinflammatorikus jelmolekulák (iNOS, IL-6) expresszióját'' (Moreno ''és mtsai.'', 2008)''.'' ''Míg ezeknek a jeleknek a jól időzített expressziója elengedhetetlen az idegi stresszre vagy sejtkárosodásra adott válasz kialakításában, addig túlprodukciójuk nemkívánatos, gyakran súlyosbítja a toxikus hatásokat. Mn-nak kitett primer emberi astrocyták microarray génexpresszió profilozása proinflammatorikus cytokineket kódoló gének upregulációját, ezzel párhuzamosan pedig a sejtciklussal, DNS replikációval és kijavítással kapcsolatos gének downregulációját mutatta ki ''(Sengupta ''és mtsai.'', 2007).'' '' '' |
| Line 50: | Line 52: |
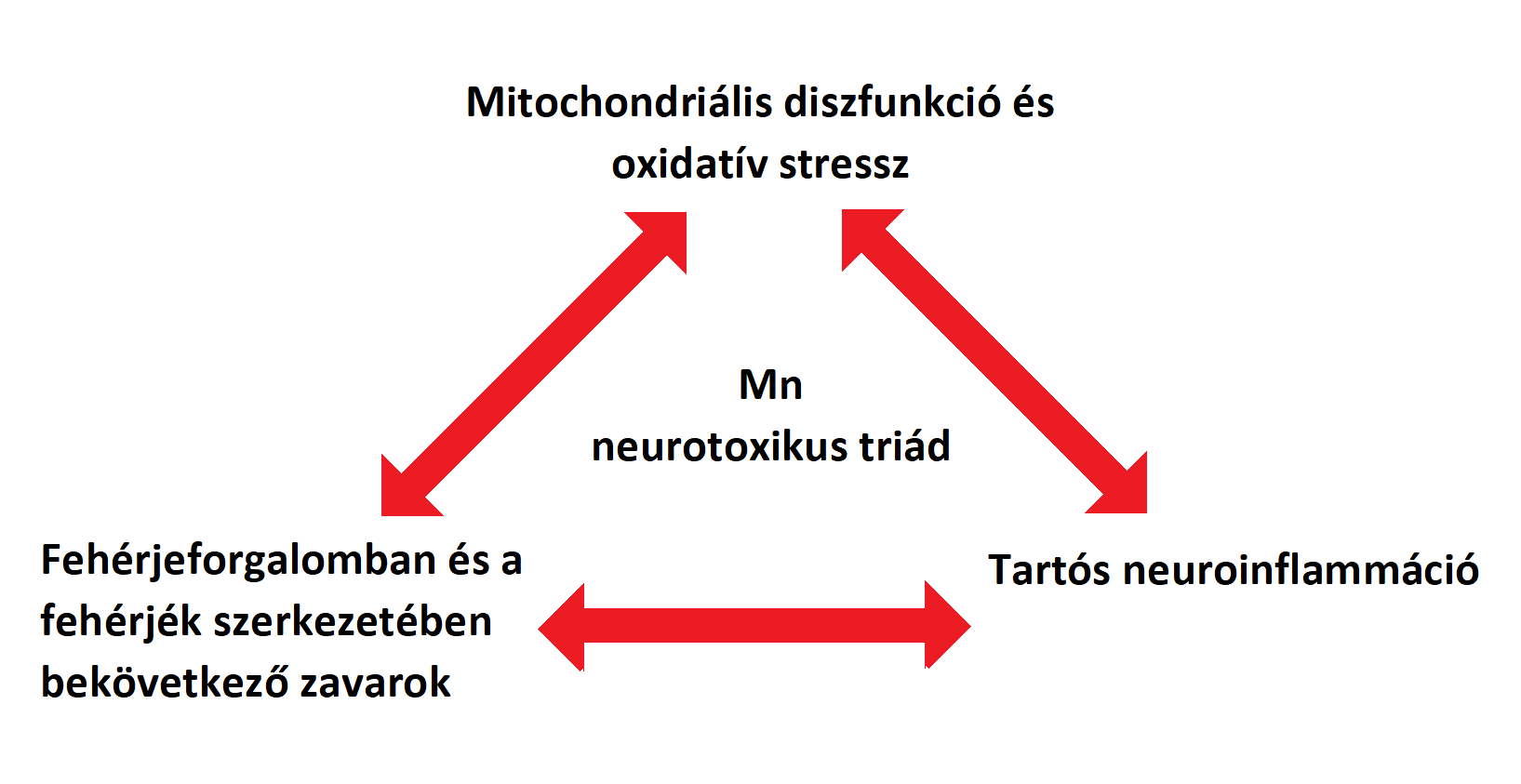
| A [[https://onlinelibrary.wiley.com/doi/full/10.1111/j.1471-4159.2006.03913.x|glutamát-GABA ciklus]] különösen fontos az astrocyta-neuron anyagcsere kapcsán. A glutamát és a GABA szintézisében a glutamin mint ezek előanyaga van jelen (''Bak és mtsai., 2006''). A neuronális glutamin glutamáttá történő deamidációjakor ammónia keletkezik, ami ezután az astrocytákhoz szállítódik és a glutamát amidációjához használódik fel. Az astrocyták által kibocsátott glutamint a glutamát- és GABAerg neuronok veszik fel, amik nyúlványokkal rendelkeznek a [[https://hu.wikipedia.org/wiki/Törzsdúcok_és_összeköttetéseik|basalis ganglionokban]] (törzsdúcokban) és segítenek az akaratlagos mozgások szabályozásában (''Sidoryk-Wegrzynowicz and Aschner, 2013''). Válaszul az agyban lévő Mn-többletre, a Mn rövid idő alatt belép az astrocyták mitochondriumaiba. A mitochondriumok magas Mn-szintje károsítja a sejtlégzést, valamint megakadályozza a glutation-peroxidáz (GPx) termelését és aktiválását. '''(3. ábra)''' Összegezve, úgy tűnik az astrocyták részben érintettek az agy Mn-homeosztázisának károsodásakor. Ez negatívan hathat a glutamát- és GABAerg neuronok basalis ganglionokban levő nyúlványaira, ami a Mn neurotoxicitásra jellemző motoros elégtelenségekhez vezet. '''(4. ábra)''' | A [[https://onlinelibrary.wiley.com/doi/full/10.1111/j.1471-4159.2006.03913.x|glutamát-GABA ciklus]] különösen fontos az astrocyta-neuron anyagcsere kapcsán. A glutamát és a GABA szintézisében a glutamin mint ezek előanyaga van jelen (''Bak és mtsai., 2006''). A neuronális glutamin glutamáttá történő deamidációjakor ammónia keletkezik, ami ezután az astrocytákhoz szállítódik és a glutamát amidációjához használódik fel. Az astrocyták által kibocsátott glutamint a glutamát- és GABAerg neuronok veszik fel, amik nyúlványokkal rendelkeznek a [[https://hu.wikipedia.org/wiki/Törzsdúcok_és_összeköttetéseik|basalis ganglionokban]] (törzsdúcokban) az extrapyramidális motoros rendszerben, és segítenek az akaratlagos mozgások szabályozásában (''Sidoryk-Wegrzynowicz and Aschner, 2013''). Válaszul az agyban lévő Mn-többletre, a Mn rövid idő alatt belép az astrocyták mitochondriumaiba. A mitochondriumok magas Mn-szintje károsítja a sejtlégzést, valamint megakadályozza a glutation-peroxidáz (GPx) termelését és aktiválását. Ez ROS (reactive oxygen species) keletkezéséhez vezet, ami felhalmozódva oxidatív stresszt idéz elő. '''(3. ábra)''' Ez a folyamat negatívan hathat a glutamát- és GABAerg neuronok basalis ganglionokban levő nyúlványaira, ami a Mn neurotoxicitásra jellemző motoros elégtelenségekhez vezet. '''(4. ábra)''' |
| Line 99: | Line 101: |
| ||<rowbgcolor="#eeeeee">6. ábra: A hegesztés során keletkező Mn-tartalmú gőzök tartós belélegzése Mn-toxicitáshoz vezethet ''''' ''''' || | ||<rowbgcolor="#eeeeee">6. ábra: A hegesztés során keletkező Mn-tartalmú gőzök tartós belélegzése Mn-toxicitáshoz vezethet ''''' ''''' || |
| Line 120: | Line 122: |
| == Diagnosztizálás == A szervezetbe történő mangán felhalmozódás által okozott PD-hoz rendkívül hasonló Mn neurotoxicitás azonosítására nyújthat új lehetőséget az UPDRS3 (Unified Parkinson Disease Rating Scale Motor Subsection Part 3)(Fahn és mtsai., 1987) eredményét megjósoló több tényezőt fegyelembe vevő lineáris regressziós model ami lehetővé teszi, hogy egy neurológus nélkül is viszonylag pontosan azonosítsuk a betegséget. Ezáltal lehetőséget nyújt, hogy a parkinzonizmus jelenlétét viszonylag kis hibarátával körzetiorvosok vagy akár asszisztensek is azonosítani tudják. A teszt megalkotásában felhasznált adatok: az életkor, mindkét kéz időre történő motoros funkciójának értékelése egy pontozási rendszerben, ahol az alacsonyabb pontszám rosszabb eredményt jelent (Criswell és mtsai., 2010). A teszt figyelembe vett olyan pszichológiai tényezőket, mint depresszió, szorongás, magány. Ezenkívül intenciós tremor, fájdalom, beszéd nehézségek, valamint dohányzás volt az, amit még vizsgáltak. Az UPDRS3 rendszerben a parkinzonismusra pozitívnak vett eredmény ponthatárát, ha 15 pontnál állapítjuk meg 95%-os megbízhatósági intervallumot érthetünk el. A tesztet a mangán mérgezésnek fokozottan kitett hegesztő munkásokon, segédeken végezték azzal a céllal, hogy a mangánizmust és PD-t egymástól megkülönböztethessék, valamint a klinika szempontból jelentős neurotoxicitást azonosítani tudják. Korábbi kutatások azt mutatják, hogy a hegesztők 15%-ának van klinikailag jelentős mangánizmusa (Racette és mtsai., 2012). A kísérletben 18 és 65 év közötti munkások vettek rész, a vizsgálatokat pedig 2 mozgási rendellenességekkel foglalkozó neurológus végezte el összesen 886 főn. Elkészítették a UPDRS3-at is, a felső korhatárt 65 évnél szabták meg, hiszen így a modelt azokra az emberekre lehetett szabni, akik jelenleg is ki vannak téve mangánmérgezésnek. Több különböző kérdéssorral további információkat szereztek a munkásokról, elvégeztek egy a PD specifikus életminőségről szolót (PDQ39, Jenkinson és mtsai., 1997), egy PD tüneteket vizsgálót (Duarte és mtsai., 1995; Tanner és mtsai., 1990) valamint a munkások életviteléről és egészségügyi állapotáról is nyertek adatokat, a figyelem középpontjába helyezve a rizikó faktorokat (Hobson és mtsai., 2009; Checkoway és mtsai., 2002). Sor került ezenkívül egy utolsó kérdéssorra is, amivel a hegesztési gázoknak való egyedi kitettséget és az ebből fakadó mangán felhalmozódást becsülték meg (Racette és mtsai., 2012, 2017). Ezek után 38 munkást az eredmények megerősítéséhez megvizsgáltak MRI-vel (Racette és mtsai., 2017), majd az eredményeket összegezték. Az eredményváltozónak használt UPDRS3 mellék pontszámokat beállították,(erre szükség volt hiszen 2 vizsgáló több év lefolyása alatt végezte el a teszteket) és létrehoztak egy lineáris regressziós modellt ami alkalmas a parkinzonizmus jelenlétére következtetni. Ehhez figyelembe veszik az életkort, a kéz motoros funkciót vizsgáló teszt pontszámokat, azok UPDRS3-el erős korrelációjuk miatt. Külön hangsúlyt fektettek azokra a mellék pontszámokra amiket nemcsak neurológusok tudnak felvenni. Sokkalinkább az egyes megfigyelések, tünetek jelenlétét vagy hiányát tartották lényegesnek, mintsem annak szakszerű pontozását amire csak egy neurológus lenne alkalmas. A vizsgálat figyelembe vett egyéb tényezőket is, hogy ezzel tovább pontosíthassák az eredményt, mint például a kérdéssorokból származó adatok(gyógyszerhasználat, depresszió,szorongás, a résztvevők által saját magukon megfigyelt tünetek), amelyek esetén korábbi kutatások kapcsolatot fedeztek fel a mangánnak való túlzott kitettséggel (Bowler és mtsai., 2006, 1999; Mergler és mtsai., 1994). Valamint másodlagos változókat is használtak a végleges változat megalkotásához, végül egy több változós lineáris regressziós modellt kaptak. Az összegzett eredmények alapján a következő következtetsre jutottak: a teszt alanyok korában, erős lineáris asszociációt figyeltek meg a domináns kéz pontszáma és a UPDRS3 pontszám között. A helyzet azonban nem volt ennyire egyértelmű a nem domináns kéz esetén, itt a magasabb pontszám elérésekor (>35) ellentétes módon asszociáltak a UPDRS3 pontszámmal. A legtöbb elsődleges előrejelző amiket a kérdőívek segítségével nyertek, rendkívül hasznosnak bizonyultak, erős kapcsolat volt közöttük és a UPDRS3 pontszám között. A másodlagos előrejelzők között a fájdalom, dohányzás, nem volt a leglényegesebb szerepű, végül a nem eltávolításra került a kis számú női résztvevő miatt. A fájdalom, szorongás, magány és depresszió jelentőséggel bíró értékeit egy változóba foglalták (PALD: pain, anxiety, lonliness, depression). Ezen változó és a dohányzás között összefügést találtak miszerint a magasabb PALD pontszámmal rendelkező nem dohányzók UPDRS3 értéke magasabb volt, a jelenleg is dohányzók értékei a végső változóba nem kerültek be az egyszerűsítés jegyében. A model segítésével az esetek mindössze 8%-ában azonosítanánk hibásan azokat akik nem rendelkeznek a betegséggel. Pontosításokat végezhetünk ezenkívül a jobb specificitás vagy szenzitivitás elérése érdekében. Az előrejelzett UPDRS3 pontok esetén 9,88 míg a rendes UPDRS3-nál''' '''≥15 bizonyult az optimálisnak (Rascol és mtsai., 2011; Parkinson Study Group, 1996), ilyen feltételekkel 80% a szenzitivitás. Abban az esetben, ha magasabb értéknél szabjuk meg az előrejelzett UPDRS3 pontszámot, akkor a specifictás pontosságát tudjuk növelni. Az eredményeket tovább lehet pontosítani különböző biológia markerek figyelembe vételével mint például a nyál, vizelet, vér, igaz ez még csak az első fokát jelentené egy több lépcsős elemzési program megalkotásának (Myers és mtsai., 2009). A kutatás legfontosabb eredménye azonban az, hogy a mangán hatására kialakuló neurológia elváltozások egyszerűbb szűrhetőségére lehetőséget biztosít, igaz a végső diagnózis felállításához továbbra is elengedhetetlen egy szakértő tudása de a klinikailag súlyosabb esetek kiszűrése az ő jelenlétük nélkül is lehetségesé válna. Azokat akik eredménye pozitív lenne, tényleges indokkal lehetne elküldeni egy MRI vizsgálatra, ahol a T1 relaxációs idő (Lee és mtsai., 2015; Lewis és mtsai., 2016) és pallidális index (Criswell és mtsai., 2012; Nelson és mtsai., 1993) alapján már pontos diagnózist lehetne felállítani. '' ''''' ''' ''''' '' ''' ''''' '' ''' |
== Diagnosztikai lehetőségek == A szervezetbe történő mangán felhalmozódás által okozott PD-hoz rendkívül hasonló Mn neurotoxicitás azonosítására nyújthat új lehetőséget az UPDRS3 (Unified Parkinson Disease Rating Scale Motor Subsection Part 3)(''Fahn és mtsai., 1987'') eredményét megjósoló több tényezőt figyelembe vevő lineáris regressziós modell ami lehetővé teszi, hogy egy neurológus nélkül is viszonylag pontosan azonosítsuk a betegséget. Ezáltal lehetőséget nyújt, hogy a parkinzonizmus jelenlétét viszonylag kis hibarátával körzetiorvosok vagy akár asszisztensek is azonosítani tudják. A teszt megalkotásában felhasznált adatok: az életkor, mindkét kéz időre történő motoros funkciójának értékelése egy pontozási rendszerben, ahol az alacsonyabb pontszám rosszabb eredményt jelent (''Criswell és mtsai., 2010''). A teszt figyelembe vett olyan pszichológiai tényezőket is, mint a depresszió, a szorongás vagy a magány. Ezenkívül vizsgálták még az intenciós tremort, fájdalmat, a beszéd nehézségeit, valamint a dohányzást. Az UPDRS3 rendszerben a parkinzonismusra pozitívnak vett eredmény ponthatárát, ha 15 pontnál állapítjuk meg 95%-os megbízhatósági intervallumot érhetünk el. A tesztet a mangánmérgezésnek fokozottan kitett hegesztőmunkásokon, segédeken végezték azzal a céllal, hogy a mangánizmust és a PD-t egymástól megkülönböztethessék, valamint a klinikum szempontjából jelentős neurotoxicitást azonosítani tudják. Korábbi kutatások azt mutatják, hogy a hegesztők 15%-ának van klinikailag jelentős mangánizmusa (''Racette és mtsai., 2012''). A kísérletben 18 és 65 év közötti munkások vettek rész, a vizsgálatokat pedig 2 mozgási rendellenességekkel foglalkozó neurológus végezte el összesen 886 főn. Elkészítették a UPDRS3-at is, a felső korhatárt 65 évnél szabták meg, hiszen így a modellt azokra az emberekre lehetett szabni, akik jelenleg is ki vannak téve mangánmérgezésnek. Több különböző kérdéssorral további információkat szereztek a munkásokról, elvégeztek egy a PD-specifikus életminőségről szólót (''PDQ39, Jenkinson és mtsai., 1997''), egy PD tüneteket vizsgálót (''Duarte és mtsai., 1995; Tanner és mtsai., 1990'') valamint a munkások életviteléről és egészségügyi állapotáról is nyertek adatokat, a rizikó faktorokra összpontosítva (''Hobson és mtsai., 2009; Checkoway és mtsai., 2002''). Sor került ezenkívül egy utolsó kérdéssorra is, amivel a hegesztési gázoknak való egyedi kitettséget és az ebből fakadó Mn-felhalmozódást becsülték meg (''Racette és mtsai., 2012, 2017''). Ezek után 38 munkást az eredmények megerősítéséhez megvizsgáltak MRI-vel (''Racette és mtsai., 2017''), majd az eredményeket összegezték. Az eredményváltozónak használt UPDRS3 mellék pontszámokat beállították, (erre szükség volt hiszen 2 vizsgáló több év lefolyása alatt végezte el a teszteket) és létrehoztak egy lineáris regressziós modellt ami képes a parkinzonizmus jelenlétére következtetni. Ehhez figyelembe veszik az életkort, a kéz motoros funkciót vizsgáló teszt pontszámait, azok UPDRS3-el erős korrelációjuk miatt. Külön hangsúlyt fektettek azokra a mellék pontszámokra amiket nemcsak neurológusok tudnak felvenni. Sokkal inkább az egyes megfigyelések, tünetek jelenlétét vagy hiányát tartották lényegesnek, mintsem annak szakszerű pontozását amire csak egy neurológus lenne alkalmas. A vizsgálat figyelembe vett egyéb tényezőket is, hogy ezzel tovább pontosíthassák az eredményt, mint például a kérdéssorokból származó adatok (gyógyszerhasználat, depresszió, szorongás, a résztvevők által saját magukon megfigyelt tünetek), amelyek esetén korábbi kutatások kapcsolatot fedeztek fel a mangánnak való túlzott kitettséggel (''Bowler és mtsai., 2006, 1999; Mergler és mtsai., 1994''). Valamint másodlagos változókat is használtak a végleges változat megalkotásához, végül egy több változós lineáris regressziós modellt kaptak. Az összegzett eredmények alapján a következő következtetsre jutottak: a teszt alanyok korában, erős lineáris asszociációt figyeltek meg a domináns kéz pontszáma és a UPDRS3 pontszám között. A helyzet azonban nem volt ennyire egyértelmű a nem domináns kéz esetén. Itt a magasabb pontszám elérésekor (>35) ellentétes módon asszociáltak a UPDRS3 pontszámmal. A legtöbb elsődleges előrejelző amiket a kérdőívek segítségével nyertek, rendkívül hasznosnak bizonyultak, erős kapcsolat volt közöttük és a UPDRS3 pontszám között. A másodlagos előrejelzők között a fájdalom, dohányzás, nem volt a leglényegesebb szerepű, végül a nem eltávolításra került a kis számú női résztvevő miatt. A fájdalom, szorongás, magány és depresszió jelentőséggel bíró értékeit egy változóba foglalták (PALD: pain, anxiety, lonliness, depression). Ezen változó és a dohányzás között összefügést találtak miszerint a magasabb PALD pontszámmal rendelkező nem dohányzók UPDRS3 értéke magasabb volt, a jelenleg is dohányzók értékei a végső változóba nem kerültek be az egyszerűsítés jegyében. A modell segítésével az esetek mindössze 8%-ában azonosítanánk hibásan azokat akik nem rendelkeznek a betegséggel. Pontosításokat végezhetünk ezenkívül a jobb specificitás vagy szenzitivitás elérése érdekében. Az előrejelzett UPDRS3 pontok esetén 9,88 míg a rendes UPDRS3-nál''' '''≥15 bizonyult az optimálisnak (''Rascol és mtsai., 2011; Parkinson Study Group, 1996''), ilyen feltételekkel 80% a szenzitivitás. Abban az esetben, ha magasabb értéknél szabjuk meg az előrejelzett UPDRS3 pontszámot, akkor a specifictás pontosságát tudjuk növelni. Az eredményeket tovább lehet pontosítani különböző biológia markerek figyelembe vételével mint például a nyál, vizelet, vér, igaz ez még csak az első fokát jelentené egy több lépcsős elemzési program megalkotásának (''Myers és mtsai., 2009''). A kutatás legfontosabb eredménye azonban az, hogy a mangán hatására kialakuló neurológiai elváltozások egyszerűbb szűrhetőségére biztosít lehetőséget. Igaz a végső diagnózis felállításához továbbra is elengedhetetlen egy szakértő tudása, de a klinikailag súlyosabb esetek kiszűrése az ő jelenlétük nélkül is lehetségessé válna. Azokat, akiknek az eredménye pozitív lenne, tényleges indokkal lehetne elküldeni egy MRI vizsgálatra, ahol a T1 relaxációs idő (''Lee és mtsai., 2015; Lewis és mtsai., 2016'') és pallidális index (''Criswell és mtsai., 2012; Nelson és mtsai., 1993'') alapján már pontos diagnózist lehetne felállítani. '' ''''' ''' ''''' '' ''' ''''' '' ''' |
| Line 137: | Line 139: |
| Line 138: | Line 141: |
| A mangán indukálta neuroinflamáció kezelésére lehet alkalmas a patkányokon tesztelt Nátrium-P-Aminoszalicilsav (PAS-Na), ami nemcsak a neuroinflamációra közvetlenül hatva mint gyulladás csökkentő hanem mint kelát képző is segíthet a mangánizmus kezelésében. A kísérletet 6 darab 15 állaltból álló csoporton végezték el, volt egy kontrol csoport, egy csak PAS-Na-at kapó csoport, egy csak mangánt (Mn) 〖MnCl〗_2⋅〖4H〗_2 O formájában kapó csoport (12 hét) a maradék 3 csoportot szintén mangánt kapott 12 hétig majd azután 6 hétig PAS-Na-t csoportonként eltérő dózisban (80, 160 and 240 mg/kg). Az állatok tanulási képességét és memóriáját a Morris féle vízi labirintus tesztel vizsgálták (Li et al 2014; Li et al 2015; Ou et al., 2016). A mangánszint és gyulladáskeltő citokinek mennyiségének kiértékeléshez az állatokból vért vettek, valamint szövetmintát nyertek a thalamuszból, hipocampuszból és a cortexből is a GFAP (glial fibrillary acidic protein) immunhisztokémia vizsgálatához (Li et al., 2015), ezeken kívül valós idejű polimer láncreakciót (RT-PCR) és Western blott-ot használtak a kiértékeléshez. Az eredmények egyértelműen jelezték a PAS-Na kedvező hatását, a csak Mn-al kezelt csoportban jelentős súly csökkenést figyeltek meg valamint a vér, agykéreg, thalamusz, és hipokampusz Mn koncentrációja is magas volt, a PAS-Na kezelt csoportokban kevésbé volt jellemző a súly csökkenés valamint a Mn koncentráció is lényeges alacsonyabb volt. A legnagyobb dózist kapó csoport (240 mg/Kg) eredményi bizonyultak a legjobbnak a Mn-al és PAS-NA-val is kezelt csoportok közül. A Morris féle vízi labirintus teszt esetén mind 3 PAS-al kezelt csoport jobb eredményt ért el mint a csak mangánnal kezelt csoport, viszont a PAS-Na kezelés ellenére sem érték el a kontroll csoport szintjét. A mangánt kapó csoportokban megfigyelték ezenkívül a GFAP általi fokozott immunreakciót, emelkedett gyulladáskeltő citokin szintet (IL-1β , IL-6, TNF-α and PGE2) valamint az ezek szintetizálásáért felelős mRNA expressziójának növekedését, a 3 PAS-NA-at kapó csoportban a normál értékekhez kezdek vissza térni a 6 hetes kezelés során. A csak PAS-Na-val kezelt és kontrol csoport eredményei között nem találtak különbséget. A gyulladás kialakulásáért felelős ciklooxigenáz-2 (COX-2) és agyi mitogén-aktivált proteinkináz (MAPK) hatása is csökkent a kezelt csoportokban. A PAS tehát bizonyítottan csökkenti a kóros mangán szintet a vérben és agyban is és gátolja aszterociták aktivációját, valamint segít a memória és tanulási képesség helyreállításában. A hosszabb felezési ideje, jobb lipid oldhatósága és szövetekhez való erősebb kötődése miatt az Acetil-para-N-aminoszalicilsav (AcPAS) a PAS-Na-nál is hatékonyabbnak bizonyulhat (Hong et al., 2011a,b), azonban ennek használata további kutató munkát igényel. Szintén alkalmas kezelési módot biztosíthat kvercetin (QCT), ami hatását az oxidatívstressz csökkentése (Dong 2014) és gyulladás ellenes tulajdonsága révén éri el. Előfordulását tekintve számos zöldségben, valamint gyümölcsben megtalálható flavonoidról van szó (Van Duynhoven 2011; Erlund 2004) amely számos egyéb betegség kezelésében is segíthet (Zhang 2015; Comalada 2005; Lu 2006). A neurodegenárció valamint inflamáció ellenes hatása sokrétű, az NF-κB reakciútra kifejtett gátló hatása révén az olyan gyulladásért felelős enzimek mint a indukálható nitrogén monoxid szintáz (iNOS) és COX-2 szintje csökken, serkentő hatására az Nrf2 (Nuclear factor erythroid 2-related factor 2) és hemoxigenáz-1 (HO-1) antioxidáns tulajdonságú anyagok mennyisége pedig növekszik (Kinaci 2012; Saw 2014). A lipidperoxidáció hatására felszabaduló malondialdehid és 8-OHDdG (8-hydroxy-2' deoxyguanosine) mennyisége a Mn hatására károsan megnövekedett viszont QCT hatására mennyiségük csökkeni kezdett, a szuperoxid-dizmutáz (SOD), kataláz (CAT), glutation (GSH) antioxidáns vegyületek szintje pedig emelkedni kezdtek a QCT-nek köszönhetően. A mitokondrium membránja a Mn hatására kialakul oxidatív stressz miatt depolarizálódik, ezért a sejt halál irányításában szerepet játszó Bax miat citokróm-c jut a sejtplazmába, ez aktiválni fogja kaszpáz reakcióutat (O’Rourke 2005) ami kaszpáz-9, kaszpáz-3 és PARP-1 felszabadulással jár ami végül sejthalálhoz vezet (Debatin 2002; Lazebnik 1994). A QCT képes a sejthalálért felelős anyagok mennyiségét csökkenteni ezzel védve az idegsejteket. A QCT ezenkívül csökkentette az inflamáció kialakulásában fontos szerepet játszó citikonnek szintjét valamint a kísérleti patkányokon nem találtak agyi bevérzéseket ami egy jól megfigyelhető elváltozás volt a mangánnal kezelt állatokban. ---- {{attachment:Quercetin.jpg||width="350"}}''' '' ''''' '' '' ''''' '' ''' ||<rowbgcolor="#eeeeee">'''7. ábra: '''Kvercetin szerkezeti képlette'' '' || {{attachment:Quercetin hatása.jpg||width="800"}} ||<rowbgcolor="#eeeeee">'''8. ábra: '''A kvercetin neuroinflamáció ellenes hatása'' '' || |
A mangán indukálta neuroinflammáció kezelésére lehet alkalmas a patkányokon tesztelt Nátrium-P-Aminoszalicilsav (PAS-Na), ami nemcsak a neuroinflammációra közvetlenül hatva, mint gyulladáscsökkentő, hanem mint kelátképző is segíthet a mangánizmus kezelésében. ((((((A kísérletet 6 darab 15 állaltból álló csoporton végezték el, volt egy kontroll csoport, egy csak PAS-Na-at kapó csoport, egy csak mangánt (Mn) 〖MnCl〗_2⋅〖4H〗_2 O formájában kapó csoport (12 hét) a maradék három csoportot szintén mangánt kapott 12 hétig majd azután 6 hétig PAS-Na-t csoportonként eltérő dózisban (80, 160 and 240 mg/kg).))))))) Az állatok tanulási képességét és memóriáját a Morris-féle vízi labirintus teszttel vizsgálták (''Li et al 2014; Li et al 2015; Ou et al., 2016''). A mangánszint és gyulladáskeltő cytokinek mennyiségének kiértékeléshez az állatokból vért vettek, valamint szövetmintát nyertek a thalamusból, hippocampusból és a cortexből is a GFAP (glial fibrillary acidic protein) immunhisztokémiai vizsgálatához (''Li et al., 2015''). Ezeken kívül valós idejű polimer láncreakciót (RT-PCR) és Western blott-ot használtak a kiértékeléshez. Az eredmények egyértelműen jelezték a PAS-Na kedvező hatását. A csak Mn-al kezelt csoportban jelentős súlycsökkenést figyeltek meg, valamint a vér, agykéreg, thalamus, és hippocampus Mn-koncentrációja is magas volt. A PAS-Na kezelt csoportokban kevésbé volt jellemző a súly csökkenés valamint a Mn-koncentráció is lényegesen alacsonyabb volt. A legnagyobb dózist kapó csoport (240 mg/Kg) eredményei bizonyultak a legjobbnak a Mn-al és PAS-NA-val is kezelt csoportok közül. A Morris féle vízi labirintus teszt esetén mindhárom PAS-sal kezelt csoport jobb eredményt ért el, mint a csak mangánnal kezelt csoport, viszont a PAS-Na kezelés ellenére sem érték el a kontroll csoport szintjét. A mangánt kapó csoportokban megfigyelték ezenkívül a GFAP általi fokozott immunreakciót, emelkedett gyulladáskeltő cytokin szintet (IL-1β , IL-6, TNF-α és PGE2) valamint az ezek szintetizálásáért felelős mRNS expressziójának növekedését. A három PAS-NA-ot kapó csoportban a normál értékekhez kezdtek visszatérni a 6 hetes kezelés során. A csak PAS-Na-val kezelt és kontroll csoport eredményei között nem találtak különbséget. A gyulladás kialakulásáért felelős ciklooxigenáz-2 (COX-2) és agyi mitogén-aktivált proteinkináz (MAPK) hatása is csökkent a kezelt csoportokban. A PAS tehát bizonyítottan csökkenti a kóros mangán szintet a vérben és az agyban is, és gátolja astrocyták aktivációját, valamint segít a memória és tanulási képesség helyreállításában. A hosszabb felezési ideje, jobb lipid oldhatósága és szövetekhez való erősebb kötődése miatt az Acetil-para-N-aminoszalicilsav (AcPAS) a PAS-Na-nál is hatékonyabbnak bizonyulhat (''Hong et al., 2011a,b''), azonban ennek használata további kutató munkát igényel. Szintén alkalmas kezelési módot biztosíthat a kvercetin (QCT), ami hatását az oxidatív stressz csökkentése (''Dong 2014'') és gyulladás ellenes tulajdonsága révén éri el. Előfordulását tekintve számos zöldségben és gyümölcsben megtalálható flavonoidról van szó (''Van Duynhoven 2011; Erlund 2004''), amely sok egyéb betegség kezelésében is segíthet (''Zhang, 2015; Comalada, 2005; Lu, 2006''). A neurodegeneráció valamint inflammáció ellenes hatása sokrétű. Az NF-κB reakcióútra kifejtett gátló hatása révén az olyan gyulladásért felelős enzimek mint a indukálható nitrogén monoxid szintáz (iNOS) és COX-2 szintje csökken. Serkentő hatására az Nrf2 (Nuclear factor erythroid 2-related factor 2) és hemoxigenáz-1 (HO-1) antioxidáns tulajdonságú anyagok mennyisége pedig növekszik (''Kinaci 2012; Saw 2014''). A lipidperoxidáció hatására felszabaduló malondialdehid és 8-OHDdG (8-hydroxy-2' deoxyguanosine) mennyisége a Mn hatására károsan megnövekedett, viszont QCT hatására mennyiségük csökkenni kezdett, a szuperoxid-dizmutáz (SOD), kataláz (CAT), glutation (GSH) antioxidáns vegyületek szintje pedig emelkedni kezdtek a QCT-nek köszönhetően. A mitochondrium membránja a Mn hatására kialakult oxidatív stressz miatt depolarizálódik, ezért az apoptózis (sejthalál) irányításában szerepet játszó Bax miat citokróm-c jut a sejtplazmába, ez aktiválni fogja a kaszpáz reakcióutat (''O’Rourke 2005''), ami kaszpáz-9, kaszpáz-3 és PARP-1 felszabadulással jár, ami végül sejthalálhoz vezet (''Debatin 2002; Lazebnik 1994''). A QCT képes a sejthalálért felelős anyagok mennyiségét csökkenteni, ezzel védve az idegsejteket. A QCT ezenkívül csökkentette az inflammáció kialakulásában fontos szerepet játszó cytokinek szintjét, valamint a kísérleti patkányokon nem találtak agyi bevérzéseket, ami egy jól megfigyelhető elváltozás volt a mangánnal kezelt állatokban. ---- {{attachment:Quercetin.jpg||width="350"}} ''' '' ''''' '' '' ''''' '' ''' ||<rowbgcolor="#eeeeee">'''7. ábra: '''Kvercetin szerkezeti képlete'' '' || {{attachment:Quercetin hatása.jpg|Quercetin hatása.jpg|width="800"}} ||<rowbgcolor="#eeeeee">'''8. ábra: '''A kvercetin neuroinflammáció-ellenes hatása'' '' || |
| Line 168: | Line 182: |
| '''16.Codolo, G.; Plotegher, N.; Pozzobon, T.; Brucale, M.; Tessari, I.; Bubacco, L.; de Bernard, M.; Triggering of inflammasome by aggregated –synuclein, an inflammatory response in synucleinopathies. PLOS ONE 8, e55375 (2013). '' '' ' ' ''' ''''' '' '' ''''' ''''' '' '' ''''''''''' ''' ''''' ''' ''17.Zhou, R.; Yazdi, A.S.; Menu, P.; Tschopp, J.; A role for mitochondria in NLRP3 inflammasome activation. Nature 469, 221–225 (2011). '' '' ''''' ''' ''' ''''' '' '' ' ''' '''''''' '' ''''''''''' ''' ''''' ''' 18. Alfonso-Loeches, S.; Ureña-Peralta, J. R.; Morillo-Bargues, M. J.; Oliver-De La Cruz, J.; Guerri, C.; Role of mitochondria ROS generation in ethanol-induced NLRP3 inflammasome activation and cell death in astroglial cells. Front. Cell. Neurosci. 8, 216 (2014). '' '' ' ' ''' ''''' '' '' ''''' '' ''''''' ''' ''' ''''' ''' ''19.Franklin, B. S.; Bossaller, L.; De Nardo, D.; Ratter, J. M.; Stutz, A.; Engels, G.; Brenker, C.; Nordhoff, M.; Mirandola, S.R.; Al-Amoudi, A.; Mangan, M.S.; Zimmer, S.; Monks, B.G.; Fricke, M.; Schmidt, R. E.; Espevik, T.; Jones, B.; Jarnicki, A. G.; Hansbro, P. M.; Busto, P.; Marshak-Rothstein, A.; Hornemann, S.; Aguzzi, A.; Kastenmüller, W.; Latz, E.; The adaptor ASC has extracellular and ‘prionoid’ activities that propagate inflammation. Nat. Immunol. 15, 727–737 (2014). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' ''''' ''' ''' ''' ''''' 26.Milatovic, D.; Yin, Z.; Gupta, R. C.; Sidoryk, M.; Albrecht, J.; Aschner, J. L.; M. Aschner, Manganese induces oxidative impairment in cultured rat astrocytes. Toxicol. Sci. 98, 198–205 (2007). '' '' ' ' ''''' ''''' '' '' ''' ''''' ''''' ''' ''' ''' ''34.Yin, Z.; Aschner, J.L.; dos Santos, A.P.; Aschner, M.: Mitochondrial-dependent manganese neurotoxicity in rat primary astrocyte cultures. Brain Res. 1203, 1–11 (2008). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' ''' 43.Sarkar, S.; Malovic, E.; Harishchandra, D. S.; Ghaisas, S.; Panicker, N.; Charli, A.; Palanisamy, B. N.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A.; Kanthasamy, A. G.: Mitochondrial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease. NPJ Parkinsons Dis. 3, 30 (2017). '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' ''' ''''' '''''50.Roth,J. A.; Horbinski, C.; Higgins, D.; Lein, P.; Garrick, M. D.:Mechanisms of manganeseinduced rat pheochromocytoma (PC12) cell death and cell differentiation. Neurotoxicology 23, 147–157 (2002). '''''''' '' ''''' ''' ''' ''''' '' '' ' ''''''''''' ''''' '' ' ''' ''''' 54.Tang, F.- L.; Liu, W.; Hu, J.-X.; Erion, J. R.; Ye, J.; Mei, W.-C. Xiong, VPS35 deficiency or mutation causes dopaminergic neuronal loss by impairing mitochondrial fusion and function. Cell Rep. 12, 1631–1643 (2015). '' '' ' ''''' ''' ''''' '' '' ' ''''' '' ''''' ''''' ''' ''' 58.Jo, E.-K.; Kim, J. K.; Shin D. N.; Sasakawa, C.: Molecular mechanisms regulating NLRP3 inflammasome activation. Cell. Mol. Immunol. 13, 148–159 (2016). '' '' ''''' ''' ''' ''''' '' '' ' ''' '' ''''' '' ''' ''' ''' ''''' '''59.Martinon, F.; Pétrilli, V.; Mayor, A, Tardivel, A.,Tschopp, J.: Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 440, 237–241 (2006). '' '' ' ' ' ''''' '' '' ' '' '' ''' ''''' '''60. Dostert, C.; Pétrilli, V.; Van Bruggen, R.; Steele, C.; Mossman, B.T.; Tschopp, J.: Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science 320, 674–677 (2008). '' '' ''''' ''' ''' ''''' '' '' ''''' ''' ''''' ''''' '' ''''' ''' ''''' '''61. Lawana, V.; Singh, N.; Sarkar, S.; Charli, A.; Jin, H.; Anantharam, V.; Kanthasamy, A. G.; Kanthasamy, A.: Involvement of c-Abl kinase in microglial activation of NLRP3 inflammasome and impairment in autolysosomal system. J. Neuroimmune Pharmacol. 12, 624–660 (2017). '' '' ' ' ''' ''''' '' '' ' ''''' ''''' '' '' ''''' 72.Aflaki, E.; Moaven, N.; Borger, D. K.; Lopez, G.; Westbroek, W.; Chae, J. J.; Marugan, J .; Patnaik, S.; Maniwang, E.; Gonzalez,A. N.; Sidransky, E.: Lysosomal storage and impaired autophagy lead to inflammasome activation in Gaucher macrophages. Aging Cell 15, 77–88 (2016). '' '' ''''' ''' ''' ''''' '' '' ''''' ''' ''''' ''' ''' '' ''''' 73.Rao, K. V. R.; Norenberg, M. D.: Manganese induces the mitochondrial permeability transition in cultured astrocytes. J. Biol. Chem. 279, 32333–32338 (2004). '' '' ' ''''' ''' ''''' '' '' ' ''''' ''' '''''''' ''' ''''' ''''' ''74.Rakovic, A.; Grünewald, A.; Kottwitz, J.; Brüggemann, N.; Pramstaller, P. P.; Lohmann, K.; Klein, C.:Mutations in PINK1 and Parkin impair ubiquitination of Mitofusins in human fibroblasts. PLOS ONE 6, e16746 (2011). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' '' ''''' '' ''' ''''' ''75.Rocha, N.; Bulger, D.A; Frontini, A.; Titheradge, H.; Gribsholt, S. B.; Knox, R.; Page, M.; Harris, J.; Payne, F.; Adams, C.; Sleigh, A.; Crawford, J.; Gjesing, A. P.; Bork-Jensen, J.; Pedersen, O.; Barroso, I.; Hansen, T.; Cox, H.; Reilly, M.; Rossor, A.; Brown, R.J.; Taylor, S. I.; McHale, D.; Armstrong, M.; Oral, E. A.; Saudek, V.; O'Rahilly, S. I.; Maher, E. R.; Richelsen, B.; Savage, B. D.; Semple, R. K.: Human biallelic MFN2 mutations induce mitochondrial dysfunction, upper body adipose hyperplasia, and suppression of leptin expression. eLife 6, e23813 (2017). '' '' ' ' ''' ''''' '' '' ''''' ''''' '' '' ''' ''' 78. Wang,W.; Wang, X.; Fujioka, H.; Hoppel, C.; Whone, A. L.; Caldwell, M. A.; Cullen, P. A.; Liu, J.; Zhu, X.:Parkinson’s disease–associated mutant VPS35 causes mitochondrial dysfunction by recycling DLP1 complexes. Nat. Med. 22, 54–63 (2016). '' '' ''''' ''' ''' ''''' '' '' ''' ''' '' '' ''' ''' ''81. Follett, J.; Norwood, S. J.; Hamilton, N. A.; Mohan, M.; Kovtun, O.; Tay, S.; Zhe, Y.; Wood, S. A; Mellick, G. D.; Silburn, P. A.; Collins, B. M.; Bugarcic, A.; Teasdale, R. D.:The Vps35 D620N mutation linked to Parkinson’s disease disrupts the cargo sorting function of retromer. Traffic 15, 230–244 (2014). '' '' ' ' ''' ''''' '' '' ''''' '' ''' ''''' '' ''' 82.Vella, L. J.; Hill, A. F.; Cheng, L.: Focus on extracellular vesicles: Exosomes and their role in protein trafficking and biomarker potential in Alzheimer’s and Parkinson’s disease. Int. J. Mol. Sci. 17, 173 (2016). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' ''''' ''' ''''' ''''' ''' ''86.Gupta, A.; Pulliam, L.:Exosomes as mediators of neuroinflammation. J. Neuroinflammation 11, 68 (2014). '' '' ' ' ' ''''' '' '' ''' ''''' ''''' ''' '' ''''' '''''88.Dierschke, K.; Isaxon, C.; Andersson, U. B. K.; Assarsson, E.; Axmon, A.; Stockfelt, L.; Gudmundsson, A.; Jönsson, B. A. G.; Kåredal, M.; Löndahl, J.; Pagels, J.; Wierzbicka, A.; Bohgard M.; Nielsen, J.:Acute respiratory effects and biomarkers of inflammation due to welding-derived nanoparticle aggregates. Int. Arch. Occup. Environ. Health 90, 451–463 (2017). '' '' ''''' ''' ''' ''''' '' '' ' ''''' ''''' '' ''''' ''' ''''' '''''Exosoma' '''''''' '' ' ' ''''''''''' ''''' '' '' ' ''' '' '' ''''' ''''' ''' '''''__Felhasznált irodalom: __ '' '' ''''' ''' ''' ''''' '' '' ''''''' ''' '''''''' '' '' ''''' ''''' ''' |
'''16.Codolo, G.; Plotegher, N.; Pozzobon, T.; Brucale, M.; Tessari, I.; Bubacco, L.; de Bernard, M.; Triggering of inflammasome by aggregated –synuclein, an inflammatory response in synucleinopathies. PLOS ONE 8, e55375 (2013). '' '' ' ' ''' ''''' '' '' ''''' ''''' '' '' ''''' ''' ''''' ''' ''''' '''17.Zhou, R.; Yazdi, A.S.; Menu, P.; Tschopp, J.; A role for mitochondria in NLRP3 inflammasome activation. Nature 469, 221–225 (2011). '' '' ''''' ''' ''' ''''' '' '' ' ''' '' '' ''''' ''' ''''' ''' 18. Alfonso-Loeches, S.; Ureña-Peralta, J. R.; Morillo-Bargues, M. J.; Oliver-De La Cruz, J.; Guerri, C.; Role of mitochondria ROS generation in ethanol-induced NLRP3 inflammasome activation and cell death in astroglial cells. Front. Cell. Neurosci. 8, 216 (2014). '' '' ' ' ''' ''''' '' '' ''''' '' ''''''''''' ''' ''' ''''' ''' ''' '''''19.Franklin, B. S.; Bossaller, L.; De Nardo, D.; Ratter, J. M.; Stutz, A.; Engels, G.; Brenker, C.; Nordhoff, M.; Mirandola, S.R.; Al-Amoudi, A.; Mangan, M.S.; Zimmer, S.; Monks, B.G.; Fricke, M.; Schmidt, R. E.; Espevik, T.; Jones, B.; Jarnicki, A. G.; Hansbro, P. M.; Busto, P.; Marshak-Rothstein, A.; Hornemann, S.; Aguzzi, A.; Kastenmüller, W.; Latz, E.; The adaptor ASC has extracellular and ‘prionoid’ activities that propagate inflammation. Nat. Immunol. 15, 727–737 (2014). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' ''''' ''' ''' ''' ''''' ''' '''26.Milatovic, D.; Yin, Z.; Gupta, R. C.; Sidoryk, M.; Albrecht, J.; Aschner, J. L.; M. Aschner, Manganese induces oxidative impairment in cultured rat astrocytes. Toxicol. Sci. 98, 198–205 (2007). '' '' ' ' ''''' ''''' '' '' ''' ''''' ''''' ''' ''' ''' ''' '''''34.Yin, Z.; Aschner, J.L.; dos Santos, A.P.; Aschner, M.: Mitochondrial-dependent manganese neurotoxicity in rat primary astrocyte cultures. Brain Res. 1203, 1–11 (2008). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' ''' ''' '''43.Sarkar, S.; Malovic, E.; Harishchandra, D. S.; Ghaisas, S.; Panicker, N.; Charli, A.; Palanisamy, B. N.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A.; Kanthasamy, A. G.: Mitochondrial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease. NPJ Parkinsons Dis. 3, 30 (2017). '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' ''' ''''' ''' ''50.Roth,J. A.; Horbinski, C.; Higgins, D.; Lein, P.; Garrick, M. D.:Mechanisms of manganeseinduced rat pheochromocytoma (PC12) cell death and cell differentiation. Neurotoxicology 23, 147–157 (2002). '' '' ''''' ''' ''' ''''' '' '' ' ''''' ''''' '' ' ''' ''''' '' ''54.Tang, F.- L.; Liu, W.; Hu, J.-X.; Erion, J. R.; Ye, J.; Mei, W.-C. Xiong, VPS35 deficiency or mutation causes dopaminergic neuronal loss by impairing mitochondrial fusion and function. Cell Rep. 12, 1631–1643 (2015). '' '' ' ''''' ''' ''''' '' '' ' ''''' '' ''''' ''''' ''' ''' '' ''58.Jo, E.-K.; Kim, J. K.; Shin D. N.; Sasakawa, C.: Molecular mechanisms regulating NLRP3 inflammasome activation. Cell. Mol. Immunol. 13, 148–159 (2016). '' '' ''''' ''' ''' ''''' '' '' ' ''' '''''''' ''''' '' ''' ''' ''' ''''' '' '''''59.Martinon, F.; Pétrilli, V.; Mayor, A, Tardivel, A.,Tschopp, J.: Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 440, 237–241 (2006). '''''''' '' ' ' ' ''''' '' '' ' '' '' ''' ''''' '' '''''60. Dostert, C.; Pétrilli, V.; Van Bruggen, R.; Steele, C.; Mossman, B.T.; Tschopp, J.: Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science 320, 674–677 (2008). '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''' ''''' ''''' '' ''''' ''' ''''' '' '''''61. Lawana, V.; Singh, N.; Sarkar, S.; Charli, A.; Jin, H.; Anantharam, V.; Kanthasamy, A. G.; Kanthasamy, A.: Involvement of c-Abl kinase in microglial activation of NLRP3 inflammasome and impairment in autolysosomal system. J. Neuroimmune Pharmacol. 12, 624–660 (2017). '''''''' '' ' ' ''''''' ''''' '' '' ' ''''' ''''' '' '' ''''' '' ''72.Aflaki, E.; Moaven, N.; Borger, D. K.; Lopez, G.; Westbroek, W.; Chae, J. J.; Marugan, J .; Patnaik, S.; Maniwang, E.; Gonzalez,A. N.; Sidransky, E.: Lysosomal storage and impaired autophagy lead to inflammasome activation in Gaucher macrophages. Aging Cell 15, 77–88 (2016). '' '' ''''' ''' ''' ''''' '' '' ''''' ''' ''''' ''' ''' '''''''' ''''' '' ''73.Rao, K. V. R.; Norenberg, M. D.: Manganese induces the mitochondrial permeability transition in cultured astrocytes. J. Biol. Chem. 279, 32333–32338 (2004). '' '' ' ''''' ''' ''''' '' '' ' ''''' ''' '''''''' ''' ''''' ''''' '' 74.Rakovic, A.; Grünewald, A.; Kottwitz, J.; Brüggemann, N.; Pramstaller, P. P.; Lohmann, K.; Klein, C.:Mutations in PINK1 and Parkin impair ubiquitination of Mitofusins in human fibroblasts. PLOS ONE 6, e16746 (2011). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' '' ''''' '' ''' ''''' '' 75.Rocha, N.; Bulger, D.A; Frontini, A.; Titheradge, H.; Gribsholt, S. B.; Knox, R.; Page, M.; Harris, J.; Payne, F.; Adams, C.; Sleigh, A.; Crawford, J.; Gjesing, A. P.; Bork-Jensen, J.; Pedersen, O.; Barroso, I.; Hansen, T.; Cox, H.; Reilly, M.; Rossor, A.; Brown, R.J.; Taylor, S. I.; McHale, D.; Armstrong, M.; Oral, E. A.; Saudek, V.; O'Rahilly, S. I.; Maher, E. R.; Richelsen, B.; Savage, B. D.; Semple, R. K.: Human biallelic MFN2 mutations induce mitochondrial dysfunction, upper body adipose hyperplasia, and suppression of leptin expression. eLife 6, e23813 (2017). '' '' ' ' ''' ''''' '' '' ''''' ''''' '' '' ''' ''' '' ''78. Wang,W.; Wang, X.; Fujioka, H.; Hoppel, C.; Whone, A. L.; Caldwell, M. A.; Cullen, P. A.; Liu, J.; Zhu, X.:Parkinson’s disease–associated mutant VPS35 causes mitochondrial dysfunction by recycling DLP1 complexes. Nat. Med. 22, 54–63 (2016). '' '' ''''' ''' ''' ''''' '' '' ''' ''' '' '' ''' ''' '' 81. Follett, J.; Norwood, S. J.; Hamilton, N. A.; Mohan, M.; Kovtun, O.; Tay, S.; Zhe, Y.; Wood, S. A; Mellick, G. D.; Silburn, P. A.; Collins, B. M.; Bugarcic, A.; Teasdale, R. D.:The Vps35 D620N mutation linked to Parkinson’s disease disrupts the cargo sorting function of retromer. Traffic 15, 230–244 (2014). '' '' ' ' ''' ''''' '' '' ''''' '' ''''''' ''''' '' ''''''' '' ''82.Vella, L. J.; Hill, A. F.; Cheng, L.: Focus on extracellular vesicles: Exosomes and their role in protein trafficking and biomarker potential in Alzheimer’s and Parkinson’s disease. Int. J. Mol. Sci. 17, 173 (2016). '' '' ''''' ''' ''' ''''' '' '' ' ' ''''' ''''' ''' ''''' ''''' ''' '' 86.Gupta, A.; Pulliam, L.:Exosomes as mediators of neuroinflammation. J. Neuroinflammation 11, 68 (2014). '' '' ' ' ' ''''' '' '' ''''''' ''''' ''''' ''' '''''''' ''''' '' '''88.Dierschke, K.; Isaxon, C.; Andersson, U. B. K.; Assarsson, E.; Axmon, A.; Stockfelt, L.; Gudmundsson, A.; Jönsson, B. A. G.; Kåredal, M.; Löndahl, J.; Pagels, J.; Wierzbicka, A.; Bohgard M.; Nielsen, J.:Acute respiratory effects and biomarkers of inflammation due to welding-derived nanoparticle aggregates. Int. Arch. Occup. Environ. Health 90, 451–463 (2017). '' '' ''''' ''' ''' ''''' '' '' ' ''''' ''''' '' ''''' ''' ''''' '' '''Exosoma' '''''''' '' ' ' ''''' ''''' '' '' ' ''' '' '' ''''' ''''' ''' ''' ''__Felhasznált irodalom: __ '' '' ''''' ''' ''' ''''' '' '' ' ''' '''''''' '' '' ''''' ''''' ''' |
| Line 222: | Line 236: |
| Thery, C.; Zitvogel, L.; and Amigorena, S. (2002). Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2, 569–579. doi: 10.1038/nri855 '' '' ''''' ''' ''' ''''' '' '' ' ''' '''''''' '' '' ''''''' '' '''''Sarko, D. K.; and McKinney, C. E. (2017). Exosomes: origins and therapeutic potential for neurodegenerative disease. Front. Neurosci. 11:82. doi: 10.3389/fnins.2017.00082 '''''''' '' ' ''''''' ''' ''''' '' '' ''''' '' ''''' '' ''''' ''' '' |
Thery, C.; Zitvogel, L.; and Amigorena, S. (2002). Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2, 569–579. doi: 10.1038/nri855 '' '' ''''' ''' ''' ''''' '' '' ' ''' '''''''' '' '' ''''''''''' '''''''' ''' ''Sarko, D. K.; and McKinney, C. E. (2017). Exosomes: origins and therapeutic potential for neurodegenerative disease. Front. Neurosci. 11:82. doi: 10.3389/fnins.2017.00082 '' '' ' ' ''' ''''' '' '' ''''' '' ''''' '' ''''' ''' '' |
| Line 228: | Line 242: |
| '''''Munson, P.; Lam, Y. W.; Macpherson, M.; Beuschel, S.; and Shukla, A. (2018). Mouse serum exosomal proteomic signature in response to asbestos exposure. J. Cell. Biochem. 119, 6266–6273. doi: 10.1002/jcb.26863 '''''''' '' ' ' ''''''' ''''' '' '' ''''' ''' '''''''' '' ''''' ''' ''''' '' '''Ngalame, N. N. O.; Luz, A. L.; Makia, N.; and Tokar, E. J. (2018). Arsenic alters exosome quantity and cargo to mediate stem cell recruitment into a cancer stem cell-like phenotype. Toxicol. Sci. 165, 40–49. doi: 10.1093/toxsci/kfy176 '''''''' '' ''''' ''' ''' ''''' '' '' ''''''' ''' '' '' '' ''''' ''' ''''' ''''' ''Harischandra, D. S.; Ghaisas, S.; Rokad, D.; and Kanthasamy, A. G. (2017). Exosomes in toxicology: relevance to chemical exposure and pathogenesis of environmentally linked diseases. Toxicol. Sci. 158, 3–13. doi: 10.1093/toxsci/kfx074 '' '' ' ' ''' ''''' '' '' ''''' '' ''''' '' ''''' ''''' Harischandra, D. S.; Ghaisas, S.; Rokad, D.; Zamanian, M.; Jin, H.; Anantharam, V., és mtsai. (2018). Environmental neurotoxicant manganese regulates exosome-mediated extracellular miRNAs in cell culture model of Parkinson’s disease: relevance to alpha-synuclein misfolding in metal neurotoxicity. Neurotoxicology 64, 267–277. doi: 10.1016/j.neuro.2017.04.007 '' '' ''''' ''' ''' ''''' '' '' ' ''' ''' ''''' '' ''''' '' '''''Harischandra, D. S.; Jin, H.; Anantharam, V.; Kanthasamy, A., and Kanthasamy, A. G. (2015a). alpha-Synuclein protects against manganese neurotoxic insult during the early stages of exposure in a dopaminergic cell model of Parkinson’s disease. Toxicol. Sci. 143, 454–468. doi: 10.1093/toxsci/kfu247 '''''''' '' ' ' ''''''' ''''' '' '' ''''''' ''' '' '' ''''' ''''' |
'''''Munson, P.; Lam, Y. W.; Macpherson, M.; Beuschel, S.; and Shukla, A. (2018). Mouse serum exosomal proteomic signature in response to asbestos exposure. J. Cell. Biochem. 119, 6266–6273. doi: 10.1002/jcb.26863 '''''''' '' ' ' ''''''''''' ''''' '' '' ''''' ''' '' '' ''''' ''' ''''' '' ''' Ngalame, N. N. O.; Luz, A. L.; Makia, N.; and Tokar, E. J. (2018). Arsenic alters exosome quantity and cargo to mediate stem cell recruitment into a cancer stem cell-like phenotype. Toxicol. Sci. 165, 40–49. doi: 10.1093/toxsci/kfy176 '' '' ''''' ''' ''' ''''' '' '' ' ''' '' '' '' ''''' ''' ''''' ''''' ''' '''''Harischandra, D. S.; Ghaisas, S.; Rokad, D.; and Kanthasamy, A. G. (2017). Exosomes in toxicology: relevance to chemical exposure and pathogenesis of environmentally linked diseases. Toxicol. Sci. 158, 3–13. doi: 10.1093/toxsci/kfx074 '' '' ' ' ''''''' ''''' '' '' ''''' '' ''''' '' ''''' ''''' ''' '''Harischandra, D. S.; Ghaisas, S.; Rokad, D.; Zamanian, M.; Jin, H.; Anantharam, V., és mtsai. (2018). Environmental neurotoxicant manganese regulates exosome-mediated extracellular miRNAs in cell culture model of Parkinson’s disease: relevance to alpha-synuclein misfolding in metal neurotoxicity. Neurotoxicology 64, 267–277. doi: 10.1016/j.neuro.2017.04.007 '' '' ''''' ''' ''' ''''' '' '' ' ''' ''' ''''' '' ''''' '' ''' ''Harischandra, D. S.; Jin, H.; Anantharam, V.; Kanthasamy, A., and Kanthasamy, A. G. (2015a). alpha-Synuclein protects against manganese neurotoxic insult during the early stages of exposure in a dopaminergic cell model of Parkinson’s disease. Toxicol. Sci. 143, 454–468. doi: 10.1093/toxsci/kfu247 '' '' ' ' ' ''''' '' '' ''''''' ''' '' '' ''''' ''''' |
| Line 250: | Line 264: |
| '''''https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full '''''''' '' ''''' ''' ''' ''''' '' '' ' ''''''''''' ''' '' ''' ''''' '' '''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 '''''''' '' ' ' ''''' ''''' '' '' ''''' ''' ''''' ''' '''''''' ''''' ''' ''''' '' https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-017-0871-0 ' ''' ''''' '' '' ' ' '' ''' ''''' ''''' ''' '' '' '''Kirkley, K. S.; Popichak, K. A.; Afzali, M. F. ''''''''et al.'' Microglia amplify inflammatory activation of astrocytes in manganese neurotoxicity. ''J Neuroinflammation'' '''''14, '''99 (2017). https://doi.org/10.1186/s12974-017-0871-0 ''' ''' ''''' ''' ''' '' ' ' '' ''' '''''''' ''''' '' '' ''__Referenciák__':' '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' '' ''' '''''''' ''''' ''' ''' '' '''''Erikson, K. M.; and Aschner, M. (2006). Increased manganese uptake by primary astrocyte cultures with altered iron status is mediated primarily by divalent metal transporter. Neurotoxicology 27, 125–130. doi: 10.1016/j.neuro.2005. 07.003 '''''''' '' ' ' ' ''''' ''' ''''' '' ' ''''' ''' ''''' ''''' ''' ''' '' '''''Huang, C. C. (2007). Parkinsonism induced by chronic manganese intoxication–an experience in Taiwan. Chang Gung Med. J. 30, 385–395. '''''''' '' ''''' ''' ''' ''''' ''' ''' '''''''' ' ''''' ''' '''''''' ''''' ''' ''' '' Perl, D. P.; and Olanow, C. W. (2007). The neuropathology of manganese-induced Parkinsonism. J. Neuropathol. Exp. Neurol. 66, 675–682. doi: 10.1097/nen. 0b013e31812503cf '' '' ' ' ' ''''' ''' '' ' ''''' ''' '' ''''' ''' '' Cordova, F. M.; Aguiar, A. S. Jr.; Peres, T. V.; Lopes, M. W.; Gonçalves, F. M.; Pedro, D. Z., és mtsai. (2013). Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox. Arch. Toxicol. 87, 1231–1244. doi: 10.1007/s00204-013-1017-5 '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' ''' ''''' ''''' ''' '' '''''Carson, M. J.; Bilousova, T. V.; Puntambekar, S. S.; Melchior, B.; Doose, J. M.; and Ethell, I. M. (2007). A rose by any other name? The potential consequences of microglial heterogeneity during CNS health and disease. Neurotherapeutics 4, 571–579. doi: 10.1016/j.nurt.2007.07.002 '''''''' '' ' ''''' ''' ''''' ''' ''''' '' ' ''''' ''' '' ''' ''''' ''''' ''' '' '''Tansey, M. G.; Frank-Cannon, T. C.; Mccoy, M. K.; Lee, J. K.; Martinez, T. N.; Mcalpine, F. E., és mtsai. (2008). Neuroinflammation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy? Front. Biosci. 13, 709–717. doi: 10.1007/s11481-009-9176-0 '' '' ''''' ''' ''' ''''' ''' ''' '''''''' ' ''''' ''' ''''' ''' ''''' ''''' ''' '' ''Mogi, M.; Harada, M.; Kondo, T.; Riederer, P.; Inagaki, H.; Minami, M., és mtsai. (1994). Interleukin-1 beta, interleukin-6, epidermal growth factor and transforming growth factor-alpha are elevated in the brain from Parkinsonian patients. Neurosci. Lett. 180, 147–150. doi: 10.1016/0304-3940(94)90 508-8 '' '' ' ' ''' ''''' ''' '''''''' ' ''''' ''' ''''' ''' ''''' ''''' ''' '' '''''Przedborski, S.; and Vila, M. (2003). The 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine mouse model: a tool to explore the pathogenesis of Parkinson’s disease. Ann. N. Y. Acad. Sci. 991, 189–198. doi: 10.1111/j.1749-6632.2003.tb07476.x '''''''' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' ''' '' ''' ''''' ''''' ''' '' Ghosh, A.; Roy, A.; Liu, X.; Kordower, J. H.; Mufson, E. J.; Hartley, D. M., és mtsai. (2007). Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proc. Natl. Acad. Sci. U.S.A. 104, 18754–18759. doi: 10.1073/pnas.0704908104 '' '' ' ' ' ''''' ''' ''''' '' ''''' ''' '''''''' ''' '' ''''' ''' '' '''Miklossy, J.; Doudet, D. D.; Schwab, C.; Yu, S.; Mcgeer, E. G.; and Mcgeer, P. L. (2006). Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys. Exp. Neurol. 197, 275–283. doi: 10.1016/j.expneurol.2005. 10.034 '' '' ''''' ''' ''' ''''' ''' ''' '''''''' ''''' ''' '''''''' ''' '' ''''' ''' '' '''''Ghosh, A.; Roy, A.; Matras, J.; Brahmachari, S.; Gendelman, H. E.; and Pahan, K. (2009). Simvastatin inhibits the activation of p21ras and prevents the loss of dopaminergic neurons in a mouse model of Parkinson’s disease. J. Neurosci. 29, 13543–13556. doi: 10.1523/JNEUROSCI.4144-09.2009 '''''''' '' ' ' ' ''''' ''' '''''''' ''''' '' ' '' ''''' ''' '' '''''Wedler, F. C.; and Denman, R. B. (1984). Glutamine synthetase: the major Mn(II) enzyme in mammalian brain. Curr. Top. Cell. Regul. 24, 153–169. '''''''' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' '' ' '' '' ''''''' '' Wedler, F. C.; Vichnin, M. C.; Ley, B. W.; Tholey, G.; Ledig, M.; and Copin, J. C. (1994). Effects of Ca(II) ions on Mn(II) dynamics in chick glia and rat astrocytes: potential regulation of glutamine synthetase. Neurochem. Res. 19, 145–151. doi: 10.1007/bf00966809 '' '' ' ''''' ''' ''''' ''' ''''' '' ' '' '' '' ''''''' '' ''Farina, M.; Avila, D. S.; Da Rocha, J. B.; and Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury. Neurochem. Int. 62, 575–594. doi: 10.1016/j.neuint.2012.12.006 '' '' ''''' ''' ''' ''''' ''' ''' '' ''' '''''''' '' '' ''''''' '' Rama Rao, K. V.; Reddy, P. V.; Hazell, A. S.; and Norenberg, M. D. (2007). Manganese induces cell swelling in cultured astrocytes. Neurotoxicology 28, 807–812. doi: 10.1016/j.neuro.2007.03.001 '' '' ' ''''' ''' ''''' ''' '' ' '' ' ''' ''''' '' '''''Moreno, J. A.; Sullivan, K. A.; Carbone, D. L.; Hanneman, W. H.; and Tjalkens, R. B. (2008). Manganese potentiates nuclear factor-kappaB-dependent expression of nitric oxide synthase 2 in astrocytes by activating soluble guanylate cyclase and extracellular responsive kinase signaling pathways. J. Neurosci. Res. 86, 2028–2038. doi: 10.1002/jnr.21640 '''''''' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' '' ''' ''''' '' Hazell, A. S.; and Norenberg, M. D. (1998). Ammonia and manganese increase arginine uptake in cultured astrocytes. Neurochem. Res. 23, 869–873. '' '' ' ' ''' ''''' ''' ''''' '' '' ''' ''''' '' Sengupta, A.; Mense, S. M.; Lan, C.; Zhou, M.; Mauro, R. E.; Kellerman, L., és mtsai. (2007). Gene expression profiling of human primary astrocytes exposed to manganese chloride indicates selective effects on several functions of the cells. Neurotoxicology 28, 478–489. doi: 10.1016/j.neuro.2006.10.005 '' '' ''''' ''' ''' ''''' ''' ''' '' '' ''' ''''' '' ''Bak, L. K.; Schousboe, A.; and Waagepetersen, H. S. (2006). The glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer. J. Neurochem. 98, 641–653. doi: 10.1111/j.1471-4159.2006. 03913.x '' '' ' ' ''' ''''' ''' '''''''' '' ''''' '' ''' ''''' '' Sidoryk-Wegrzynowicz, M.; and Aschner, M. (2013). Manganese toxicity in the central nervous system: the glutamine/glutamate-gamma-aminobutyric acid cycle. J. Intern. Med. 273, 466–477. doi: 10.1111/joim.12040 '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' '' ' '' ''''' '' ''Diagnosztika:' '' '' ' ''''' ''' ''''' ''' '' '' '' ' '' '' Fahn, S., Elton, R.L., Members of the UPDRS Development Committee, 1987. Unified Parkinson’s disease rating scale. In: Fahn, S., Marsden, C.D., Goldstein, M., Calne, D.B. (Eds.), Recent Developments in Parkinson’s Disease. Macmillan, New York, pp. 153–163. '' '' ''''' ''' ''' ''''' ''' ''' ''' '''''''' '' ''''' '' ''' ''''' '' Criswell, S., Sterling, C., Swisher, L., Evanoff, B., Racette, B.A., 2010. Sensitivity and specificity of the finger tapping task for the detection of psychogenic movement disorders. Parkinsonism Relat. Disord. 16 (3), 197–201. '' '' ' ''''' ''' ''''' ''' ''' ''' ''''' '' '' ' '' ''''' '' ''Racette, B.A., Criswell, S.R., Lundin, J.I., Hobson, A., Seixas, N., Kotzbauer, P.T., Evanoff, B.A., Perlmutter, J.S., Zhang, J., Sheppard, L., Checkoway, H., 2012. Increased risk of parkinsonism associated with welding exposure. Neurotoxicology 33 (5), 1356–1361. '' '' ''''' ''' ''' ''''' ''' ''' '' ' ''''' '' '' ''''''' ''''' ''''' '' '''Jenkinson, C., Fitzpatrick, R., Peto, V., Greenhall, R., Hyman, N., 1997. The Parkinson’s Disease Questionnaire (PDQ-39): development and validation of a Parkinson’s disease summary index score. Age Ageing 26 (5), 353–357. '''''''' '' ' ' ''''''' ''''' ''' '''''''' ' ''''' '' '' ''' ''''' ''''' ''''' '''Duarte, J., Claveria, L.E., Pedro-Cuesta, J., Sempere, A.P., Coria, F., Calne, D.B., 1995. Screening Parkinson’s disease: a validated questionnaire of high specificity and sensitivity. Mov. Disord. 10 (5), 643–649. '' '' ''''' ''' ''' ''''' ''' ''' ''' ''' ''''' '' '' ''' ''''' ''''' ''''' '''''Hobson, A.J., Sterling, D.A., Emo, B., Evanoff, B.A., Sterling, C.S., Good, L., Seixas, N., Checkoway, H., Racette, B.A., 2009. Validity and reliability of an occupational exposure questionnaire for parkinsonism in welders. J. Occup. Environ. Hyg. 6 (6), 324–331. '''''''' '' ' ' ''''' ''''' ''' ''' ''''' '' ''' ''''' '' ''' ''''' ''''' ''''' '''Checkoway, H., Powers, K., Smith-Weller, T., Franklin, G.M., Longstreth Jr., W.T., Swanson, P.D., 2002. Parkinson’s disease risks associated with cigarette smoking, alcohol consumption, and caffeine intake. Am. J. Epidemiol. 155 (8), 732–738. '' '' ''''' ''' ''' ''''' ''' ''' '' ''''' '' ''' ''''' '' ''' ''''' ''''' ''''' '''''Racette, B.A., Searles Nielsen, S., Criswell, S.R., Sheppard, L., Seixas, N., Warden, M.N., Checkoway, H., 2017. Dose-dependent progression of parkinsonism in manganese-exposed welders. Neurology 88 (4), 344–351. '''''''' '' ' ' ''''' ''''' ''' '' ''''' ''''' ''' ''''' ''' ''' ''' ''''' ''''' ''''' '''Bowler, R.M., Gysens, S., Diamond, E., Nakagawa, S., Drezgic, M., Roels, H.A., 2006. Manganese exposure: neuropsychological and neurological symptoms and effects in welders. Neurotoxicology 27 (3), 315–326. '' '' ''''' ''' ''' ''''' ''' ''' ''' ''''' ''''' ''' ''''' ''' ''' ''' ''''' ''''' ''''' '''''Bowler, R.M., Nakagawa, S., Drezgic, M., Roels, H.A., Park, R.M., Diamond, E., Mergler, D., Bouchard, M., Bowler, R.P., Kollerg, W., 2007. Sequelae of fume exposure in confined space welding: a neurological and neuropsychological case series. Neurotoxicology 28 (2), 298–311. '''''''' '' ' ''''' ''' ''''' ''' ''' ''' ''''' ''' ''''' ''' ''' ''' ''''' ''''' ''''' Mergler, D., Huel, G., Bowler, R., Iregren, A., Belanger, S., Baldwin, M., Tardif, R., Smargiassi, A., Martin, L., 1994. Nervous system dysfunction among workers with long-term exposure to manganese. Environ. Res. 64 (2), 151–180. '' '' ''''' ''' ''' ''''' ''' ''' '' ' ''''' ''' '' ''' ''' ''' ''''' ''''' ''''' '''''Rascol, O., Fitzer-Attas, C.J., Hauser, R., Jankovic, J., Lang, A., Langston, J.W., Melamed, E., Poewe, W., Stocchi, F., Tolosa, E., Eyal, E., Weiss, Y.M., Olanow, C.W., 2011. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease (the ADAGIO study): prespecified and post-hoc analyses of the need for additional therapies, changes in UPDRS scores, and non-motor outcomes. Lancet Neurol.10 (5), 415–423. '''''''' '' ' ' ''''' ''''' ''' '' ' ''''' ''' '' ''''' ''' ''' ''''' ''' ''' ''Parkinson Study Group, 1996. Impact of deprenyl and tocopherol treatment on Parkinson’s disease in DATATOP patients requiring levodopa. Ann. Neurol. 39, 37–45. '' '' ''''' ''' ''' ''''' ''' ''' ''' ''' ''''' ''' '' ' ''' ''' ''''' ''' '''Myers, J.E., Fine, J., Ormond-Brown, D., Fry, J., Thomson, A., Thompson, M.L., 2009. Estimating the prevalence of clinical manganism using a cascaded screening process in a South African manganese smelter. Neurotoxicology 30 (6), 934– 940. '' '' ' ' ' ''''' ''' ''' ''''' ''' '' ' ''' ''''' '''Criswell, S.R., Perlmutter, J.S., Huang, J.L., Golchin, N., Flores, H.P., Hobson, A., Aschner, M., Erikson, K.M., Checkoway, H., Racette, B.A., 2012. Basal ganglia intensity indices and diffusion weighted imaging in manganese-exposed welders. Occup. Environ. Med. 69 (6), 437–443. '' '' ''''' ''' ''' ''''' ''' ''' '' ''''' ''' '' ''''' ''' ''''' ''' ''''' '''Nelson, K., Golnick, J., Korn, T., Angle, C., 1993. Manganese encephalopathy: utility of early magnetic resonance imaging. Br. J. Ind. Med. 50 (6), 510–513. '' '' ' ' ' ''''' ''' '''''''' ''''' '' ''''' ''' ''''' ''' ''' ''' ''' ''''' ''' ''' '' ''''' '' ''''''' ''' ''''' ''''' Kísérlet:' '' '' ' ' ''' ''''' ''' ''''' ''''' '' ''''''' ''' ''''' ''''' '''__Felhasznát irodalom__: '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''' ''''' '' ''Moreno, J. A., Streifel, K. M., Sullivan, K. A., Hanneman, W. H., Tjalkens, R. B.: Manganese-Induced NF-jB Activation and Nitrosative Stress Is Decreased by Estrogen in Juvenile Mice. Toxicological Scienses, 122 : (1) 121-133, 2011 '' '' ' ' ' ''''' ''' ''''' '' ''''''' '' ''''' ''__Referenciák__: '' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' '' '' '''Bouchard, M. F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M. E., Bouffard, T., Limoges, E., Bellinger, D. C., and Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect. 119, 138–143. '''''''' '' ' ''''''' ''' ''''' ''' ''''' ''''' '' ' '' '' Callier, S., Morissette, M., Grandbois, M., Pelaprat, D., and Di Paolo, T. (2001). Neuroprotective properties of 17beta-estradiol, progesterone, and raloxifene in MPTP C57Bl/6 mice. Synapse. 41, 131–138. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''''' '' ''''' '''''Collipp, P. J., Chen, S. Y., and Maitinsky, S. (1983). Manganese in infant formulas and learning disability. Ann. Nutr. Metab. 27, 488–494. '' '' ' ''''' ''' ''''' ''' ''''' '' ' ''''' ''' ''''' ''''' '''He, P., Liu, D. H., and Zhang, G. Q. (1994). [Effects of high-level-manganese sewage irrigation on children’s neurobehavior]. Zhonghua Yu Fang Yi Xue Za Zhi. 28, 216–218. '' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''''' ''' '' ''''' ''Liu, X., Sullivan, K. A., Madl, J. E., Legare, M., and Tjalkens, R. B. (2006). Manganese-induced neurotoxicity: the role of astroglial-derived nitric oxide in striatal interneuron degeneration. Toxicol. Sci. 91, 521–531. '' '' ' ' ''' ''''' ''' ''''' ''''' '' ' ''''' ''' '' ''''' '''''Moreno, J. A., Streifel, K. M., Sullivan, K. A., Legare, M. E., and Tjalkens, R. B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci. 112, 405–415. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' ''' ''''' ''''' Moreno, J. A., Yeomans, E. C., Streifel, K. M., Brattin, B. L., Taylor, R. J., and Tjalkens, R. B. (2009b). Age-dependent susceptibility to manganese-induced neurological dysfunction. Toxicol. Sci. 112, 394–404. '' '' ' ' ' ''''' ''' ''''' '' ''''' ''' ''''' '' '''Murray, H. E., Pillai, A. V., McArthur, S. R., Razvi, N., Datla, K. P., Dexter, D. T., and Gillies, G. E. (2003). Dose- and sex-dependent effects of the neurotoxin 6-hydroxydopamine on the nigrostriatal dopaminergic pathway of adult rats: differential actions of estrogen in males and females. Neuroscience. 116, 213–222. '''''''' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ''''' ''' ''''' '' '''''Pihl, R. O., and Parkes, M. (1977). Hair element content in learning disabled children. Science. 198, 204–206. '''''''' '' ' ''''' ''' ''''' ''' ''''' ''''' '' ''''' ''' '''''''' ''''' '' Tripanichkul, W., Sripanichkulchai, K., and Finkelstein, D. I. (2006). Estrogen down-regulates glial activation in male mice following 1-methyl-4phenyl-1,2,3,6-tetrahydropyridine intoxication. Brain Res 1084, 28–37. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' ''' '''''''' ''''' '' |
[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#bib0225]] __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Sarka]]r__, S.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Malovi]]c__, E.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Harischandr]]a__, D. S.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Ngw]]a__, H. A.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Ghos]]h__, A.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Hoga]]n__, C.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Roka]]d__, D.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Zenitsk]]y__, G.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Ji]]n__, H.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Ananthara]]m__, V.; __[[https://www.sciencedirect.com/science/article/pii/S0161813X17300943#!|Kanthasam]]y__, A. G., (2017): Manganese exposure induces neuroinflammation by impairing mitochondrial dynamics in astrocytes. '''[[https://www.sciencedirect.com/science/journal/0161813X|NeuroToxicology]], '''[[https://www.sciencedirect.com/science/journal/0161813X/64/supp/C|Volume 64]], January 2018, Pages 204-218 '''''https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full '''''''' '' ''''' ''' ''' ''''' '' '' ' ''''' ''' '' ''''''' ''''' '' ''''' ''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 '' '' ' ' ''''' ''''' '' '' ''''' ''' ''''' ''' '' ''''' ''' ''''' '' ''''' '''''https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-017-0871-0 ' ''''''' ''''' '' '' ' ' '' ''''''' ''''' ''''' ''' '''''''' '' ''''' ''Kirkley, K. S.; Popichak, K. A.; Afzali, M. F. ''et al.'' Microglia amplify inflammatory activation of astrocytes in manganese neurotoxicity. ''J Neuroinflammation'' '''''14, '''99 (2017). https://doi.org/10.1186/s12974-017-0871-0 ''' ''' ''''' ''' ''' '''''''' ' ' '' ''''''' '' ''''' '' '' ''''' '''__Referenciák__':' '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' '' ''' '' ''''' ''' ''' '' ''''' Karki, P.; Lee, E.; Aschner, M., (2013): Manganese neurotoxicity: a focus on glutamate transporters; Ann. Occup. Environ. Med., 25 (1) (2013), p. 4 Erikson, K. M.; and Aschner, M. (2006). Increased manganese uptake by primary astrocyte cultures with altered iron status is mediated primarily by divalent metal transporter. Neurotoxicology 27, 125–130. doi: 10.1016/j.neuro.2005. 07.003 '' '' ' ' ' ''''' ''' ''''' '' ' ''''' ''' ''''' ''''' ''' ''' '' ''''' Huang, C. C. (2007). Parkinsonism induced by chronic manganese intoxication–an experience in Taiwan. Chang Gung Med. J. 30, 385–395. '' '' ''''' ''' ''' ''''' ''' ''' '' ' ''''' ''' '' ''''' ''' ''' '' ''''' '''''Perl, D. P.; and Olanow, C. W. (2007). The neuropathology of manganese-induced Parkinsonism. J. Neuropathol. Exp. Neurol. 66, 675–682. doi: 10.1097/nen. 0b013e31812503cf '' '' ' ' ' ''''' ''' '' ' ''''' ''' '' ''''' ''' '' ''''' '''''Cordova, F. M.; Aguiar, A. S. Jr.; Peres, T. V.; Lopes, M. W.; Gonçalves, F. M.; Pedro, D. Z., és mtsai. (2013). Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox. Arch. Toxicol. 87, 1231–1244. doi: 10.1007/s00204-013-1017-5 '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' ''' ''''' ''''' ''' '' ''''' Carson, M. J.; Bilousova, T. V.; Puntambekar, S. S.; Melchior, B.; Doose, J. M.; and Ethell, I. M. (2007). A rose by any other name? The potential consequences of microglial heterogeneity during CNS health and disease. Neurotherapeutics 4, 571–579. doi: 10.1016/j.nurt.2007.07.002 '' '' ' ''''' ''' ''''' ''' ''''' '' ' ''''' ''' '''''''' ''' ''''' ''''' ''' '' ''''' ''Tansey, M. G.; Frank-Cannon, T. C.; Mccoy, M. K.; Lee, J. K.; Martinez, T. N.; Mcalpine, F. E., és mtsai. (2008). Neuroinflammation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy? Front. Biosci. 13, 709–717. doi: 10.1007/s11481-009-9176-0 '' '' ''''' ''' ''' ''''' ''' ''' '' ' ''''' ''' ''''' ''' ''''' ''''' ''' '' ''''' '''Mogi, M.; Harada, M.; Kondo, T.; Riederer, P.; Inagaki, H.; Minami, M., és mtsai. (1994). Interleukin-1 beta, interleukin-6, epidermal growth factor and transforming growth factor-alpha are elevated in the brain from Parkinsonian patients. Neurosci. Lett. 180, 147–150. doi: 10.1016/0304-3940(94)90 508-8 '' '' ' ' ''' ''''' ''' '' ' ''''' ''' ''''' ''' ''''' ''''' ''' '' ''''' Przedborski, S.; and Vila, M. (2003). The 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine mouse model: a tool to explore the pathogenesis of Parkinson’s disease. Ann. N. Y. Acad. Sci. 991, 189–198. doi: 10.1111/j.1749-6632.2003.tb07476.x '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' ''' '''''''' ''' ''''' ''''' ''' '' ''''' '''''Ghosh, A.; Roy, A.; Liu, X.; Kordower, J. H.; Mufson, E. J.; Hartley, D. M., és mtsai. (2007). Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proc. Natl. Acad. Sci. U.S.A. 104, 18754–18759. doi: 10.1073/pnas.0704908104 '' '' ' ' ' ''''' ''' ''''' '' ''''' ''' '' ''' '' ''''' ''' '' ''''' ''Miklossy, J.; Doudet, D. D.; Schwab, C.; Yu, S.; Mcgeer, E. G.; and Mcgeer, P. L. (2006). Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys. Exp. Neurol. 197, 275–283. doi: 10.1016/j.expneurol.2005. 10.034 '' '' ''''' ''' ''' ''''' ''' ''' '' ''''' ''' '' ''' '' ''''' ''' '' ''''' Ghosh, A.; Roy, A.; Matras, J.; Brahmachari, S.; Gendelman, H. E.; and Pahan, K. (2009). Simvastatin inhibits the activation of p21ras and prevents the loss of dopaminergic neurons in a mouse model of Parkinson’s disease. J. Neurosci. 29, 13543–13556. doi: 10.1523/JNEUROSCI.4144-09.2009 '' '' ' ' ' ''''' ''' '' ''''' '' ' '' ''''' ''' '' ''''' Wedler, F. C.; and Denman, R. B. (1984). Glutamine synthetase: the major Mn(II) enzyme in mammalian brain. Curr. Top. Cell. Regul. 24, 153–169. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' '' ' '' '' ' '' '' ''Wedler, F. C.; Vichnin, M. C.; Ley, B. W.; Tholey, G.; Ledig, M.; and Copin, J. C. (1994). Effects of Ca(II) ions on Mn(II) dynamics in chick glia and rat astrocytes: potential regulation of glutamine synthetase. Neurochem. Res. 19, 145–151. doi: 10.1007/bf00966809 '' '' ' ''''' ''' ''''' ''' ''''' '' ' '' '' '' ''''''' '' ''''' '''Farina, M.; Avila, D. S.; Da Rocha, J. B.; and Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury. Neurochem. Int. 62, 575–594. doi: 10.1016/j.neuint.2012.12.006 '' '' ''''' ''' ''' ''''' ''' ''' '' ''''''' '' '' '' ' '' '' ''Rama Rao, K. V.; Reddy, P. V.; Hazell, A. S.; and Norenberg, M. D. (2007). Manganese induces cell swelling in cultured astrocytes. Neurotoxicology 28, 807–812. doi: 10.1016/j.neuro.2007.03.001 '' '' ' ''''' ''' ''''' ''' '' ' '' ' ''' ''''' '' '' '''Moreno, J. A.; Sullivan, K. A.; Carbone, D. L.; Hanneman, W. H.; and Tjalkens, R. B. (2008). Manganese potentiates nuclear factor-kappaB-dependent expression of nitric oxide synthase 2 in astrocytes by activating soluble guanylate cyclase and extracellular responsive kinase signaling pathways. J. Neurosci. Res. 86, 2028–2038. doi: 10.1002/jnr.21640 '''''''' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' '' ''' ''''' '' '' ''Hazell, A. S.; and Norenberg, M. D. (1998). Ammonia and manganese increase arginine uptake in cultured astrocytes. Neurochem. Res. 23, 869–873. '' '' ' ' ''' ''''' ''' ''''' '' '' ''' ''''' '' '' ''Sengupta, A.; Mense, S. M.; Lan, C.; Zhou, M.; Mauro, R. E.; Kellerman, L., és mtsai. (2007). Gene expression profiling of human primary astrocytes exposed to manganese chloride indicates selective effects on several functions of the cells. Neurotoxicology 28, 478–489. doi: 10.1016/j.neuro.2006.10.005 '' '' ''''' ''' ''' ''''' ''' ''' '' '' ''' ''''' '' '' Bak, L. K.; Schousboe, A.; and Waagepetersen, H. S. (2006). The glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer. J. Neurochem. 98, 641–653. doi: 10.1111/j.1471-4159.2006. 03913.x '' '' ' ' ''' ''''' ''' '''''''' '' ''''' '' ''' ''''' '' '' ''Sidoryk-Wegrzynowicz, M.; and Aschner, M. (2013). Manganese toxicity in the central nervous system: the glutamine/glutamate-gamma-aminobutyric acid cycle. J. Intern. Med. 273, 466–477. doi: 10.1111/joim.12040 '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' '' ' '' ''''' '' '' Diagnosztika:' '' '' ' ''''' ''' ''''' ''' '' '' '' ' '' '' '' ''Fahn, S., Elton, R.L., Members of the UPDRS Development Committee, 1987. Unified Parkinson’s disease rating scale. In: Fahn, S., Marsden, C.D., Goldstein, M., Calne, D.B. (Eds.), Recent Developments in Parkinson’s Disease. Macmillan, New York, pp. 153–163. '' '' ''''' ''' ''' ''''' ''' ''' ''' '''''''' '' ''''' '' ''' ''''' '' '' ''Criswell, S., Sterling, C., Swisher, L., Evanoff, B., Racette, B.A., 2010. Sensitivity and specificity of the finger tapping task for the detection of psychogenic movement disorders. Parkinsonism Relat. Disord. 16 (3), 197–201. '' '' ' ''''' ''' ''''' ''' ''' ''' ''''' '' '' ' '' ''''' '' '' Racette, B.A., Criswell, S.R., Lundin, J.I., Hobson, A., Seixas, N., Kotzbauer, P.T., Evanoff, B.A., Perlmutter, J.S., Zhang, J., Sheppard, L., Checkoway, H., 2012. Increased risk of parkinsonism associated with welding exposure. Neurotoxicology 33 (5), 1356–1361. '' '' ''''' ''' ''' ''''' ''' ''' '' ' ''''' '' '' ''''''' ''''' ''''' '' ''''' ''Jenkinson, C., Fitzpatrick, R., Peto, V., Greenhall, R., Hyman, N., 1997. The Parkinson’s Disease Questionnaire (PDQ-39): development and validation of a Parkinson’s disease summary index score. Age Ageing 26 (5), 353–357. '' '' ' ' ' ''''' ''' '' ' ''''' '' '' ''' ''''' ''''' ''''' ''''' ''Duarte, J., Claveria, L.E., Pedro-Cuesta, J., Sempere, A.P., Coria, F., Calne, D.B., 1995. Screening Parkinson’s disease: a validated questionnaire of high specificity and sensitivity. Mov. Disord. 10 (5), 643–649. '' '' ''''' ''' ''' ''''' ''' ''' ''' ''' ''''' '' '' ''' ''''' ''''' ''''' ''''' Hobson, A.J., Sterling, D.A., Emo, B., Evanoff, B.A., Sterling, C.S., Good, L., Seixas, N., Checkoway, H., Racette, B.A., 2009. Validity and reliability of an occupational exposure questionnaire for parkinsonism in welders. J. Occup. Environ. Hyg. 6 (6), 324–331. '' '' ' ' ''''' ''''' ''' ''' ''''' '' ''' ''''' '' ''' ''''' ''''' ''''' ''''' ''Checkoway, H., Powers, K., Smith-Weller, T., Franklin, G.M., Longstreth Jr., W.T., Swanson, P.D., 2002. Parkinson’s disease risks associated with cigarette smoking, alcohol consumption, and caffeine intake. Am. J. Epidemiol. 155 (8), 732–738. '' '' ''''' ''' ''' ''''' ''' ''' '' ''''' '' ''' ''''' '' ''' ''''' ''''' ''''' ''''' Racette, B.A., Searles Nielsen, S., Criswell, S.R., Sheppard, L., Seixas, N., Warden, M.N., Checkoway, H., 2017. Dose-dependent progression of parkinsonism in manganese-exposed welders. Neurology 88 (4), 344–351. '' '' ' ' ''''' ''''' ''' '' ''''' ''''' ''' ''''' ''' ''' ''' ''''' ''''' ''''' ''''' ''Bowler, R.M., Gysens, S., Diamond, E., Nakagawa, S., Drezgic, M., Roels, H.A., 2006. Manganese exposure: neuropsychological and neurological symptoms and effects in welders. Neurotoxicology 27 (3), 315–326. '' '' ''''' ''' ''' ''''' ''' ''' ''' ''''' ''''' ''' ''''' ''' ''' ''' ''''' ''''' ''''' ''''' Bowler, R.M., Nakagawa, S., Drezgic, M., Roels, H.A., Park, R.M., Diamond, E., Mergler, D., Bouchard, M., Bowler, R.P., Kollerg, W., 2007. Sequelae of fume exposure in confined space welding: a neurological and neuropsychological case series. Neurotoxicology 28 (2), 298–311. '' '' ' ''''' ''' ''''' ''' ''' ''' ''''' ''' ''''' ''' ''' ''' ''''' ''''' ''''' ''''' '''''Mergler, D., Huel, G., Bowler, R., Iregren, A., Belanger, S., Baldwin, M., Tardif, R., Smargiassi, A., Martin, L., 1994. Nervous system dysfunction among workers with long-term exposure to manganese. Environ. Res. 64 (2), 151–180. '''''''' '' ''''' ''' ''' ''''' ''' ''' '''''''' ' ''''' ''' '''''''' ''' ''' ''' ''''' ''''' ''''' ''''' Rascol, O., Fitzer-Attas, C.J., Hauser, R., Jankovic, J., Lang, A., Langston, J.W., Melamed, E., Poewe, W., Stocchi, F., Tolosa, E., Eyal, E., Weiss, Y.M., Olanow, C.W., 2011. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease (the ADAGIO study): prespecified and post-hoc analyses of the need for additional therapies, changes in UPDRS scores, and non-motor outcomes. Lancet Neurol.10 (5), 415–423. '' '' ' ' ''''' ''''' ''' '' ' ''''' ''' '' ''''' ''' ''' ''''' ''' ''' ''''' '''Parkinson Study Group, 1996. Impact of deprenyl and tocopherol treatment on Parkinson’s disease in DATATOP patients requiring levodopa. Ann. Neurol. 39, 37–45. '' '' ''''' ''' ''' ''''' ''' ''' ''' ''' ''''' ''' '''''''' ' ''' ''' ''''' ''' ''''' ''Myers, J.E., Fine, J., Ormond-Brown, D., Fry, J., Thomson, A., Thompson, M.L., 2009. Estimating the prevalence of clinical manganism using a cascaded screening process in a South African manganese smelter. Neurotoxicology 30 (6), 934– 940. '' '' ' ' ' ''''' ''' ''' ''''' ''' '''''''' ' ''' ''''' ''''' ''Criswell, S.R., Perlmutter, J.S., Huang, J.L., Golchin, N., Flores, H.P., Hobson, A., Aschner, M., Erikson, K.M., Checkoway, H., Racette, B.A., 2012. Basal ganglia intensity indices and diffusion weighted imaging in manganese-exposed welders. Occup. Environ. Med. 69 (6), 437–443. '' '' ''''' ''' ''' ''''' ''' ''' '' ''''' ''' '' ''''' ''' ''''' ''' ''''' ''''' ''Nelson, K., Golnick, J., Korn, T., Angle, C., 1993. Manganese encephalopathy: utility of early magnetic resonance imaging. Br. J. Ind. Med. 50 (6), 510–513. '' '' ' ' ' ''''' ''' '' ''''' '' ''''' ''' ''''' ''' ''''' '' ''' ''' ''''' ''' ''' '' ''''' '' ' ''' ''''' ''''' ''''' '''''Kísérlet:' '''''''' '' ' ' ''''''' ''''' ''' ''''' ''''' '' ' ''' ''''' ''''' ''''' ''__Felhasznát irodalom__: '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''''' ''''' '' ''''' '''Moreno, J. A., Streifel, K. M., Sullivan, K. A., Hanneman, W. H., Tjalkens, R. B.: Manganese-Induced NF-jB Activation and Nitrosative Stress Is Decreased by Estrogen in Juvenile Mice. Toxicological Scienses, 122 : (1) 121-133, 2011 '' '' ' ' ' ''''' ''' ''''' '' ' '' ''''' ''''' '''__Referenciák__: '' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' '' '' ''''' ''Bouchard, M. F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M. E., Bouffard, T., Limoges, E., Bellinger, D. C., and Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect. 119, 138–143. '' '' ' ' ''' ''''' ''' ''''' ''''' '' ' '' '' ''''' '''''Callier, S., Morissette, M., Grandbois, M., Pelaprat, D., and Di Paolo, T. (2001). Neuroprotective properties of 17beta-estradiol, progesterone, and raloxifene in MPTP C57Bl/6 mice. Synapse. 41, 131–138. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' '' ''''' ''''' Collipp, P. J., Chen, S. Y., and Maitinsky, S. (1983). Manganese in infant formulas and learning disability. Ann. Nutr. Metab. 27, 488–494. '' '' ' ''''' ''' ''''' ''' ''''' '' ' ''''' ''' ''''' ''''' ''''' ''He, P., Liu, D. H., and Zhang, G. Q. (1994). [Effects of high-level-manganese sewage irrigation on children’s neurobehavior]. Zhonghua Yu Fang Yi Xue Za Zhi. 28, 216–218. '' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''''' ''' '' ''''' ''''' '''Liu, X., Sullivan, K. A., Madl, J. E., Legare, M., and Tjalkens, R. B. (2006). Manganese-induced neurotoxicity: the role of astroglial-derived nitric oxide in striatal interneuron degeneration. Toxicol. Sci. 91, 521–531. '' '' ' ' ''' ''''' ''' ''''' ''''' '' ' ''''' ''' '' ''''' ''''' Moreno, J. A., Streifel, K. M., Sullivan, K. A., Legare, M. E., and Tjalkens, R. B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci. 112, 405–415. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ' ''''' ''' ''''' ''''' ''''' '''''Moreno, J. A., Yeomans, E. C., Streifel, K. M., Brattin, B. L., Taylor, R. J., and Tjalkens, R. B. (2009b). Age-dependent susceptibility to manganese-induced neurological dysfunction. Toxicol. Sci. 112, 394–404. '''''''' '' ' ' ' ''''' ''' ''''' '' ''''' ''' ''''' '' ''''' ''Murray, H. E., Pillai, A. V., McArthur, S. R., Razvi, N., Datla, K. P., Dexter, D. T., and Gillies, G. E. (2003). Dose- and sex-dependent effects of the neurotoxin 6-hydroxydopamine on the nigrostriatal dopaminergic pathway of adult rats: differential actions of estrogen in males and females. Neuroscience. 116, 213–222. '' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ''''' ''' ''''' '' ''''' Pihl, R. O., and Parkes, M. (1977). Hair element content in learning disabled children. Science. 198, 204–206. '' '' ' ''''' ''' ''''' ''' ''''' ''''' '' ''''' ''' '' ''''' '' ''''' '''''Tripanichkul, W., Sripanichkulchai, K., and Finkelstein, D. I. (2006). Estrogen down-regulates glial activation in male mice following 1-methyl-4phenyl-1,2,3,6-tetrahydropyridine intoxication. Brain Res 1084, 28–37. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' ''' '' ''''' '' ''''' |
| Line 365: | Line 387: |
| ''1. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' '' ''''' ''' '' ''''' '' ''' ''''' . '''''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654; figure 5. '''''''' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''' '' ''''' '' ''''' 2. ábra: '' '' ' ''''' ''' ''''' ''' ''''' ''''' '' ' ''' '''''''' ''''' '' . ''Manganit, piroluzit és egyéb mangánércek az úrkúti mangánérc-bánya meddőhányóiról; Horváth András gyűjtése és fényképe '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' ''' '' ''''' '' ''' ''''' ''3. ábra, (újrarajzolt): '' '' ' ' ' ''''' ''' ''''' '' ' ''''' ''''' '' ''''' . ''[[https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system:-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1|https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system%3A-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1]] ' ' ''' ''''' ''' ''' ''''' '' ' '' '' '' ''''' '''''4. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' . ''https://faculty.virginia.edu/.archived/metals/cases/corson1.html '' '' https://www.sciencedirect.com/science/article/pii/S0020169307005464#fig1 ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''''' ''' '' '' ''' ''''' '''5. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' ''''' '' ' ''''' ''' '' '' '' ''''' . '''''https://stke.sciencemag.org/content/12/563/eaat9900.full '' '' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900; figure 7. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' '''''6. ábra: '''''''' '' ' ' ' ''''' ''' ''''' '' ''''' ''' ''''' ''''' ''' ''''' . ''https://www.pxfuel.com/en/free-photo-ozirv ' ''' ''' ''''' ''' ''' ''''' '' ''''' ''' ''''' ''''' ''' ''''' '''''7. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' . ''https://upload.wikimedia.org/wikipedia/commons/8/81/Quercetin.svg ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ''''' ''' '' '' ''' ''''' '''''8. ábra, (újrarajzolt): '' '' ''''' ''' ''''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' . ''https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click%20on%20image%20to%20zoom&p=PMC3&id=5618638_ijms-18-01989-g012.jpg '' '' Entaz Bahar., Ji-Ye Kim., Hyonok Yoon.,Quercetin Attenuates Manganese-Induced Neuroinflammation by Alleviating Oxidative Stress through Regulation of Apoptosis, iNOS/NF-κB and HO-1/Nrf2 Pathways; pii: E1989. doi: 10.3390/ijms18091989. ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''''' ''' '' '' ''' ''''' |
'''1. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' '' ''''' ''' '' ''''' '' ''' ''''' ''''' . Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654; figure 5. '' '' ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''' '''''''' ''''' '' ''''' ''''' '''''2. ábra: '''''''' '' ' ''''' ''' ''''' ''' ''''' ''''' '' ' ''' '' ''''' '' ''''' . '''Manganit, piroluzit és egyéb mangánércek az úrkúti mangánérc-bánya meddőhányóiról; Horváth András gyűjtése és fényképe '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' ''' '' ''''' '' ''' ''''' ''''' '''3. ábra, (újrarajzolt): '' '' ' ' ' ''''' ''' ''''' '' ' ''''' ''''' '' ''''' ''''' . '''[[https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system:-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1|https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system%3A-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1]] ' ' ''' ''''' ''' ''' ''''' '' ' '' '' '' ''''' ''''' 4. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' ''''' . '''https://faculty.virginia.edu/.archived/metals/cases/corson1.html '' '' https://www.sciencedirect.com/science/article/pii/S0020169307005464#fig1 ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''''' ''' '' '' ''' ''''' ''''' ''5. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' ''''' '' ' ''''' ''' '' '' '' ''''' ''''' . https://stke.sciencemag.org/content/12/563/eaat9900.full '' '' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900; figure 7. '' '' ''''' ''' ''' ''''' ''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' ''''' 6. ábra: '' '' ' ' ' ''''' ''' ''''' '' ''''' ''' ''''' ''''' ''' ''''' ''''' . '''https://www.pxfuel.com/en/free-photo-ozirv ' ''' ''' ''''' ''' ''' ''''' '' ''''' ''' ''''' ''''' ''' ''''' ''''' 7. ábra, (újrarajzolt): '' '' ' ''''' ''' ''''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' ''''' . '''https://upload.wikimedia.org/wikipedia/commons/8/81/Quercetin.svg ''''' ''' ''' ''''' ''' ''' ''''' ''''' '' ''''' ''' '' '' ''' ''''' ''''' 8. ábra, (újrarajzolt): '' '' ''''' ''' ''''' ''' ''''' '' ''''' ''''' ''' ''''' '' ''' ''''' ''''' . '''[[https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click%20on%20image%20to%20zoom&p=PMC3&id=5618638_ijms-18-01989-g012.jpg|https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click%20on%20image%20to%20zoom&p=PMC3&id=5618638_ijms-18-01989-g012.jpg]] '' '' Entaz Bahar., Ji-Ye Kim., Hyonok Yoon.,Quercetin Attenuates Manganese-Induced Neuroinflammation by Alleviating Oxidative Stress through Regulation of Apoptosis, iNOS/NF-κB and HO-1/Nrf2 Pathways; pii: E1989. doi: 10.3390/ijms18091989. ''' ''' ''''' ''' ''' ''''' ''''' '' ' ''''' ''' '' '' ''' ''''' |
| Line 412: | Line 435: |
| '''''__Referenciák:__ '' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''' ''14.Freeman, L. C.; Ting, J. P.-Y. The pathogenic role of the inflammasome in neurodegenerative diseases. J. Neurochem. 136, 29–38 (2015). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''''' 15.Halle, A.; Hornung, V.; Petzold, G. C.; Stewart, C. R.; Monks, B. G.; Reinheckel, T.; Fitzgerald, K. A.; Latz, E.; Moore, K. J.; Golenbock, D.T.; The NALP3 inflammasome is involved in the innate immune response to amyloid-. Nat. Immunol. 9, 857–865 (2008). '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '''''16.Codolo, G.; Plotegher, N.; Pozzobon, T.; Brucale, M.; Tessari, I.; Bubacco, L.; de Bernard, M.; Triggering of inflammasome by aggregated –synuclein, an inflammatory response in synucleinopathies. PLOS ONE 8, e55375 (2013). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' '''17.Zhou, R.; Yazdi, A.S.; Menu, P.; Tschopp, J.; A role for mitochondria in NLRP3 inflammasome activation. Nature 469, 221–225 (2011). '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' 18. Alfonso-Loeches, S.; Ureña-Peralta, J. R.; Morillo-Bargues, M. J.; Oliver-De La Cruz, J.; Guerri, C.; Role of mitochondria ROS generation in ethanol-induced NLRP3 inflammasome activation and cell death in astroglial cells. Front. Cell. Neurosci. 8, 216 (2014). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''19.Franklin, B. S.; Bossaller, L.; De Nardo, D.; Ratter, J. M.; Stutz, A.; Engels, G.; Brenker, C.; Nordhoff, M.; Mirandola, S.R.; Al-Amoudi, A.; Mangan, M.S.; Zimmer, S.; Monks, B.G.; Fricke, M.; Schmidt, R. E.; Espevik, T.; Jones, B.; Jarnicki, A. G.; Hansbro, P. M.; Busto, P.; Marshak-Rothstein, A.; Hornemann, S.; Aguzzi, A.; Kastenmüller, W.; Latz, E.; The adaptor ASC has extracellular and ‘prionoid’ activities that propagate inflammation. Nat. Immunol. 15, 727–737 (2014). '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''26.Milatovic, D.; Yin, Z.; Gupta, R. C.; Sidoryk, M.; Albrecht, J.; Aschner, J. L.; M. Aschner, Manganese induces oxidative impairment in cultured rat astrocytes. Toxicol. Sci. 98, 198–205 (2007). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' 34.Yin, Z.; Aschner, J.L.; dos Santos, A.P.; Aschner, M.: Mitochondrial-dependent manganese neurotoxicity in rat primary astrocyte cultures. Brain Res. 1203, 1–11 (2008). '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' '''43.Sarkar, S.; Malovic, E.; Harishchandra, D. S.; Ghaisas, S.; Panicker, N.; Charli, A.; Palanisamy, B. N.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A.; Kanthasamy, A. G.: Mitochondrial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease. NPJ Parkinsons Dis. 3, 30 (2017). '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' '''''50. J. A. Roth, C. Horbinski, D. Higgins, P. Lein, M. D. Garrick, Mechanisms of manganeseinduced rat pheochromocytoma (PC12) cell death and cell differentiation. Neurotoxicology 23, 147–157 (2002). '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' ''' ''''' |
'''''__Referenciák:__ '' '' ' ''''''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''' ''' '''''14.Freeman, L. C.; Ting, J. P.-Y. The pathogenic role of the inflammasome in neurodegenerative diseases. J. Neurochem. 136, 29–38 (2015). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''''' ''' '''15.Halle, A.; Hornung, V.; Petzold, G. C.; Stewart, C. R.; Monks, B. G.; Reinheckel, T.; Fitzgerald, K. A.; Latz, E.; Moore, K. J.; Golenbock, D.T.; The NALP3 inflammasome is involved in the innate immune response to amyloid-. Nat. Immunol. 9, 857–865 (2008). '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''16.Codolo, G.; Plotegher, N.; Pozzobon, T.; Brucale, M.; Tessari, I.; Bubacco, L.; de Bernard, M.; Triggering of inflammasome by aggregated –synuclein, an inflammatory response in synucleinopathies. PLOS ONE 8, e55375 (2013). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' 17.Zhou, R.; Yazdi, A.S.; Menu, P.; Tschopp, J.; A role for mitochondria in NLRP3 inflammasome activation. Nature 469, 221–225 (2011). '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''18. Alfonso-Loeches, S.; Ureña-Peralta, J. R.; Morillo-Bargues, M. J.; Oliver-De La Cruz, J.; Guerri, C.; Role of mitochondria ROS generation in ethanol-induced NLRP3 inflammasome activation and cell death in astroglial cells. Front. Cell. Neurosci. 8, 216 (2014). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' '''''19.Franklin, B. S.; Bossaller, L.; De Nardo, D.; Ratter, J. M.; Stutz, A.; Engels, G.; Brenker, C.; Nordhoff, M.; Mirandola, S.R.; Al-Amoudi, A.; Mangan, M.S.; Zimmer, S.; Monks, B.G.; Fricke, M.; Schmidt, R. E.; Espevik, T.; Jones, B.; Jarnicki, A. G.; Hansbro, P. M.; Busto, P.; Marshak-Rothstein, A.; Hornemann, S.; Aguzzi, A.; Kastenmüller, W.; Latz, E.; The adaptor ASC has extracellular and ‘prionoid’ activities that propagate inflammation. Nat. Immunol. 15, 727–737 (2014). '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '''''26.Milatovic, D.; Yin, Z.; Gupta, R. C.; Sidoryk, M.; Albrecht, J.; Aschner, J. L.; M. Aschner, Manganese induces oxidative impairment in cultured rat astrocytes. Toxicol. Sci. 98, 198–205 (2007). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' '''34.Yin, Z.; Aschner, J.L.; dos Santos, A.P.; Aschner, M.: Mitochondrial-dependent manganese neurotoxicity in rat primary astrocyte cultures. Brain Res. 1203, 1–11 (2008). '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' 43.Sarkar, S.; Malovic, E.; Harishchandra, D. S.; Ghaisas, S.; Panicker, N.; Charli, A.; Palanisamy, B. N.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A.; Kanthasamy, A. G.: Mitochondrial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease. NPJ Parkinsons Dis. 3, 30 (2017). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''50. J. A. Roth, C. Horbinski, D. Higgins, P. Lein, M. D. Garrick, Mechanisms of manganeseinduced rat pheochromocytoma (PC12) cell death and cell differentiation. Neurotoxicology 23, 147–157 (2002). '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ' ''' ''''' |
| Line 438: | Line 461: |
| '''''59. F. Martinon, V. Pétrilli, A. Mayor, A. Tardivel, J. Tschopp, Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 440, 237–241 (2006). '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''' ''''' '''60. C. Dostert, V. Pétrilli, R. Van Bruggen, C. Steele, B. T. Mossman, J. Tschopp, Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science 320, 674–677 (2008). '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''''' '''61. V. Lawana, N. Singh, S. Sarkar, A. Charli, H. Jin, V. Anantharam, A. G. Kanthasamy, A. Kanthasamy, Involvement of c-Abl kinase in microglial activation of NLRP3 inflammasome and impairment in autolysosomal system. J. Neuroimmune Pharmacol. 12, 624–660 (2017). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''' '''''72. E. Aflaki, N. Moaven, D. K. Borger, G. Lopez, W. Westbroek, J. J. Chae, J. Marugan, S. Patnaik, E. Maniwang, A. N. Gonzalez, E. Sidransky, Lysosomal storage and impaired autophagy lead to inflammasome activation in Gaucher macrophages. Aging Cell 15, 77–88 (2016). '' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''' |
'''''59. F. Martinon, V. Pétrilli, A. Mayor, A. Tardivel, J. Tschopp, Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 440, 237–241 (2006). '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''''''' ''' ''''' ''' 60. C. Dostert, V. Pétrilli, R. Van Bruggen, C. Steele, B. T. Mossman, J. Tschopp, Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science 320, 674–677 (2008). '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' ''''' ''' 61. V. Lawana, N. Singh, S. Sarkar, A. Charli, H. Jin, V. Anantharam, A. G. Kanthasamy, A. Kanthasamy, Involvement of c-Abl kinase in microglial activation of NLRP3 inflammasome and impairment in autolysosomal system. J. Neuroimmune Pharmacol. 12, 624–660 (2017). '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''' ''' ''72. E. Aflaki, N. Moaven, D. K. Borger, G. Lopez, W. Westbroek, J. J. Chae, J. Marugan, S. Patnaik, E. Maniwang, A. N. Gonzalez, E. Sidransky, Lysosomal storage and impaired autophagy lead to inflammasome activation in Gaucher macrophages. Aging Cell 15, 77–88 (2016). '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''' |
| Line 464: | Line 487: |
| '''''__Felhasznált irodalom: __ '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' ''' ''''' https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''''' ''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''''' '''''__Referenciák:__ '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''' ''''' |
'''''__Felhasznált irodalom: __ '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''''''' ''' ''''' ''' '''https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''''' ''''' ''' '''''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 '' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''''' ''''' ''' ''__Referenciák:__ '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ' ''' ''''' |
| Line 476: | Line 499: |
| '''''Luan, X.; Sansanaphongpricha, K.; Myers, I.; Chen, H.; Yuan, H.; and Sun, D. (2017). Engineering exosomes as refined biological nanoplatforms for drug delivery. Acta Pharmacol. Sin. 38, 754–763. doi: 10.1038/aps.2017.12 '' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''' ''Munson, P.; Lam, Y. W.; Macpherson, M.; Beuschel, S.; and Shukla, A. (2018). Mouse serum exosomal proteomic signature in response to asbestos exposure. J. Cell. Biochem. 119, 6266–6273. doi: 10.1002/jcb.26863 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''''' Ngalame, N. N. O.; Luz, A. L.; Makia, N.; and Tokar, E. J. (2018). Arsenic alters exosome quantity and cargo to mediate stem cell recruitment into a cancer stem cell-like phenotype. Toxicol. Sci. 165, 40–49. doi: 10.1093/toxsci/kfy176 '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '''''Harischandra, D. S.; Ghaisas, S.; Rokad, D.; and Kanthasamy, A. G. (2017). Exosomes in toxicology: relevance to chemical exposure and pathogenesis of environmentally linked diseases. Toxicol. Sci. 158, 3–13. doi: 10.1093/toxsci/kfx074 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' '''Harischandra, D. S.; Ghaisas, S.; Rokad, D.; Zamanian, M.; Jin, H.; Anantharam, V., és mtsai. (2018). Environmental neurotoxicant manganese regulates exosome-mediated extracellular miRNAs in cell culture model of Parkinson’s disease: relevance to alpha-synuclein misfolding in metal neurotoxicity. Neurotoxicology 64, 267–277. doi: 10.1016/j.neuro.2017.04.007 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' Harischandra, D. S.; Jin, H.; Anantharam, V.; Kanthasamy, A., and Kanthasamy, A. G. (2015a). alpha-Synuclein protects against manganese neurotoxic insult during the early stages of exposure in a dopaminergic cell model of Parkinson’s disease. Toxicol. Sci. 143, 454–468. doi: 10.1093/toxsci/kfu247 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''Harischandra, D. S.; Lawana, V.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A., és mtsai. (2015b). Lysosomal dysfunction caused by the environmental neurotoxicant manganese increases exosome-mediated cell-to-cell transfer of α-synuclein by a prion-like mechanism. Neurotoxicol. Teratol. 49:109. doi: 10.1016/j.ntt.2015.04.034 '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''Harischandra, D. S.; Rokad, D.; Neal, M. L.; Ghaisas, S.; Manne, S.; Sarkar, S., és mtsai. (2019). Manganese promotes the aggregation and prion-like cell-to-cell exosomal transmission of alpha-synuclein. Sci. Signal. 12:eaau4543. doi: 10.1126/scisignal.aau4543 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' Pfeffer, S. R. (2010). Two Rabs for exosome release. Nat. Cell Biol. 12, 3–4. doi: 10.1038/ncb0110-3 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' '''Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900 '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''Astroglia, glutamát-GABA ciklus:''' '''''''' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' ''' ''''' |
'''''Luan, X.; Sansanaphongpricha, K.; Myers, I.; Chen, H.; Yuan, H.; and Sun, D. (2017). Engineering exosomes as refined biological nanoplatforms for drug delivery. Acta Pharmacol. Sin. 38, 754–763. doi: 10.1038/aps.2017.12 '' '' ' ''''''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''''' ''' '''''Munson, P.; Lam, Y. W.; Macpherson, M.; Beuschel, S.; and Shukla, A. (2018). Mouse serum exosomal proteomic signature in response to asbestos exposure. J. Cell. Biochem. 119, 6266–6273. doi: 10.1002/jcb.26863 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''''' ''' '''Ngalame, N. N. O.; Luz, A. L.; Makia, N.; and Tokar, E. J. (2018). Arsenic alters exosome quantity and cargo to mediate stem cell recruitment into a cancer stem cell-like phenotype. Toxicol. Sci. 165, 40–49. doi: 10.1093/toxsci/kfy176 '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''Harischandra, D. S.; Ghaisas, S.; Rokad, D.; and Kanthasamy, A. G. (2017). Exosomes in toxicology: relevance to chemical exposure and pathogenesis of environmentally linked diseases. Toxicol. Sci. 158, 3–13. doi: 10.1093/toxsci/kfx074 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' Harischandra, D. S.; Ghaisas, S.; Rokad, D.; Zamanian, M.; Jin, H.; Anantharam, V., és mtsai. (2018). Environmental neurotoxicant manganese regulates exosome-mediated extracellular miRNAs in cell culture model of Parkinson’s disease: relevance to alpha-synuclein misfolding in metal neurotoxicity. Neurotoxicology 64, 267–277. doi: 10.1016/j.neuro.2017.04.007 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''Harischandra, D. S.; Jin, H.; Anantharam, V.; Kanthasamy, A., and Kanthasamy, A. G. (2015a). alpha-Synuclein protects against manganese neurotoxic insult during the early stages of exposure in a dopaminergic cell model of Parkinson’s disease. Toxicol. Sci. 143, 454–468. doi: 10.1093/toxsci/kfu247 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' '''''Harischandra, D. S.; Lawana, V.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A., és mtsai. (2015b). Lysosomal dysfunction caused by the environmental neurotoxicant manganese increases exosome-mediated cell-to-cell transfer of α-synuclein by a prion-like mechanism. Neurotoxicol. Teratol. 49:109. doi: 10.1016/j.ntt.2015.04.034 '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '''''Harischandra, D. S.; Rokad, D.; Neal, M. L.; Ghaisas, S.; Manne, S.; Sarkar, S., és mtsai. (2019). Manganese promotes the aggregation and prion-like cell-to-cell exosomal transmission of alpha-synuclein. Sci. Signal. 12:eaau4543. doi: 10.1126/scisignal.aau4543 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' '''Pfeffer, S. R. (2010). Two Rabs for exosome release. Nat. Cell Biol. 12, 3–4. doi: 10.1038/ncb0110-3 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' '''''Astroglia, glutamát-GABA ciklus:''''''' '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ' ''' ''''' |
| Line 502: | Line 525: |
| '''''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''' ''''' https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-017-0871-0 ' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' '' Kirkley, K. S.; Popichak, K. A.; Afzali, M. F. ''et al.'' Microglia amplify inflammatory activation of astrocytes in manganese neurotoxicity. ''J Neuroinflammation'' 14, 99 (2017).' https://doi.org/10.1186/s12974-017-0871-0 ' '' '' '' ''''' ''''' ''' '''''''' '' ''''''' '' |
'''''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''''''' ''' ''''' ''' '''https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-017-0871-0 ' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''' '''''''' ''' '''Kirkley, K. S.; Popichak, K. A.; Afzali, M. F. ''et al.'' Microglia amplify inflammatory activation of astrocytes in manganese neurotoxicity. ''J Neuroinflammation'' 14, 99 (2017).' https://doi.org/10.1186/s12974-017-0871-0 ' '' '' '' ''''' ''''' ''' '' '' ' '' |
| Line 516: | Line 539: |
| '''''Cordova, F. M.; Aguiar, A. S. Jr.; Peres, T. V.; Lopes, M. W.; Gonçalves, F. M.; Pedro, D. Z., és mtsai. (2013). Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox. Arch. Toxicol. 87, 1231–1244. doi: 10.1007/s00204-013-1017-5 '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '''''Carson, M. J.; Bilousova, T. V.; Puntambekar, S. S.; Melchior, B.; Doose, J. M.; and Ethell, I. M. (2007). A rose by any other name? The potential consequences of microglial heterogeneity during CNS health and disease. Neurotherapeutics 4, 571–579. doi: 10.1016/j.nurt.2007.07.002 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' '''Tansey, M. G.; Frank-Cannon, T. C.; Mccoy, M. K.; Lee, J. K.; Martinez, T. N.; Mcalpine, F. E., és mtsai. (2008). Neuroinflammation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy? Front. Biosci. 13, 709–717. doi: 10.1007/s11481-009-9176-0 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' Mogi, M.; Harada, M.; Kondo, T.; Riederer, P.; Inagaki, H.; Minami, M., és mtsai. (1994). Interleukin-1 beta, interleukin-6, epidermal growth factor and transforming growth factor-alpha are elevated in the brain from Parkinsonian patients. Neurosci. Lett. 180, 147–150. doi: 10.1016/0304-3940(94)90 508-8 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''Przedborski, S.; and Vila, M. (2003). The 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine mouse model: a tool to explore the pathogenesis of Parkinson’s disease. Ann. N. Y. Acad. Sci. 991, 189–198. doi: 10.1111/j.1749-6632.2003.tb07476.x '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '' '''Ghosh, A.; Roy, A.; Liu, X.; Kordower, J. H.; Mufson, E. J.; Hartley, D. M., és mtsai. (2007). Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proc. Natl. Acad. Sci. U.S.A. 104, 18754–18759. doi: 10.1073/pnas.0704908104 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''''' '' '''''Miklossy, J.; Doudet, D. D.; Schwab, C.; Yu, S.; Mcgeer, E. G.; and Mcgeer, P. L. (2006). Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys. Exp. Neurol. 197, 275–283. doi: 10.1016/j.expneurol.2005. 10.034 '''''''' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''''''' '' |
'''''Cordova, F. M.; Aguiar, A. S. Jr.; Peres, T. V.; Lopes, M. W.; Gonçalves, F. M.; Pedro, D. Z., és mtsai. (2013). Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox. Arch. Toxicol. 87, 1231–1244. doi: 10.1007/s00204-013-1017-5 '' '' ' ' ''''''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''Carson, M. J.; Bilousova, T. V.; Puntambekar, S. S.; Melchior, B.; Doose, J. M.; and Ethell, I. M. (2007). A rose by any other name? The potential consequences of microglial heterogeneity during CNS health and disease. Neurotherapeutics 4, 571–579. doi: 10.1016/j.nurt.2007.07.002 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' Tansey, M. G.; Frank-Cannon, T. C.; Mccoy, M. K.; Lee, J. K.; Martinez, T. N.; Mcalpine, F. E., és mtsai. (2008). Neuroinflammation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy? Front. Biosci. 13, 709–717. doi: 10.1007/s11481-009-9176-0 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''Mogi, M.; Harada, M.; Kondo, T.; Riederer, P.; Inagaki, H.; Minami, M., és mtsai. (1994). Interleukin-1 beta, interleukin-6, epidermal growth factor and transforming growth factor-alpha are elevated in the brain from Parkinsonian patients. Neurosci. Lett. 180, 147–150. doi: 10.1016/0304-3940(94)90 508-8 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' '''''Przedborski, S.; and Vila, M. (2003). The 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine mouse model: a tool to explore the pathogenesis of Parkinson’s disease. Ann. N. Y. Acad. Sci. 991, 189–198. doi: 10.1111/j.1749-6632.2003.tb07476.x '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' ''' '''''''' ''' Ghosh, A.; Roy, A.; Liu, X.; Kordower, J. H.; Mufson, E. J.; Hartley, D. M., és mtsai. (2007). Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proc. Natl. Acad. Sci. U.S.A. 104, 18754–18759. doi: 10.1073/pnas.0704908104 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ' '' '''''Miklossy, J.; Doudet, D. D.; Schwab, C.; Yu, S.; Mcgeer, E. G.; and Mcgeer, P. L. (2006). Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys. Exp. Neurol. 197, 275–283. doi: 10.1016/j.expneurol.2005. 10.034 '''''''' '' ' ''''''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ' '' |
| Line 532: | Line 555: |
| Wedler, F. C.; and Denman, R. B. (1984). Glutamine synthetase: the major Mn(II) enzyme in mammalian brain. Curr. Top. Cell. Regul. 24, 153–169. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' '' Wedler, F. C.; Vichnin, M. C.; Ley, B. W.; Tholey, G.; Ledig, M.; and Copin, J. C. (1994). Effects of Ca(II) ions on Mn(II) dynamics in chick glia and rat astrocytes: potential regulation of glutamine synthetase. Neurochem. Res. 19, 145–151. doi: 10.1007/bf00966809 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' '' ''Farina, M.; Avila, D. S.; Da Rocha, J. B.; and Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury. Neurochem. Int. 62, 575–594. doi: 10.1016/j.neuint.2012.12.006 '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' '' '''''Rama Rao, K. V.; Reddy, P. V.; Hazell, A. S.; and Norenberg, M. D. (2007). Manganese induces cell swelling in cultured astrocytes. Neurotoxicology 28, 807–812. doi: 10.1016/j.neuro.2007.03.001 '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' '' |
Wedler, F. C.; and Denman, R. B. (1984). Glutamine synthetase: the major Mn(II) enzyme in mammalian brain. Curr. Top. Cell. Regul. 24, 153–169. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''''''' '''''''' ''' '''Wedler, F. C.; Vichnin, M. C.; Ley, B. W.; Tholey, G.; Ledig, M.; and Copin, J. C. (1994). Effects of Ca(II) ions on Mn(II) dynamics in chick glia and rat astrocytes: potential regulation of glutamine synthetase. Neurochem. Res. 19, 145–151. doi: 10.1007/bf00966809 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' '' ''' '''''Farina, M.; Avila, D. S.; Da Rocha, J. B.; and Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury. Neurochem. Int. 62, 575–594. doi: 10.1016/j.neuint.2012.12.006 '' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' '' ''' ''Rama Rao, K. V.; Reddy, P. V.; Hazell, A. S.; and Norenberg, M. D. (2007). Manganese induces cell swelling in cultured astrocytes. Neurotoxicology 28, 807–812. doi: 10.1016/j.neuro.2007.03.001 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ' '' |
| Line 548: | Line 571: |
| '''''Sidoryk-Wegrzynowicz, M.; and Aschner, M. (2013). Manganese toxicity in the central nervous system: the glutamine/glutamate-gamma-aminobutyric acid cycle. J. Intern. Med. 273, 466–477. doi: 10.1111/joim.12040 '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''Diagnosztika:' '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' Fahn, S., Elton, R.L., Members of the UPDRS Development Committee, 1987. Unified Parkinson’s disease rating scale. In: Fahn, S., Marsden, C.D., Goldstein, M., Calne, D.B. (Eds.), Recent Developments in Parkinson’s Disease. Macmillan, New York, pp. 153–163. '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''Criswell, S., Sterling, C., Swisher, L., Evanoff, B., Racette, B.A., 2010. Sensitivity and specificity of the finger tapping task for the detection of psychogenic movement disorders. Parkinsonism Relat. Disord. 16 (3), 197–201. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' '''''Racette, B.A., Criswell, S.R., Lundin, J.I., Hobson, A., Seixas, N., Kotzbauer, P.T., Evanoff, B.A., Perlmutter, J.S., Zhang, J., Sheppard, L., Checkoway, H., 2012. Increased risk of parkinsonism associated with welding exposure. Neurotoxicology 33 (5), 1356–1361. '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' |
'''''Sidoryk-Wegrzynowicz, M.; and Aschner, M. (2013). Manganese toxicity in the central nervous system: the glutamine/glutamate-gamma-aminobutyric acid cycle. J. Intern. Med. 273, 466–477. doi: 10.1111/joim.12040 '' '' ' ' ''''''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' '''''Diagnosztika:' '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' ''' '''Fahn, S., Elton, R.L., Members of the UPDRS Development Committee, 1987. Unified Parkinson’s disease rating scale. In: Fahn, S., Marsden, C.D., Goldstein, M., Calne, D.B. (Eds.), Recent Developments in Parkinson’s Disease. Macmillan, New York, pp. 153–163. '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' ''' ''' Criswell, S., Sterling, C., Swisher, L., Evanoff, B., Racette, B.A., 2010. Sensitivity and specificity of the finger tapping task for the detection of psychogenic movement disorders. Parkinsonism Relat. Disord. 16 (3), 197–201. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' ''' ''Racette, B.A., Criswell, S.R., Lundin, J.I., Hobson, A., Seixas, N., Kotzbauer, P.T., Evanoff, B.A., Perlmutter, J.S., Zhang, J., Sheppard, L., Checkoway, H., 2012. Increased risk of parkinsonism associated with welding exposure. Neurotoxicology 33 (5), 1356–1361. '' '' ' ' ' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' |
| Line 566: | Line 589: |
| '''Racette, B.A., Searles Nielsen, S., Criswell, S.R., Sheppard, L., Seixas, N., Warden, M.N., Checkoway, H., 2017. Dose-dependent progression of parkinsonism in manganese-exposed welders. Neurology 88 (4), 344–351. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''''' '' '''''Bowler, R.M., Gysens, S., Diamond, E., Nakagawa, S., Drezgic, M., Roels, H.A., 2006. Manganese exposure: neuropsychological and neurological symptoms and effects in welders. Neurotoxicology 27 (3), 315–326. '''''''' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''''''' '' ''Bowler, R.M., Nakagawa, S., Drezgic, M., Roels, H.A., Park, R.M., Diamond, E., Mergler, D., Bouchard, M., Bowler, R.P., Kollerg, W., 2007. Sequelae of fume exposure in confined space welding: a neurological and neuropsychological case series. Neurotoxicology 28 (2), 298–311. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' '' Mergler, D., Huel, G., Bowler, R., Iregren, A., Belanger, S., Baldwin, M., Tardif, R., Smargiassi, A., Martin, L., 1994. Nervous system dysfunction among workers with long-term exposure to manganese. Environ. Res. 64 (2), 151–180. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' '' |
'''Racette, B.A., Searles Nielsen, S., Criswell, S.R., Sheppard, L., Seixas, N., Warden, M.N., Checkoway, H., 2017. Dose-dependent progression of parkinsonism in manganese-exposed welders. Neurology 88 (4), 344–351. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''''''''' '''''''' ''' ''Bowler, R.M., Gysens, S., Diamond, E., Nakagawa, S., Drezgic, M., Roels, H.A., 2006. Manganese exposure: neuropsychological and neurological symptoms and effects in welders. Neurotoxicology 27 (3), 315–326. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''''''''''' '''''''' ''' '''''Bowler, R.M., Nakagawa, S., Drezgic, M., Roels, H.A., Park, R.M., Diamond, E., Mergler, D., Bouchard, M., Bowler, R.P., Kollerg, W., 2007. Sequelae of fume exposure in confined space welding: a neurological and neuropsychological case series. Neurotoxicology 28 (2), 298–311. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' ''' '''''''' ''' '''Mergler, D., Huel, G., Bowler, R., Iregren, A., Belanger, S., Baldwin, M., Tardif, R., Smargiassi, A., Martin, L., 1994. Nervous system dysfunction among workers with long-term exposure to manganese. Environ. Res. 64 (2), 151–180. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '' '' ' '' |
| Line 578: | Line 601: |
| '''''Myers, J.E., Fine, J., Ormond-Brown, D., Fry, J., Thomson, A., Thompson, M.L., 2009. Estimating the prevalence of clinical manganism using a cascaded screening process in a South African manganese smelter. Neurotoxicology 30 (6), 934– 940. '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' '' '''Criswell, S.R., Perlmutter, J.S., Huang, J.L., Golchin, N., Flores, H.P., Hobson, A., Aschner, M., Erikson, K.M., Checkoway, H., Racette, B.A., 2012. Basal ganglia intensity indices and diffusion weighted imaging in manganese-exposed welders. Occup. Environ. Med. 69 (6), 437–443. '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''Nelson, K., Golnick, J., Korn, T., Angle, C., 1993. Manganese encephalopathy: utility of early magnetic resonance imaging. Br. J. Ind. Med. 50 (6), 510–513. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' ''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' '''''Kísérlet:' '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' '''__Felhasznát irodalom__: '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' Moreno, J. A., Streifel, K. M., Sullivan, K. A., Hanneman, W. H., Tjalkens, R. B.: Manganese-Induced NF-jB Activation and Nitrosative Stress Is Decreased by Estrogen in Juvenile Mice. Toxicological Scienses, 122 : (1) 121-133, 2011 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''__Referenciák__: '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '' '''Bouchard, M. F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M. E., Bouffard, T., Limoges, E., Bellinger, D. C., and Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect. 119, 138–143. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''''''' '' '''''Callier, S., Morissette, M., Grandbois, M., Pelaprat, D., and Di Paolo, T. (2001). Neuroprotective properties of 17beta-estradiol, progesterone, and raloxifene in MPTP C57Bl/6 mice. Synapse. 41, 131–138. '''''''' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''''''' '' |
'''''Myers, J.E., Fine, J., Ormond-Brown, D., Fry, J., Thomson, A., Thompson, M.L., 2009. Estimating the prevalence of clinical manganism using a cascaded screening process in a South African manganese smelter. Neurotoxicology 30 (6), 934– 940. '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''''''' '''''''' ''' Criswell, S.R., Perlmutter, J.S., Huang, J.L., Golchin, N., Flores, H.P., Hobson, A., Aschner, M., Erikson, K.M., Checkoway, H., Racette, B.A., 2012. Basal ganglia intensity indices and diffusion weighted imaging in manganese-exposed welders. Occup. Environ. Med. 69 (6), 437–443. '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''' '''''Nelson, K., Golnick, J., Korn, T., Angle, C., 1993. Manganese encephalopathy: utility of early magnetic resonance imaging. Br. J. Ind. Med. 50 (6), 510–513. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' ''' '' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''' ''Kísérlet:' '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' __Felhasznát irodalom__: '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''Moreno, J. A., Streifel, K. M., Sullivan, K. A., Hanneman, W. H., Tjalkens, R. B.: Manganese-Induced NF-jB Activation and Nitrosative Stress Is Decreased by Estrogen in Juvenile Mice. Toxicological Scienses, 122 : (1) 121-133, 2011 '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' '''''__Referenciák__: '' '' ' ''''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' ''' '''''''' ''' Bouchard, M. F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M. E., Bouffard, T., Limoges, E., Bellinger, D. C., and Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect. 119, 138–143. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ' '' '''''Callier, S., Morissette, M., Grandbois, M., Pelaprat, D., and Di Paolo, T. (2001). Neuroprotective properties of 17beta-estradiol, progesterone, and raloxifene in MPTP C57Bl/6 mice. Synapse. 41, 131–138. '''''''' '' ' ''''''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ' '' |
| Line 600: | Line 623: |
| He, P., Liu, D. H., and Zhang, G. Q. (1994). [Effects of high-level-manganese sewage irrigation on children’s neurobehavior]. Zhonghua Yu Fang Yi Xue Za Zhi. 28, 216–218. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''' '' Liu, X., Sullivan, K. A., Madl, J. E., Legare, M., and Tjalkens, R. B. (2006). Manganese-induced neurotoxicity: the role of astroglial-derived nitric oxide in striatal interneuron degeneration. Toxicol. Sci. 91, 521–531. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' '' ''Moreno, J. A., Streifel, K. M., Sullivan, K. A., Legare, M. E., and Tjalkens, R. B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci. 112, 405–415. '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' '' '''''Moreno, J. A., Yeomans, E. C., Streifel, K. M., Brattin, B. L., Taylor, R. J., and Tjalkens, R. B. (2009b). Age-dependent susceptibility to manganese-induced neurological dysfunction. Toxicol. Sci. 112, 394–404. '''''''' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''''''' '' |
He, P., Liu, D. H., and Zhang, G. Q. (1994). [Effects of high-level-manganese sewage irrigation on children’s neurobehavior]. Zhonghua Yu Fang Yi Xue Za Zhi. 28, 216–218. '' '' ' ' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' ''''''''''' '''''''' ''' '''Liu, X., Sullivan, K. A., Madl, J. E., Legare, M., and Tjalkens, R. B. (2006). Manganese-induced neurotoxicity: the role of astroglial-derived nitric oxide in striatal interneuron degeneration. Toxicol. Sci. 91, 521–531. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' '' ''' '''''Moreno, J. A., Streifel, K. M., Sullivan, K. A., Legare, M. E., and Tjalkens, R. B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci. 112, 405–415. '' '' ' ''''''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' '' ''' ''Moreno, J. A., Yeomans, E. C., Streifel, K. M., Brattin, B. L., Taylor, R. J., and Tjalkens, R. B. (2009b). Age-dependent susceptibility to manganese-induced neurological dysfunction. Toxicol. Sci. 112, 394–404. '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ' '' |
| Line 617: | Line 640: |
| . '''''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654; figure 5. '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' '''''2. ábra: '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' . '''Manganit, piroluzit és egyéb mangánércek az úrkúti mangánérc-bánya meddőhányóiról; Horváth András gyűjtése és fényképe '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' 3. ábra, (újrarajzolt): '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' . ''[[https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system:-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1|https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system%3A-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1]] ' ' ''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''4. ábra, (újrarajzolt): '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' . https://faculty.virginia.edu/.archived/metals/cases/corson1.html '' '' https://www.sciencedirect.com/science/article/pii/S0020169307005464#fig1 ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''5. ábra, (újrarajzolt): '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' . '''''https://stke.sciencemag.org/content/12/563/eaat9900.full '' '' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900; figure 7. '' '' ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' |
. '''''Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654; figure 5. '' '' ' ' ''''''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''2. ábra: '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' . Manganit, piroluzit és egyéb mangánércek az úrkúti mangánérc-bánya meddőhányóiról; Horváth András gyűjtése és fényképe '' '' ' ''' ''' ''''' '' '' ''''' ''''' ''' '' '' '' ''' ''' '''3. ábra, (újrarajzolt): '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' . '''''[[https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system:-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1|https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system%3A-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1]] ' ' ''''''' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' ''' ''' '''''4. ábra, (újrarajzolt): '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' '' ''' ''' ''' . '''https://faculty.virginia.edu/.archived/metals/cases/corson1.html '' '' https://www.sciencedirect.com/science/article/pii/S0020169307005464#fig1 ' ''' ''' ''''' '' '' ''''' ''''' ''' '''''''' '' '' ''' ''' ''' 5. ábra, (újrarajzolt): '' '' ''''' ''' ''' ''''' '' '' ''''' ''''' ''' ''''' '' ''' ''' ''' ''' . ''https://stke.sciencemag.org/content/12/563/eaat9900.full '' '' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900; figure 7. '' '' ' ' ' ''''' '' '' ''''' ''''' ''' '' '' ''' ''' |
| Line 640: | Line 663: |
| ''' '' '' '' ''''''' ''''' ''''' '' '' /!\ 'End of edit conflict''''' '' '' ''''' '' ' '' '' '' ''''' ''' ---- ''' ''''' '' '' '' ''' '' ''''' '' '' '' '' ''''' '' ''''' '' ''''' '' ''' |
''' '' '' '' ''''''''''' ''''' ''''' '' '' /!\ 'End of edit conflict''''' '' '' ''''' '' ' '' '' '' ''''' ''' ''' ---- ''' ''' ''''' '' '' '' ''' '' ''''' '' '' '' '' ''''' '' ''''' '' ''''' '' ''' ''' |
Mangán indukálta neuroinflammáció
Bevezetés
A mangán okozta neurotoxikáció („Manganism”) egy idegrendszert érintő megbetegedés, mely a Parkinson-kórhoz (PD) hasonló tüneteket okoz. Elsősorban a központi idegrendszert érinti, azon belül is főként a nigrostriatális pályát, ami később viselkedési és motorikus károsodásokhoz vezet. Ennek hátterében számos, részben még ismeretlen mechanizmus áll. Eleinte a magas mangán-koncentráció mitochondriumokra gyakorolt hatását és a rajtuk keresztül létrejövő oxidatív stresszt vizsgálták. Újabb kísérletek azonban rávilágítottak arra, hogy a környezetből felvett mérgező anyagok elindíthatnak bizonyos neurodegeneratív folyamatokat azáltal, hogy befolyásolnak egyes betegség-specifikus fehérjéket. Ennek kapcsán kiderült, hogy a mangán részt vehet például az amyloidok és az alpha-synuclein fehérjék szerkezetének módosításában is. A Mn, a „manganizmuson” és a PD-on kívül, így szerepet játszhat még prionbetegségekben és a Huntington-kórban is. Tekintve, hogy a Mn hatással van a fehérjék szerkezetére, a mitochondriumok működésére, ezáltal a neuroinflammáció és neurodegeneráció kialakulására, egyes kutatók bevezették a „Mn Mechanistic Neurotoxic Triad” fogalmát (1. mitochondriális funkciózavar és oxidatív stressz, 2. protein „trafficking” és „misfolding”, valamint 3. neuroinflammáció). Ez a megközelítés segít megérteni és feltárni a túlzott Mn-expozíció által kiváltott folyamatokat és ezek összefüggéseit (D. S. Harischandra, S. Ghaisas, és mtsai. 2019), (1.ábra). A Mn és a szervezetre gyakorolt hatásai a mai napig egy intenzíven kutatott terület.
1. ábra: "Mn Mechanistic Neurotoxic Triad" |
Contents
Rövid kutatástörténet
A mangán okozta idegrendszeri betegségek kutatása szorosan összefügg az ipar fejlődésével. Elsőként 1837-ben John Couper írta le a jelenséget Skóciában. A glasgow-i Charles Tennant fehérítő gyárban (a kor legnagyobb fehérítő gyára volt) dolgozó munkások még újnak számító technológiával klórt állítottak elő. A folyamat nagy mennyiségű mangánt kívánt, így a dolgozók minden nap magas mangán-koncentrációnak voltak kitéve, amely végül mérgezéshez vezetett. A század előrehaladtával, az új fémelőállítási technológiák használata szintén jelentősen megnövelte a mangán felhasználását. Az új tudományos megfigyelésig azonban egészen 1901-ig kellett várni. Embden és von Jaksch egymástól függetlenül számoltak be esetekről, melyeket a sok mangánport tartalmazó levegő okozott. Az első világháború előtti évekből már 9 beteget jelentettek mangán okozta idegrendszeri megbetegedéssel Európa különböző pontjairól. A világháborúban lőszergyártásra használták fel, amitől tovább növekedett a mangánnal történő érintkezések száma. A XX. század közepétől kezdve az új diagnosztikai technológiák segítségével egyre több beteget regisztráltak. (Blanc 2018)
Az ember napjainkban is számos területen ki lehet téve már károsnak számító Mn-koncentrációnak a mezőgazdaságtól (Mn-tartalmú peszticidek) a bányászaton (2. ábra) és kohászaton át a szennyezett ivóvízig.
2. ábra: Manganit, piroluzit és egyéb mangánércek az úrkúti mangánbánya meddőhányóiról
A Mn-indukálta neuroinflammáció pathomechanizmusa
Gliasejtek aktivációja
A gliasejt-aktiváció fontos szerepet játszik a neuroinflammáció kialakulásában, kiváltva a nem neuron eredetű ROS (reactive oxygen species) és gyulladásos mediátorok (pl. proinflammatorikus cytokinek) felszabadulását. A glia-aktiváció jellegét meghatározza azok morfológiája, proliferációja, migrációja, illetve az immunmoduláló molekulák expressziója. A gliasejtek két fő csoportja a központi idegrendszerben az astrocyták és a microglia. Utóbbi a központi idegrendszer összes gliasejtjének körülbelül 10%-át adja.
Ma már jól dokumentált, hogy a glia-aktiváció kimagasló a Mn-expozíciónak kitett emberek agyában, ahogy a Mn neurotoxicitás főemlős és rágcsáló modelljeiben (Erikson and Aschner, 2006; Huang, 2007; Perl and Olanow, 2007; Cordova és mtsai., 2013). A microgliák főszerepet játszanak az agyat érő idegen eredetű vagy endogén bántalmakra történő válaszadásban. Eltávolítják a felhalmozódott neurotoxinokat, elhalt sejteket, sejttörmelékeket és proinflammatorikus cytokineket szabadítanak fel (Carson és mtsai., 2007; Tansey és mtsai., 2008). Emellett a microglia sejtek gyulladásos mediátorok (pl. LPS, cytokinek) jelenlétére válaszként indukálható nitrogén-monoxid-szintázt (iNOS) szabadítanak fel, ami nagy mennyiségű NO-t képes előállítani. A microgliával ellentétben az astrocyták nem támadják meg a pathológiás célpontokat, ehelyett olyan faktorokat termelnek, melyek gyulladásos reakciókat közvetítenek a PD-os agy substantia nigrájában (Miklossy és mtsai., 2006). Az astrocyták szintén hozzájárulnak még a Mn-stimulálta NO-termeléshez.
A gyors microgliális válasz gyakran megelőzi a jóval későbbi astrocyta-aktivációt, ami a PD és AD (Alzheimer-kór) esetében már ismert gliasejtek közti interakcióra enged következtetni. Neurotoxicitáskor az aktivált microgliák serkentő faktorok (pl. tumor nekrózis faktor, IL-1β) segítségével képesek serkenteni a szomszédos astrocyták aktiválódását egy NF-κB (κB nukleáris faktor)-dependens mechanizmuson keresztül. Mn expozíció során ha a microgliákat eltávolítják, az aktivációt elősegítő cytokinek hiányában az astrocyták nem képesek neuronális apoptózist előidézni. Ez alátámasztja a microgliák inflammatorikus folyamatokban betöltött iniciációs szerepét. (K. S. Kirkley, K. A. Popichak és mtsai., 2017)
Astrocyták
Az astrocyták jelentős szerepet játszanak a Mn-indukálta neuroinflammációban, mivel az agy Mn-homeosztázisának központját képezik (Wedler and Denman, 1984). Az astrocytákon található transferrin receptorok azonnal hozzákötődnek a Tf-Mn3+-hoz, emiatt található bennük több Mn, mint bármely más idegsejt-típusban. Valójában az astrocyták 10-50-szer nagyobb Mn koncentrációt is mutathatnak, mint a neuronok, ezért is érzékenyebbek a Mn toxicitásra más sejttípusoknál.
Az astrocyták hármas szinapszisokon keresztül szabályozzák a neuronok közti extracelluláris glutamát mennyiségét (Karki és mtsai., 2013, Popoli és mtsai., 2011). A magas Mn-koncentráció tumor nekrózis faktor-α (TNF- α) indukálásával megzavarja ezt a regulációt. Glutamát-indukálta excitotoxicitás során a többlet glutamát hirtelen annyira megnöveli az intracellularis Ca2+ szintet, hogy az blokkolni fogja a Mn2+ felvételét, elősegítve a mitochondrialis Mn2+ kijutását a cytosolba. A cytosol magas Mn2+ koncentrációja az astrocytákban aktiválja a glutamin-szintetázt, ami eltávolítja a fölösleges glutamátot (Wedler és mtsai., 1994). A többlet extracelluláris Mn2+ azonban kompetitíven kötődve a Ca2+-kötő helyekhez megszakíthatja az intracelluláris Ca2+ jeladást az astrocytákban, így megzavarva a mitochondriális Ca2+ homeostasist (Farina és mtsai., 2013), ami astrogliosist vált ki. Ezenkívül a Mn3+ oxidatív/nitrozatív utakon az astrocyták megduzzadását okozza (Rama Rao és mtsai., 2007). A megnövekedett Mn-szint az astrocytákban növeli a proinflammatorikus jelmolekulák (iNOS, IL-6) expresszióját (Moreno és mtsai., 2008). Míg ezeknek a jeleknek a jól időzített expressziója elengedhetetlen az idegi stresszre vagy sejtkárosodásra adott válasz kialakításában, addig túlprodukciójuk nemkívánatos, gyakran súlyosbítja a toxikus hatásokat. Mn-nak kitett primer emberi astrocyták microarray génexpresszió profilozása proinflammatorikus cytokineket kódoló gének upregulációját, ezzel párhuzamosan pedig a sejtciklussal, DNS replikációval és kijavítással kapcsolatos gének downregulációját mutatta ki (Sengupta és mtsai., 2007).
Glutamát-GABA ciklus
A glutamát-GABA ciklus különösen fontos az astrocyta-neuron anyagcsere kapcsán. A glutamát és a GABA szintézisében a glutamin mint ezek előanyaga van jelen (Bak és mtsai., 2006). A neuronális glutamin glutamáttá történő deamidációjakor ammónia keletkezik, ami ezután az astrocytákhoz szállítódik és a glutamát amidációjához használódik fel. Az astrocyták által kibocsátott glutamint a glutamát- és GABAerg neuronok veszik fel, amik nyúlványokkal rendelkeznek a basalis ganglionokban (törzsdúcokban) az extrapyramidális motoros rendszerben, és segítenek az akaratlagos mozgások szabályozásában (Sidoryk-Wegrzynowicz and Aschner, 2013). Válaszul az agyban lévő Mn-többletre, a Mn rövid idő alatt belép az astrocyták mitochondriumaiba. A mitochondriumok magas Mn-szintje károsítja a sejtlégzést, valamint megakadályozza a glutation-peroxidáz (GPx) termelését és aktiválását. Ez ROS (reactive oxygen species) keletkezéséhez vezet, ami felhalmozódva oxidatív stresszt idéz elő. (3. ábra) Ez a folyamat negatívan hathat a glutamát- és GABAerg neuronok basalis ganglionokban levő nyúlványaira, ami a Mn neurotoxicitásra jellemző motoros elégtelenségekhez vezet. (4. ábra)
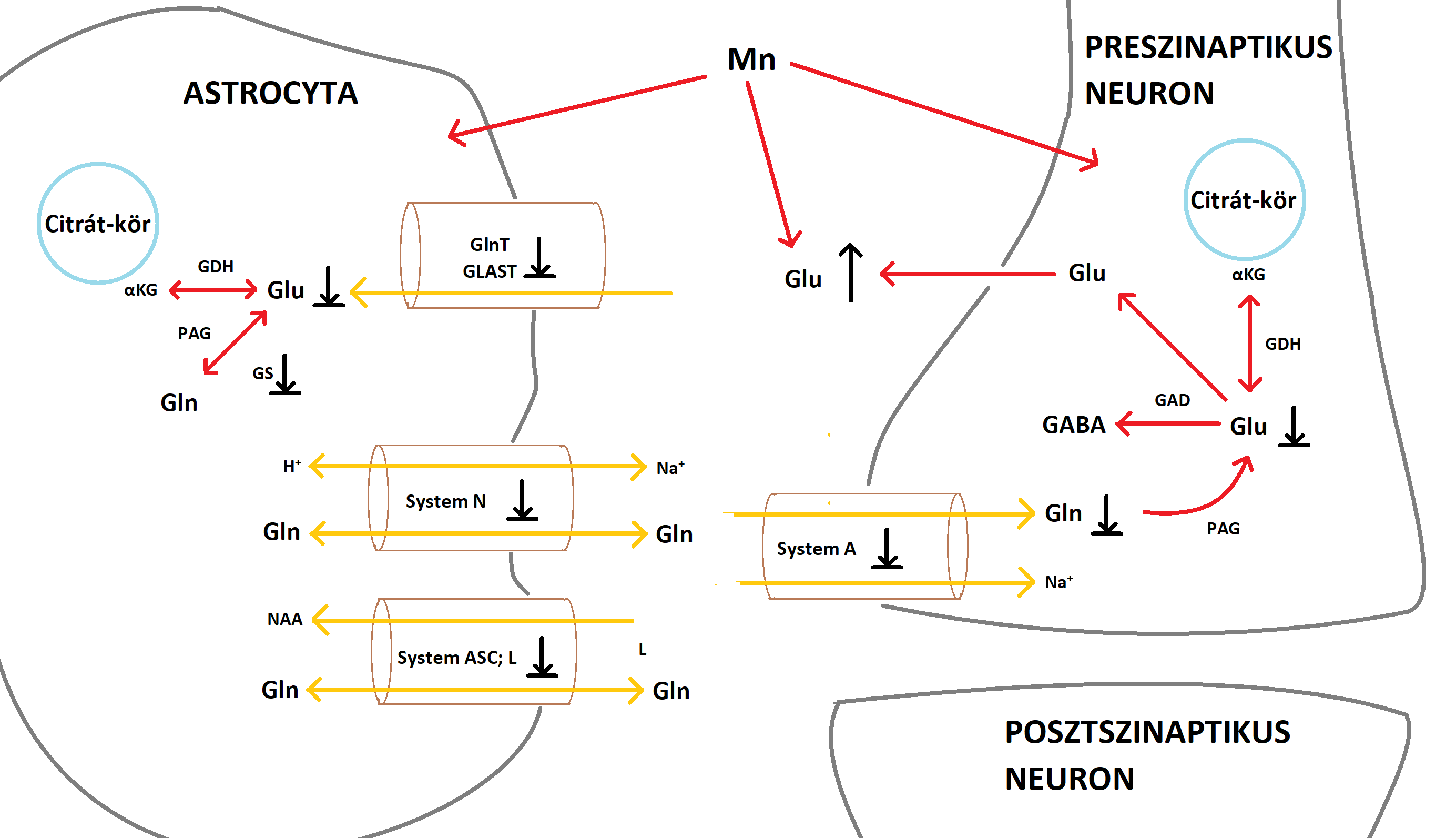
3. ábra: A Mn hatása a glutamát-GABA ciklusra |
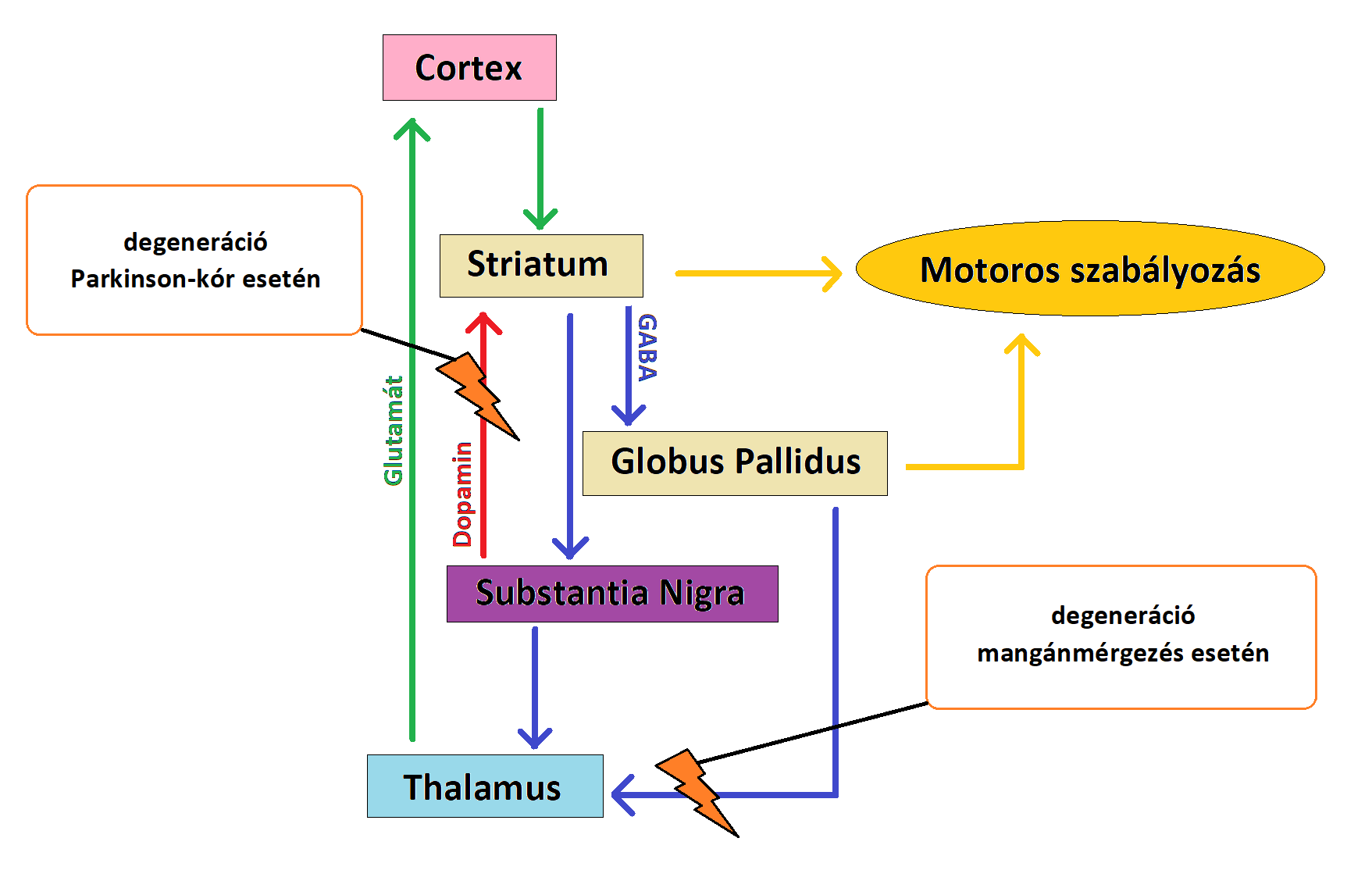
4. ábra: A PD és a Mn-mérgezés során bekövetkező neuronális zavar eltérő helyen alakul ki, mégis hasonló tünetekhez vezet |
Microglia sejtek aktivációja
Mangán-aktiválta NLRP3 inflammasoma jelpálya
A microgliákban lezajló inflammasoma-aktiváció különféle neurodegeneratív rendellenességekkel (pl. Parkinson-kór, Alzheimer-kór, traumatikus agyi sérülés) áll kapcsolatban (L. C. Freeman, J. P.-Y. Ting, 2015). Az inflammasomák fertőzés vagy stressz hatására aktiválódó molekulák, melyek proinflammatorikus cytokinek termelődését váltják ki, ezzel belső immunválaszt előidézve. Az ATP-től (E. -K. Jo, J. K. Kim, és mtsai., 2016) különféle ásványokon (F. Martinon, V. Pétrilli, és mtsai., 2006; C. Dostert, V. Pétrilli, és mtsai., 2008) és mitochondriális inhibitoron (R. Zhou, A. S. Yazdi, és mtsai., 2011; V. Lawana, N. Singh, és mtsai., 2017) keresztül a szerkezetükben módosult proteinekig (A. Halle, V. Hornung, és mtsai., 2008; G. Codolo, N. Plotegher, és mtsai., 2013) nagyon sok tényező kiválthat NLRP3 inflammasoma-aktivációt. Bár a teljes folyamat még nem ismert, számos stimulusról bebizonyosodott, hogy az NLRP3 inflammasoma-kaszkád aktiválásának 2-es szignáljaként működnek. Megannyi faktor (pl. mitochondriális és lysosoma diszfunkció, mitochondriális superoxid-termelés) képes előidézni az NLRP3 felszaporodását és aktiválását (R. Zhou, A. S. Yazdi, és mtsai., 2011; S. Alfonso-Loeches, J. R. Ureña-Peralta, és mtsai., 2014; S. Sarkar, E. Malovic, és mtsai., 2017; E. Aflaki, N. Moaven, és mtsai., 2016). A felgyülemlő Mn képes előidézni az astrocyták és neuronok mitochondriumainak funkciózavarát, illetve superoxid-termelését (D. Milatovic, Z. Yin, és mtsai., 2007; Z. Yin, J. L. Aschner, és mtsai., 2008; J. A. Roth, C. Horbinski, és mtsai., 2002; K. V. R. Rao, M. D. Norenberg, és mtsai., 2004). A PD-ral összefüggésben lévő PARKIN gén egyik terméke, a mitochondriális fúziós protein 2 (Mfn2) fontos szerepet játszik a mitochondriumok fúziójában (A. Rakovic, A. Grünewald, és mtsai., 2011; N. Rocha, D. A. Bulger, és mtsai., 2017). Bebizonyították, hogy a Mn túlzott jelenléte csökkent Mfn2-expresszióhoz vezet, amivel mitochondriális diszfunkció és inflammasoma-aktiváció jár együtt.
A VPS35 retromer komplex protein mutációja vagy csökkent expressziója képes kiváltani a mitochondriumok funkciózavarát akár az Mfn2 csökkentésével a dopaminerg neuronokban (F.-L. Tang, W. Liu, és mtsai., 2015), akár a dynamin-like protein 1 komplex újra felhasználásával (W. Wang, X. Wang, és mtsai., 2016). Kimutatták, hogy a Mn-terhelés csökkenti a VPS35 mennyiségét az LPS-primed microglia sejtekben, serkentve az Mfn2 degradációját, ami kapcsolatban áll a mitochondriális ubiquitin-ligáz (Mul1) expressziójával. Ennek pontos mechanizmusa még nem ismert. Mindemellett, a VPS35 befolyásolja az exosomák celluláris biogenezisét és felszabadulását (J. Follett, S. J. Norwood, és mtsai., 2014; L. J. Vella, A. F. Hill, és mtsai., 2016). Ezek az exosomák hozzájárulnak a neurodegeneratív betegségek kifejlődéséhez. Az általuk szállított aggregálódott α-Synuclein kulcs szignálként működik a többi sejt számára, így szintén segítenek a neuroinflammáció modulálásában (A. Gupta, L. Pulliam, és mtsai., 2014). Úgy látszik, egy újfajta pyroptotikus-phagocytikus kaszkád a prionokhoz hasonló módon terjeszti el az NLRP3 inflammasoma és annak adapter molekulájának (ASC) együttesét a sejtek között (B. S. Franklin, L. Bossaller, és mtsai., 2014).
A Mn serkenti az ASC exosomális felszabadulását az LPS-primed microgliákból, ugyanakkor az exosoma-felvétel blokkolása csökkenti az interleukin-1β (IL-1β) felszabadítását. Ezeknek az eredményeknek számos vonzata lehet, mivel az exosomák akár szervek közötti kommunikáció lebonyolítására is képesek és a vér-agy gáton is át tudnak hatolni. (5. ábra)
5. ábra: NLRP3 Mn-indukálta aktivációja a microglia sejtekben és az exosomák szerepe a neuroinflammáció terjedésében 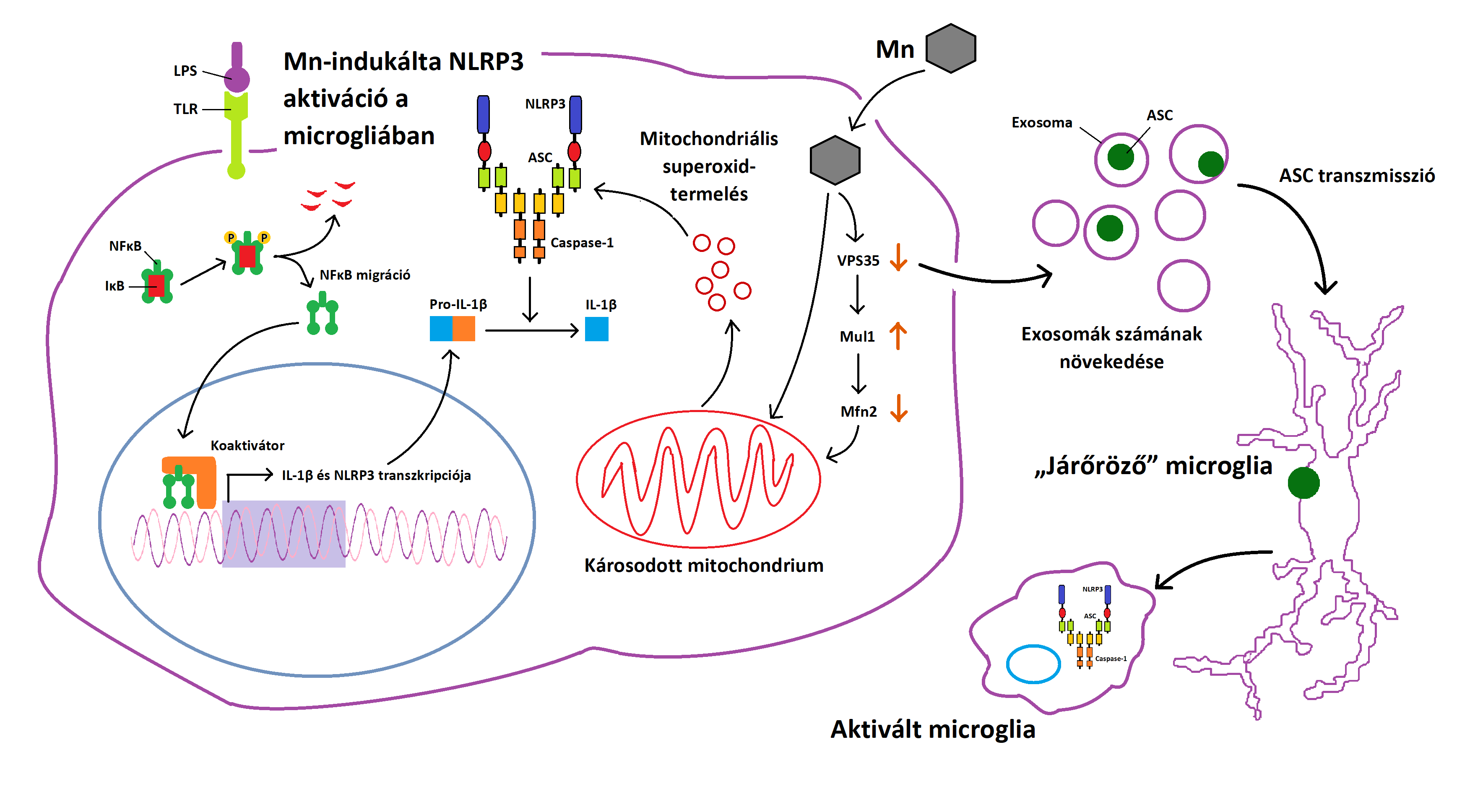
A fentieket igazolni látszanak a svéd hegesztőmunkások vizsgálatával nyert adatok. A szervezetükbe hegesztés során bekerült fém nanorészecskék megnövekedett inflammatorikus profilt idéztek elő (K. Dierschke, C. Isaxon, és mtsai., 2017).
6. ábra: A hegesztés során keletkező Mn-tartalmú gőzök tartós belélegzése Mn-toxicitáshoz vezethet 
Exosomák szerepe a neuroinflammációban
Az exosomák nanoméretű (50-150 nm), sejtek által kibocsátott vezikulumok az extracelluláris térben (Thery és mtsai., 2002). Ezek a test egészében keringenek és képesek átjutni a vér-agy gáton, illetve más barriereken. Az exosomákat övező növekvő érdeklődés a betegségek fejlődésében betöltött potenciális szerepüknek köszönhető, ami lehetővé teszi esetleges felhasználásukat korai biomarkerek felkutatásában (Sarko and McKinney, 2017) és gyógyszerek szervezetben történő szállításában (Luan és mtsai., 2017). Toxikológiai kutatók abból a felfedezésből indulnak ki, miszerint a környezetben lévő méreganyagok megváltoztatják az egészséges ember exosoma-profilját, mint ahogy a rák vagy neurodegeneratív betegségek esetén (Harischandra és mtsai., 2017; Munson és mtsai., 2018; Ngalame és mtsai., 2018).Ebben a vonatkozásban, a Mn-expozíció neuronális exosoma-profilját és annak a neuroinflammációra és neurodegenerációra gyakorolt hatásait részletesen vizsgálják (Harischandra és mtsai., 2015 a, b, 2017, 2018, 2019). Kimutatták, hogy a Mn-terhelés számottevően upregulálja a kis GTPáz Rab27a-t. Ez közrejátszik a multivesiculáris testek membránfúziójában (Pfeffer, 2010), amik ezt követően exosomákat juttatnak az extracelluláris környezetbe (Harischandra et al., 2018). Továbbá a Mn-indukálta neuronális exosomák miRNS (mikro-) profiling analízise bizonyos miRNS-ek (pl. miR-210, miR-325, miR-125b, miR-450b) megemelkedett expresszióját mutatta ki, melyek kontroll biológiai kulcsfolyamatok (gyulladás, autophagia, protein aggregáció és hypoxia) kapcsán ismertek (Harischandra és mtsai., 2018). Ezek az exosomák caveola-mediált endocytosissal a sejtbe kerültek, ezáltal neuroinflammációt indukáltak, ami ezután neurodegeneratív folyamatokhoz vezetett mind sejttenyészetben, mind állatmodellekben (Harischandra és mtsai., 2019). Érdekesség, hogy a hegesztés során keletkező Mn-tartalmú gőzöknek tartósan kitett munkásoktól gyűjtött szérum exosoma mintákból megnövekedett mennyiségben mutattak ki megváltozott szerkezetű α-Synucleint az exosomákban. Ezzel összefügésbe hozható a környezetből származó Mn-terhelés a fejlődő Parkinson-kórral (Harischandra és mtsai., 2019). (6. ábra) Összegezve, az eredmények rávilágítottak a Mn endosomális forgalmat befolyásoló hatására az exosomákból kiszabaduló anyagok neuroinflammációt és progresszív neurodegenerációt előidéző tulajdonságán keresztül.
Diagnosztikai lehetőségek
A szervezetbe történő mangán felhalmozódás által okozott PD-hoz rendkívül hasonló Mn neurotoxicitás azonosítására nyújthat új lehetőséget az UPDRS3 (Unified Parkinson Disease Rating Scale Motor Subsection Part 3)(Fahn és mtsai., 1987) eredményét megjósoló több tényezőt figyelembe vevő lineáris regressziós modell ami lehetővé teszi, hogy egy neurológus nélkül is viszonylag pontosan azonosítsuk a betegséget. Ezáltal lehetőséget nyújt, hogy a parkinzonizmus jelenlétét viszonylag kis hibarátával körzetiorvosok vagy akár asszisztensek is azonosítani tudják. A teszt megalkotásában felhasznált adatok: az életkor, mindkét kéz időre történő motoros funkciójának értékelése egy pontozási rendszerben, ahol az alacsonyabb pontszám rosszabb eredményt jelent (Criswell és mtsai., 2010). A teszt figyelembe vett olyan pszichológiai tényezőket is, mint a depresszió, a szorongás vagy a magány. Ezenkívül vizsgálták még az intenciós tremort, fájdalmat, a beszéd nehézségeit, valamint a dohányzást. Az UPDRS3 rendszerben a parkinzonismusra pozitívnak vett eredmény ponthatárát, ha 15 pontnál állapítjuk meg 95%-os megbízhatósági intervallumot érhetünk el.
A tesztet a mangánmérgezésnek fokozottan kitett hegesztőmunkásokon, segédeken végezték azzal a céllal, hogy a mangánizmust és a PD-t egymástól megkülönböztethessék, valamint a klinikum szempontjából jelentős neurotoxicitást azonosítani tudják. Korábbi kutatások azt mutatják, hogy a hegesztők 15%-ának van klinikailag jelentős mangánizmusa (Racette és mtsai., 2012). A kísérletben 18 és 65 év közötti munkások vettek rész, a vizsgálatokat pedig 2 mozgási rendellenességekkel foglalkozó neurológus végezte el összesen 886 főn. Elkészítették a UPDRS3-at is, a felső korhatárt 65 évnél szabták meg, hiszen így a modellt azokra az emberekre lehetett szabni, akik jelenleg is ki vannak téve mangánmérgezésnek. Több különböző kérdéssorral további információkat szereztek a munkásokról, elvégeztek egy a PD-specifikus életminőségről szólót (PDQ39, Jenkinson és mtsai., 1997), egy PD tüneteket vizsgálót (Duarte és mtsai., 1995; Tanner és mtsai., 1990) valamint a munkások életviteléről és egészségügyi állapotáról is nyertek adatokat, a rizikó faktorokra összpontosítva (Hobson és mtsai., 2009; Checkoway és mtsai., 2002). Sor került ezenkívül egy utolsó kérdéssorra is, amivel a hegesztési gázoknak való egyedi kitettséget és az ebből fakadó Mn-felhalmozódást becsülték meg (Racette és mtsai., 2012, 2017). Ezek után 38 munkást az eredmények megerősítéséhez megvizsgáltak MRI-vel (Racette és mtsai., 2017), majd az eredményeket összegezték. Az eredményváltozónak használt UPDRS3 mellék pontszámokat beállították, (erre szükség volt hiszen 2 vizsgáló több év lefolyása alatt végezte el a teszteket) és létrehoztak egy lineáris regressziós modellt ami képes a parkinzonizmus jelenlétére következtetni. Ehhez figyelembe veszik az életkort, a kéz motoros funkciót vizsgáló teszt pontszámait, azok UPDRS3-el erős korrelációjuk miatt. Külön hangsúlyt fektettek azokra a mellék pontszámokra amiket nemcsak neurológusok tudnak felvenni. Sokkal inkább az egyes megfigyelések, tünetek jelenlétét vagy hiányát tartották lényegesnek, mintsem annak szakszerű pontozását amire csak egy neurológus lenne alkalmas. A vizsgálat figyelembe vett egyéb tényezőket is, hogy ezzel tovább pontosíthassák az eredményt, mint például a kérdéssorokból származó adatok (gyógyszerhasználat, depresszió, szorongás, a résztvevők által saját magukon megfigyelt tünetek), amelyek esetén korábbi kutatások kapcsolatot fedeztek fel a mangánnak való túlzott kitettséggel (Bowler és mtsai., 2006, 1999; Mergler és mtsai., 1994). Valamint másodlagos változókat is használtak a végleges változat megalkotásához, végül egy több változós lineáris regressziós modellt kaptak. Az összegzett eredmények alapján a következő következtetsre jutottak: a teszt alanyok korában, erős lineáris asszociációt figyeltek meg a domináns kéz pontszáma és a UPDRS3 pontszám között. A helyzet azonban nem volt ennyire egyértelmű a nem domináns kéz esetén. Itt a magasabb pontszám elérésekor (>35) ellentétes módon asszociáltak a UPDRS3 pontszámmal. A legtöbb elsődleges előrejelző amiket a kérdőívek segítségével nyertek, rendkívül hasznosnak bizonyultak, erős kapcsolat volt közöttük és a UPDRS3 pontszám között. A másodlagos előrejelzők között a fájdalom, dohányzás, nem volt a leglényegesebb szerepű, végül a nem eltávolításra került a kis számú női résztvevő miatt. A fájdalom, szorongás, magány és depresszió jelentőséggel bíró értékeit egy változóba foglalták (PALD: pain, anxiety, lonliness, depression). Ezen változó és a dohányzás között összefügést találtak miszerint a magasabb PALD pontszámmal rendelkező nem dohányzók UPDRS3 értéke magasabb volt, a jelenleg is dohányzók értékei a végső változóba nem kerültek be az egyszerűsítés jegyében. A modell segítésével az esetek mindössze 8%-ában azonosítanánk hibásan azokat akik nem rendelkeznek a betegséggel. Pontosításokat végezhetünk ezenkívül a jobb specificitás vagy szenzitivitás elérése érdekében. Az előrejelzett UPDRS3 pontok esetén 9,88 míg a rendes UPDRS3-nál ≥15 bizonyult az optimálisnak (Rascol és mtsai., 2011; Parkinson Study Group, 1996), ilyen feltételekkel 80% a szenzitivitás. Abban az esetben, ha magasabb értéknél szabjuk meg az előrejelzett UPDRS3 pontszámot, akkor a specifictás pontosságát tudjuk növelni. Az eredményeket tovább lehet pontosítani különböző biológia markerek figyelembe vételével mint például a nyál, vizelet, vér, igaz ez még csak az első fokát jelentené egy több lépcsős elemzési program megalkotásának (Myers és mtsai., 2009). A kutatás legfontosabb eredménye azonban az, hogy a mangán hatására kialakuló neurológiai elváltozások egyszerűbb szűrhetőségére biztosít lehetőséget. Igaz a végső diagnózis felállításához továbbra is elengedhetetlen egy szakértő tudása, de a klinikailag súlyosabb esetek kiszűrése az ő jelenlétük nélkül is lehetségessé válna. Azokat, akiknek az eredménye pozitív lenne, tényleges indokkal lehetne elküldeni egy MRI vizsgálatra, ahol a T1 relaxációs idő (Lee és mtsai., 2015; Lewis és mtsai., 2016) és pallidális index (Criswell és mtsai., 2012; Nelson és mtsai., 1993) alapján már pontos diagnózist lehetne felállítani.
||kep7
Kísérletek
A közelmúltban végzett kutatások a mangán okozta idegrendszeri megbetegedések életkorbeli és nembeli differenciáira irányultak. Különböző vizsgálatok bizonyították, hogy nagyon magas mangán koncentrációjú ivóvíz fogyasztása neuroinflammációt okoz (Morreno és mtsai., 2011), ami tanulási nehézségeket, hiperaktivitást és ebből kifolyólag az iskolai teljesítőképesség romlását okozza. (Collipp és mtsai., 1983; Pihl and Parkes, 1977; He és mtsai., 1994). Ezt a jelenséget gyermekekben figyelték meg, felnőtteknél nem jelentkeztek ilyen súlyos problémák, hiszen a fejlődő szervezet sokkal érzékenyebb a túl magas mangán szintre, mint a felnőtt. Azonban nem csak életkorbeli, hanem nembeli különbségeket is tapasztaltak a kutatók. (Bouchard és mtsai., 2011).
Létrehoztak egy kísérletet, melyben fiatal egereket tanulmányoztak. A kutatás korábbi vizsgálatokra alapult. Az egyik ilyen kísérletben bebizonyították, hogy a magas mangán-expozíció felnőtt egerekben apoptotikus neuronvesztéshez vezet a területén, és a jelenség kapcsolatba hozható az astrocyták által nagy mennyiségben expresszált, indukálható nitrogén-monoxid-szintázzal (NOS2). (Liu és mtsai., 2006). A másikban pedig kimutatták, hogy a fejlődésben lévő hím egerek a magas mangánszint okozta viselkedésbeli és kórtani hatásokra érzékenyebbek, mint nőstény társaik. Ezekben az állatokban emelkedett neuroinflammáció és nitrozatív stressz alakult ki a basalis ganglionokban. (Moreno és mtsai., 2009). Valószínűsíthető, hogy a nőstény egerekben található gyulladás-ellenes hatású E2 (ösztradiol) lehet az oka, hogy a nőstény egerek kevésbé érintettek. Korábban már kimutatták az E2 idegvédő hatását (Callier és mtsai., 2001; Murray és mtsai., 2003; Tripanichkul és mtsai., 2006), azonban az E2 NOS2 expresszióban betöltött szerepét még nem bizonyították.
A kísérletben három csoportba sorolt egerek szerepeltek (nőstények, hímek és E2-vel kezelt hímek). Mindegyik csoportnak 5mg/ testtömeg kg adagolásban adtak mangánt, ami a helyes emberi étrendben szereplő mangán mennyiségének 50-szerese. Végül az egerek striatum és globus pallidus agyterületeiről mintát véve immunfluoreszcens technikával vizsgálták az idegsejteket. (Moreno és mtsai., 2011)
Az eredmények alapján a kutatóknak sikerült bizonyítania az E2 idegsejtekre gyakorolt védő hatását mangánmérgezés esetén is. Azok a hím egerek, melyek ösztradiol kezelést kaptak, kevésbé voltak érzékenyek a magas mangán koncentrációra, hasonló eredményt mutattak, mint nőstény társaik, míg a nem kezelt hím csoport basalis ganglionjaiban jelentős mértékben növekedett a NOS2 expressziója és a fehérjék nitrációja. (Moreno és mtsai., 2011)
Kezelés
A mangán indukálta neuroinflammáció kezelésére lehet alkalmas a patkányokon tesztelt Nátrium-P-Aminoszalicilsav (PAS-Na), ami nemcsak a neuroinflammációra közvetlenül hatva, mint gyulladáscsökkentő, hanem mint kelátképző is segíthet a mangánizmus kezelésében. ((((((A kísérletet 6 darab 15 állaltból álló csoporton végezték el, volt egy kontroll csoport, egy csak PAS-Na-at kapó csoport, egy csak mangánt (Mn) 〖MnCl〗_2⋅〖4H〗_2 O formájában kapó csoport (12 hét) a maradék három csoportot szintén mangánt kapott 12 hétig majd azután 6 hétig PAS-Na-t csoportonként eltérő dózisban (80, 160 and 240 mg/kg).))))))) Az állatok tanulási képességét és memóriáját a Morris-féle vízi labirintus teszttel vizsgálták (Li et al 2014; Li et al 2015; Ou et al., 2016). A mangánszint és gyulladáskeltő cytokinek mennyiségének kiértékeléshez az állatokból vért vettek, valamint szövetmintát nyertek a thalamusból, hippocampusból és a cortexből is a GFAP (glial fibrillary acidic protein) immunhisztokémiai vizsgálatához (Li et al., 2015). Ezeken kívül valós idejű polimer láncreakciót (RT-PCR) és Western blott-ot használtak a kiértékeléshez. Az eredmények egyértelműen jelezték a PAS-Na kedvező hatását. A csak Mn-al kezelt csoportban jelentős súlycsökkenést figyeltek meg, valamint a vér, agykéreg, thalamus, és hippocampus Mn-koncentrációja is magas volt. A PAS-Na kezelt csoportokban kevésbé volt jellemző a súly csökkenés valamint a Mn-koncentráció is lényegesen alacsonyabb volt. A legnagyobb dózist kapó csoport (240 mg/Kg) eredményei bizonyultak a legjobbnak a Mn-al és PAS-NA-val is kezelt csoportok közül. A Morris féle vízi labirintus teszt esetén mindhárom PAS-sal kezelt csoport jobb eredményt ért el, mint a csak mangánnal kezelt csoport, viszont a PAS-Na kezelés ellenére sem érték el a kontroll csoport szintjét. A mangánt kapó csoportokban megfigyelték ezenkívül a GFAP általi fokozott immunreakciót, emelkedett gyulladáskeltő cytokin szintet (IL-1β , IL-6, TNF-α és PGE2) valamint az ezek szintetizálásáért felelős mRNS expressziójának növekedését. A három PAS-NA-ot kapó csoportban a normál értékekhez kezdtek visszatérni a 6 hetes kezelés során. A csak PAS-Na-val kezelt és kontroll csoport eredményei között nem találtak különbséget. A gyulladás kialakulásáért felelős ciklooxigenáz-2 (COX-2) és agyi mitogén-aktivált proteinkináz (MAPK) hatása is csökkent a kezelt csoportokban. A PAS tehát bizonyítottan csökkenti a kóros mangán szintet a vérben és az agyban is, és gátolja astrocyták aktivációját, valamint segít a memória és tanulási képesség helyreállításában. A hosszabb felezési ideje, jobb lipid oldhatósága és szövetekhez való erősebb kötődése miatt az Acetil-para-N-aminoszalicilsav (AcPAS) a PAS-Na-nál is hatékonyabbnak bizonyulhat (Hong et al., 2011a,b), azonban ennek használata további kutató munkát igényel.
Szintén alkalmas kezelési módot biztosíthat a kvercetin (QCT), ami hatását az oxidatív stressz csökkentése (Dong 2014) és gyulladás ellenes tulajdonsága révén éri el. Előfordulását tekintve számos zöldségben és gyümölcsben megtalálható flavonoidról van szó (Van Duynhoven 2011; Erlund 2004), amely sok egyéb betegség kezelésében is segíthet (Zhang, 2015; Comalada, 2005; Lu, 2006). A neurodegeneráció valamint inflammáció ellenes hatása sokrétű. Az NF-κB reakcióútra kifejtett gátló hatása révén az olyan gyulladásért felelős enzimek mint a indukálható nitrogén monoxid szintáz (iNOS) és COX-2 szintje csökken. Serkentő hatására az Nrf2 (Nuclear factor erythroid 2-related factor 2) és hemoxigenáz-1 (HO-1) antioxidáns tulajdonságú anyagok mennyisége pedig növekszik (Kinaci 2012; Saw 2014). A lipidperoxidáció hatására felszabaduló malondialdehid és 8-OHDdG (8-hydroxy-2' deoxyguanosine) mennyisége a Mn hatására károsan megnövekedett, viszont QCT hatására mennyiségük csökkenni kezdett, a szuperoxid-dizmutáz (SOD), kataláz (CAT), glutation (GSH) antioxidáns vegyületek szintje pedig emelkedni kezdtek a QCT-nek köszönhetően. A mitochondrium membránja a Mn hatására kialakult oxidatív stressz miatt depolarizálódik, ezért az apoptózis (sejthalál) irányításában szerepet játszó Bax miat citokróm-c jut a sejtplazmába, ez aktiválni fogja a kaszpáz reakcióutat (O’Rourke 2005), ami kaszpáz-9, kaszpáz-3 és PARP-1 felszabadulással jár, ami végül sejthalálhoz vezet (Debatin 2002; Lazebnik 1994). A QCT képes a sejthalálért felelős anyagok mennyiségét csökkenteni, ezzel védve az idegsejteket. A QCT ezenkívül csökkentette az inflammáció kialakulásában fontos szerepet játszó cytokinek szintjét, valamint a kísérleti patkányokon nem találtak agyi bevérzéseket, ami egy jól megfigyelhető elváltozás volt a mangánnal kezelt állatokban.
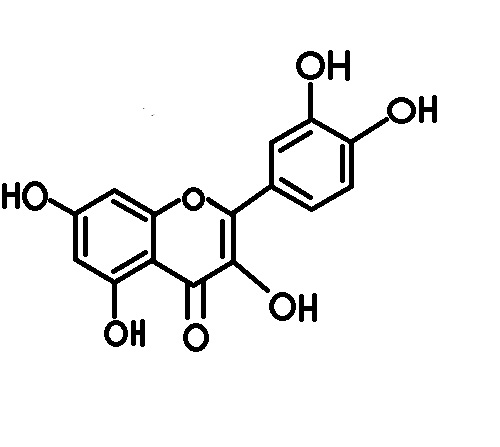
7. ábra: Kvercetin szerkezeti képlete |
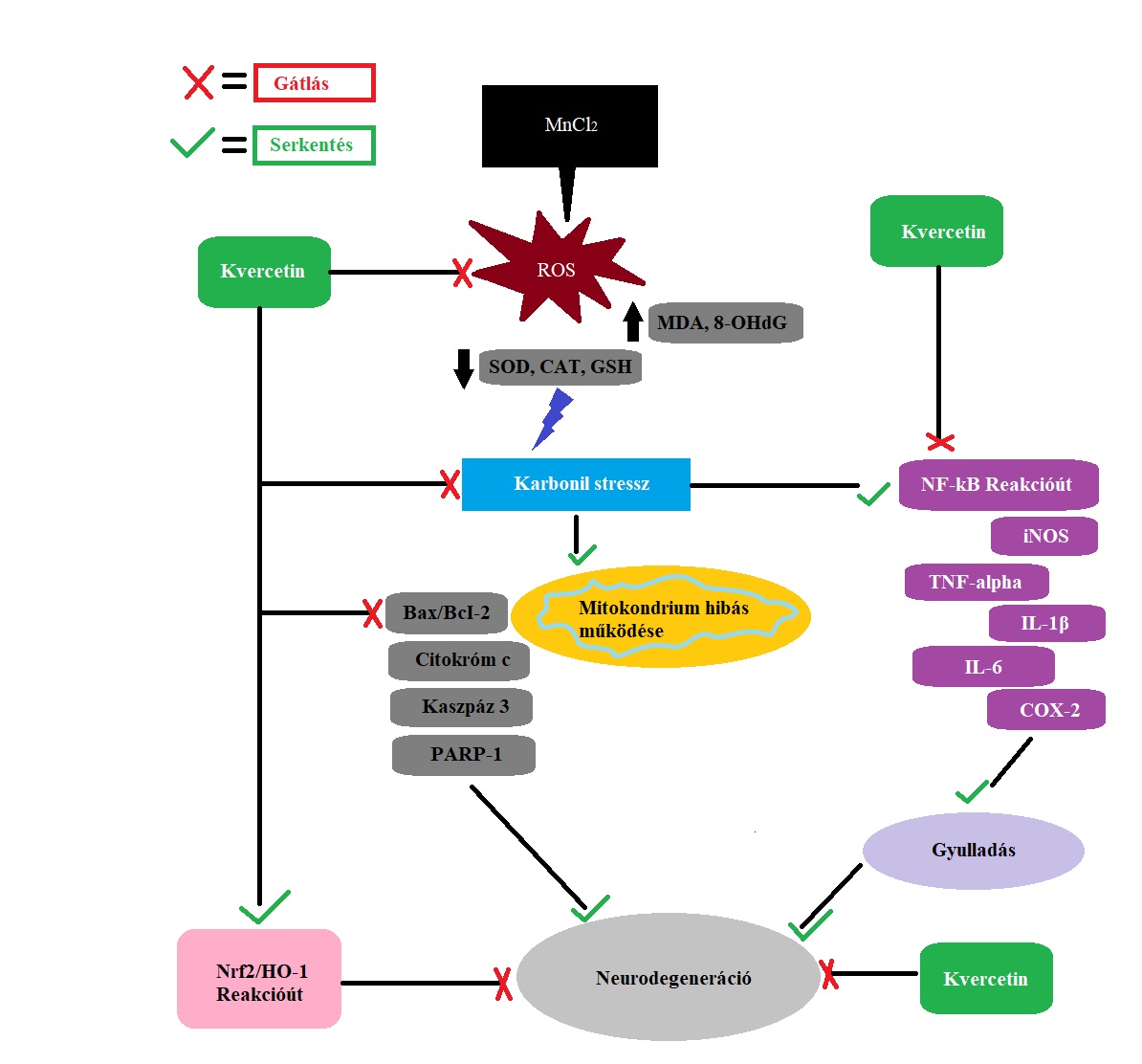
8. ábra: A kvercetin neuroinflammáció-ellenes hatása |
Források
Irodalomjegyzék
![]() 'Edit conflict - other version:
'Edit conflict - other version:
Múltbéli kutatások: '
Felhasznált irodalom:
Blanc, P. D.: The early history of manganese and the recognition of its neurotoxicity, 1837-1936. Neurotoxycology 64 (2018) 5-11 ' '
NLRP3 '
Felhasznált irodalom: ' '
S. Sarkar, D. Rokad, E. Malovic, J. Luo, D. S. Harischandra, H. Jin, V. Anantharam, X. Huang, M. Lewis, A. Kanthasamy, A. G. Kanthasamy, Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. Sci. Signal. 12, eaat9900 (2019). ' '
Referenciák:
14.Freeman, L. C.; Ting, J. P.-Y. The pathogenic role of the inflammasome in neurodegenerative diseases. J. Neurochem. 136, 29–38 (2015). ' '
15.Halle, A.; Hornung, V.; Petzold, G. C.; Stewart, C. R.; Monks, B. G.; Reinheckel, T.; Fitzgerald, K. A.; Latz, E.; Moore, K. J.; Golenbock, D.T.; The NALP3 inflammasome is involved in the innate immune response to amyloid-. Nat. Immunol. 9, 857–865 (2008). ' '
16.Codolo, G.; Plotegher, N.; Pozzobon, T.; Brucale, M.; Tessari, I.; Bubacco, L.; de Bernard, M.; Triggering of inflammasome by aggregated –synuclein, an inflammatory response in synucleinopathies. PLOS ONE 8, e55375 (2013). ' '
17.Zhou, R.; Yazdi, A.S.; Menu, P.; Tschopp, J.; A role for mitochondria in NLRP3 inflammasome activation. Nature 469, 221–225 (2011). '
18. Alfonso-Loeches, S.; Ureña-Peralta, J. R.; Morillo-Bargues, M. J.; Oliver-De La Cruz, J.; Guerri, C.; Role of mitochondria ROS generation in ethanol-induced NLRP3 inflammasome activation and cell death in astroglial cells. Front. Cell. Neurosci. 8, 216 (2014). ' ' 19.Franklin, B. S.; Bossaller, L.; De Nardo, D.; Ratter, J. M.; Stutz, A.; Engels, G.; Brenker, C.; Nordhoff, M.; Mirandola, S.R.; Al-Amoudi, A.; Mangan, M.S.; Zimmer, S.; Monks, B.G.; Fricke, M.; Schmidt, R. E.; Espevik, T.; Jones, B.; Jarnicki, A. G.; Hansbro, P. M.; Busto, P.; Marshak-Rothstein, A.; Hornemann, S.; Aguzzi, A.; Kastenmüller, W.; Latz, E.; The adaptor ASC has extracellular and ‘prionoid’ activities that propagate inflammation. Nat. Immunol. 15, 727–737 (2014). ' ' 26.Milatovic, D.; Yin, Z.; Gupta, R. C.; Sidoryk, M.; Albrecht, J.; Aschner, J. L.; M. Aschner, Manganese induces oxidative impairment in cultured rat astrocytes. Toxicol. Sci. 98, 198–205 (2007). ' ' 34.Yin, Z.; Aschner, J.L.; dos Santos, A.P.; Aschner, M.: Mitochondrial-dependent manganese neurotoxicity in rat primary astrocyte cultures. Brain Res. 1203, 1–11 (2008). ' ' 43.Sarkar, S.; Malovic, E.; Harishchandra, D. S.; Ghaisas, S.; Panicker, N.; Charli, A.; Palanisamy, B. N.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A.; Kanthasamy, A. G.: Mitochondrial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease. NPJ Parkinsons Dis. 3, 30 (2017). ' 50.Roth,J. A.; Horbinski, C.; Higgins, D.; Lein, P.; Garrick, M. D.:Mechanisms of manganeseinduced rat pheochromocytoma (PC12) cell death and cell differentiation. Neurotoxicology 23, 147–157 (2002). 74.Rakovic, A.; Grünewald, A.; Kottwitz, J.; Brüggemann, N.; Pramstaller, P. P.; Lohmann, K.; Klein, C.:Mutations in PINK1 and Parkin impair ubiquitination of Mitofusins in human fibroblasts. PLOS ONE 6, e16746 (2011). 75.Rocha, N.; Bulger, D.A; Frontini, A.; Titheradge, H.; Gribsholt, S. B.; Knox, R.; Page, M.; Harris, J.; Payne, F.; Adams, C.; Sleigh, A.; Crawford, J.; Gjesing, A. P.; Bork-Jensen, J.; Pedersen, O.; Barroso, I.; Hansen, T.; Cox, H.; Reilly, M.; Rossor, A.; Brown, R.J.; Taylor, S. I.; McHale, D.; Armstrong, M.; Oral, E. A.; Saudek, V.; O'Rahilly, S. I.; Maher, E. R.; Richelsen, B.; Savage, B. D.; Semple, R. K.: Human biallelic MFN2 mutations induce mitochondrial dysfunction, upper body adipose hyperplasia, and suppression of leptin expression. eLife 6, e23813 (2017). 81. Follett, J.; Norwood, S. J.; Hamilton, N. A.; Mohan, M.; Kovtun, O.; Tay, S.; Zhe, Y.; Wood, S. A; Mellick, G. D.; Silburn, P. A.; Collins, B. M.; Bugarcic, A.; Teasdale, R. D.:The Vps35 D620N mutation linked to Parkinson’s disease disrupts the cargo sorting function of retromer. Traffic 15, 230–244 (2014). 86.Gupta, A.; Pulliam, L.:Exosomes as mediators of neuroinflammation. J. Neuroinflammation 11, 68 (2014). Exosoma' Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 Referenciák: ' ' Thery, C.; Zitvogel, L.; and Amigorena, S. (2002). Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2, 569–579. doi: 10.1038/nri855
Sarko, D. K.; and McKinney, C. E. (2017). Exosomes: origins and therapeutic potential for neurodegenerative disease. Front. Neurosci. 11:82. doi: 10.3389/fnins.2017.00082 ' '
Luan, X.; Sansanaphongpricha, K.; Myers, I.; Chen, H.; Yuan, H.; and Sun, D. (2017). Engineering exosomes as refined biological nanoplatforms for drug delivery. Acta Pharmacol. Sin. 38, 754–763. doi: 10.1038/aps.2017.12 '
Munson, P.; Lam, Y. W.; Macpherson, M.; Beuschel, S.; and Shukla, A. (2018). Mouse serum exosomal proteomic signature in response to asbestos exposure. J. Cell. Biochem. 119, 6266–6273. doi: 10.1002/jcb.26863 ' ' Ngalame, N. N. O.; Luz, A. L.; Makia, N.; and Tokar, E. J. (2018). Arsenic alters exosome quantity and cargo to mediate stem cell recruitment into a cancer stem cell-like phenotype. Toxicol. Sci. 165, 40–49. doi: 10.1093/toxsci/kfy176 Harischandra, D. S.; Ghaisas, S.; Rokad, D.; Zamanian, M.; Jin, H.; Anantharam, V., és mtsai. (2018). Environmental neurotoxicant manganese regulates exosome-mediated extracellular miRNAs in cell culture model of Parkinson’s disease: relevance to alpha-synuclein misfolding in metal neurotoxicity. Neurotoxicology 64, 267–277. doi: 10.1016/j.neuro.2017.04.007
Harischandra, D. S.; Lawana, V.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A., és mtsai. (2015b). Lysosomal dysfunction caused by the environmental neurotoxicant manganese increases exosome-mediated cell-to-cell transfer of α-synuclein by a prion-like mechanism. Neurotoxicol. Teratol. 49:109. doi: 10.1016/j.ntt.2015.04.034
Harischandra, D. S.; Rokad, D.; Neal, M. L.; Ghaisas, S.; Manne, S.; Sarkar, S., és mtsai. (2019). Manganese promotes the aggregation and prion-like cell-to-cell exosomal transmission of alpha-synuclein. Sci. Signal. 12:eaau4543. doi: 10.1126/scisignal.aau4543 ' ' Pfeffer, S. R. (2010). Two Rabs for exosome release. Nat. Cell Biol. 12, 3–4. doi: 10.1038/ncb0110-3 Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900 ' ' ' Astroglia, glutamát-GABA ciklus:' ' Felhasznált irodalom: Sarkar, S.; Malovic, E.; Harischandra, D. S.; Ngwa, H. A.; Ghosh, A.; Hogan, C.; Rokad, D.; Zenitsky, G.; Jin, H.; Anantharam, V.; Kanthasamy, A. G., (2017): Manganese exposure induces neuroinflammation by impairing mitochondrial dynamics in astrocytes. NeuroToxicology, Volume 64, January 2018, Pages 204-218 Referenciák':' Karki, P.; Lee, E.; Aschner, M., (2013): Manganese neurotoxicity: a focus on glutamate transporters; Ann. Occup. Environ. Med., 25 (1) (2013), p. 4 Erikson, K. M.; and Aschner, M. (2006). Increased manganese uptake by primary astrocyte cultures with altered iron status is mediated primarily by divalent metal transporter. Neurotoxicology 27, 125–130. doi: 10.1016/j.neuro.2005. 07.003 Huang, C. C. (2007). Parkinsonism induced by chronic manganese intoxication–an experience in Taiwan. Chang Gung Med. J. 30, 385–395. Perl, D. P.; and Olanow, C. W. (2007). The neuropathology of manganese-induced Parkinsonism. J. Neuropathol. Exp. Neurol. 66, 675–682. doi: 10.1097/nen. 0b013e31812503cf ' ' ' ' Cordova, F. M.; Aguiar, A. S. Jr.; Peres, T. V.; Lopes, M. W.; Gonçalves, F. M.; Pedro, D. Z., és mtsai. (2013). Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox. Arch. Toxicol. 87, 1231–1244. doi: 10.1007/s00204-013-1017-5 '
Carson, M. J.; Bilousova, T. V.; Puntambekar, S. S.; Melchior, B.; Doose, J. M.; and Ethell, I. M. (2007). A rose by any other name? The potential consequences of microglial heterogeneity during CNS health and disease. Neurotherapeutics 4, 571–579. doi: 10.1016/j.nurt.2007.07.002 ' '
Tansey, M. G.; Frank-Cannon, T. C.; Mccoy, M. K.; Lee, J. K.; Martinez, T. N.; Mcalpine, F. E., és mtsai. (2008). Neuroinflammation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy? Front. Biosci. 13, 709–717. doi: 10.1007/s11481-009-9176-0 '
Mogi, M.; Harada, M.; Kondo, T.; Riederer, P.; Inagaki, H.; Minami, M., és mtsai. (1994). Interleukin-1 beta, interleukin-6, epidermal growth factor and transforming growth factor-alpha are elevated in the brain from Parkinsonian patients. Neurosci. Lett. 180, 147–150. doi: 10.1016/0304-3940(94)90 508-8 ' ' '
Przedborski, S.; and Vila, M. (2003). The 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine mouse model: a tool to explore the pathogenesis of Parkinson’s disease. Ann. N. Y. Acad. Sci. 991, 189–198. doi: 10.1111/j.1749-6632.2003.tb07476.x '
Ghosh, A.; Roy, A.; Liu, X.; Kordower, J. H.; Mufson, E. J.; Hartley, D. M., és mtsai. (2007). Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proc. Natl. Acad. Sci. U.S.A. 104, 18754–18759. doi: 10.1073/pnas.0704908104 ' ' ' Miklossy, J.; Doudet, D. D.; Schwab, C.; Yu, S.; Mcgeer, E. G.; and Mcgeer, P. L. (2006). Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys. Exp. Neurol. 197, 275–283. doi: 10.1016/j.expneurol.2005. 10.034 Ghosh, A.; Roy, A.; Matras, J.; Brahmachari, S.; Gendelman, H. E.; and Pahan, K. (2009). Simvastatin inhibits the activation of p21ras and prevents the loss of dopaminergic neurons in a mouse model of Parkinson’s disease. J. Neurosci. 29, 13543–13556. doi: 10.1523/JNEUROSCI.4144-09.2009 Wedler, F. C.; and Denman, R. B. (1984). Glutamine synthetase: the major Mn(II) enzyme in mammalian brain. Curr. Top. Cell. Regul. 24, 153–169.
Farina, M.; Avila, D. S.; Da Rocha, J. B.; and Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury. Neurochem. Int. 62, 575–594. doi: 10.1016/j.neuint.2012.12.006 ' ' Rama Rao, K. V.; Reddy, P. V.; Hazell, A. S.; and Norenberg, M. D. (2007). Manganese induces cell swelling in cultured astrocytes. Neurotoxicology 28, 807–812. doi: 10.1016/j.neuro.2007.03.001 ' ' ' Moreno, J. A.; Sullivan, K. A.; Carbone, D. L.; Hanneman, W. H.; and Tjalkens, R. B. (2008). Manganese potentiates nuclear factor-kappaB-dependent expression of nitric oxide synthase 2 in astrocytes by activating soluble guanylate cyclase and extracellular responsive kinase signaling pathways. J. Neurosci. Res. 86, 2028–2038. doi: 10.1002/jnr.21640 ' Hazell, A. S.; and Norenberg, M. D. (1998). Ammonia and manganese increase arginine uptake in cultured astrocytes. Neurochem. Res. 23, 869–873. ' ' Sengupta, A.; Mense, S. M.; Lan, C.; Zhou, M.; Mauro, R. E.; Kellerman, L., és mtsai. (2007). Gene expression profiling of human primary astrocytes exposed to manganese chloride indicates selective effects on several functions of the cells. Neurotoxicology 28, 478–489. doi: 10.1016/j.neuro.2006.10.005 Bak, L. K.; Schousboe, A.; and Waagepetersen, H. S. (2006). The glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer. J. Neurochem. 98, 641–653. doi: 10.1111/j.1471-4159.2006. 03913.x Diagnosztika:' Racette, B.A., Criswell, S.R., Lundin, J.I., Hobson, A., Seixas, N., Kotzbauer, P.T., Evanoff, B.A., Perlmutter, J.S., Zhang, J., Sheppard, L., Checkoway, H., 2012. Increased risk of parkinsonism associated with welding exposure. Neurotoxicology 33 (5), 1356–1361. Hobson, A.J., Sterling, D.A., Emo, B., Evanoff, B.A., Sterling, C.S., Good, L., Seixas, N., Checkoway, H., Racette, B.A., 2009. Validity and reliability of an occupational exposure questionnaire for parkinsonism in welders. J. Occup. Environ. Hyg. 6 (6), 324–331. Racette, B.A., Searles Nielsen, S., Criswell, S.R., Sheppard, L., Seixas, N., Warden, M.N., Checkoway, H., 2017. Dose-dependent progression of parkinsonism in manganese-exposed welders. Neurology 88 (4), 344–351. Bowler, R.M., Nakagawa, S., Drezgic, M., Roels, H.A., Park, R.M., Diamond, E., Mergler, D., Bouchard, M., Bowler, R.P., Kollerg, W., 2007. Sequelae of fume exposure in confined space welding: a neurological and neuropsychological case series. Neurotoxicology 28 (2), 298–311. Rascol, O., Fitzer-Attas, C.J., Hauser, R., Jankovic, J., Lang, A., Langston, J.W., Melamed, E., Poewe, W., Stocchi, F., Tolosa, E., Eyal, E., Weiss, Y.M., Olanow, C.W., 2011. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease (the ADAGIO study): prespecified and post-hoc analyses of the need for additional therapies, changes in UPDRS scores, and non-motor outcomes. Lancet Neurol.10 (5), 415–423.
Felhasznát irodalom: ' ' Moreno, J. A., Streifel, K. M., Sullivan, K. A., Hanneman, W. H., Tjalkens, R. B.: Manganese-Induced NF-jB Activation and Nitrosative Stress Is Decreased by Estrogen in Juvenile Mice. Toxicological Scienses, 122 : (1) 121-133, 2011 ' ' ' ' Referenciák: ' Bouchard, M. F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M. E., Bouffard, T., Limoges, E., Bellinger, D. C., and Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect. 119, 138–143. ' ' ' Callier, S., Morissette, M., Grandbois, M., Pelaprat, D., and Di Paolo, T. (2001). Neuroprotective properties of 17beta-estradiol, progesterone, and raloxifene in MPTP C57Bl/6 mice. Synapse. 41, 131–138. ' Collipp, P. J., Chen, S. Y., and Maitinsky, S. (1983). Manganese in infant formulas and learning disability. Ann. Nutr. Metab. 27, 488–494. Moreno, J. A., Streifel, K. M., Sullivan, K. A., Legare, M. E., and Tjalkens, R. B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci. 112, 405–415. Pihl, R. O., and Parkes, M. (1977). Hair element content in learning disabled children. Science. 198, 204–206.
Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654; figure 5. 4. ábra, (újrarajzolt): 6. ábra: 7. ábra, (újrarajzolt): 8. ábra, (újrarajzolt): Ábrajegyzék
1. ábra, (újrarajzolt): '
' 2. ábra: ' '
Manganit, piroluzit és egyéb mangánércek az úrkúti mangánérc-bánya meddőhányóiról; Horváth András gyűjtése és fényképe 3. ábra, (újrarajzolt): ' ' ' '
https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system%3A-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1 ' ' '
https://faculty.virginia.edu/.archived/metals/cases/corson1.html https://www.sciencedirect.com/science/article/pii/S0020169307005464#fig1 ' 5. ábra, (újrarajzolt): ' ' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900; figure 7.
https://www.pxfuel.com/en/free-photo-ozirv '
https://upload.wikimedia.org/wikipedia/commons/8/81/Quercetin.svg
https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click%20on%20image%20to%20zoom&p=PMC3&id=5618638_ijms-18-01989-g012.jpg Entaz Bahar., Ji-Ye Kim., Hyonok Yoon.,Quercetin Attenuates Manganese-Induced Neuroinflammation by Alleviating Oxidative Stress through Regulation of Apoptosis, iNOS/NF-κB and HO-1/Nrf2 Pathways; pii: E1989. doi: 10.3390/ijms18091989. ' ![]() Edit conflict - your version:
Edit conflict - your version:
S. Sarkar, D. Rokad, E. Malovic, J. Luo, D. S. Harischandra, H. Jin, V. Anantharam, X. Huang, M. Lewis, A. Kanthasamy, A. G. Kanthasamy, Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. Sci. Signal. 12, eaat9900 (2019). Referenciák: '
14.Freeman, L. C.; Ting, J. P.-Y. The pathogenic role of the inflammasome in neurodegenerative diseases. J. Neurochem. 136, 29–38 (2015). ' 15.Halle, A.; Hornung, V.; Petzold, G. C.; Stewart, C. R.; Monks, B. G.; Reinheckel, T.; Fitzgerald, K. A.; Latz, E.; Moore, K. J.; Golenbock, D.T.; The NALP3 inflammasome is involved in the innate immune response to amyloid-. Nat. Immunol. 9, 857–865 (2008). ' 16.Codolo, G.; Plotegher, N.; Pozzobon, T.; Brucale, M.; Tessari, I.; Bubacco, L.; de Bernard, M.; Triggering of inflammasome by aggregated –synuclein, an inflammatory response in synucleinopathies. PLOS ONE 8, e55375 (2013). 17.Zhou, R.; Yazdi, A.S.; Menu, P.; Tschopp, J.; A role for mitochondria in NLRP3 inflammasome activation. Nature 469, 221–225 (2011). '
26.Milatovic, D.; Yin, Z.; Gupta, R. C.; Sidoryk, M.; Albrecht, J.; Aschner, J. L.; M. Aschner, Manganese induces oxidative impairment in cultured rat astrocytes. Toxicol. Sci. 98, 198–205 (2007).
34.Yin, Z.; Aschner, J.L.; dos Santos, A.P.; Aschner, M.: Mitochondrial-dependent manganese neurotoxicity in rat primary astrocyte cultures. Brain Res. 1203, 1–11 (2008). '
43.Sarkar, S.; Malovic, E.; Harishchandra, D. S.; Ghaisas, S.; Panicker, N.; Charli, A.; Palanisamy, B. N.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A.; Kanthasamy, A. G.: Mitochondrial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease. NPJ Parkinsons Dis. 3, 30 (2017).
50. J. A. Roth, C. Horbinski, D. Higgins, P. Lein, M. D. Garrick, Mechanisms of manganeseinduced rat pheochromocytoma (PC12) cell death and cell differentiation. Neurotoxicology 23, 147–157 (2002). ' '
54. F.-L. Tang, W. Liu, J.-X. Hu, J. R. Erion, J. Ye, L. Mei, W.-C. Xiong, VPS35 deficiency or mutation causes dopaminergic neuronal loss by impairing mitochondrial fusion and function. Cell Rep. 12, 1631–1643 (2015).
58. E. -K. Jo, J. K. Kim, D.-M. Shin, C. Sasakawa, Molecular mechanisms regulating NLRP3 inflammasome activation. Cell. Mol. Immunol. 13, 148–159 (2016). '
59. F. Martinon, V. Pétrilli, A. Mayor, A. Tardivel, J. Tschopp, Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 440, 237–241 (2006). 60. C. Dostert, V. Pétrilli, R. Van Bruggen, C. Steele, B. T. Mossman, J. Tschopp, Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science 320, 674–677 (2008). ' ' 61. V. Lawana, N. Singh, S. Sarkar, A. Charli, H. Jin, V. Anantharam, A. G. Kanthasamy, A. Kanthasamy, Involvement of c-Abl kinase in microglial activation of NLRP3 inflammasome and impairment in autolysosomal system. J. Neuroimmune Pharmacol. 12, 624–660 (2017).
73. K. V. R. Rao, M. D. Norenberg, Manganese induces the mitochondrial permeability transition in cultured astrocytes. J. Biol. Chem. 279, 32333–32338 (2004).
74. A. Rakovic, A. Grünewald, J. Kottwitz, N. Brüggemann, P. P. Pramstaller, K. Lohmann, C. Klein, Mutations in PINK1 and Parkin impair ubiquitination of Mitofusins in human fibroblasts. PLOS ONE 6, e16746 (2011). ' 75. N. Rocha, D. A. Bulger, A. Frontini, H. Titheradge, S. B. Gribsholt, R. Knox, M. Page, J. Harris, F. Payne, C. Adams, A. Sleigh, J. Crawford, A. P. Gjesing, J. Bork-Jensen, O. Pedersen, I. Barroso, T. Hansen, H. Cox, M. Reilly, A. Rossor, R. J. Brown, S. I. Taylor, D. McHale, M. Armstrong, E. A. Oral, V. Saudek, S. I. O'Rahilly, E. R. Maher, B. Richelsen, D. B. Savage, R. K. Semple, Human biallelic MFN2 mutations induce mitochondrial dysfunction, upper body adipose hyperplasia, and suppression of leptin expression. eLife 6, e23813 (2017).
78. W. Wang, X. Wang, H. Fujioka, C. Hoppel, A. L. Whone, M. A. Caldwell, P. J. Cullen, J. Liu, X. Zhu, Parkinson’s disease–associated mutant VPS35 causes mitochondrial dysfunction by recycling DLP1 complexes. Nat. Med. 22, 54–63 (2016). '
81. J. Follett, S. J. Norwood, N. A. Hamilton, M. Mohan, O. Kovtun, S. Tay, Y. Zhe, S. A. Wood, G. D. Mellick, P. A. Silburn, B. M. Collins, A. Bugarcic, R. D. Teasdale, The Vps35 D620N mutation linked to Parkinson’s disease disrupts the cargo sorting function of retromer. Traffic 15, 230–244 (2014). 82. L. J. Vella, A. F. Hill, L. Cheng, Focus on extracellular vesicles: Exosomes and their role in protein trafficking and biomarker potential in Alzheimer’s and Parkinson’s disease. Int. J. Mol. Sci. 17, 173 (2016). ' '
86. A. Gupta, L. Pulliam, Exosomes as mediators of neuroinflammation. J. Neuroinflammation 11, 68 (2014). 88. K. Dierschke, C. Isaxon, U. B. K. Andersson, E. Assarsson, A. Axmon, L. Stockfelt, A. Gudmundsson, B. A. G. Jönsson, M. Kåredal, J. Löndahl, J. Pagels, A. Wierzbicka, M. Bohgard, J. Nielsen, Acute respiratory effects and biomarkers of inflammation due to welding-derived nanoparticle aggregates. Int. Arch. Occup. Environ. Health 90, 451–463 (2017). Exosoma Felhasznált irodalom: ' https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full '
Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 ' ' '
Referenciák: '
Thery, C.; Zitvogel, L.; and Amigorena, S. (2002). Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2, 569–579. doi: 10.1038/nri855 ' '
Sarko, D. K.; and McKinney, C. E. (2017). Exosomes: origins and therapeutic potential for neurodegenerative disease. Front. Neurosci. 11:82. doi: 10.3389/fnins.2017.00082
Luan, X.; Sansanaphongpricha, K.; Myers, I.; Chen, H.; Yuan, H.; and Sun, D. (2017). Engineering exosomes as refined biological nanoplatforms for drug delivery. Acta Pharmacol. Sin. 38, 754–763. doi: 10.1038/aps.2017.12 ' Munson, P.; Lam, Y. W.; Macpherson, M.; Beuschel, S.; and Shukla, A. (2018). Mouse serum exosomal proteomic signature in response to asbestos exposure. J. Cell. Biochem. 119, 6266–6273. doi: 10.1002/jcb.26863 ' Ngalame, N. N. O.; Luz, A. L.; Makia, N.; and Tokar, E. J. (2018). Arsenic alters exosome quantity and cargo to mediate stem cell recruitment into a cancer stem cell-like phenotype. Toxicol. Sci. 165, 40–49. doi: 10.1093/toxsci/kfy176
Harischandra, D. S.; Ghaisas, S.; Rokad, D.; and Kanthasamy, A. G. (2017). Exosomes in toxicology: relevance to chemical exposure and pathogenesis of environmentally linked diseases. Toxicol. Sci. 158, 3–13. doi: 10.1093/toxsci/kfx074 Harischandra, D. S.; Ghaisas, S.; Rokad, D.; Zamanian, M.; Jin, H.; Anantharam, V., és mtsai. (2018). Environmental neurotoxicant manganese regulates exosome-mediated extracellular miRNAs in cell culture model of Parkinson’s disease: relevance to alpha-synuclein misfolding in metal neurotoxicity. Neurotoxicology 64, 267–277. doi: 10.1016/j.neuro.2017.04.007 Harischandra, D. S.; Jin, H.; Anantharam, V.; Kanthasamy, A., and Kanthasamy, A. G. (2015a). alpha-Synuclein protects against manganese neurotoxic insult during the early stages of exposure in a dopaminergic cell model of Parkinson’s disease. Toxicol. Sci. 143, 454–468. doi: 10.1093/toxsci/kfu247 Harischandra, D. S.; Lawana, V.; Rokad, D.; Jin, H.; Anantharam, V.; Kanthasamy, A., és mtsai. (2015b). Lysosomal dysfunction caused by the environmental neurotoxicant manganese increases exosome-mediated cell-to-cell transfer of α-synuclein by a prion-like mechanism. Neurotoxicol. Teratol. 49:109. doi: 10.1016/j.ntt.2015.04.034 ' ' ' Harischandra, D. S.; Rokad, D.; Neal, M. L.; Ghaisas, S.; Manne, S.; Sarkar, S., és mtsai. (2019). Manganese promotes the aggregation and prion-like cell-to-cell exosomal transmission of alpha-synuclein. Sci. Signal. 12:eaau4543. doi: 10.1126/scisignal.aau4543 Pfeffer, S. R. (2010). Two Rabs for exosome release. Nat. Cell Biol. 12, 3–4. doi: 10.1038/ncb0110-3 ' Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900
Felhasznált irodalom:
https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full '
Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654 https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-017-0871-0 ' '
Kirkley, K. S.; Popichak, K. A.; Afzali, M. F. et al. Microglia amplify inflammatory activation of astrocytes in manganese neurotoxicity. J Neuroinflammation 14, 99 (2017).' https://doi.org/10.1186/s12974-017-0871-0 ' '
Referenciák': '
Erikson, K. M.; and Aschner, M. (2006). Increased manganese uptake by primary astrocyte cultures with altered iron status is mediated primarily by divalent metal transporter. Neurotoxicology 27, 125–130. doi: 10.1016/j.neuro.2005. 07.003
Huang, C. C. (2007). Parkinsonism induced by chronic manganese intoxication–an experience in Taiwan. Chang Gung Med. J. 30, 385–395. '
Perl, D. P.; and Olanow, C. W. (2007). The neuropathology of manganese-induced Parkinsonism. J. Neuropathol. Exp. Neurol. 66, 675–682. doi: 10.1097/nen. 0b013e31812503cf
Cordova, F. M.; Aguiar, A. S. Jr.; Peres, T. V.; Lopes, M. W.; Gonçalves, F. M.; Pedro, D. Z., és mtsai. (2013). Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox. Arch. Toxicol. 87, 1231–1244. doi: 10.1007/s00204-013-1017-5 ' ' Carson, M. J.; Bilousova, T. V.; Puntambekar, S. S.; Melchior, B.; Doose, J. M.; and Ethell, I. M. (2007). A rose by any other name? The potential consequences of microglial heterogeneity during CNS health and disease. Neurotherapeutics 4, 571–579. doi: 10.1016/j.nurt.2007.07.002 Tansey, M. G.; Frank-Cannon, T. C.; Mccoy, M. K.; Lee, J. K.; Martinez, T. N.; Mcalpine, F. E., és mtsai. (2008). Neuroinflammation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy? Front. Biosci. 13, 709–717. doi: 10.1007/s11481-009-9176-0 ' Ghosh, A.; Roy, A.; Liu, X.; Kordower, J. H.; Mufson, E. J.; Hartley, D. M., és mtsai. (2007). Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proc. Natl. Acad. Sci. U.S.A. 104, 18754–18759. doi: 10.1073/pnas.0704908104 Ghosh, A.; Roy, A.; Matras, J.; Brahmachari, S.; Gendelman, H. E.; and Pahan, K. (2009). Simvastatin inhibits the activation of p21ras and prevents the loss of dopaminergic neurons in a mouse model of Parkinson’s disease. J. Neurosci. 29, 13543–13556. doi: 10.1523/JNEUROSCI.4144-09.2009
Wedler, F. C.; and Denman, R. B. (1984). Glutamine synthetase: the major Mn(II) enzyme in mammalian brain. Curr. Top. Cell. Regul. 24, 153–169. ' ' Wedler, F. C.; Vichnin, M. C.; Ley, B. W.; Tholey, G.; Ledig, M.; and Copin, J. C. (1994). Effects of Ca(II) ions on Mn(II) dynamics in chick glia and rat astrocytes: potential regulation of glutamine synthetase. Neurochem. Res. 19, 145–151. doi: 10.1007/bf00966809 Farina, M.; Avila, D. S.; Da Rocha, J. B.; and Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury. Neurochem. Int. 62, 575–594. doi: 10.1016/j.neuint.2012.12.006 ' ' Rama Rao, K. V.; Reddy, P. V.; Hazell, A. S.; and Norenberg, M. D. (2007). Manganese induces cell swelling in cultured astrocytes. Neurotoxicology 28, 807–812. doi: 10.1016/j.neuro.2007.03.001 ' Moreno, J. A.; Sullivan, K. A.; Carbone, D. L.; Hanneman, W. H.; and Tjalkens, R. B. (2008). Manganese potentiates nuclear factor-kappaB-dependent expression of nitric oxide synthase 2 in astrocytes by activating soluble guanylate cyclase and extracellular responsive kinase signaling pathways. J. Neurosci. Res. 86, 2028–2038. doi: 10.1002/jnr.21640 ' Hazell, A. S.; and Norenberg, M. D. (1998). Ammonia and manganese increase arginine uptake in cultured astrocytes. Neurochem. Res. 23, 869–873. Sengupta, A.; Mense, S. M.; Lan, C.; Zhou, M.; Mauro, R. E.; Kellerman, L., és mtsai. (2007). Gene expression profiling of human primary astrocytes exposed to manganese chloride indicates selective effects on several functions of the cells. Neurotoxicology 28, 478–489. doi: 10.1016/j.neuro.2006.10.005 '
Diagnosztika:'
Fahn, S., Elton, R.L., Members of the UPDRS Development Committee, 1987. Unified Parkinson’s disease rating scale. In: Fahn, S., Marsden, C.D., Goldstein, M., Calne, D.B. (Eds.), Recent Developments in Parkinson’s Disease. Macmillan, New York, pp. 153–163. '
Criswell, S., Sterling, C., Swisher, L., Evanoff, B., Racette, B.A., 2010. Sensitivity and specificity of the finger tapping task for the detection of psychogenic movement disorders. Parkinsonism Relat. Disord. 16 (3), 197–201.
Racette, B.A., Criswell, S.R., Lundin, J.I., Hobson, A., Seixas, N., Kotzbauer, P.T., Evanoff, B.A., Perlmutter, J.S., Zhang, J., Sheppard, L., Checkoway, H., 2012. Increased risk of parkinsonism associated with welding exposure. Neurotoxicology 33 (5), 1356–1361. ' ' '
Jenkinson, C., Fitzpatrick, R., Peto, V., Greenhall, R., Hyman, N., 1997. The Parkinson’s Disease Questionnaire (PDQ-39): development and validation of a Parkinson’s disease summary index score. Age Ageing 26 (5), 353–357.
Duarte, J., Claveria, L.E., Pedro-Cuesta, J., Sempere, A.P., Coria, F., Calne, D.B., 1995. Screening Parkinson’s disease: a validated questionnaire of high specificity and sensitivity. Mov. Disord. 10 (5), 643–649. '
Hobson, A.J., Sterling, D.A., Emo, B., Evanoff, B.A., Sterling, C.S., Good, L., Seixas, N., Checkoway, H., Racette, B.A., 2009. Validity and reliability of an occupational exposure questionnaire for parkinsonism in welders. J. Occup. Environ. Hyg. 6 (6), 324–331.
Checkoway, H., Powers, K., Smith-Weller, T., Franklin, G.M., Longstreth Jr., W.T., Swanson, P.D., 2002. Parkinson’s disease risks associated with cigarette smoking, alcohol consumption, and caffeine intake. Am. J. Epidemiol. 155 (8), 732–738. '
Racette, B.A., Searles Nielsen, S., Criswell, S.R., Sheppard, L., Seixas, N., Warden, M.N., Checkoway, H., 2017. Dose-dependent progression of parkinsonism in manganese-exposed welders. Neurology 88 (4), 344–351. Bowler, R.M., Gysens, S., Diamond, E., Nakagawa, S., Drezgic, M., Roels, H.A., 2006. Manganese exposure: neuropsychological and neurological symptoms and effects in welders. Neurotoxicology 27 (3), 315–326. ' '
Bowler, R.M., Nakagawa, S., Drezgic, M., Roels, H.A., Park, R.M., Diamond, E., Mergler, D., Bouchard, M., Bowler, R.P., Kollerg, W., 2007. Sequelae of fume exposure in confined space welding: a neurological and neuropsychological case series. Neurotoxicology 28 (2), 298–311. ' Mergler, D., Huel, G., Bowler, R., Iregren, A., Belanger, S., Baldwin, M., Tardif, R., Smargiassi, A., Martin, L., 1994. Nervous system dysfunction among workers with long-term exposure to manganese. Environ. Res. 64 (2), 151–180. ' ' ' Rascol, O., Fitzer-Attas, C.J., Hauser, R., Jankovic, J., Lang, A., Langston, J.W., Melamed, E., Poewe, W., Stocchi, F., Tolosa, E., Eyal, E., Weiss, Y.M., Olanow, C.W., 2011. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease (the ADAGIO study): prespecified and post-hoc analyses of the need for additional therapies, changes in UPDRS scores, and non-motor outcomes. Lancet Neurol.10 (5), 415–423. Parkinson Study Group, 1996. Impact of deprenyl and tocopherol treatment on Parkinson’s disease in DATATOP patients requiring levodopa. Ann. Neurol. 39, 37–45. ' Myers, J.E., Fine, J., Ormond-Brown, D., Fry, J., Thomson, A., Thompson, M.L., 2009. Estimating the prevalence of clinical manganism using a cascaded screening process in a South African manganese smelter. Neurotoxicology 30 (6), 934– 940. Criswell, S.R., Perlmutter, J.S., Huang, J.L., Golchin, N., Flores, H.P., Hobson, A., Aschner, M., Erikson, K.M., Checkoway, H., Racette, B.A., 2012. Basal ganglia intensity indices and diffusion weighted imaging in manganese-exposed welders. Occup. Environ. Med. 69 (6), 437–443. Nelson, K., Golnick, J., Korn, T., Angle, C., 1993. Manganese encephalopathy: utility of early magnetic resonance imaging. Br. J. Ind. Med. 50 (6), 510–513.
Kísérlet:' Felhasznát irodalom: Moreno, J. A., Streifel, K. M., Sullivan, K. A., Hanneman, W. H., Tjalkens, R. B.: Manganese-Induced NF-jB Activation and Nitrosative Stress Is Decreased by Estrogen in Juvenile Mice. Toxicological Scienses, 122 : (1) 121-133, 2011 Referenciák: ' ' Bouchard, M. F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M. E., Bouffard, T., Limoges, E., Bellinger, D. C., and Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect. 119, 138–143.
Collipp, P. J., Chen, S. Y., and Maitinsky, S. (1983). Manganese in infant formulas and learning disability. Ann. Nutr. Metab. 27, 488–494.
He, P., Liu, D. H., and Zhang, G. Q. (1994). [Effects of high-level-manganese sewage irrigation on children’s neurobehavior]. Zhonghua Yu Fang Yi Xue Za Zhi. 28, 216–218. ' ' Liu, X., Sullivan, K. A., Madl, J. E., Legare, M., and Tjalkens, R. B. (2006). Manganese-induced neurotoxicity: the role of astroglial-derived nitric oxide in striatal interneuron degeneration. Toxicol. Sci. 91, 521–531. Moreno, J. A., Streifel, K. M., Sullivan, K. A., Legare, M. E., and Tjalkens, R. B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci. 112, 405–415. ' '
Moreno, J. A., Yeomans, E. C., Streifel, K. M., Brattin, B. L., Taylor, R. J., and Tjalkens, R. B. (2009b). Age-dependent susceptibility to manganese-induced neurological dysfunction. Toxicol. Sci. 112, 394–404. ' Murray, H. E., Pillai, A. V., McArthur, S. R., Razvi, N., Datla, K. P., Dexter, D. T., and Gillies, G. E. (2003). Dose- and sex-dependent effects of the neurotoxin 6-hydroxydopamine on the nigrostriatal dopaminergic pathway of adult rats: differential actions of estrogen in males and females. Neuroscience. 116, 213–222.
Pihl, R. O., and Parkes, M. (1977). Hair element content in learning disabled children. Science. 198, 204–206. Tripanichkul, W., Sripanichkulchai, K., and Finkelstein, D. I. (2006). Estrogen down-regulates glial activation in male mice following 1-methyl-4phenyl-1,2,3,6-tetrahydropyridine intoxication. Brain Res 1084, 28–37.
1. ábra, (újrarajzolt): 2. ábra: Manganit, piroluzit és egyéb mangánércek az úrkúti mangánérc-bánya meddőhányóiról; Horváth András gyűjtése és fényképe ' Ábrajegyzék
Harischandra, D. S.; Ghaisas, S.; Zenitsky, G.; Jin, H.; Kanthasamy, A.; Anantharam, V.; and Kanthasamy, A. G. (2019) Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation. Front. Neurosci. 13:654. doi: 10.3389/fnins.2019.00654; figure 5. ' '
3. ábra, (újrarajzolt):
https://www.semanticscholar.org/paper/Manganese-toxicity-in-the-central-nervous-system%3A-Sidoryk-Węgrzynowicz-Aschner/59b184e542b4dc9059d12c28b81556aa5b7c8f19/figure/1 ' ' '
4. ábra, (újrarajzolt):
https://faculty.virginia.edu/.archived/metals/cases/corson1.html https://www.sciencedirect.com/science/article/pii/S0020169307005464#fig1 '
5. ábra, (újrarajzolt):
https://stke.sciencemag.org/content/12/563/eaat9900.full Sarkar, S., Rokad, D., Malovic, E., Luo, J., Harischandra, D. S., Jin, H., és mtsai. (2019). Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells. FASEB J. 12:eaat9900. doi: 10.1126/scisignal.aat9900; figure 7. ' ' '
6. ábra:
![]() 'End of edit conflict '
'End of edit conflict '