Mangán indukálta neuroinflammáció
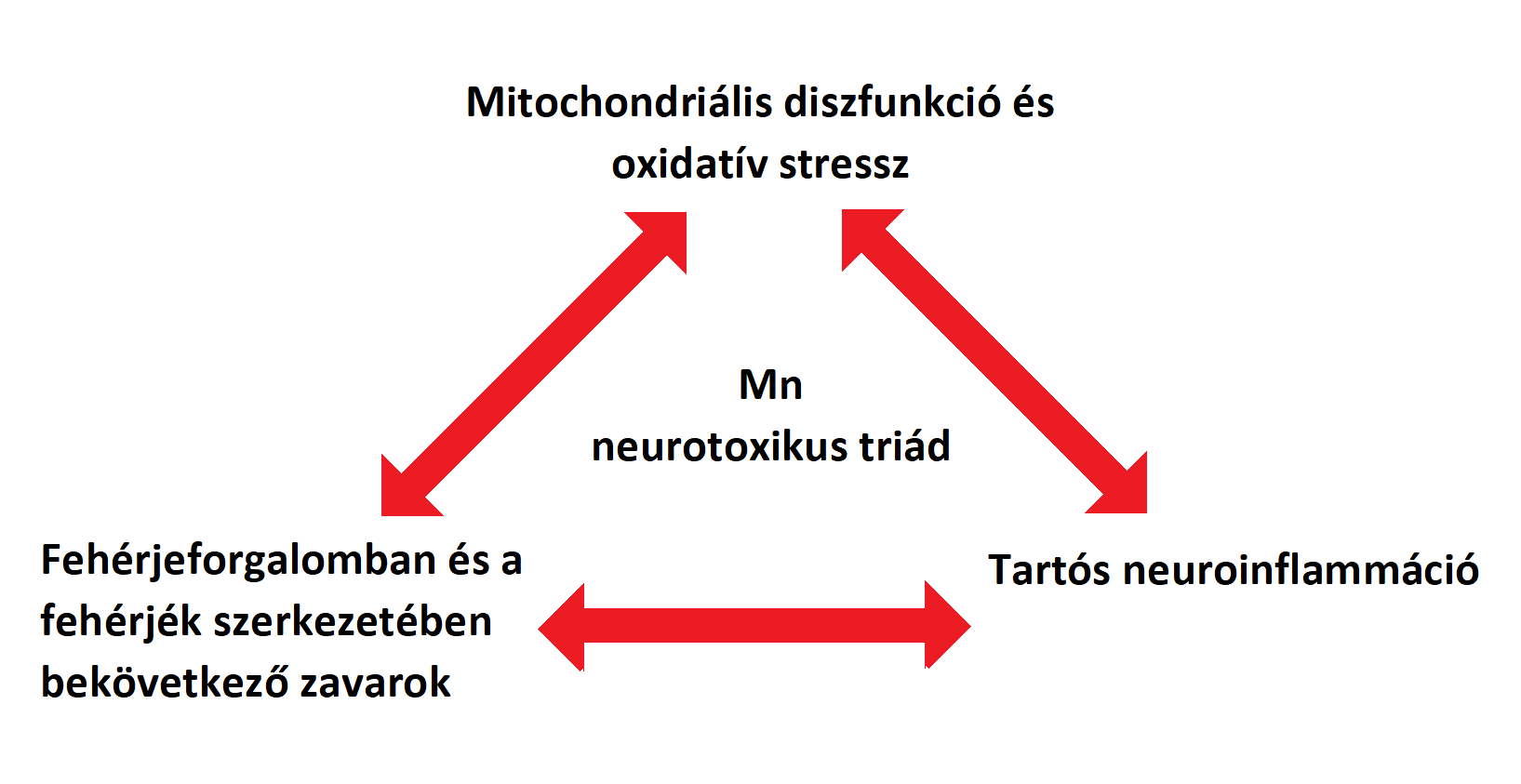
A mangán okozta neurotoxikáció („Manganism”) egy idegrendszert érintő betegség, mely hasonló tünetek kialakulásához vezet, mint a Parkinson-kór (PD). A PD-hoz hasonlóan ez a betegség is a központi idegrendszert érinti, azon belül is főként a nigrostriatális pályát, ami később viselkedési és motorikus károsodásokhoz vezet. A betegséget 1837-ben fedezték fel először, azóta számos kutatás született a témában. A korai kísérletek a magas mangán-koncentráció hatását kutatták a mitochondrium működésére és az ebből kifolyólag létrejövő oxidatív stressz kialakulására. Napjainkban főként a sejtes és molekuláris utakat kutatják, melyek részt vehetnek a mangánmérgezésben. Emellett friss kísérletek szerint a mangán részt vehet olyan fehérjék szerkezetének módosításában is, mint az alfa-synukleninek és amyloidok, ezáltal hitelt adva a feltételezésnek, hogy a környezetből felvett mérgező anyagok elindíthatnak, vagy akár tovább is terjeszthetnek neurodegeneratív folyamatokat azáltal, hogy befolyásolnak egyes betegség-specifikus fehérjéket. A Mn, a „manganizmuson” és a PD-on kívül, így szerepet játszhat még prionbetegségekben és a Huntington-kórban is. Tekintve, hogy a Mn hatással van a fehérjék szerkezetére, a mitochondriumok működésére, ezáltal a neuroinflammáció és neurodegeneráció kialakulására, egyes kutatók bevezették a „Mn Mechanistic Neurotoxic Triad” fogalmát (1. mitochondriális funkciózavar és oxidatív stressz, 2. protein „trafficking” és „misfolding”, valamint 3. neuroinflammáció). Ez a megközelítés segít megérteni és feltárni a túlzott Mn-expozíció által kiváltott folyamatokat és ezek összefüggéseit (D. S. Harischandra, S. Ghaisas, et al. 2019), (1.kép)
 ||
||
"1. ábra:" "Mn Mechanistic Neurotoxic Triad" |
tartalom
Múltbéli kutatások, rövid kutatástörténet
A mangán okozta idegrendszeri betegségek kutatása szorosan összefügg az ipar fejlődésével. Elsőként 1837-ben John Couper írta le a jelenséget Skóciában. A glasgow-i Charles Tennant fehérítő gyárban (a kor legnagyobb fehérítő gyára volt a korban) dolgozó munkások még újnak számító technológiával klórt állítottak elő. A folyamat nagy mennyiségű mangánt kívánt, így a dolgozók minden nap magas mangán-koncentrációnak voltak kitéve, amely végül mérgezéshez vezetett. A század előrehaladtával, az új fémelőállítási technikák használata szintén jelentősen megnövelte a mangán felhasználását. Az új tudományos megfigyelésig azonban egészen 1901-ig kellett várni. Embden és von Jaksch egymástól függetlenül számoltak be esetekről, melyeket a sok mangánport tartalmazó levegő okozott. Az első világháború előtti évekből már 9 beteget jelentettek mangán okozta idegrendszeri megbetegedéssel Európa különböző pontjairól. A világháborúban fegyverkezési célokra használták fel, amitől tovább növekedett a mangánnal történő érintkezések száma. A XX. század közepétől kezdve az új diagnosztikai technológiák segítségével egyre több beteget regisztráltak. (Blanc 2018) Az ember napjainkban is számos területen ki lehet téve már károsnak számító Mn-koncentrációnak a mezőgazdaságtól (Mn-tartalmú peszticidek) a bányászaton (2. kép) és kohászaton át a szennyezett ivóvízig. A Mn és a szervezetre gyakorolt hatása ma is egy erősen kutatott terület, amelyben még sok az ismeretlen mechanizmus.
{{attachment:mangan.JPG}
A Mn-indukálta neuroinflammáció részfolyamatai
Mangán-aktiválta NLRP3 inflammasoma jelpálya, exosomák, ASC a microglia sejtekben
A krónikus Mn-terhelés károsítja a nigrostriatális régiót (37, 42, 62-66 K. S. Kirkley, K. A. Popichak, et al., 2017; T. V. Peres, M. R. C. Schettinger, et al., 2016; T. R. Guilarte, 2010, 2013; T. R. Guilarte, K. K. Gonzales, 2015; M. Aschner, K. M. Erikson, et al., 2009; K. J. Horning, S. W. Caito, et al., 2015), főemlősökben microglia-aktivációt vált ki a substantia nigra pars compacta területén (67 T. Verina, S. F. Kiihl, et al., 2011), és astrogliális inflammációt indukál (37 K. S. Kirkley, K. A. Popichak, et al., 2017). Szintén elősegíti a gliasejtek proinflammatorikus cytokin-termelését (68-70 C.-J. Chen, Y.-C. Ou, et al., 2006; P. L. Crittenden, N. M. Filipov, et al., 2008; N. M. Filipov, C. A. Dodd, et al., 2011) valamint serkenti az NFκB és p38 mitogén-aktiválta protein-kináz útvonalat a gliasejtekben (30, 69 N. M. Filipov, R. F. Seegal, et al., 2005; P. L. Crittenden, N. M. Filipov, et al., 2008). A Mn-indukálta neurotoxicitás hátterében húzódó krónikus gyulladás mechanizmusa még nem teljesen ismert. Az inflammasoma-aktiváció különféle neurodegeneratív rendellenességekkel (pl. Parkinson-kór, Alzheimer-kór, traumatikus agyi sérülés) áll kapcsolatban (14 L. C. Freeman, J. P.-Y. Ting, 2015). Az ATP-től (58 E. -K. Jo, J. K. Kim, et al., 2016) különféle ásványokon (59, 60 F. Martinon, V. Pétrilli, et al., 2006; C. Dostert, V. Pétrilli, et al., 2008) és mitochondriális inhibitoron (17, 61 R. Zhou, A. S. Yazdi, et al., 2011; V. Lawana, N. Singh, et al., 2017) keresztül a szerkezetükben módosult proteinekig (15,16 A. Halle, V. Hornung, et al., 2008; G. Codolo, N. Plotegher, et al., 2013) nagyon sok tényező kiválthat NLRP3 inflammasoma-aktivációt. Bár a teljes folyamat még nem ismert, számos stimulusról bebizonyosodott, hogy az NLRP3 inflammasoma-kaszkád aktiválásának 2-es szignáljaként működnek. Megannyi faktor (pl. mitochondriális és lysosoma diszfunkció, mitochondriális superoxid-termelés) képes előidézni az NLRP3 felszaporodását és aktiválását (17, 18, 72, 43 R. Zhou, A. S. Yazdi, et al., 2011; S. Alfonso-Loeches, J. R. Ureña-Peralta, et al., 2014; S. Sarkar, E. Malovic, et al., 2017; E. Aflaki, N. Moaven, et al., 2016). Az astrocyták és neuronok mitochondriumainak funkciózavarát, illetve superoxid-termelését a bennük felgyülemlő Mn képes előidézni (26, 34, 50, 73 D. Milatovic, Z. Yin, et al., 2007; Z. Yin, J. L. Aschner, et al., 2008; J. A. Roth, C. Horbinski, et al., 2002; K. V. R. Rao, M. D. Norenberg, et al., 2004). A PD-ral összefüggésben lévő PARKIN gén egyik terméke, a mitochondriális fúziós protein 2 (Mfn2) fontos szerepet játszik a mitochondriális fúzióban (74, 75 A. Rakovic, A. Grünewald, et al., 2011; N. Rocha, D. A. Bulger, et al., 2017). Bebizonyították, hogy a Mn túlzott jelenléte csökkent Mfn2-expresszióhoz vezet, amivel mitochondriális diszfunkció és inflammasoma-aktiváció jár együtt.
A VPS35 retromer komplex protein mutációja vagy csökkent expressziója képes kiváltani a mitochondriumok funkciózavarát akár az Mfn2 csökkentésével a dopaminerg neuronokban (54 F.-L. Tang, W. Liu, et al., 2015), akár a dynamin-like protein 1 komplex újra felhasználásával (78 W. Wang, X. Wang, et al., 2016). Kimutatták, hogy a Mn-terhelés csökkenti a VPS35 mennyiségét az LPS-primed microglia sejtekben, serkentve az Mfn2 degradációját, ami kapcsolatban áll a mitochondriális ubiquitin-ligáz (Mul1) expressziójával. A pontos mechanizmus még nem ismert. Mindemellett, a VPS35 befolyásolja az exosomák celluláris biogenezisét és felszabadulását (81, 82 J. Follett, S. J. Norwood, et al., 2014; L. J. Vella, A. F. Hill, et al., 2016). Ezek az exosomák hozzájárulnak a neurodegeneratív betegségek kifejlődéséhez. Az általuk szállított aggregálódott α-Synuclein kulcs szignálként működik a többi sejt számára, így szintén segítenek a neuroinflammáció modulálásában (86 A. Gupta, L. Pulliam, et al., 2014). Úgy látszik, egy újfajta pyroptotikus-phagocytikus kaszkád terjeszti el az NLRP3 inflammasoma és annak adapter molekulájának (ASC) együttesét a sejtek között, hasonlóan a prionokhoz (19 B. S. Franklin, L. Bossaller, et al., 2014). A Mn serkenti az ASC exosomális felszabadulását az LPS-primed microgliákból, ugyanakkor az exosoma-felvétel blokkolása csökkenti az interleukin-1β (IL-1β) felszabadítását. Ezeknek az eredményeknek számos vonzata lehet, mivel az exosomák akár szervek közötti kommunikáció lebonyolítására is képesek és a vér-agy gáton is át tudnak hatolni(3.kép)
{{attachment:kep3.png}
A fentieket igazolni látszanak a svéd hegesztőmunkások vizsgálatával nyert adatok. A szervezetükbe hegesztés során bekerült fém nanorészecskék megnövekedett inflammatorikus profilt eredményeztek (88 K. Dierschke, C. Isaxon, et al., 2017).
Exosomák szerepe a neuroinflammációbanAz exosomák nanoméretű (50-150 nm), sejtek által kibocsátott vezikulumok az extracelluláris térben (Thery et al., 2002). Ezek a test egészében keringenek és képesek átjutni a vér-agy gáton, illetve más barriereken. Az exosomákat övező növekvő érdeklődés a betegségek fejlődésében betöltött potenciális szerepüknek köszönhető, ami lehetővé teszi esetleges felhasználásukat korai biomarkerek felkutatásában (Sarko and McKinney, 2017) és gyógyszerek szervezetben történő szállításában (Luan et al., 2017). Toxikológiai kutatók abból a felfedezésből indulnak ki, miszerint a környezetben lévő méreganyagok megváltoztatják az ember egészségi állapotának megfelelő exosoma-profilját, mint ahogy a rák vagy neurodegeneratív betegségek esetén (Harischandra et al., 2017; Munson et al., 2018; Ngalame et al., 2018).Ebben a vonatkozásban, a Mn-expozíció neuronális exosoma-profilját és annak a neuroinflammációra és neurodegenerációra gyakorolt hatásait részletesen vizsgálják (Harischandra et al., 2015 a, b, 2017, 2018, 2019). Kimutatták, hogy a Mn-terhelés számottevően upregulálja a kis GTPáz Rab27a-t. Ez közrejátszik a multivesiculáris testek membránfúziójában (Pfeffer, 2010), amik ezt követően exosomákat juttatnak az extracelluláris környezetbe (Harischandra et al., 2018). Továbbá a Mn-indukálta neuronális exosomák miRNS (mikro-) profiling analízise bizonyos miRNS-ek (pl. miR-210, miR-325, miR-125b, miR-450b) megemelkedett expresszióját mutatta ki, melyek kontroll biológiai kulcsfolyamatok (gyulladás, autophagia, protein aggregáció és hypoxia) kapcsán ismertek (Harischandra et al., 2018). Ezek az exosomák caveola-mediált endocytosissal a sejtbe kerültek, ezáltal neuroinflammációt indukáltak, ami ezután neurodegeneratív folyamatokhoz vezetett mind sejttenyészetben, mind állatmodellekben (Harischandra et al., 2019). Érdekesség, hogy a hegesztés során keletkező Mn-tartalmú gőzöknek tartósan kitett munkásoktól gyűjtött szérum exosoma mintákból megnövekedett mennyiségben mutattak ki megváltozott szerkezetű α-Synucleint az exosomákban. Ezzel összefügésbe hozható a környezetből származó Mn-terhelés a fejlődő Parkinson-kórral (Harischandra et al., 2019). (4. kép) Párhuzamosan futó kutatásokban feltárták a Mn microglia sejtekben zajló inflammaszóma-aktivációban betöltött szerepét. Azt találták, hogy a Mn az LPS-primed (lipopoliszacharid-) microglia sejtekben 2-es jelként szolgál az NLRP3 inflammaszóma-aktivációban, kiváltva az ASC „prionoidok” exosomális felszabadulását, ami az inflammaszóma elterjedését eredményezi (Sarkar et al., 2019). Összegezve, az eredmények rávilágítottak a Mn endosomális forgalmat befolyásoló hatására az exosomákból kiszabaduló anyagok neuroinflammációt és progresszív neurodegenerációt előidéző tulajdonságán keresztül. {{attachment:hegeszt.jpg} Astrogliák és a glutamát-GABA ciklus Az oxidatív stressz a dopaminerg neuronok mangán-indukálta diszfunkciójában lévő jelentőségén kívül a gliasejt aktiváció is fontos szerepet játszik a mangán (Mn) neurotoxicitás kialakulásában, kiváltva a nem neuron eredetű ROS (reactive oxygen species) és gyulladásos mediátorok (pl. proinflammatorikus cytokinek) felszabadulását. A glia-aktiváció mértékét/milyenségét meghatározza azok morfológiája, proliferációja, migrációja, illetve az immunmoduláló molekulák expressziója. A gliasejtek két fő csoportja a központi idegrendszerben az astrocyták és a microglia. Utóbbi a központi idegrendszer összes gliasejtjének körülbelül 10%-át adja.
Ma már jól dokumentált, hogy a glia-aktiváció kimagasló a Mn-expozíciónak kitett emberek agyában, ahogy a Mn neurotoxicitás főemlős és rágcsáló modelljeiben (Erikson and Aschner, 2006; Huang, 2007; Perl and Olanow, 2007; Cordova et al., 2013). A Parkinson-kórban (PD) a neuroinflammációt a dopaminerg neuronok elvesztése mögött álló folyamatok egyik kulcs mediátorának tartják. A microgliák aktivációja főszerepet játszik a környezeti stresszre és az immunológiai kihívásokra történő válaszadásban a felhalmozódott neurotoxinok, elhaló sejtek, sejttörmelékek eltávolításával és proinflammatorikus cytokinek felszabadításával (Carson et al., 2007; Tansey et al., 2008). Gyulladásos mediátorok (pl. LPS, cytokinek) jelenlétére válaszként a microglia sejtek indukálható nitrogén-monoxid-szintázt (iNOS) (ami nagy mennyiségű NO-t képes előállítani) szabadítanak fel. A microgliával ellentétben az astrocyták nem támadják meg a pathológiás célpontokat, ehelyett olyan faktorokat termelnek, melyek gyulladásos reakciókat közvetítenek a PD-os agy substantia nigrájában (Miklossy et al., 2006).
Az astrocyták jelentős szerepet játszanak a Mn-indukálta neuroinflammációban, mivel az agy Mn-homeosztázisának központját képezik (Wedler and Denman, 1984). Az astrocytákon található transferrin receptorok azonnal hozzákötődnek a Tf-Mn3+-hoz, emiatt található bennük több Mn, mint bármely más idegsejt-típusban. Valójában az astrocyták 10-50-szer nagyobb Mn koncentrációt is mutathatnak, mint a neuronok, ezért is érzékenyebbek a Mn toxicitásra más sejttípusoknál. Glutamát-indukálta excitotoxicitás során a többlet glutamát hirtelen annyira megnöveli az intracellularis Ca2+ szintet, hogy az blokkolni fogja a Mn2+ felvételét, elősegítve a mitochondrialis Mn2+ kijutását a cytosolba. A cytosol magas Mn2+ koncentrációja az astrocytákban aktiválja a glutamin-szintetázt, ami eltávolítja a fölösleges glutamátot (Wedler et al., 1994). A többlet extracelluláris Mn2+ azonban kompetitíven kötődve a Ca2+-kötő helyekhez megszakíthatja az intracelluláris Ca2+ jeladást az astrocytákban, így megzavarva a mitochondriális Ca2+ homeostasist (Farina et al., 2013), ami astrogliosist vált ki. Ezenkívül a Mn3+ oxidatív/nitrozatív utakon az astrocyták megduzzadását okozza (Rama Rao et al., 2007). A megnövekedett Mn-szint az astrocytákban növeli a proinflammatorikus jelmolekulák (iNOS, IL-6) expresszióját (Moreno et al., 2008). In vitro kutatások azt mutatják, hogy a Mn-nal kezelt astrocyták nagyobb mennyiségben használnak fel L-arginint, ami egy szubsztrát a NO számára (Hazell and Norenberg, 1998). Míg ezeknek a jeleknek a jól időzített expressziója elengedhetetlen az idegi stresszre vagy sejtkárosodásra adott válasz kialakításában, addig túlprodukciójuk nemkívánatos, gyakran súlyosbítja a toxikus hatásokat. Mn-nak kitett primer emberi astrocyták microarray génexpresszió profilozása proinflammatorikus cytokineket kódoló gének upregulációját, ezzel párhuzamosan pedig a sejtciklussal, DNS replikációval és kijavítással kapcsolatos gének downregulációját mutatta ki (Sengupta et al., 2007).
A glutamát-GABA ciklus különösen fontos az astrocyta-neuron anyagcsere kapcsán. A glutamát és a GABA szintézisében a glutamin mint ezek előanyaga van jelen (Bak et al., 2006). A neuronális glutamin glutamáttá történő deamidációjakor ammónia keletkezik, ami ezután az astrocytákhoz szállítódik és a glutamát amidációjához használódik fel. Az astrocyták által kibocsátott glutamint a glutamát- és GABAerg neuronok veszik fel, amik nyúlványokkal rendelkeznek a basalis ganglionokban és segítenek az akaratlagos mozgások szabályozásában (Sidoryk-Wegrzynowicz and Aschner, 2013). Válaszul az agyban lévő Mn-többletre, a Mn hamar belép az astrocyták mitochondriumaiba. A mitochondriumok magas Mn-szintje károsítja a sejtlégzést, valamint megakadályozza a glutation-peroxidáz (GPx) termelését és aktiválását. (5. kép) Összegezve, úgy tűnik az astrocyták részben érintettek az agy Mn-homeosztázisának károsodásakor. Ez másfelől negatívan hathat a glutamát- és GABAerg neuronok basalis ganglionokban levő nyúlványaira, ami a Mn neurotoxicitásra jellemző motoros elégtelenségekhez vezet. (6. kép)
