Mangán indukálta neuroinflammáció
A mangán okozta neurotoxikáció („Manganism”) egy idegrendszert érintő betegség, mely hasonló tünetek kialakulásához vezet, mint a Parkinson-kór (PD). A PD-hoz hasonlóan ez a betegség is a központi idegrendszert érinti, azon belül is főként a nigrostriatális pályát, ami később viselkedési és motorikus károsodásokhoz vezet. A betegséget 1837-ben fedezték fel először, azóta számos kutatás született a témában. A korai kísérletek a magas mangán-koncentráció hatását kutatták a mitochondrium működésére és az ebből kifolyólag létrejövő oxidatív stressz kialakulására. Napjainkban főként a sejtes és molekuláris utakat kutatják, melyek részt vehetnek a mangánmérgezésben. Emellett friss kísérletek szerint a mangán részt vehet olyan fehérjék szerkezetének módosításában is, mint az alfa-synukleninek és amyloidok, ezáltal hitelt adva a feltételezésnek, hogy a környezetből felvett mérgező anyagok elindíthatnak, vagy akár tovább is terjeszthetnek neurodegeneratív folyamatokat azáltal, hogy befolyásolnak egyes betegség-specifikus fehérjéket. A Mn, a „manganizmuson” és a PD-on kívül, így szerepet játszhat még prionbetegségekben és a Huntington-kórban is. Tekintve, hogy a Mn hatással van a fehérjék szerkezetére, a mitochondriumok működésére, ezáltal a neuroinflammáció és neurodegeneráció kialakulására, egyes kutatók bevezették a „Mn Mechanistic Neurotoxic Triad” fogalmát (1. mitochondriális funkciózavar és oxidatív stressz, 2. protein „trafficking” és „misfolding”, valamint 3. neuroinflammáció). Ez a megközelítés segít megérteni és feltárni a túlzott Mn-expozíció által kiváltott folyamatokat és ezek összefüggéseit (D. S. Harischandra, S. Ghaisas, et al. 2019), (1.kép)
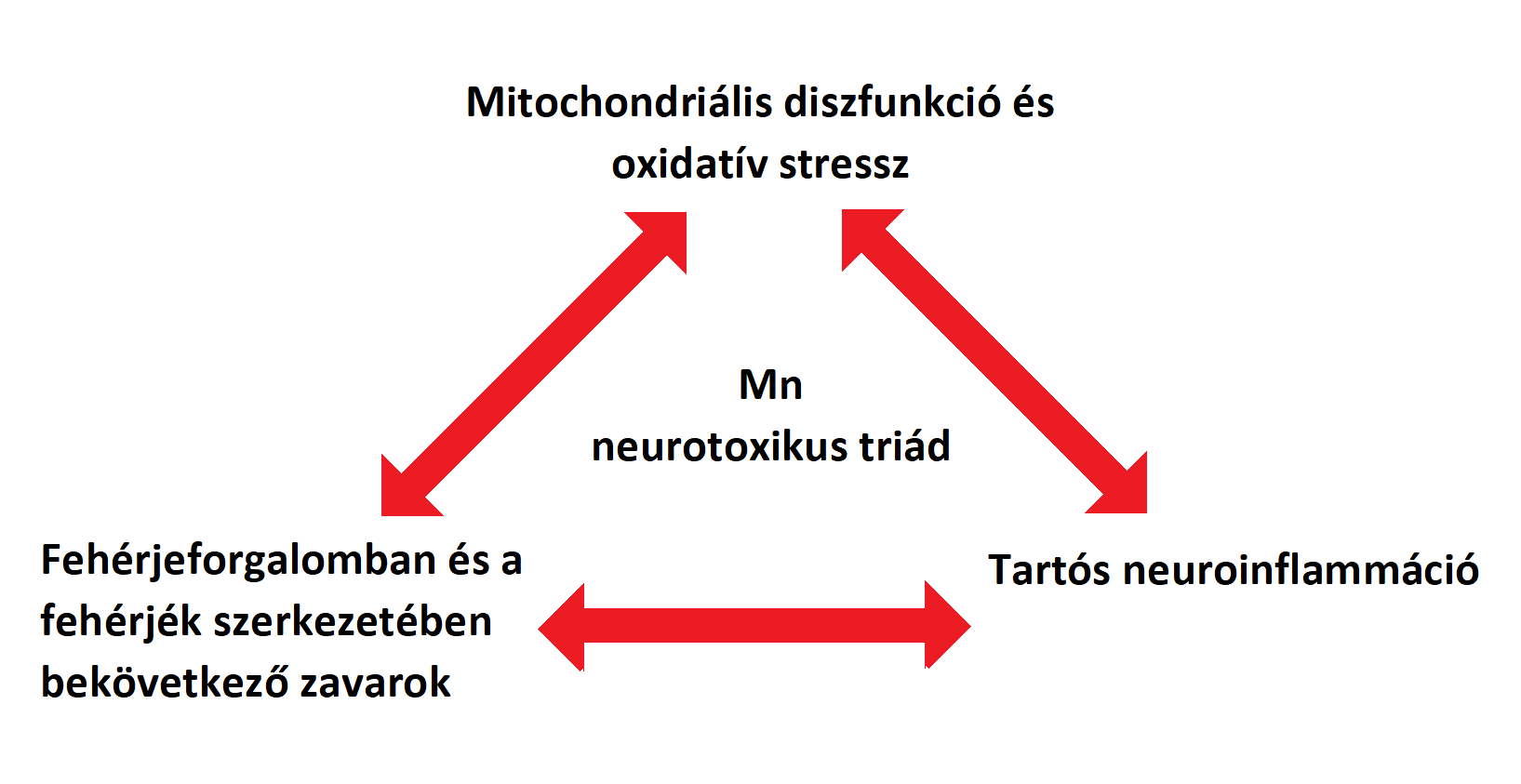
1.ábra: Mn Mechanistic Neurotoxic Triad" |
tartalom
Múltbéli kutatások, rövid kutatástörténet
A mangán okozta idegrendszeri betegségek kutatása szorosan összefügg az ipar fejlődésével. Elsőként 1837-ben John Couper írta le a jelenséget Skóciában. A glasgow-i Charles Tennant fehérítő gyárban (a kor legnagyobb fehérítő gyára volt a korban) dolgozó munkások még újnak számító technológiával klórt állítottak elő. A folyamat nagy mennyiségű mangánt kívánt, így a dolgozók minden nap magas mangán-koncentrációnak voltak kitéve, amely végül mérgezéshez vezetett. A század előrehaladtával, az új fémelőállítási technikák használata szintén jelentősen megnövelte a mangán felhasználását. Az új tudományos megfigyelésig azonban egészen 1901-ig kellett várni. Embden és von Jaksch egymástól függetlenül számoltak be esetekről, melyeket a sok mangánport tartalmazó levegő okozott. Az első világháború előtti évekből már 9 beteget jelentettek mangán okozta idegrendszeri megbetegedéssel Európa különböző pontjairól. A világháborúban fegyverkezési célokra használták fel, amitől tovább növekedett a mangánnal történő érintkezések száma. A XX. század közepétől kezdve az új diagnosztikai technológiák segítségével egyre több beteget regisztráltak. (Blanc 2018) Az ember napjainkban is számos területen ki lehet téve már károsnak számító Mn-koncentrációnak a mezőgazdaságtól (Mn-tartalmú peszticidek) a bányászaton (2. kép) és kohászaton át a szennyezett ivóvízig. A Mn és a szervezetre gyakorolt hatása ma is egy erősen kutatott terület, amelyben még sok az ismeretlen mechanizmus. 2.ábra: Manganit, piroluzit és egyéb mangánércek az úrkúti mangánbánya meddőhányóiról
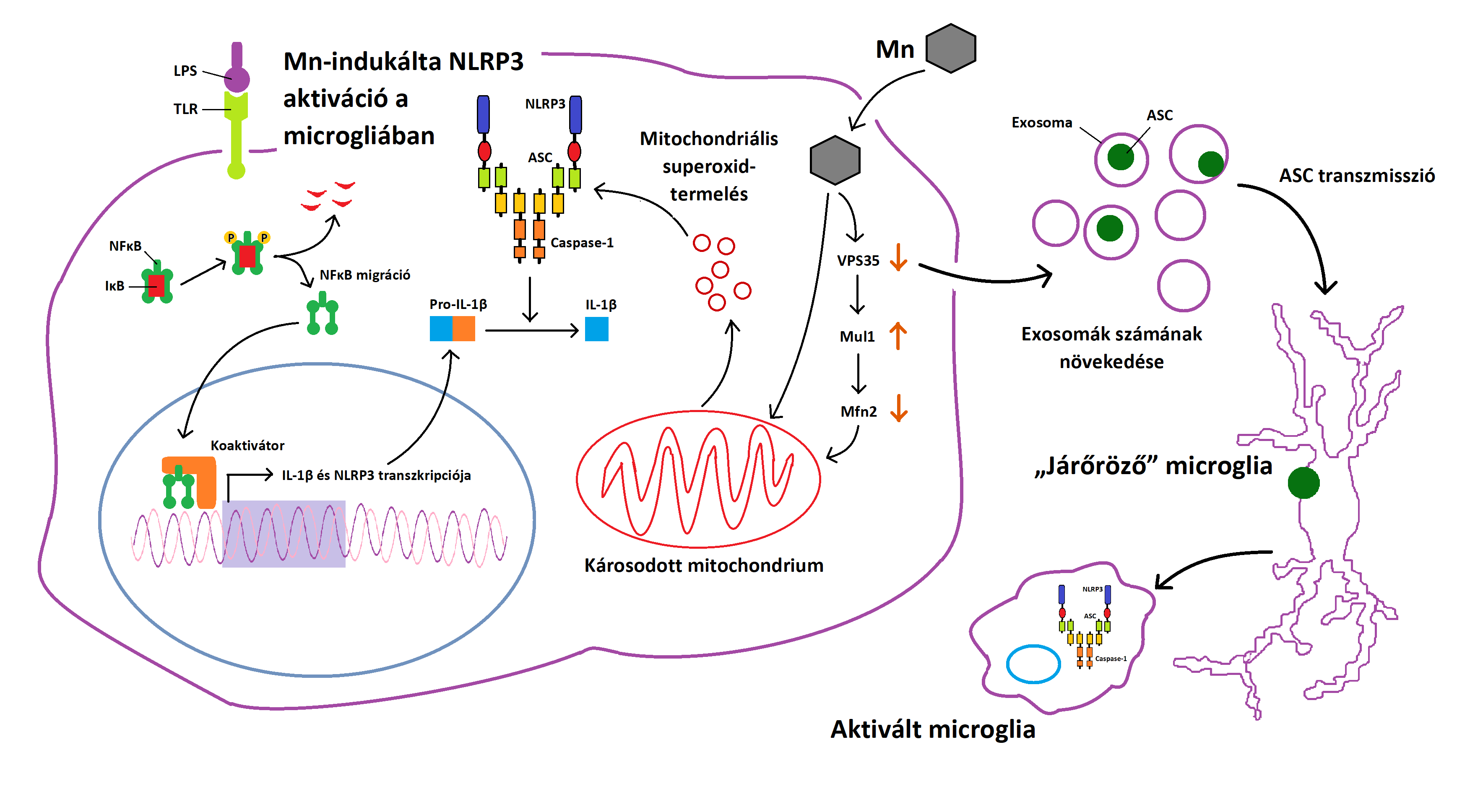
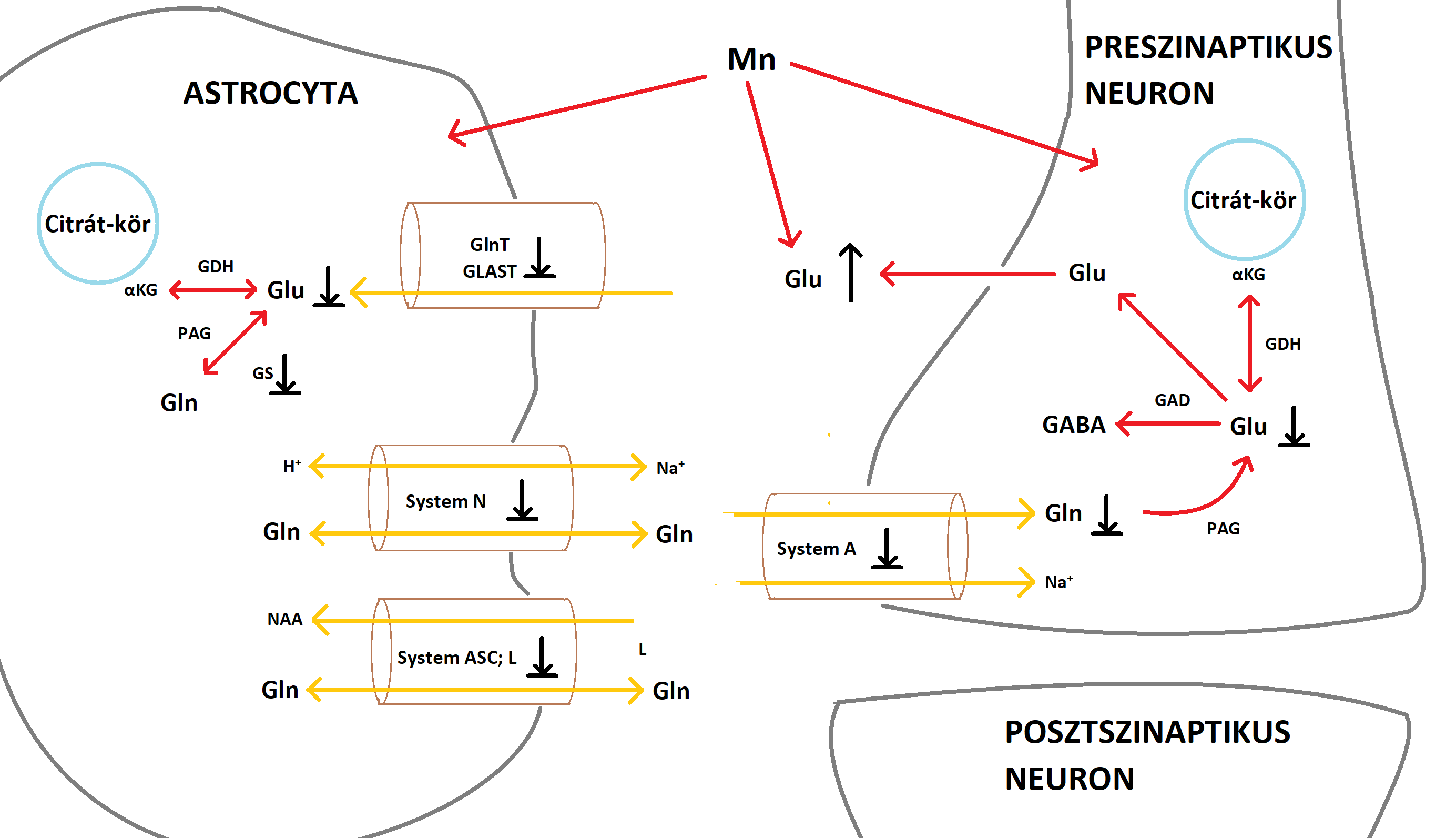
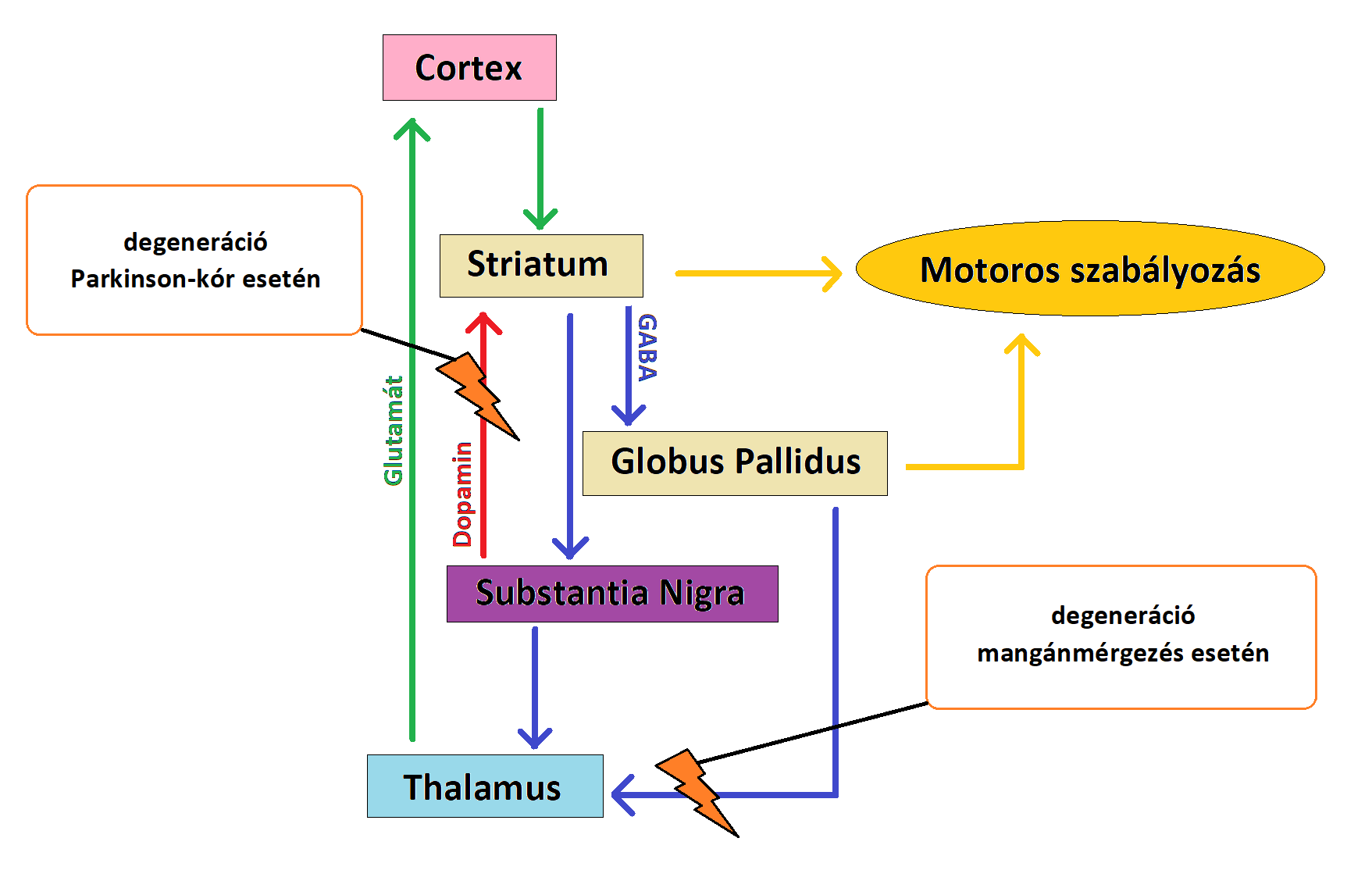
A krónikus Mn-terhelés károsítja a nigrostriatális régiót A VPS35 retromer komplex protein mutációja vagy csökkent expressziója képes kiváltani a mitochondriumok funkciózavarát akár az Mfn2 csökkentésével a dopaminerg neuronokban 3.ábra:NLRP3 Mn-indukálta aktivációja a microglia sejtekben és az exosomák szerepe a neuroinflammáció terjedésében A fentieket igazolni látszanak a svéd hegesztőmunkások vizsgálatával nyert adatok. A szervezetükbe hegesztés során bekerült fém nanorészecskék megnövekedett inflammatorikus profilt eredményeztek (88 K. Dierschke, C. Isaxon, et al., 2017). 4.ábra:A hegesztés során keletkező Mn-tartalmú gőzök tartós belélegzése Mn-toxicitáshoz vezethet Exosomák szerepe a neuroinflammációban Az exosomák nanoméretű (50-150 nm), sejtek által kibocsátott vezikulumok az extracelluláris térben Ma már jól dokumentált, hogy a glia-aktiváció kimagasló a Mn-expozíciónak kitett emberek agyában, ahogy a Mn neurotoxicitás főemlős és rágcsáló modelljeiben Az astrocyták jelentős szerepet játszanak a Mn-indukálta neuroinflammációban, mivel az agy Mn-homeosztázisának központját képezik A glutamát-GABA ciklus különösen fontos az astrocyta-neuron anyagcsere kapcsán. A glutamát és a GABA szintézisében a glutamin mint ezek előanyaga van jelen 5.ábra:A Mn hatása a glutamát-GABA ciklusra 6.ábra:A PD és a Mn-mérgezés során bekövetkező neuronális zavar eltérő helyen alakul ki, mégis hasonló tünetekhez vezet
A szervezebe történő magán felhalmozódás által okozott PD-hez rendkívül hasonló mangán neurotoxicitás azonosítóra nyújthat új lehetőséget UPDRS3 (Unified Parkinson Disease Rating Scale motor subsection part 3)(Fahn et al., 1987) eredményét megjósoló több tényezőt fegyelembe vevő lineáris regressziós model ami lehetővé teszi hogy egy neurológus nélkül is viszonylag pontosan azonosítsuk a betegséget. Ezáltal lehetőséget nyújt, hogy a parkinzonizmus jelenlétét viszonylag kis hibarátával körzetorvosok vagy akár asszisztensek is azonosítani tudják. A tesztmegalkotásában felhasznált adatok az életkor, mindkét kéz időre történő motoros funkciójának értékelése egy pontozási rendszerben, ahol az alacsonyabb pontszám rosszabb eredményt jelent (Criswell et al., 2010), a teszt figyelembe vett olyan pszichológiai tényezőket, mint depresszió, szorongás, magány. Ezenkívül intenciós tremor, fájdalom, beszéd nehézségek, valamint dohányzás volt az amit még vizsgáltak. Az UPDRS3 rendszerben a parkinzonismusra pozitívnak vett eredmény ponthatárát, ha 15 pontnál állapítjuk meg 95%-os megbízhatósági intervallumot érthetünk el. A tesztet a mangán mérgezésnek fokozottan kitett hegesztő munkásokon, segédeken végezték azzal a céllal hogy a mangánizmus és PD egymástól megkülönböztethessék, valamint klinika szempontból jelentős neurotoxicitást azonosítani tudják, kutatások azt mutatják hogy a hegesztők 15%-ának van klinikailag jelentős mangánizmusa (Racette et al., 2012). A vizsgálatban 18 és 65 év közötti munkások vettek rész a vizsgálatokat pedig 2 mozgási rendellenességekkel foglalkozó neurológus végezte el összesen 886 főn elvégezve a UPDRS3-at is, a felső korhatárt 65 évnél szabták meg hiszen így a model azókra az emberekre lehetett szabni akik jelenleg is ki vannak téve mangán mérgezésnek. Több különböző kérdéssorral további információkat szereztek a munkásokról, elvégeztek PD specifikus életminőségről szolót (PDQ39, Jenkinson et al., 1997), egy PD tüneteket vizsgálót (Duarte et al., 1995; Tanner et al., 1990) valamint a munkások életviteléről és egészségügyi állapotáról is nyertek adatokat a figyelem középpontjába helyezve a rizikó faktorokat (Hobson et al., 2009; Checkoway et al., 2002). Sor került ezenkívül egy utolsó kérdéssorra is amivel a hegesztési gázoknak való egyedi kitettséget és az ebből fakadó mangán felhalmozódást becsülték meg (Racette et al., 2012, 2017), ezek után 38 munkást az eredmények megerősítéséhez megvizsgáltak MRI-vel (Racette et al., 2017), majd az eredményeket összegezték. Miután az eredményváltozónak használt UPDRS3 mellék pontszámokat beállították, erre szükség volt hiszen 2 vizsgáló több év lefolyása alatt végezte el a teszteket és létrehoztak egy lineáris regressziós modellt ami alkalmas a parkinzonizmus jelenlétére következtetni. Ehhez figyelembe veszi az életkort a kéz motoros funkciót vizsgáló tesz pontszámokat azok UPDRS3-el erős korrelációjuk miatt. Külön hangsúlyt fektettek azokra a mellék pontszámokra amiket nemcsak neurológusok tudnak felvenni, inkább az egyes megfigyelések, tünetek jelenlétét vagy hiányát vették lényegesnek mintsem annak szakszerű pontozását amire csak egy neurológus lenne alkalmas. A vizsgálat figyelembe vett egyéb tényezőket is hogy ezzel tovább pontosíthassák az eredményt, mint például a kérdés sorokból származó adatok gyógyszerhasználat, depresszió,szorongás, résztvevők által saját magukon megfigyelt tünetek amelyek esetén korábbi kutatások kapcsolatot fedeztek fel a mangánnak való túlzott kitettséggel (Bowler et al., 2006, 1999; Mergler et al., 1994). Valamint másodlagos változókat is használtak a végleges változat megalkotásához, végül egy több változós lineáris regressziós modellt kaptak. Az összegzett eredményekben meghatározó szerepet fedeztek fel a tesz alanyok korában, erős lineáris asszociációt a domináns kéz pontszáma és a UPDRS3 pontszám között, a helyzet nem volt ennyire egyértelmű a nem domináns kéz esetén, itt a magasabb pontszám elérésekor (>35) ellentétes módon asszociáltak a UPDRS3 pontszámmal. A legtöbb elsődleges előrejelző amiket a kérdőívek segítségével nyertek rendkívül hasznosnak bizonyultak erős kapcsolat volt közöttük és a UPDRS3 pontszám között. A másodlagos előrejelzők között a fájdalom, dohányzás és nem volt a leglényegesebb szerepű, igaz a nem végül eltávolításra került a kis számú női részt vevő miatt. A fájdalom, szorongás, magány és depresszió jelentőséggel bíró értékeit egy változóba foglalták (PALD: pain, anxiety, lonliness, depression), ezen változó és a dohányzás között összefügést találtak miszerint a magasabb PALD pontszámmal rendelkező nem dohányzók UPDRS3 értéke magasabb volt, a jelenleg is dohányzók értékei a végső változóba nem kerültek be az egyszerűsítés jegyében. A model segítésével az esetek mindössze 8%-ában azonosítanánk hibásan azokat akik nem rendelkeznek a betegséggel, pontosításokat végezhetünk ezenkívül a jobb specificitás vagy szenzitivitás elérése érdekében. Az előrejelzett UPDRS3 pontok esetén 9,88 míg a rendes UPDRS3-nál ≥15 bizonyult az optimálisnak (Rascol et al., 2011; Parkinson Study Group, 1996), ilyen feltételekkel 80% a szenzitivitás. Az esetben ha magasabb értéknél szabjuk meg az előrejelzett UPDRS3 pontszámot akkor a specifictás pontosságát tudjuk növelni. Az eredményeket tovább lehetséges hogy tovább lehet pontosítani különböző biológia markerek figyelembe vételével mint például a nyál, vizelet ,blood igaz még ez csak az első lépcsőjét jelentené egy több lépcsős elemzési program megalkotásának (Myers et al., 2009). A leglényegesebb pontja a kutatás eredményének hogy általa a mangán hatására kialakuló neurológia elváltozások egyszerűbb szűrhetőségére biztosíthat lehetőséget, igaz a végső diagnózis felállításához továbbra is elengedhetetlen egy szakértő tudása de a klinikailag súlyosabb esetek kiszűrése az ő jelenlétük nélkül is lehetségesé válna. Azokat akik eredménye pozitív lenne lényeges indokkal lehetne elküldeni egy MRI vizsgálatra ahol a T1 relaxációs idő (Lee et al., 2015; Lewis et al., 2016) és pallidális index (Criswell et al., 2012; Nelson et al., 1993) alapján már pontos diagnózist lehetne felállítani. ||kep7
A közelmúltban végzett kutatások a mangán okozta idegrendszeri megbetegedések életkorbeli és nembeli differenciáira irányultak. Különböző vizsgálatok bizonyították, hogy nagyon magas mangán koncentrációjú ivóvíz fogyasztása neuroinflammációt okoz (Morreno et al., 2011), ami tanulási nehézségeket, hiperaktivitást és ebből kifolyólag az iskolai teljesítőképesség romlását okozza. (Collipp et al., 1983; Pihl and Parkes, 1977; He et al., 1994). Ezt a jelenséget gyermekekben figyelték meg, felnőtteknél nem jelentkeztek ilyen súlyos problémák, hiszen a fejlődő szervezet sokkal érzékenyebb a túl magas mangán szintre, mint a felnőtt. Azonban nem csak életkorbeli, hanem nembeli különbségeket is tapasztaltak a kutatók. (Bouchard et al., 2011). Létrehoztak egy kísérletet, melyben fiatal egereket tanulmányoztak. A kutatás korábbi vizsgálatokra alapult. Az egyik ilyen kísérletben bebizonyították, hogy a magas mangán-expozíció felnőtt egerekben apoptotikus neuronvesztéshez vezet a területén, és a jelenség kapcsolatba hozható az astrocyták által nagy mennyiségben expresszált, indukálható nitrogén-monoxid-szintázzal (NOS2). (Liu et al.,2006). A másikban pedig kimutatták, hogy a fejlődésben lévő hím egerek a magas mangánszint okozta viselkedésbeli és kórtani hatásokra érzékenyebbek, mint nőstény társaik. Ezekben az állatokban emelkedett neuroinflammáció és nitrozatív stressz alakult ki a basalis ganglionokban. (Moreno et al.,2009). Valószínűsíthető, hogy a nőstény egerekben található gyulladás-ellenes hatású E2 (ösztradiol) lehet az oka, hogy a nőstény egerek kevésbé érintettek. Korábban már kimutatták az E2 idegvédő hatását (Callier et al., 2001; Murray et al., 2003; Tripanichkul et al., 2006), azonban az E2 NOS2 expresszióban betöltött szerepét még nem bizonyították. A kísérletben három csoportba sorolt egerek szerepeltek (nőstények, hímek és E2-vel kezelt hímek). Mindegyik csoportnak 5mg/ testtömeg kg adagolásban adtak mangánt, ami a helyes emberi étrendben szereplő mangán mennyiségének 50-szerese. Végül az egerek striatum és globus pallidus agyterületeiről mintát véve immunfluoreszcens technikával vizsgálták az idegsejteket. (Moreno et al., 2011) Az eredmények alapján a kutatóknak sikerült bizonyítania az E2 idegsejtekre gyakorolt védő hatását mangánmérgezés esetén is. Azok a hím egerek, melyek ösztradiol kezelést kaptak, kevésbé voltak érzékenyek a magas mangán koncentrációra, hasonló eredményt mutattak, mint nőstény társaik, míg a nem kezelt hím csoport basalis ganglionjaiban jelentős mértékben növekedett a NOS2 expressziója és a fehérjék nitrációja. (Moreno et al., 2011)
A Mn-indukálta neuroinflammáció részfolyamatai
Mangán-aktiválta NLRP3 inflammasoma jelpálya, exosomák, ASC a microglia sejtekben

Diagnosztizálás
Kísérletek
